11-12版高中化学全程学习方略配套课件:专题质量评估(一)(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:专题质量评估(一)(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 233.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-11 08:26:08 | ||
图片预览











文档简介
(共32张PPT)
(一)
专题1 化学家眼中的物质世界
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,
共48分)
1.胶体分散系与其他分散系的本质区别是 ( )
A.是否有丁达尔效应 B.是否透明
C.分散质直径大小 D.是否稳定
【解析】选C。胶体分散系与其他分散系的本质区别是分散质粒子直径大小。
2.下列说法正确的是( )
A.氢氧化钠的摩尔质量是40 g
B.“物质的量浓度”可简称为“量浓度”
C.阿伏加德罗常数的单位是mol-1
D.1 mol任何物质所占体积都是22.4 L
【解析】选C。摩尔质量的单位是g·mol-1,A不正确;“物质的量浓度”是一个整体概念,不可拆分理解,B不正确;C正确;D中未注明气体所处的状态,D不正确。
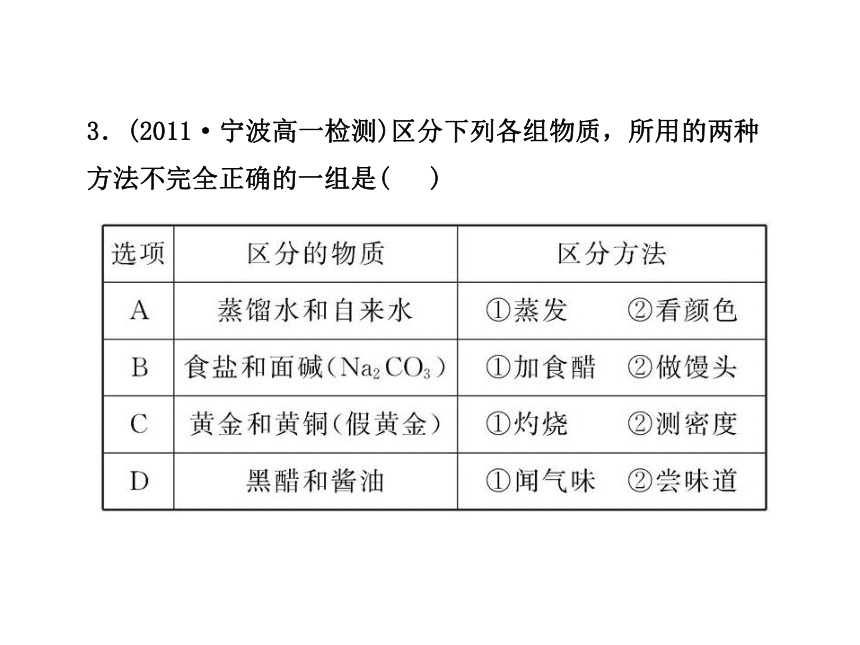
3.(2011·宁波高一检测)区分下列各组物质,所用的两种方法不完全正确的一组是( )
【解析】选A。蒸馏水和自来水都是无色的液体,通过观察颜色无法区别,A选项错误。Na2CO3遇到食醋有气泡产生,食盐遇到食醋没有明显现象产生;面碱可以作为制馒头的蓬松剂,而食盐不能,B选项正确。黄铜在灼烧时颜色会变黑,而黄金不变色;黄金的密度比黄铜的大,C选项正确。黑醋容易挥发出有刺激性气味的醋酸,而酱油不容易挥发;黑醋有酸味,酱油有咸味,D选项正确。
4.若A+酸 盐+水,则A不可能属于( )
A.氧化物 B.单质
C.碱 D.电解质
【解析】选B。本题考查各类物质之间的转化关系。碱性氧化物能够和酸反应生成盐和水,如Na2O+2HCl====2NaCl
+H2O,A选项符合;一般活泼金属单质能够和酸反应生成盐和氢气,而不能生成水,B选项不符合;碱和酸发生中和反应生成盐和水,如NaOH+HCl====NaCl+H2O,C选项符合;碱性氧化物和碱都属于电解质,所以D选项符合。
5.有一种黄棕色气体X,其体积为20毫升,完全分解后生成10毫升氯气和20毫升氧气(同温同压下测定),判断X为三原子分子的依据是( )
①质量守恒定律 ②能量守恒定律
③能量最低原理 ④阿伏加德罗定律
A.①② B.①④
C.②③ D.②④
【解析】选B。由阿伏加德罗定律可确定物质化学计量数:2X====Cl2+2O2,然后,再根据质量守恒定律,可求得X为ClO2。
6.发射我国第一颗探月卫星嫦娥三号的长征三号运载火箭的燃料中含有肼(N2H4)。下列分子所含电子总数与肼分子不相同的是( )
A.F2 B.CH3OH
C.CH3NH2 D.N2O4
【解析】选D。N2O4分子中含电子总数为7×2+8×4=46,其余的都含18个电子。
7.“黑火药”是制造节日焰火的主要原料,一般含有硫磺、木炭和硝酸钾。“黑火药”属于( )
A.单质 B.化合物 C.混合物 D.有机物
【解析】选C。由于黑火药中含硫磺、木炭和硝酸钾三种物质,属于混合物。
8.不另加试剂,用最简捷的方法来鉴别下列5种溶液:
①KOH;②Ba(NO3)2;③FeCl3;④NaCl;⑤MgSO4,被鉴
别出的先后顺序为( )
A.①⑤②④③ B.③①⑤②④
C.①③⑤④② D.⑤②①③④
【解析】选B。FeCl3溶液呈棕黄色,其余溶液都无色,所以最先鉴别出FeCl3溶液;将FeCl3溶液加到剩余四种溶液中,KOH和FeCl3溶液反应生成红褐色的Fe(OH)3沉淀;将KOH溶液加到剩余三种溶液中,MgSO4和KOH溶液反应生成白色的Mg(OH)2沉淀;最后将MgSO4溶液加到剩余两种溶液中,Ba(NO3)2和MgSO4溶液反应生成白色的BaSO4沉淀,而NaCl和MgSO4溶液不反应。
【方法技巧】“不用其他任何试剂鉴别”的问题应遵循的原则:
(1)先根据物质的外观特征,鉴别出其中的一种或几种,然后再利用它们鉴别其他几种物质。
(2)若无明显的外观特征,则可以考虑是否可以用加热或焰色反应来鉴别。
(3)若以上两种方法都不能鉴别时,可以考虑两两混合法,记录混合后的反应现象,分析确定。
(4)若被鉴别物质为两种时,还可以考虑从试剂加入顺序不同,现象不同这一方面而进行鉴别。
9.(2011·汕头高一检测)配制相同体积、相同物质的量浓度的溶液,所用溶质的质量最大的是( )
A.CuCl2 B.CaCl2 C.K2SO4 D.ZnSO4
【解析】选C。根据m(溶质)=c×V×M,在溶液的物质的量浓度和溶液的体积相同的情况下,溶质的摩尔质量越大,溶质的质量也越大。各物质的摩尔质量依次是:135 g/mol、111 g/mol、174 g/mol和161 g/mol。
10.除去下列溶液中的杂质(括号内为杂质),选择试剂不正确的是( )
A.HNO3(HCl):用AgNO3
B.NaOH[Ba(OH)2]:用Na2SO4
C.NaCl(Na2SO4):用Ba(NO3)2
D.KOH(K2CO3):用Ca(OH)2
【解析】选C。除去NaCl中的Na2SO4,若选用Ba(NO3)2溶液,则会带入不容易除去的杂质NO3-,应选用BaCl2溶液。
11.V2O5常用作制硫酸和有机合成的催化剂。V2O5和V2O3按不同物质的量之比混合,可按计量完全反应。今欲制备V8O17,则V2O3和V2O5的物质的量之比应为( )
A.1∶3 B.3∶1
C.3∶5 D.5∶3
【解析】选C。假设V2O3和V2O5的物质的量分别是x和y,根据化学反应前后V和O元素守恒得:2x+2y=8,3x+5y=17,解得:x=1.5,y=2.5,所以x∶y=3∶5。
12.按体积比为1∶2∶3组成的N2、O2、CO2的混合气体共100 g,在标准状况下的体积为( )
A.60 L B.30 L C.11.2 L D.112 L
【解析】选A。根据阿伏加德罗定律,在同温同压下,气体的体积比等于物质的量之比,假设三种气体的物质的量分别为x、2x和3x,则有:x×28 g·mol-1+2x×32 g·mol-1
+3x×44 g·mol-1=100 g,得x= mol,n(混合)=x+2x+3x=6x= mol,V(混合)= mol×22.4 L·
mol-1=60 L。
二、非选择题(本题包括4小题,共52分)
13.(14分)(2011·宿迁高一检测)用98%的浓硫酸(ρ=1.84 g·cm-3)配制480 mL 0.5 mol·L-1的稀硫酸,请按要求填空:
(1)实验中需要用到的定量仪器有_________。
(2)若实验中出现下列现象,对所配溶液的浓度有什么影响(填“偏高”、“偏低”或“无影响”)?
①浓硫酸溶解后未冷却至室温就进行转移、定容________。
②定容时仰视刻度线_________。
(3)若实验操作全部无误,最后所得的溶液应存放在试剂瓶中,并贴上标签,请你把标签上的内容写一下(如图)。
【解析】(1)密度为1.84 g·cm-3的98%的浓硫酸的物质的量
浓度为18.4 mol·L-1,则用该浓硫酸配制480 mL 0.5 mol·
L-1的稀硫酸时需要用500 mL的容量瓶,根据稀释前后硫酸的
物质的量不变,则有:V×18.4 mol·L-1=500 mL×0.5 mol·
L-1,所以需要浓硫酸的体积为V=13.6 mL,则用到20 mL的量
筒,稀释时又用到烧杯和玻璃棒,转移时用到500 mL的容量
瓶,定容时还需要胶头滴管。(2)因为浓硫酸溶于水放热,温度
未恢复至室温就转移至容量瓶中并定容,当恢复至室温后,容
量瓶内的液体就会冷缩使液面降至刻度线以下,使溶液的体积偏小,所以溶液浓度偏高。定容时若仰视刻度线(如下图所示),则所加液体的体积超过刻度线,使溶液的体积偏大,所以溶液浓度偏低。(3)标签上要注明溶质的成分及其浓度。
答案:(1)20 mL量筒、500 mL容量瓶
(2)偏高 偏低
(3)
14.(12分)实验室里常用的干燥剂有:①98%的浓硫酸;②无水氯化钙;③变色硅胶[主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂];④五氧化二磷;⑤碱石灰(主要成分是氢氧化钠、氧化钙)等。
(1)上述物质中,属于纯净物的是_______(填序号)。
(2)上述干燥剂中,不能用于干燥氯化氢气体的是________
(填序号)。
(3)上述①~④中,其主要成分依次属于______、______、________、(填写各物质所属的化合物类别)。
【解析】(1)纯净物只含有一种物质,无水氯化钙和五氧化二磷属于纯净物;(2)氯化氢是一种酸性气体,能够和氢氧化钠及氧化钙反应,不能用碱性干燥剂干燥;(3)硫酸属于酸,无水氯化钙属于盐,二氧化硅和五氧化二磷属于酸性氧化物。
答案:(1)②④ (2)⑤ (3)酸 盐 氧化物 氧化物
15. (14分)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
(1)与离子相对应的元素的符号是_____,与原子相对应的离子的结构示意图是________。
(2)电子层结构相同的是(填写代号,在本小题中下同)___,性质最稳定的是______,最容易失去电子的是________,最容易得到电子的是________。
(3)可直接相互结合形成化合物的化学式是_______,可经过得失电子后再相互结合形成化合物的化学式是________。
(4)在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号______。
【解析】(1)在A~E这五种粒子中,A是Cl,B是O2-,C是Ne,
D是Na,E是Mg2+。Ne的特殊稳定性决定了它不能形成离子。
(2)电子层结构相同,即电子层数和各个电子层上的电子数目都相同,但与原子核无关。O2-、Ne和Mg2+都具有稳定的电子层结构,但最稳定的是Ne。
(3)阳离子与阴离子可直接相互结合形成化合物;活泼金属元素的原子与活泼非金属元素的原子经过得失电子后可相互结合形成化合物;在化合物里,Na显+1价、Mg显+2价、Cl显-1价、O显-2价。
(4)在核电荷数1~10的元素内,N原子的核外共有7个电子,其中最外层上有5个,N原子得到3个电子后形成的N3-与B的电子层结构相同;F原子的核外共有9个电子,其中最外层上有7个,F原子得到1个电子后形成的F-与B的电子层结构相同。
答案:(1)O、Mg
(2)B、C、E C D A
(3)MgO NaCl (4)N3-、F-
16.(12分)(2011·杭州高一检测)如图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:
(1)两种物质都是电解质的是_______(填分类标准代号,下同),两种物质都是氧化物的是_______。
(2)分类标准代号A表示_______(多项选择)
a.两物质都是非电解质
b.两物质都是有机物
c.两物质都是含碳化合物
d.两物质都是氧化物
(3)上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,该反应的化学方程式为_________。
(4)图中相连的两种物质能相互反应的是_____(填分类标准代号),其反应的基本类型是__________反应。
(5)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为______,该反应的化学方程式为____________。
【解析】(1)酸、碱、盐和大多数金属氧化物都是电解质,酒精、蔗糖等大多数有机物、非金属氧化物等都是非电解质。氧化物中只含两种元素,其中一种是氧元素,所以NaOH不属于氧化物;(2)C2H5OH和CO2都属于非电解质,都含有碳元素,前者属于有机物,不是氧化物,后者属于无机物,属于氧化物。(3)活泼金属单质、碱性氧化物、碱能够和强酸反应,而且题目要求反应物和生成物都为图中物质,所以该反应的反应物是Fe2O3,生成物是FeCl3,则该强酸是HCl。(4)两种物质能够相互反应的只有D,即FeCl3+
3NaOH====Fe(OH)3↓+3NaCl,该反应为复分解反应。
(5)红褐色的溶液最可能是Fe(OH)3胶体,它是由饱和FeCl3溶液和沸水反应制得的。
答案:(1)C、D B (2)a、c
(3)Fe2O3+6HCl====2FeCl3+3H2O
(4)D 复分解
(5)胶体 FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
====
(一)
专题1 化学家眼中的物质世界
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,
共48分)
1.胶体分散系与其他分散系的本质区别是 ( )
A.是否有丁达尔效应 B.是否透明
C.分散质直径大小 D.是否稳定
【解析】选C。胶体分散系与其他分散系的本质区别是分散质粒子直径大小。
2.下列说法正确的是( )
A.氢氧化钠的摩尔质量是40 g
B.“物质的量浓度”可简称为“量浓度”
C.阿伏加德罗常数的单位是mol-1
D.1 mol任何物质所占体积都是22.4 L
【解析】选C。摩尔质量的单位是g·mol-1,A不正确;“物质的量浓度”是一个整体概念,不可拆分理解,B不正确;C正确;D中未注明气体所处的状态,D不正确。
3.(2011·宁波高一检测)区分下列各组物质,所用的两种方法不完全正确的一组是( )
【解析】选A。蒸馏水和自来水都是无色的液体,通过观察颜色无法区别,A选项错误。Na2CO3遇到食醋有气泡产生,食盐遇到食醋没有明显现象产生;面碱可以作为制馒头的蓬松剂,而食盐不能,B选项正确。黄铜在灼烧时颜色会变黑,而黄金不变色;黄金的密度比黄铜的大,C选项正确。黑醋容易挥发出有刺激性气味的醋酸,而酱油不容易挥发;黑醋有酸味,酱油有咸味,D选项正确。
4.若A+酸 盐+水,则A不可能属于( )
A.氧化物 B.单质
C.碱 D.电解质
【解析】选B。本题考查各类物质之间的转化关系。碱性氧化物能够和酸反应生成盐和水,如Na2O+2HCl====2NaCl
+H2O,A选项符合;一般活泼金属单质能够和酸反应生成盐和氢气,而不能生成水,B选项不符合;碱和酸发生中和反应生成盐和水,如NaOH+HCl====NaCl+H2O,C选项符合;碱性氧化物和碱都属于电解质,所以D选项符合。
5.有一种黄棕色气体X,其体积为20毫升,完全分解后生成10毫升氯气和20毫升氧气(同温同压下测定),判断X为三原子分子的依据是( )
①质量守恒定律 ②能量守恒定律
③能量最低原理 ④阿伏加德罗定律
A.①② B.①④
C.②③ D.②④
【解析】选B。由阿伏加德罗定律可确定物质化学计量数:2X====Cl2+2O2,然后,再根据质量守恒定律,可求得X为ClO2。
6.发射我国第一颗探月卫星嫦娥三号的长征三号运载火箭的燃料中含有肼(N2H4)。下列分子所含电子总数与肼分子不相同的是( )
A.F2 B.CH3OH
C.CH3NH2 D.N2O4
【解析】选D。N2O4分子中含电子总数为7×2+8×4=46,其余的都含18个电子。
7.“黑火药”是制造节日焰火的主要原料,一般含有硫磺、木炭和硝酸钾。“黑火药”属于( )
A.单质 B.化合物 C.混合物 D.有机物
【解析】选C。由于黑火药中含硫磺、木炭和硝酸钾三种物质,属于混合物。
8.不另加试剂,用最简捷的方法来鉴别下列5种溶液:
①KOH;②Ba(NO3)2;③FeCl3;④NaCl;⑤MgSO4,被鉴
别出的先后顺序为( )
A.①⑤②④③ B.③①⑤②④
C.①③⑤④② D.⑤②①③④
【解析】选B。FeCl3溶液呈棕黄色,其余溶液都无色,所以最先鉴别出FeCl3溶液;将FeCl3溶液加到剩余四种溶液中,KOH和FeCl3溶液反应生成红褐色的Fe(OH)3沉淀;将KOH溶液加到剩余三种溶液中,MgSO4和KOH溶液反应生成白色的Mg(OH)2沉淀;最后将MgSO4溶液加到剩余两种溶液中,Ba(NO3)2和MgSO4溶液反应生成白色的BaSO4沉淀,而NaCl和MgSO4溶液不反应。
【方法技巧】“不用其他任何试剂鉴别”的问题应遵循的原则:
(1)先根据物质的外观特征,鉴别出其中的一种或几种,然后再利用它们鉴别其他几种物质。
(2)若无明显的外观特征,则可以考虑是否可以用加热或焰色反应来鉴别。
(3)若以上两种方法都不能鉴别时,可以考虑两两混合法,记录混合后的反应现象,分析确定。
(4)若被鉴别物质为两种时,还可以考虑从试剂加入顺序不同,现象不同这一方面而进行鉴别。
9.(2011·汕头高一检测)配制相同体积、相同物质的量浓度的溶液,所用溶质的质量最大的是( )
A.CuCl2 B.CaCl2 C.K2SO4 D.ZnSO4
【解析】选C。根据m(溶质)=c×V×M,在溶液的物质的量浓度和溶液的体积相同的情况下,溶质的摩尔质量越大,溶质的质量也越大。各物质的摩尔质量依次是:135 g/mol、111 g/mol、174 g/mol和161 g/mol。
10.除去下列溶液中的杂质(括号内为杂质),选择试剂不正确的是( )
A.HNO3(HCl):用AgNO3
B.NaOH[Ba(OH)2]:用Na2SO4
C.NaCl(Na2SO4):用Ba(NO3)2
D.KOH(K2CO3):用Ca(OH)2
【解析】选C。除去NaCl中的Na2SO4,若选用Ba(NO3)2溶液,则会带入不容易除去的杂质NO3-,应选用BaCl2溶液。
11.V2O5常用作制硫酸和有机合成的催化剂。V2O5和V2O3按不同物质的量之比混合,可按计量完全反应。今欲制备V8O17,则V2O3和V2O5的物质的量之比应为( )
A.1∶3 B.3∶1
C.3∶5 D.5∶3
【解析】选C。假设V2O3和V2O5的物质的量分别是x和y,根据化学反应前后V和O元素守恒得:2x+2y=8,3x+5y=17,解得:x=1.5,y=2.5,所以x∶y=3∶5。
12.按体积比为1∶2∶3组成的N2、O2、CO2的混合气体共100 g,在标准状况下的体积为( )
A.60 L B.30 L C.11.2 L D.112 L
【解析】选A。根据阿伏加德罗定律,在同温同压下,气体的体积比等于物质的量之比,假设三种气体的物质的量分别为x、2x和3x,则有:x×28 g·mol-1+2x×32 g·mol-1
+3x×44 g·mol-1=100 g,得x= mol,n(混合)=x+2x+3x=6x= mol,V(混合)= mol×22.4 L·
mol-1=60 L。
二、非选择题(本题包括4小题,共52分)
13.(14分)(2011·宿迁高一检测)用98%的浓硫酸(ρ=1.84 g·cm-3)配制480 mL 0.5 mol·L-1的稀硫酸,请按要求填空:
(1)实验中需要用到的定量仪器有_________。
(2)若实验中出现下列现象,对所配溶液的浓度有什么影响(填“偏高”、“偏低”或“无影响”)?
①浓硫酸溶解后未冷却至室温就进行转移、定容________。
②定容时仰视刻度线_________。
(3)若实验操作全部无误,最后所得的溶液应存放在试剂瓶中,并贴上标签,请你把标签上的内容写一下(如图)。
【解析】(1)密度为1.84 g·cm-3的98%的浓硫酸的物质的量
浓度为18.4 mol·L-1,则用该浓硫酸配制480 mL 0.5 mol·
L-1的稀硫酸时需要用500 mL的容量瓶,根据稀释前后硫酸的
物质的量不变,则有:V×18.4 mol·L-1=500 mL×0.5 mol·
L-1,所以需要浓硫酸的体积为V=13.6 mL,则用到20 mL的量
筒,稀释时又用到烧杯和玻璃棒,转移时用到500 mL的容量
瓶,定容时还需要胶头滴管。(2)因为浓硫酸溶于水放热,温度
未恢复至室温就转移至容量瓶中并定容,当恢复至室温后,容
量瓶内的液体就会冷缩使液面降至刻度线以下,使溶液的体积偏小,所以溶液浓度偏高。定容时若仰视刻度线(如下图所示),则所加液体的体积超过刻度线,使溶液的体积偏大,所以溶液浓度偏低。(3)标签上要注明溶质的成分及其浓度。
答案:(1)20 mL量筒、500 mL容量瓶
(2)偏高 偏低
(3)
14.(12分)实验室里常用的干燥剂有:①98%的浓硫酸;②无水氯化钙;③变色硅胶[主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂];④五氧化二磷;⑤碱石灰(主要成分是氢氧化钠、氧化钙)等。
(1)上述物质中,属于纯净物的是_______(填序号)。
(2)上述干燥剂中,不能用于干燥氯化氢气体的是________
(填序号)。
(3)上述①~④中,其主要成分依次属于______、______、________、(填写各物质所属的化合物类别)。
【解析】(1)纯净物只含有一种物质,无水氯化钙和五氧化二磷属于纯净物;(2)氯化氢是一种酸性气体,能够和氢氧化钠及氧化钙反应,不能用碱性干燥剂干燥;(3)硫酸属于酸,无水氯化钙属于盐,二氧化硅和五氧化二磷属于酸性氧化物。
答案:(1)②④ (2)⑤ (3)酸 盐 氧化物 氧化物
15. (14分)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
(1)与离子相对应的元素的符号是_____,与原子相对应的离子的结构示意图是________。
(2)电子层结构相同的是(填写代号,在本小题中下同)___,性质最稳定的是______,最容易失去电子的是________,最容易得到电子的是________。
(3)可直接相互结合形成化合物的化学式是_______,可经过得失电子后再相互结合形成化合物的化学式是________。
(4)在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号______。
【解析】(1)在A~E这五种粒子中,A是Cl,B是O2-,C是Ne,
D是Na,E是Mg2+。Ne的特殊稳定性决定了它不能形成离子。
(2)电子层结构相同,即电子层数和各个电子层上的电子数目都相同,但与原子核无关。O2-、Ne和Mg2+都具有稳定的电子层结构,但最稳定的是Ne。
(3)阳离子与阴离子可直接相互结合形成化合物;活泼金属元素的原子与活泼非金属元素的原子经过得失电子后可相互结合形成化合物;在化合物里,Na显+1价、Mg显+2价、Cl显-1价、O显-2价。
(4)在核电荷数1~10的元素内,N原子的核外共有7个电子,其中最外层上有5个,N原子得到3个电子后形成的N3-与B的电子层结构相同;F原子的核外共有9个电子,其中最外层上有7个,F原子得到1个电子后形成的F-与B的电子层结构相同。
答案:(1)O、Mg
(2)B、C、E C D A
(3)MgO NaCl (4)N3-、F-
16.(12分)(2011·杭州高一检测)如图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:
(1)两种物质都是电解质的是_______(填分类标准代号,下同),两种物质都是氧化物的是_______。
(2)分类标准代号A表示_______(多项选择)
a.两物质都是非电解质
b.两物质都是有机物
c.两物质都是含碳化合物
d.两物质都是氧化物
(3)上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,该反应的化学方程式为_________。
(4)图中相连的两种物质能相互反应的是_____(填分类标准代号),其反应的基本类型是__________反应。
(5)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为______,该反应的化学方程式为____________。
【解析】(1)酸、碱、盐和大多数金属氧化物都是电解质,酒精、蔗糖等大多数有机物、非金属氧化物等都是非电解质。氧化物中只含两种元素,其中一种是氧元素,所以NaOH不属于氧化物;(2)C2H5OH和CO2都属于非电解质,都含有碳元素,前者属于有机物,不是氧化物,后者属于无机物,属于氧化物。(3)活泼金属单质、碱性氧化物、碱能够和强酸反应,而且题目要求反应物和生成物都为图中物质,所以该反应的反应物是Fe2O3,生成物是FeCl3,则该强酸是HCl。(4)两种物质能够相互反应的只有D,即FeCl3+
3NaOH====Fe(OH)3↓+3NaCl,该反应为复分解反应。
(5)红褐色的溶液最可能是Fe(OH)3胶体,它是由饱和FeCl3溶液和沸水反应制得的。
答案:(1)C、D B (2)a、c
(3)Fe2O3+6HCl====2FeCl3+3H2O
(4)D 复分解
(5)胶体 FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
====
