4.3质量守恒定律巩固练习—2021-2022学年九年级化学沪教版(全国)上册(word版 含答案)
文档属性
| 名称 | 4.3质量守恒定律巩固练习—2021-2022学年九年级化学沪教版(全国)上册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 228.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-04 21:10:29 | ||
图片预览



文档简介
4.3质量守恒定律——巩固练习
一、单选题(共10题)
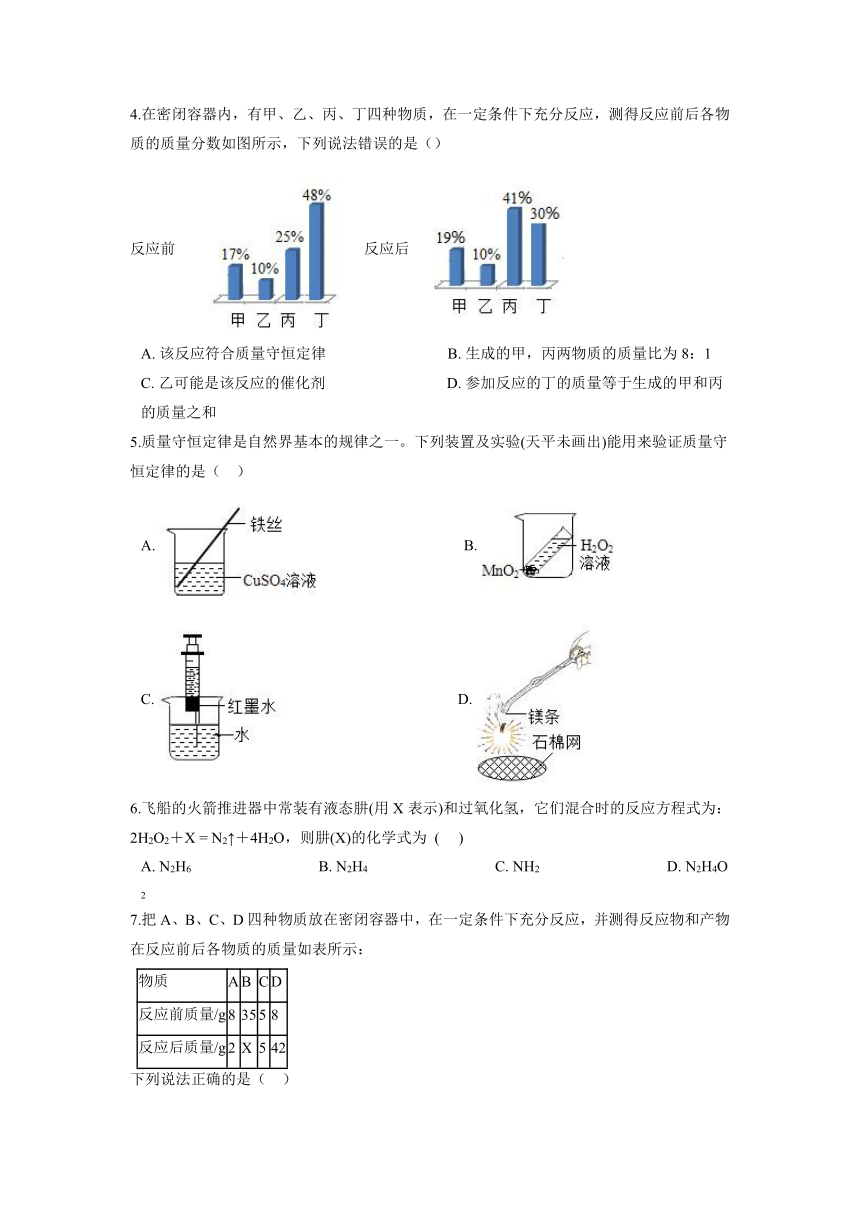
1.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图,下列说法中正确的是( )
A. 该反应为化合反应 B. 丙一定为该反应的催化剂
C. 此反应中乙物质和丁物质的质量比为3:2 D. 丁的相对分子质量是甲的2倍
2.在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示。关于此反应下列认识错误的是( )
物质 甲 乙 丙 丁
反应前质量(g) 68 100 1 0
反应后质量(g) 0 X 37 128
A. x的值为4 B. 物质甲和乙都是反应物,且甲完全反应
C. 参加反应的乙和丁的质量比96:128 D. 该反应是化合反应
3.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下反应一段时间后,测得反应前后各物质质量如下表:
物质 甲 乙 丙 丁
反应前质量(g) 20 5 12 10
反应后质量(g) 待测 5 6 34
关于此反应,下列认识错误的是:( )
A. 物质丁一定不是单质 B. 反应后容器中甲的质量是2g
C. 丙、丁的相对分子质量之比一定为1:4 D. 在该反应中,乙可能是催化剂
4.在密闭容器内,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是()
反应前 反应后
A. 该反应符合质量守恒定律 B. 生成的甲,丙两物质的质量比为8:1
C. 乙可能是该反应的催化剂 D. 参加反应的丁的质量等于生成的甲和丙的质量之和
5.质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )
A. B.
C. D.
6.飞船的火箭推进器中常装有液态肼(用X表示)和过氧化氢,它们混合时的反应方程式为:2H2O2+X = N2↑+4H2O,则肼(X)的化学式为 ( )
A. N2H6 B. N2H4 C. NH2 D. N2H4O2
7.把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 A B C D
反应前质量/g 8 35 5 8
反应后质量/g 2 X 5 42
下列说法正确的是( )
A. 该反应是分解反应
B. 反应后密闭容器中B的质量为7g
C. 反应中,C一定是催化剂
D. 该反应中A,B,D的化学计量数之比为3:14:17
8.某化学反应可表示为: ,根据以上信息,下列关于M组成的说法中正确的是( )
A. 只含有C,O元素 B. 只含有C,H元素
C. 含有C,H,O三种元素 D. 一定含有C,O元素,可能含有H元素
9.通常状况下,乙烯(C2H4)是一种无色气体,具有可燃性,其燃烧反应的化学方程式为:C2H4+3O2 2X+2H2O,则下列有关说法正确的是( )
A. 氧气中氧元素的化合价为-2价 B. 水属于有机化合物
C. X中碳、氧元素的原子个数比为1:2 D. 该反应属于化合反应
10.在密闭容器中有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质的质量如图所示,下列说法错误的是()
A. 甲一定是化合物 B. 丙可能是这个反应的催化剂
C. 该反应可能是碳酸钙的分解 D. 乙和丁一定是该反应的生成物
二、多选题(共3题)
11.在一定的条件下,向一密闭的容器内加入A、B、C、D四种物质各20g,充分反应后,测定其质量,得到数据如下:
物质 A B C D
反应前质量(g) 20 20 20 20
反应后质量(g) 20 待测值 16 14
下列说法错误的是( )
A. 容器内发生了化合反应 B. 待测值为10
C. 该反应中C和D的质量比为8:7 D. 物质A可能是该反应的催化剂
12.将一定质量的红磷在一瓶氧气中充分燃烧,其固体质量随时间的变化可用如图表示,则用m2-m1表示的质量是____(填字母序号)。
A. 生成P2O5的质量 B. 生成P2O5中氧元素的质量
C. 参加反应的红磷的质量 D. 参加氧气的质量
13.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如下图所示,图中a、b、c、d分别表示相应物质的质量分数。下列数据错误的是()
A. a=56% B. b=6% C. c=17% D. d=10%
三、填空题(共3题)
14.嫦娥四号探测器,开启了月球探测的新旅程,运载火箭用的推进剂是偏二甲肼(C2H8N2)与四氧化二氮(N2O4),二者反应的方程式为 其中X的化学式为________,你做出推断的依据是________。
15.华为公司研发了一种以甲醇(CH3OH)为原料的新型手机电池,其容量为锂电池的10倍,可连续使用1个月才充一次电,其电池反应原理为: 。其中X的化学式为________,Na2CO3 中碳元素的化合价为________。
16.“史上最贵”的实验:
步骤Ⅰ:让金刚石在充足的氧气中燃烧,收集生成的气体;
步骤Ⅱ:让足量镁条在步骤I生成的气体中燃烧,生成黑色的炭粉和白色的固体氧化物。
(1).步骤II中发生反应的化学方程式: ,
(2).若金刚石质量为m1 , 按上述步骤反应且转化完全,生成的炭粉质量为m2 , 则m1 m2
(填“<”、“>”或“=”),依据为 .
四、综合题(共4题)
17.某市正在逐步将管道煤气由石油液化气(主要成分是丁烷)改为天然气,小明家要进行灶具和燃气泄漏报警器的调整。请回答下列问题。
(1).补全丁烷燃烧的化学方程式:2C4H10+ O2 8CO2+10 。
(2).若相同条件下,气体体积比等于分子数比。改为天然气后,同体积燃料燃烧消耗空气的体积将 (填“增大”或“减小”),则灶具的调整方法是减小 (填“燃料”或“空气”)的进气量。
(3).燃气泄漏报警器的位置要从低于灶具的地方移到高于灶具的地方,其原因是 。
18.空气是一种非常宝贵的资源。
(1)氮气是生产化肥的重要原料。空气中氮气的体积分数为________。
(2)目前未计入空气污染指数监测项目的有______(填字母)。
A.一氧化碳
B.二氧化硫
C.可吸人颗粒物
D.二氧化碳
(3)化工企业的安全生产至关重要,如果合成氨工厂出现氨气泄漏,方圆几里市民都会在空气中闻到刺激性气味,请从分子原子的角度解释________。
(4)硝酸工厂排放的尾气中常含有NO、NO2等有害气体,可用氢氧化钠溶液来吸收:NO+NO2+2NaOH=2X+H2O,X的化学式为________。
19.
(1).已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:当冷却到室温后打开弹簧夹后观察到的实验现象为 。该实验中红磷稍过量的目的是 。
(2).请回忆你学习过的“质量守恒定律”的实验探究,并按要求完成实验方案一和实验方案二。(下表中“实验结论”选填“=”、“>”、“<”符号)
实验方案 方案一 方案二
反应现象 铁钉表面覆盖一层红色的物质,溶液由蓝色变成浅绿色; ;
反应前的总质量 m1 n1
反应后的总质量 m2 n2
实验结论分析 m1 m2 n1 n2
将两个实验结果进行对比讨论时,有同学分析:有一个方案观察到天平不平衡,是因为 , 因此不能说质量不守恒。在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是 。
20.某化学兴趣小组的同学分别设计四个实验用于验证质量守恒定律如图所示:
(1)实验A中,发生化学反应的化学方程式为________,小气球的作用是________。
(2)实验B中,反应前天平平衡,然后将稀盐酸倒入烧杯中与石灰石小块充分反应后再称量,观察到反应后天平不平衡,天平指针向________偏转,其原因是________。
(3)如图C所示的小实验。在一根用细铜丝吊着的长玻璃棒两端分别绕上10cm长的粗铜线,并使玻璃棒保持水平。然后,用酒精灯给左边一端铜丝加热1-2分钟。冷却后,他们观察到的现象是:①________②________。
答案部分
一、单选题
1.【答案】 C
2.【答案】 D
3.【答案】 C
4.【答案】 B
5.【答案】 A
6.【答案】 B
7.【答案】 B
8.【答案】 D
9.【答案】 C
10.【答案】 C
二、多选题
11.【答案】 B,C
12.【答案】 B,D
13.【答案】 B,C
三、填空题
14.【答案】 CO2;质量守恒定律
15.【答案】 O2;+4
16.【答案】 (1)2Mg+CO2点燃2MgO+C
(2)=;质量守恒定律定律(或化学反应前后元素质量相等)
四、综合题
17.【答案】 (1)13;H2O
(2)减小;空气
(3)甲烷的密度比空气的小,而丁烷的密度比空气的大
18.【答案】 (1)78%
(2)D
(3)分子在不断运动
(4)NaNO2
19.【答案】 (1)烧杯中的水进入集气瓶中,进入水的体积约占集气瓶内空气体积的 ;耗尽氧气
(2)=;产生大量的气泡;>;生成的气体逸出;在密闭的容器中进行实验
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
20.【答案】 (1);平衡装置内外压强,防止瓶塞飞出
(2)右;生成的二氧化碳扩散到空气中
(3)a端铜丝变黑;玻璃棒a端下降,b端上升
一、单选题(共10题)
1.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图,下列说法中正确的是( )
A. 该反应为化合反应 B. 丙一定为该反应的催化剂
C. 此反应中乙物质和丁物质的质量比为3:2 D. 丁的相对分子质量是甲的2倍
2.在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示。关于此反应下列认识错误的是( )
物质 甲 乙 丙 丁
反应前质量(g) 68 100 1 0
反应后质量(g) 0 X 37 128
A. x的值为4 B. 物质甲和乙都是反应物,且甲完全反应
C. 参加反应的乙和丁的质量比96:128 D. 该反应是化合反应
3.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下反应一段时间后,测得反应前后各物质质量如下表:
物质 甲 乙 丙 丁
反应前质量(g) 20 5 12 10
反应后质量(g) 待测 5 6 34
关于此反应,下列认识错误的是:( )
A. 物质丁一定不是单质 B. 反应后容器中甲的质量是2g
C. 丙、丁的相对分子质量之比一定为1:4 D. 在该反应中,乙可能是催化剂
4.在密闭容器内,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是()
反应前 反应后
A. 该反应符合质量守恒定律 B. 生成的甲,丙两物质的质量比为8:1
C. 乙可能是该反应的催化剂 D. 参加反应的丁的质量等于生成的甲和丙的质量之和
5.质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )
A. B.
C. D.
6.飞船的火箭推进器中常装有液态肼(用X表示)和过氧化氢,它们混合时的反应方程式为:2H2O2+X = N2↑+4H2O,则肼(X)的化学式为 ( )
A. N2H6 B. N2H4 C. NH2 D. N2H4O2
7.把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 A B C D
反应前质量/g 8 35 5 8
反应后质量/g 2 X 5 42
下列说法正确的是( )
A. 该反应是分解反应
B. 反应后密闭容器中B的质量为7g
C. 反应中,C一定是催化剂
D. 该反应中A,B,D的化学计量数之比为3:14:17
8.某化学反应可表示为: ,根据以上信息,下列关于M组成的说法中正确的是( )
A. 只含有C,O元素 B. 只含有C,H元素
C. 含有C,H,O三种元素 D. 一定含有C,O元素,可能含有H元素
9.通常状况下,乙烯(C2H4)是一种无色气体,具有可燃性,其燃烧反应的化学方程式为:C2H4+3O2 2X+2H2O,则下列有关说法正确的是( )
A. 氧气中氧元素的化合价为-2价 B. 水属于有机化合物
C. X中碳、氧元素的原子个数比为1:2 D. 该反应属于化合反应
10.在密闭容器中有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质的质量如图所示,下列说法错误的是()
A. 甲一定是化合物 B. 丙可能是这个反应的催化剂
C. 该反应可能是碳酸钙的分解 D. 乙和丁一定是该反应的生成物
二、多选题(共3题)
11.在一定的条件下,向一密闭的容器内加入A、B、C、D四种物质各20g,充分反应后,测定其质量,得到数据如下:
物质 A B C D
反应前质量(g) 20 20 20 20
反应后质量(g) 20 待测值 16 14
下列说法错误的是( )
A. 容器内发生了化合反应 B. 待测值为10
C. 该反应中C和D的质量比为8:7 D. 物质A可能是该反应的催化剂
12.将一定质量的红磷在一瓶氧气中充分燃烧,其固体质量随时间的变化可用如图表示,则用m2-m1表示的质量是____(填字母序号)。
A. 生成P2O5的质量 B. 生成P2O5中氧元素的质量
C. 参加反应的红磷的质量 D. 参加氧气的质量
13.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如下图所示,图中a、b、c、d分别表示相应物质的质量分数。下列数据错误的是()
A. a=56% B. b=6% C. c=17% D. d=10%
三、填空题(共3题)
14.嫦娥四号探测器,开启了月球探测的新旅程,运载火箭用的推进剂是偏二甲肼(C2H8N2)与四氧化二氮(N2O4),二者反应的方程式为 其中X的化学式为________,你做出推断的依据是________。
15.华为公司研发了一种以甲醇(CH3OH)为原料的新型手机电池,其容量为锂电池的10倍,可连续使用1个月才充一次电,其电池反应原理为: 。其中X的化学式为________,Na2CO3 中碳元素的化合价为________。
16.“史上最贵”的实验:
步骤Ⅰ:让金刚石在充足的氧气中燃烧,收集生成的气体;
步骤Ⅱ:让足量镁条在步骤I生成的气体中燃烧,生成黑色的炭粉和白色的固体氧化物。
(1).步骤II中发生反应的化学方程式: ,
(2).若金刚石质量为m1 , 按上述步骤反应且转化完全,生成的炭粉质量为m2 , 则m1 m2
(填“<”、“>”或“=”),依据为 .
四、综合题(共4题)
17.某市正在逐步将管道煤气由石油液化气(主要成分是丁烷)改为天然气,小明家要进行灶具和燃气泄漏报警器的调整。请回答下列问题。
(1).补全丁烷燃烧的化学方程式:2C4H10+ O2 8CO2+10 。
(2).若相同条件下,气体体积比等于分子数比。改为天然气后,同体积燃料燃烧消耗空气的体积将 (填“增大”或“减小”),则灶具的调整方法是减小 (填“燃料”或“空气”)的进气量。
(3).燃气泄漏报警器的位置要从低于灶具的地方移到高于灶具的地方,其原因是 。
18.空气是一种非常宝贵的资源。
(1)氮气是生产化肥的重要原料。空气中氮气的体积分数为________。
(2)目前未计入空气污染指数监测项目的有______(填字母)。
A.一氧化碳
B.二氧化硫
C.可吸人颗粒物
D.二氧化碳
(3)化工企业的安全生产至关重要,如果合成氨工厂出现氨气泄漏,方圆几里市民都会在空气中闻到刺激性气味,请从分子原子的角度解释________。
(4)硝酸工厂排放的尾气中常含有NO、NO2等有害气体,可用氢氧化钠溶液来吸收:NO+NO2+2NaOH=2X+H2O,X的化学式为________。
19.
(1).已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:当冷却到室温后打开弹簧夹后观察到的实验现象为 。该实验中红磷稍过量的目的是 。
(2).请回忆你学习过的“质量守恒定律”的实验探究,并按要求完成实验方案一和实验方案二。(下表中“实验结论”选填“=”、“>”、“<”符号)
实验方案 方案一 方案二
反应现象 铁钉表面覆盖一层红色的物质,溶液由蓝色变成浅绿色; ;
反应前的总质量 m1 n1
反应后的总质量 m2 n2
实验结论分析 m1 m2 n1 n2
将两个实验结果进行对比讨论时,有同学分析:有一个方案观察到天平不平衡,是因为 , 因此不能说质量不守恒。在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是 。
20.某化学兴趣小组的同学分别设计四个实验用于验证质量守恒定律如图所示:
(1)实验A中,发生化学反应的化学方程式为________,小气球的作用是________。
(2)实验B中,反应前天平平衡,然后将稀盐酸倒入烧杯中与石灰石小块充分反应后再称量,观察到反应后天平不平衡,天平指针向________偏转,其原因是________。
(3)如图C所示的小实验。在一根用细铜丝吊着的长玻璃棒两端分别绕上10cm长的粗铜线,并使玻璃棒保持水平。然后,用酒精灯给左边一端铜丝加热1-2分钟。冷却后,他们观察到的现象是:①________②________。
答案部分
一、单选题
1.【答案】 C
2.【答案】 D
3.【答案】 C
4.【答案】 B
5.【答案】 A
6.【答案】 B
7.【答案】 B
8.【答案】 D
9.【答案】 C
10.【答案】 C
二、多选题
11.【答案】 B,C
12.【答案】 B,D
13.【答案】 B,C
三、填空题
14.【答案】 CO2;质量守恒定律
15.【答案】 O2;+4
16.【答案】 (1)2Mg+CO2点燃2MgO+C
(2)=;质量守恒定律定律(或化学反应前后元素质量相等)
四、综合题
17.【答案】 (1)13;H2O
(2)减小;空气
(3)甲烷的密度比空气的小,而丁烷的密度比空气的大
18.【答案】 (1)78%
(2)D
(3)分子在不断运动
(4)NaNO2
19.【答案】 (1)烧杯中的水进入集气瓶中,进入水的体积约占集气瓶内空气体积的 ;耗尽氧气
(2)=;产生大量的气泡;>;生成的气体逸出;在密闭的容器中进行实验
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
20.【答案】 (1);平衡装置内外压强,防止瓶塞飞出
(2)右;生成的二氧化碳扩散到空气中
(3)a端铜丝变黑;玻璃棒a端下降,b端上升
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
