6.2二氧化碳制取的研究(第1课时)课件--2021-2022学年九年级化学人教版上册(20张PPT)
文档属性
| 名称 | 6.2二氧化碳制取的研究(第1课时)课件--2021-2022学年九年级化学人教版上册(20张PPT) | 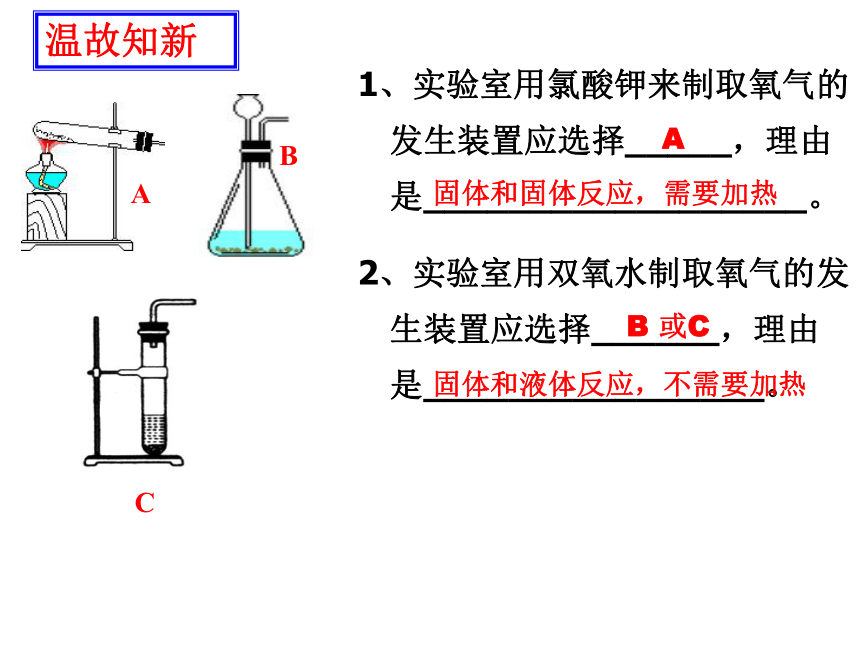 | |
| 格式 | ppt | ||
| 文件大小 | 630.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-04 21:31:15 | ||
图片预览







文档简介
(共20张PPT)
A
B
C
1、实验室用氯酸钾来制取氧气的发生装置应选择_____,理由是__________________。
2、实验室用双氧水制取氧气的发生装置应选择______,理由是________________。
A
固体和固体反应,需要加热
B 或C
固体和液体反应,不需要加热
温故知新
第六单元课题2
第1课时
学习目标
初三化学
1、通过自主学习,对演示实验观察明白实验室制取二氧化碳的原理和方法。
2、通过自主学习和合作学习,理解实验室制取气体的思路和方法。
实验1:稀硫酸与大理石(或石灰石)反应
我们通过下面三个对比实验进行探究
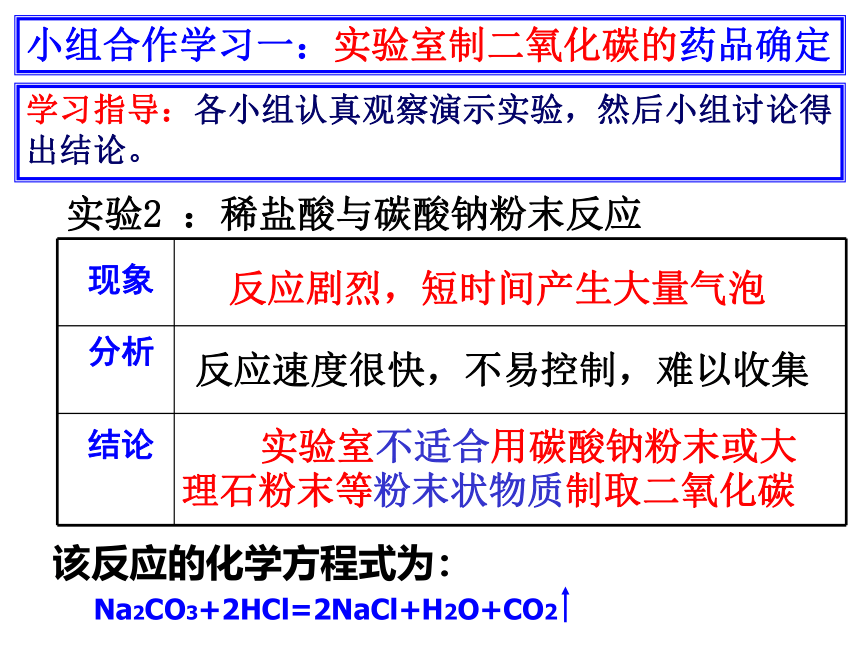
实验2 :稀盐酸与碳酸钠粉末反应
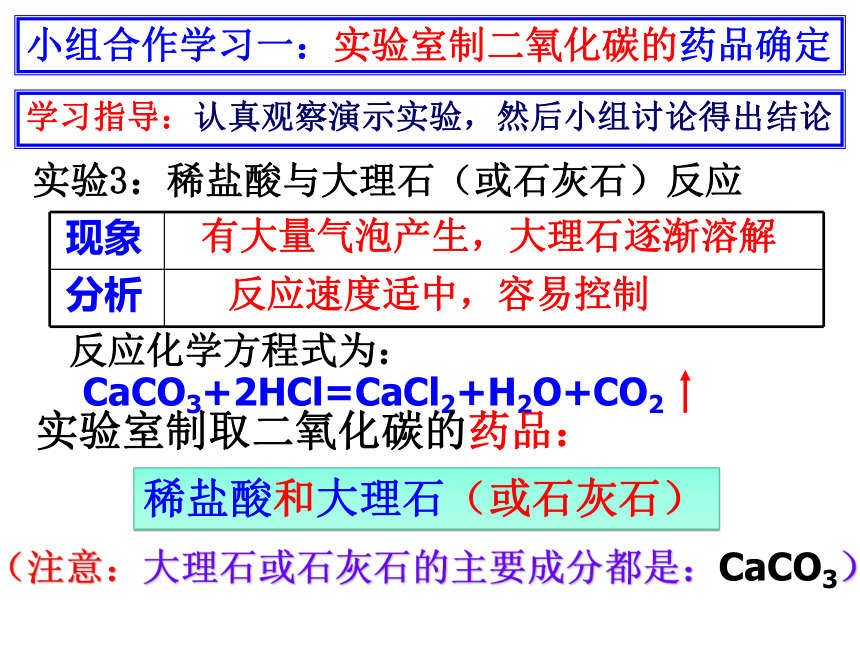
实验3:稀盐酸与大理石(或石灰石)反应
我们通过三个对比实验,确定哪一组药品适合?
小组合作学习一:实验室制二氧化碳的药品确定
学习指导:各小组认真观察演示实验,然后小组讨论得出结论。
实验1:稀硫酸与大理石(或石灰石)反应
现象
分析
刚开始有较多气泡产生,一段时间后,气泡逐渐减少 ,最后反应停止。
反应生成的CaSO4微溶于水,覆盖在大理石表面,阻止反应进行。
结论
实验室制取二氧化碳不适合用稀硫酸
CaCO3+H2SO4==CaSO4+H2O+CO2
该反应的化学方程式为:
小组合作学习一:实验室制二氧化碳的药品确定
学习指导:各小组认真观察演示实验,然后小组讨论得出结论。
实验2 :稀盐酸与碳酸钠粉末反应
现象
分析
结论
反应剧烈,短时间产生大量气泡
反应速度很快,不易控制,难以收集
实验室不适合用碳酸钠粉末或大理石粉末等粉末状物质制取二氧化碳
该反应的化学方程式为:
Na2CO3+2HCl=2NaCl+H2O+CO2
小组合作学习一:实验室制二氧化碳的药品确定
学习指导:各小组认真观察演示实验,然后小组讨论得出结论。
实验3:稀盐酸与大理石(或石灰石)反应
现象
分析
有大量气泡产生,大理石逐渐溶解
反应化学方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2
反应速度适中,容易控制
实验室制取二氧化碳的药品:
稀盐酸和大理石(或石灰石)
(注意:大理石或石灰石的主要成分都是:CaCO3)
小组合作学习一:实验室制二氧化碳的药品确定
学习指导:认真观察演示实验,然后小组讨论得出结论
稀盐酸与大理石(或石灰石)
1、药品:
2、反应原理:
CaCO3+2HCl=CaCl2+H2O+CO2
(大理石或石灰石的主要成分都是:CaCO3)
学法指导:先自主阅读课本P113,然后小组讨论得出结论。
小组合作学习一:实验室制二氧化碳的药品确定
一、实验室制二氧化碳的药品及反应原理
注意:不能用浓盐酸代替稀盐酸。因为浓盐酸有挥发性,会导致收集到的CO2不纯(含HCl气体)。
想一想:如何确定实验室制取二氧化碳的装置?
小组合作学习二:实验室制取气体的装置的确定
学法指导:先自主阅读课本P113-114,然后小组讨论得出结论。
问题:如何确定实验室制取气体的装置?
实验室制取气体的装置
发生装置
收集装置
反应物的状态
固体和固体反应
固体和液体反应
液体和液体反应
反应条件
…………….
一、实验室制取气体的装置的确定(P113-114)
排空气法
向上排空气法
向下排空气法
排水法
(是否需要加热、加催化剂等)
—密度比空气的大
(相对分子质量>29)
—密度比空气的小
(相对分子质量<29)
—不易溶于水或不与水发生反应
(1)反应原理选择:反应物没有气体;不选择高温、通电等反应条件;反应速度要适中。
(2)发生装置:反应物的状态、反应条件;
(3)收集装置:物质的性质(密度、溶解性等)。
一、实验室制取气体的装置的确定(P113-114)
1、制取气体的装置确定需要考虑的因素:
2、二氧化碳和氧气相关性质比较(P114)
反应物状态 反应条件 气体的密度比空气大或小 能否溶于水
CO2
O2
固体
固体和液体
加热
不加热
密度比空气大
密度比空气大
不易溶于水,不与水反应
溶于水,与水反应
想一想:根据以上提信息,你认为实验室制取CO2时应怎样选择发生装置和收集装置?
液体
不加热、催化剂
密度比空气大
不易溶于水,不与水反应
3、制取CO2的发生装置(课本P115图6-12)
注意事项:
(1)固体药品应先加入锥形瓶中。
(2)长颈漏斗的作用
(3)长颈漏斗的下端管口应伸入反应液面以下;
(4)锥形瓶中的导气管应刚露出胶塞为宜;
--固、液常温型(固体与液体反应,不需加热)
便于加入液体药品。
防止气体从长颈漏斗逸出。
便于气体导出。
4、收集装置
向上排空气法
注意:伸入集气瓶中的导气管口应位于集气瓶底部
目的使空气尽量排出。
想一想:为什么只能用向上排气法收集,不能用排水法收集?
CO2的密度比空气大,且能溶于水
5、二氧化碳的检验(P115讨论1)
将生成的气体通入澄清的石灰水,石灰水变浑浊,证明生成的气体是二氧化碳。
6、验满(P115讨论2)
用燃着的木条放在集气瓶口,如果木条
立即熄灭,证明已集满。
澄清的石灰水
7、实验室制取二氧化碳的 操作步骤
①连接仪器
②检查气密性
③加药品(先固体,后液体)
④收集气体
C+O2 = CO2
点燃
反应物有气体,导致收集到的CO2不纯。
2Cu +
2CuO +
C
高温
CO2↑
“高温”条件,在实验室难以达到。
拓展提升:课本P116的T4。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
反应速度太快,难以收集,所以实验室不适合用粉末状物质与酸反应来制取二氧化碳。
CaCO3+H2SO4=CaSO4+H2O+CO2↑
反应生成的CaSO4微溶于水,覆盖在大理石表面,阻止反应进行,所以实验室不适合用大理石和稀硫酸反应来制取二氧化碳。
长颈漏斗下端没有
插入液面下
导管太长,
伸入了液面下
没有用向上排
空气法收集
下图为实验室制取二氧化碳的装置图,有哪些错误?为什么?(课本P116T2)
小组合作学习三:学以致用
Ca + Cl=CaCl2+ + CO2↑
CO3
CO3
1)反应原理
2)装置图
3)收集方法
4)检验方法
向上排空气法
将气体通入澄清石灰水或向集气瓶倒入少量澄清石灰水,澄清石灰水变浑浊
2H
2H
H2O
5)验满方法
用燃着的木条放在集气瓶口,如果木条熄灭,证明已满。
二氧化碳实验室制法
小组合作学习四:课堂小结
A
B
D
C
课堂练习
1、实验室制取氧气的发生装置应选择______,收集装置应选择______。
2、实验室制取二氧化碳的发生装置应选择______,收集装置应选择______。
A或B或C
D 或E
B 或C
D
E
F
A
B
C
1、实验室用氯酸钾来制取氧气的发生装置应选择_____,理由是__________________。
2、实验室用双氧水制取氧气的发生装置应选择______,理由是________________。
A
固体和固体反应,需要加热
B 或C
固体和液体反应,不需要加热
温故知新
第六单元课题2
第1课时
学习目标
初三化学
1、通过自主学习,对演示实验观察明白实验室制取二氧化碳的原理和方法。
2、通过自主学习和合作学习,理解实验室制取气体的思路和方法。
实验1:稀硫酸与大理石(或石灰石)反应
我们通过下面三个对比实验进行探究
实验2 :稀盐酸与碳酸钠粉末反应
实验3:稀盐酸与大理石(或石灰石)反应
我们通过三个对比实验,确定哪一组药品适合?
小组合作学习一:实验室制二氧化碳的药品确定
学习指导:各小组认真观察演示实验,然后小组讨论得出结论。
实验1:稀硫酸与大理石(或石灰石)反应
现象
分析
刚开始有较多气泡产生,一段时间后,气泡逐渐减少 ,最后反应停止。
反应生成的CaSO4微溶于水,覆盖在大理石表面,阻止反应进行。
结论
实验室制取二氧化碳不适合用稀硫酸
CaCO3+H2SO4==CaSO4+H2O+CO2
该反应的化学方程式为:
小组合作学习一:实验室制二氧化碳的药品确定
学习指导:各小组认真观察演示实验,然后小组讨论得出结论。
实验2 :稀盐酸与碳酸钠粉末反应
现象
分析
结论
反应剧烈,短时间产生大量气泡
反应速度很快,不易控制,难以收集
实验室不适合用碳酸钠粉末或大理石粉末等粉末状物质制取二氧化碳
该反应的化学方程式为:
Na2CO3+2HCl=2NaCl+H2O+CO2
小组合作学习一:实验室制二氧化碳的药品确定
学习指导:各小组认真观察演示实验,然后小组讨论得出结论。
实验3:稀盐酸与大理石(或石灰石)反应
现象
分析
有大量气泡产生,大理石逐渐溶解
反应化学方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2
反应速度适中,容易控制
实验室制取二氧化碳的药品:
稀盐酸和大理石(或石灰石)
(注意:大理石或石灰石的主要成分都是:CaCO3)
小组合作学习一:实验室制二氧化碳的药品确定
学习指导:认真观察演示实验,然后小组讨论得出结论
稀盐酸与大理石(或石灰石)
1、药品:
2、反应原理:
CaCO3+2HCl=CaCl2+H2O+CO2
(大理石或石灰石的主要成分都是:CaCO3)
学法指导:先自主阅读课本P113,然后小组讨论得出结论。
小组合作学习一:实验室制二氧化碳的药品确定
一、实验室制二氧化碳的药品及反应原理
注意:不能用浓盐酸代替稀盐酸。因为浓盐酸有挥发性,会导致收集到的CO2不纯(含HCl气体)。
想一想:如何确定实验室制取二氧化碳的装置?
小组合作学习二:实验室制取气体的装置的确定
学法指导:先自主阅读课本P113-114,然后小组讨论得出结论。
问题:如何确定实验室制取气体的装置?
实验室制取气体的装置
发生装置
收集装置
反应物的状态
固体和固体反应
固体和液体反应
液体和液体反应
反应条件
…………….
一、实验室制取气体的装置的确定(P113-114)
排空气法
向上排空气法
向下排空气法
排水法
(是否需要加热、加催化剂等)
—密度比空气的大
(相对分子质量>29)
—密度比空气的小
(相对分子质量<29)
—不易溶于水或不与水发生反应
(1)反应原理选择:反应物没有气体;不选择高温、通电等反应条件;反应速度要适中。
(2)发生装置:反应物的状态、反应条件;
(3)收集装置:物质的性质(密度、溶解性等)。
一、实验室制取气体的装置的确定(P113-114)
1、制取气体的装置确定需要考虑的因素:
2、二氧化碳和氧气相关性质比较(P114)
反应物状态 反应条件 气体的密度比空气大或小 能否溶于水
CO2
O2
固体
固体和液体
加热
不加热
密度比空气大
密度比空气大
不易溶于水,不与水反应
溶于水,与水反应
想一想:根据以上提信息,你认为实验室制取CO2时应怎样选择发生装置和收集装置?
液体
不加热、催化剂
密度比空气大
不易溶于水,不与水反应
3、制取CO2的发生装置(课本P115图6-12)
注意事项:
(1)固体药品应先加入锥形瓶中。
(2)长颈漏斗的作用
(3)长颈漏斗的下端管口应伸入反应液面以下;
(4)锥形瓶中的导气管应刚露出胶塞为宜;
--固、液常温型(固体与液体反应,不需加热)
便于加入液体药品。
防止气体从长颈漏斗逸出。
便于气体导出。
4、收集装置
向上排空气法
注意:伸入集气瓶中的导气管口应位于集气瓶底部
目的使空气尽量排出。
想一想:为什么只能用向上排气法收集,不能用排水法收集?
CO2的密度比空气大,且能溶于水
5、二氧化碳的检验(P115讨论1)
将生成的气体通入澄清的石灰水,石灰水变浑浊,证明生成的气体是二氧化碳。
6、验满(P115讨论2)
用燃着的木条放在集气瓶口,如果木条
立即熄灭,证明已集满。
澄清的石灰水
7、实验室制取二氧化碳的 操作步骤
①连接仪器
②检查气密性
③加药品(先固体,后液体)
④收集气体
C+O2 = CO2
点燃
反应物有气体,导致收集到的CO2不纯。
2Cu +
2CuO +
C
高温
CO2↑
“高温”条件,在实验室难以达到。
拓展提升:课本P116的T4。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
反应速度太快,难以收集,所以实验室不适合用粉末状物质与酸反应来制取二氧化碳。
CaCO3+H2SO4=CaSO4+H2O+CO2↑
反应生成的CaSO4微溶于水,覆盖在大理石表面,阻止反应进行,所以实验室不适合用大理石和稀硫酸反应来制取二氧化碳。
长颈漏斗下端没有
插入液面下
导管太长,
伸入了液面下
没有用向上排
空气法收集
下图为实验室制取二氧化碳的装置图,有哪些错误?为什么?(课本P116T2)
小组合作学习三:学以致用
Ca + Cl=CaCl2+ + CO2↑
CO3
CO3
1)反应原理
2)装置图
3)收集方法
4)检验方法
向上排空气法
将气体通入澄清石灰水或向集气瓶倒入少量澄清石灰水,澄清石灰水变浑浊
2H
2H
H2O
5)验满方法
用燃着的木条放在集气瓶口,如果木条熄灭,证明已满。
二氧化碳实验室制法
小组合作学习四:课堂小结
A
B
D
C
课堂练习
1、实验室制取氧气的发生装置应选择______,收集装置应选择______。
2、实验室制取二氧化碳的发生装置应选择______,收集装置应选择______。
A或B或C
D 或E
B 或C
D
E
F
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
