物质的分散系(标准课件)
图片预览









文档简介
(共35张PPT)
清晨的森林
阳光明媚
雨过天晴,阳光透过云层
雨后天空的彩虹
豆浆
牛奶
在灯光下,有雾的夜晚,会更加明亮;
在清晨的森林、雨过天晴后的云层缝隙中都会有一缕缕明亮的光线……
这些现象都和我们今天要讲的物质的分散系有关。
复习回顾:
指出溶液、悬浊液、乳浊液的共同点:
1、溶液是一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
2、悬浊液是固体小颗粒悬浮于液体里形成的混合物
3、乳浊液是小液滴分散到液体里形成的混合物
共同点:一种或几种物质分散到另一种物质里,形成的混合物
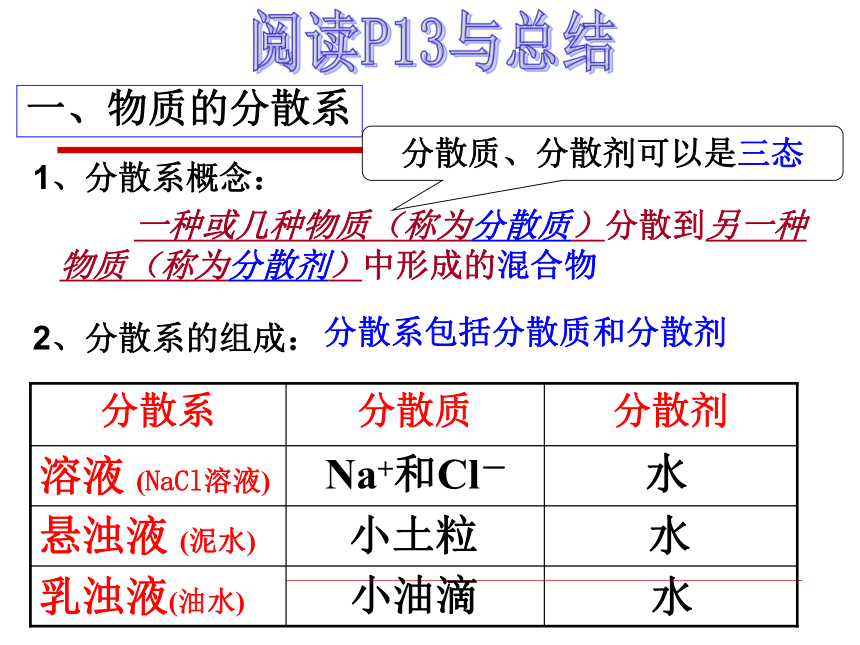
一、物质的分散系
1、分散系概念:
2、分散系的组成:
分散系包括分散质和分散剂
水
小油滴
水
小土粒
水
Na+和Cl-
乳浊液(油水)
悬浊液 (泥水)
溶液 (NaCl溶液)
分散剂
分散质
分散系
一种或几种物质(称为分散质)分散到另一种物质(称为分散剂)中形成的混合物
分散质、分散剂可以是三态
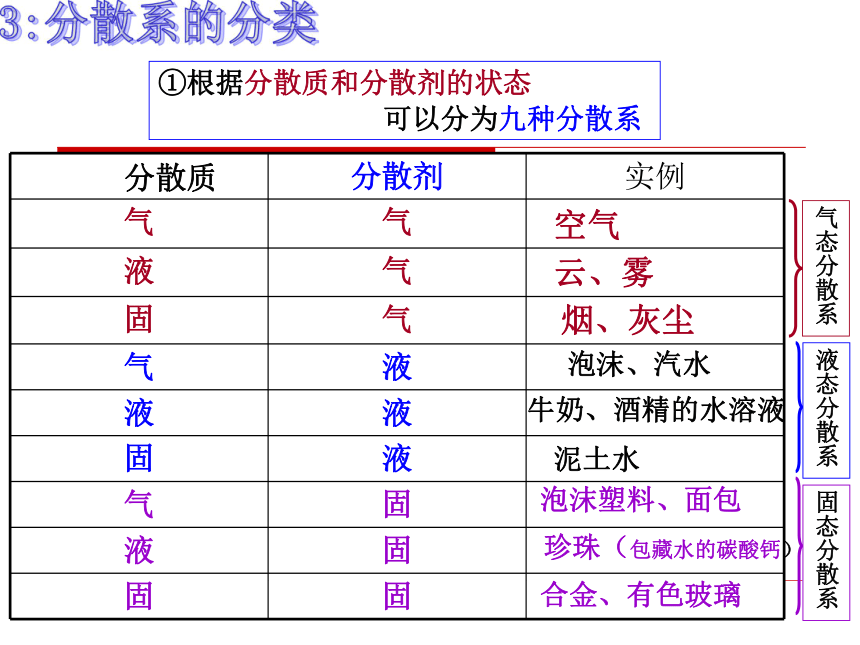
分散质 分散剂 实例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
空气
云、雾
烟、灰尘
泡沫、汽水
牛奶、酒精的水溶液
泥土水
泡沫塑料、面包
珍珠(包藏水的碳酸钙)
合金、有色玻璃
①根据分散质和分散剂的状态
可以分为九种分散系
气态分散系
液态分散系
固态分散系
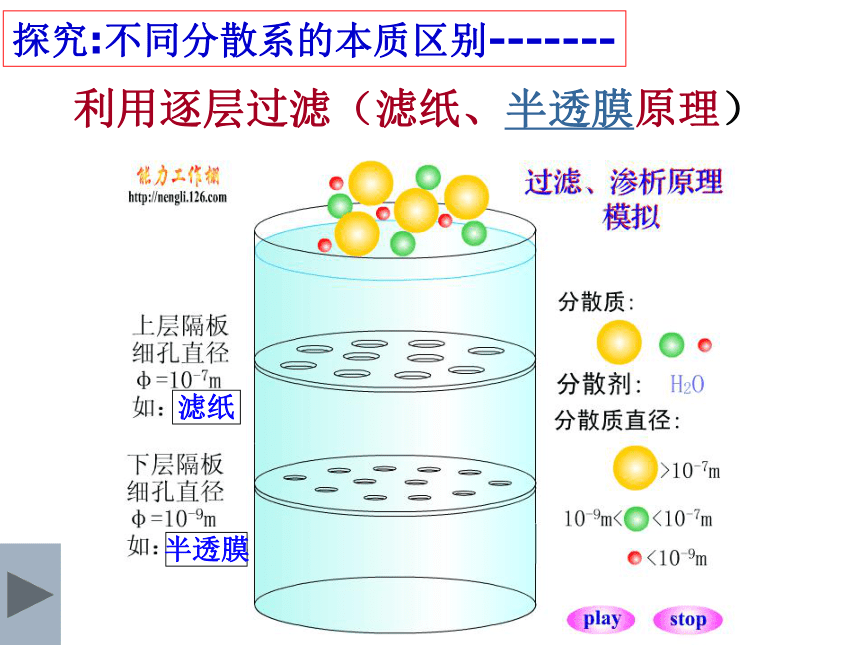
利用逐层过滤(滤纸、半透膜原理)
探究:不同分散系的本质区别-------
滤纸
半透膜
由此可见,不同分散系本质区别:
--------------- 分散质微粒大小不同
②按分散质微粒大小不同分:
1、溶液: < 1nm(10-9m)
2、浊液: > 100nm (10-7m)
3、胶体:介于1nm和100nm之间
分散系
1nm~100nm
>100nm
<1nm
均一透明
较稳定
不均一、不稳定
均一、透明、稳定
不能
不能
能
能
不能
能
分散质微粒大小
外观特征稳定性
能否透过半透膜
能否透过滤纸
胶体
浊液
溶液
分散系
胶体、溶液、浊液三种分散系的比较P导学11
1、定义:
分散质微粒的直径大小在10-9~10-7m之间的分散系
2、性质:
P12
⑴通过实验1和实验2试比较硫酸铜溶液与氢氧化铁胶体有何异同?
——观察与思考
二、胶体的性质和应用
实验内容 实验现象 实验结论
1、溶液、胶体被光照射
2、在悬浊液中加入氢氧化铁胶体
氢氧化铁胶体中有“一条光亮的通路”,硫酸铜溶液中没有
加入氢氧化铁胶体,烧杯中浑浊现象消失并出现沉淀;
另一个烧杯仍然浑浊
胶体具有“丁达尔效应”
胶体具有较强的吸附性,能吸附溶液中悬浮颗粒
表1-5 胶体的性质试验
丁达尔现象 P14
当一束强光透过胶体时,可以看到一条光
亮的通路,这种现象叫做丁达尔现象
用这种方法可以区别溶液和胶体
溶 液
胶 体
2、胶体的性质:
①丁达尔现象(区分溶液和胶体)
②吸附性(作净水剂)
含铝的化合物水解生成Al(OH)3胶体
含铁的化合物水解生成Fe(OH)3胶体
1、如何用简便的方法鉴别胶体和溶液
2、胶体(氢氧化铁,氢氧化铝)的净水原理
用“丁达尔现象”
⑵:根据对以上实验现象的分析,回答下列问题P14
液溶胶:AgI胶体、Fe(OH)3胶体、墨水
淀粉溶液、蛋白质溶液、
血液、 涂料
根据分散剂状态分
固溶胶:有色玻璃、水晶
气溶胶:烟、云、雾
*3、胶体的分类
4、胶体的应用与危害
应用:在日常生活中如,墨水、墨汁、明矾
净水、土壤保肥中均应用胶体原理
危害:烟、雾对生活、交通带来的危害也不可小视
——阅读p14-15
练习
1、胶体和其他分散系(溶液、浊液)的本质区别是 ( )
A、分散质粒子的大小
B、是不是一种稳定的体系
C、会不会产生丁达尔效应
D、粒子有没有带电荷
A
2、“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )。
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会出现黑色沉淀
A.①④ B.②③④
C.②③ D.①③④
C
2.Fe(OH)3胶体和MgCl2溶液共同具备
的性质是( )
A.都比较稳定,密封放置不产生沉淀
B.都有丁达尔现象
C.加入氢氧化钠溶先产生沉淀
D.分散质粒子可通过滤纸
AD
下列物质中哪些是电解质,哪些是非电解质?
Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、蔗糖、NaCl溶液、酒精
三、电解质和非电解质
1、定义:
电解质:在水溶液里或熔融状态下能够导电的化合物,
如酸、碱、盐等
非电解质:在水溶液里和熔融状态下都不导电的化合物,
如蔗糖、酒精等
2、注意点:
(1)电解质、非电解质都是化合物。 Cu是单质,K2SO4与NaCl溶液都是混合物
(2)电解质的导电条件:水溶液或熔融状态下。
(3)电解质导电必须是该化合物本身电离出自由移动的离子而导电,不能是发生化学反应而生成的物质导电。如:CO2、SO2不是电解质,
(4)难溶于水的无机化合物也是电解质。 如:BaSO4、AgCl在水中溶解的部分完全电离。
(5)酸、碱、盐、水是电解质,
蔗糖、酒精等有机物、CO2、SO2、NH3等是非电解质
2:判断下列说法是否正确。
A:NaCl溶液导电,所以NaCl溶液是电解质;
B:固体NaCl不导电,但NaCl是电解质;
C:Cu能导电,所以Cu是电解质;
D:SO3溶于水能导电,所以SO3是电解质;
E:BaSO4的水溶液不导电,所以BaSO4是非电解质。
√
×
×
×
×
1:下列物质中哪些是电解质,哪些是非电解质?
Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、
蔗糖、NaCl溶液、酒精
3、电离及电离方程式 P15
(1): 定义:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
表示方法:电离方程式
NaCl = Na+ + Cl-
KNO3= K+ + NO3-
NaOH=Na+ + OH-
(2):酸、碱、盐的电离 P15
盐酸、硝酸和硫酸都能够导电,说明在水溶液中电离生成了能够自由移动的离子。
电离方程式:
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO4-
电离时生成的阳离子全部是氢离子的化合物叫做酸。
全部
同样,氢氧化钠、氢氧化钾和氢氧化钡的溶液也能够导电,说明在水溶液中电离出能够自由移动的离子。
电离方程式:
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2 OH-
NaOH = Na+ + OH-
电离时生成的阴离子全部是氢氧根离子的化合物叫做碱。
全部
同样,碳酸钠、硫酸钾和氯化钡的溶液也能够导电,说明在水溶液中电离出能够自由移动的离子。
电离方程式:
Na2CO3 = 2Na+ + CO32-
MgSO4 = Mg2+ + SO42-
BaCl2 = Ba+ + 2Cl-
电离时生成金属离子和酸根离子的化合物叫做盐。
通过对酸、碱、盐电离出离子的特点,你判断一下NaHSO4、Cu2(OH)2CO3应该属于哪一类化合物?
P16 问题解决
写出下列物质的电离方程式。
KCl、KOH 、CaCl2 、 Ba(OH)2、 HCl、
Na2CO3
Na2CO3 = 2Na+ + CO3 2-
KCl = K+ + Cl-
HCl = H+ + Cl-
KOH=K+ + OH-
Ba(OH)2=Ba2+ + 2OH-
CaCl2 = Ca2+ + 2Cl-
课堂练习
1、①NaOH溶液 ②铜丝 ③液态HCl ④盐酸 ⑤硫酸 ⑥稀硫酸 ⑦液氨 ⑧氨水 ⑨SO2
⑩胆矾晶体 ⑾熔融NaCl ⑿蔗糖晶体 ⒀酒精 ⒁酒精溶液 ⒂石墨 ⒃BaSO4
(1)上述状态下可导电的是_______________
(2)属于电解质的是____________________
(3)属于非电解质的是____________________
(4)上述状态下的电解质不能导电的是_________
① ② ④ ⑥ ⑧ ⑾ ⒂
③ ⑤ ⑩ ⑾
③ ⑤ ⑩ ⑾ ⒃
⑦ ⑨ ⑿ ⒀
⑦ ⑨ ⑿ ⒀
③ ⑤ ⑩ ⒃
作业:
P书17 6 9
导学教程
清晨的森林
阳光明媚
雨过天晴,阳光透过云层
雨后天空的彩虹
豆浆
牛奶
在灯光下,有雾的夜晚,会更加明亮;
在清晨的森林、雨过天晴后的云层缝隙中都会有一缕缕明亮的光线……
这些现象都和我们今天要讲的物质的分散系有关。
复习回顾:
指出溶液、悬浊液、乳浊液的共同点:
1、溶液是一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
2、悬浊液是固体小颗粒悬浮于液体里形成的混合物
3、乳浊液是小液滴分散到液体里形成的混合物
共同点:一种或几种物质分散到另一种物质里,形成的混合物
一、物质的分散系
1、分散系概念:
2、分散系的组成:
分散系包括分散质和分散剂
水
小油滴
水
小土粒
水
Na+和Cl-
乳浊液(油水)
悬浊液 (泥水)
溶液 (NaCl溶液)
分散剂
分散质
分散系
一种或几种物质(称为分散质)分散到另一种物质(称为分散剂)中形成的混合物
分散质、分散剂可以是三态
分散质 分散剂 实例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
空气
云、雾
烟、灰尘
泡沫、汽水
牛奶、酒精的水溶液
泥土水
泡沫塑料、面包
珍珠(包藏水的碳酸钙)
合金、有色玻璃
①根据分散质和分散剂的状态
可以分为九种分散系
气态分散系
液态分散系
固态分散系
利用逐层过滤(滤纸、半透膜原理)
探究:不同分散系的本质区别-------
滤纸
半透膜
由此可见,不同分散系本质区别:
--------------- 分散质微粒大小不同
②按分散质微粒大小不同分:
1、溶液: < 1nm(10-9m)
2、浊液: > 100nm (10-7m)
3、胶体:介于1nm和100nm之间
分散系
1nm~100nm
>100nm
<1nm
均一透明
较稳定
不均一、不稳定
均一、透明、稳定
不能
不能
能
能
不能
能
分散质微粒大小
外观特征稳定性
能否透过半透膜
能否透过滤纸
胶体
浊液
溶液
分散系
胶体、溶液、浊液三种分散系的比较P导学11
1、定义:
分散质微粒的直径大小在10-9~10-7m之间的分散系
2、性质:
P12
⑴通过实验1和实验2试比较硫酸铜溶液与氢氧化铁胶体有何异同?
——观察与思考
二、胶体的性质和应用
实验内容 实验现象 实验结论
1、溶液、胶体被光照射
2、在悬浊液中加入氢氧化铁胶体
氢氧化铁胶体中有“一条光亮的通路”,硫酸铜溶液中没有
加入氢氧化铁胶体,烧杯中浑浊现象消失并出现沉淀;
另一个烧杯仍然浑浊
胶体具有“丁达尔效应”
胶体具有较强的吸附性,能吸附溶液中悬浮颗粒
表1-5 胶体的性质试验
丁达尔现象 P14
当一束强光透过胶体时,可以看到一条光
亮的通路,这种现象叫做丁达尔现象
用这种方法可以区别溶液和胶体
溶 液
胶 体
2、胶体的性质:
①丁达尔现象(区分溶液和胶体)
②吸附性(作净水剂)
含铝的化合物水解生成Al(OH)3胶体
含铁的化合物水解生成Fe(OH)3胶体
1、如何用简便的方法鉴别胶体和溶液
2、胶体(氢氧化铁,氢氧化铝)的净水原理
用“丁达尔现象”
⑵:根据对以上实验现象的分析,回答下列问题P14
液溶胶:AgI胶体、Fe(OH)3胶体、墨水
淀粉溶液、蛋白质溶液、
血液、 涂料
根据分散剂状态分
固溶胶:有色玻璃、水晶
气溶胶:烟、云、雾
*3、胶体的分类
4、胶体的应用与危害
应用:在日常生活中如,墨水、墨汁、明矾
净水、土壤保肥中均应用胶体原理
危害:烟、雾对生活、交通带来的危害也不可小视
——阅读p14-15
练习
1、胶体和其他分散系(溶液、浊液)的本质区别是 ( )
A、分散质粒子的大小
B、是不是一种稳定的体系
C、会不会产生丁达尔效应
D、粒子有没有带电荷
A
2、“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )。
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会出现黑色沉淀
A.①④ B.②③④
C.②③ D.①③④
C
2.Fe(OH)3胶体和MgCl2溶液共同具备
的性质是( )
A.都比较稳定,密封放置不产生沉淀
B.都有丁达尔现象
C.加入氢氧化钠溶先产生沉淀
D.分散质粒子可通过滤纸
AD
下列物质中哪些是电解质,哪些是非电解质?
Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、蔗糖、NaCl溶液、酒精
三、电解质和非电解质
1、定义:
电解质:在水溶液里或熔融状态下能够导电的化合物,
如酸、碱、盐等
非电解质:在水溶液里和熔融状态下都不导电的化合物,
如蔗糖、酒精等
2、注意点:
(1)电解质、非电解质都是化合物。 Cu是单质,K2SO4与NaCl溶液都是混合物
(2)电解质的导电条件:水溶液或熔融状态下。
(3)电解质导电必须是该化合物本身电离出自由移动的离子而导电,不能是发生化学反应而生成的物质导电。如:CO2、SO2不是电解质,
(4)难溶于水的无机化合物也是电解质。 如:BaSO4、AgCl在水中溶解的部分完全电离。
(5)酸、碱、盐、水是电解质,
蔗糖、酒精等有机物、CO2、SO2、NH3等是非电解质
2:判断下列说法是否正确。
A:NaCl溶液导电,所以NaCl溶液是电解质;
B:固体NaCl不导电,但NaCl是电解质;
C:Cu能导电,所以Cu是电解质;
D:SO3溶于水能导电,所以SO3是电解质;
E:BaSO4的水溶液不导电,所以BaSO4是非电解质。
√
×
×
×
×
1:下列物质中哪些是电解质,哪些是非电解质?
Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、
蔗糖、NaCl溶液、酒精
3、电离及电离方程式 P15
(1): 定义:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
表示方法:电离方程式
NaCl = Na+ + Cl-
KNO3= K+ + NO3-
NaOH=Na+ + OH-
(2):酸、碱、盐的电离 P15
盐酸、硝酸和硫酸都能够导电,说明在水溶液中电离生成了能够自由移动的离子。
电离方程式:
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO4-
电离时生成的阳离子全部是氢离子的化合物叫做酸。
全部
同样,氢氧化钠、氢氧化钾和氢氧化钡的溶液也能够导电,说明在水溶液中电离出能够自由移动的离子。
电离方程式:
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2 OH-
NaOH = Na+ + OH-
电离时生成的阴离子全部是氢氧根离子的化合物叫做碱。
全部
同样,碳酸钠、硫酸钾和氯化钡的溶液也能够导电,说明在水溶液中电离出能够自由移动的离子。
电离方程式:
Na2CO3 = 2Na+ + CO32-
MgSO4 = Mg2+ + SO42-
BaCl2 = Ba+ + 2Cl-
电离时生成金属离子和酸根离子的化合物叫做盐。
通过对酸、碱、盐电离出离子的特点,你判断一下NaHSO4、Cu2(OH)2CO3应该属于哪一类化合物?
P16 问题解决
写出下列物质的电离方程式。
KCl、KOH 、CaCl2 、 Ba(OH)2、 HCl、
Na2CO3
Na2CO3 = 2Na+ + CO3 2-
KCl = K+ + Cl-
HCl = H+ + Cl-
KOH=K+ + OH-
Ba(OH)2=Ba2+ + 2OH-
CaCl2 = Ca2+ + 2Cl-
课堂练习
1、①NaOH溶液 ②铜丝 ③液态HCl ④盐酸 ⑤硫酸 ⑥稀硫酸 ⑦液氨 ⑧氨水 ⑨SO2
⑩胆矾晶体 ⑾熔融NaCl ⑿蔗糖晶体 ⒀酒精 ⒁酒精溶液 ⒂石墨 ⒃BaSO4
(1)上述状态下可导电的是_______________
(2)属于电解质的是____________________
(3)属于非电解质的是____________________
(4)上述状态下的电解质不能导电的是_________
① ② ④ ⑥ ⑧ ⑾ ⒂
③ ⑤ ⑩ ⑾
③ ⑤ ⑩ ⑾ ⒃
⑦ ⑨ ⑿ ⒀
⑦ ⑨ ⑿ ⒀
③ ⑤ ⑩ ⒃
作业:
P书17 6 9
导学教程
