鲁教版(五四制)化学九年级全一册 2. 酸及其性质 课件(共26张PPT)
文档属性
| 名称 | 鲁教版(五四制)化学九年级全一册 2. 酸及其性质 课件(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-04 22:41:49 | ||
图片预览







文档简介
(共26张PPT)
酸及其性质
常见的酸
酸的化学性质
内容提要
1
2
学习目标
1.知道浓硫酸、浓盐酸的物理性质,认识浓硫酸的腐蚀性和稀释方法;
2.了解盐酸、硫酸的主要化学性质及用途;
3.了解酸的通性及原理,能书写有关的化学方程式。
生活中给你留下“酸”印象的物质有哪些?
科学家发现,这些有酸味的物质都含有一类组成和性质相似的化合物
——酸
酸溶于水后都能解离出相同的阳离子——氢离子(H+)
H+
一、常见的酸
盐酸、硫酸、硝酸都是常见的重要的酸
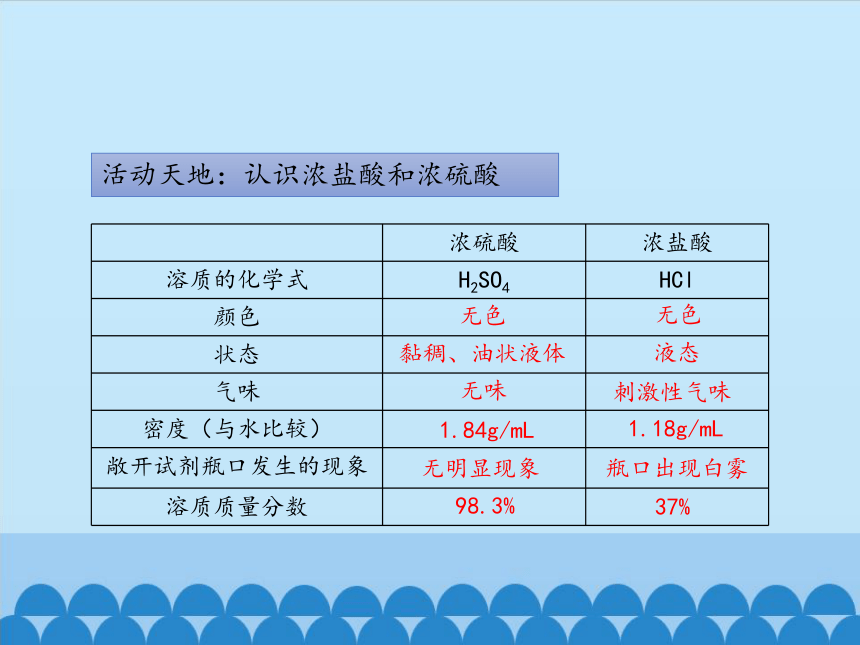
活动天地:认识浓盐酸和浓硫酸
浓硫酸 浓盐酸
溶质的化学式 H2SO4 HCl
颜色
状态
气味
密度(与水比较)
敞开试剂瓶口发生的现象
溶质质量分数
无色
黏稠、油状液体
无味
1.84g/mL
无明显现象
无色
液态
刺激性气味
1.18g/mL
瓶口出现白雾
98.3%
37%
1.用手轻轻的在瓶口扇动,仅使少量的气体飘入鼻孔。
2.禁止把鼻子凑到容器口去闻气体。因为一些化学药品有毒,一些化学气体有刺激性气味,可能对嗅觉器官造成伤害。
闻物体气味的方法:
浓盐酸和浓硫酸都具有强烈的腐蚀性,浓硫酸还具有吸水性,可用作干燥剂。
浓硫酸使纸张、木条等脱水炭化
注意:若不慎将浓硫酸溅到皮肤或衣物上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液,以防灼伤皮肤。
浓硫酸是危险品,保管和使用都要格外小心。
浓硫酸稀释方法:
把浓硫酸沿着烧杯壁缓缓注入盛有水的烧杯中,并用玻璃棒不断搅拌。
切记:不可将水倒进浓硫酸里
思考:稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着器壁慢慢注入水中,而且还不断搅拌?
水的密度较浓硫酸小,当水滴入浓硫酸溶解时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险!
而将密度大的浓硫酸缓慢地注入水中,及时搅拌,使产生的热得以迅速扩散,操作安全!
二、酸的化学性质
实验探究:酸的化学性质
实验探究1 分别取少量稀盐酸、稀硫酸,滴入石蕊试液 分别取少量稀盐酸、稀硫酸,滴入酚酞试液
现象
溶液变红
不变色
结论:盐酸和硫酸都可以使石蕊试液变红。
实验探究2:酸与金属的反应
实验内容 现象 化学方程式
将镁分别与稀盐酸、稀硫酸反应
都有气泡产生
①Mg + 2HCl === MgCl2 + H2↑
②Mg + H2SO4 === MgSO4 + H2↑
结论:酸 + 金属 → 盐 + 氢气。
盐:由金属阳离子和酸根阴离子构成的化合物,如MgCl2
实验探究3:酸与金属氧化物反应
实验内容 现象 化学方程式
分别向两支盛有生满铁锈的铁钉的试管中滴加稀盐酸、稀硫酸
①Fe2O3+6HCl == 2FeCl3+ 3H2O
②Fe2O3+3H2SO4 == Fe2(SO4)3 + 3H2O
铁锈溶解,溶液变黄
结论:酸 + 金属氧化物 → 盐 + 水。
实验探究4:酸与盐反应
实验内容 现象 化学方程式
稀盐酸与硝酸银
稀盐酸与碳酸钠
稀硫酸与氯化钡
AgNO3+HCl==AgCl↓+HNO3
有白色沉淀生成
有气体生成
Na2CO3+2HCl==2NaCl+H2O+CO2↑
H2SO4+BaCl2==BaSO4↓+2HCl
结论:酸 + 盐 → 新酸 + 新盐
有白色沉淀生成
酸与盐之间发生反应的特点:参加反应的两种化合物相互交换成分生成另外两种化合物。
像这类由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
AB + CD == AD + CB
AgNO3 + HCl == AgCl ↓ + HNO3
由于酸在溶于水时,都能解离出共同的阳离子——氢离子,导致它们具有相似的化学性质,称为酸的通性。
1.能使紫色石蕊试液变红;
2.能与某些金属氧化物反应,生成盐和水;
3.能与某些金属反应,生成盐和氢气;
4.能与部分盐反应,生成新盐和新酸。
注意:由于不同的酸溶于水时解离出的酸根阴离子不同,其性质也存在差异。
H2SO4 + BaCl2 == BaSO4↓ + 2HCl
例:硫酸能与氯化钡反应,生成白色的硫酸钡沉淀,而盐酸不能与氯化钡发生反应。
名称 主要用途
浓硫酸
浓盐酸
浓硝酸
制药、作除锈剂等
70%以上用于生产化肥,其余用于农药、炸药、染料以及冶金、石油化工、轻工、纺织等领域
生产化肥、炸药、染料、医药、橡胶、塑料及冶金、化工等领域
常见酸的主要用途
经典例题
知识点1:常见的酸
下列物质质量置于空气中,一段时间后,质量减小的是( )
A.碳酸钙 B.氯化钠
C.浓盐酸 D.氢氧化钠
C
知识点2:酸的化学性质
盐酸或稀硫酸常用作金属表面的清洁剂是利用了它们化学性质中的( )
A.能与碱反应
B.能与金属反应
C.能与某些金属氧化物反应
D.能与紫色石蕊试液反应
C
知能训练
1.酸具有酸的通性的原因是( )
A.酸都能电离出H+
B.酸都含有酸根
C.酸中都含有氢元素
D.酸中都含有氧元素
A
2.将浓盐酸和浓硫酸分别暴露在空气中,变化的结果是容器内( )
A.两瓶酸溶液质量都减小
B.两瓶酸溶液质量都增大
C.两瓶酸中溶质的质量分数都减小
D.两瓶酸中溶质的质量分数都增大
C
3.在实验室制备氢气可以用( )
A.炭粒跟水起反应
B.铁屑跟盐酸起反应
C.锌粒跟硝酸起反应
D.氧化锌跟盐酸起反应
B
谢 谢
酸及其性质
常见的酸
酸的化学性质
内容提要
1
2
学习目标
1.知道浓硫酸、浓盐酸的物理性质,认识浓硫酸的腐蚀性和稀释方法;
2.了解盐酸、硫酸的主要化学性质及用途;
3.了解酸的通性及原理,能书写有关的化学方程式。
生活中给你留下“酸”印象的物质有哪些?
科学家发现,这些有酸味的物质都含有一类组成和性质相似的化合物
——酸
酸溶于水后都能解离出相同的阳离子——氢离子(H+)
H+
一、常见的酸
盐酸、硫酸、硝酸都是常见的重要的酸
活动天地:认识浓盐酸和浓硫酸
浓硫酸 浓盐酸
溶质的化学式 H2SO4 HCl
颜色
状态
气味
密度(与水比较)
敞开试剂瓶口发生的现象
溶质质量分数
无色
黏稠、油状液体
无味
1.84g/mL
无明显现象
无色
液态
刺激性气味
1.18g/mL
瓶口出现白雾
98.3%
37%
1.用手轻轻的在瓶口扇动,仅使少量的气体飘入鼻孔。
2.禁止把鼻子凑到容器口去闻气体。因为一些化学药品有毒,一些化学气体有刺激性气味,可能对嗅觉器官造成伤害。
闻物体气味的方法:
浓盐酸和浓硫酸都具有强烈的腐蚀性,浓硫酸还具有吸水性,可用作干燥剂。
浓硫酸使纸张、木条等脱水炭化
注意:若不慎将浓硫酸溅到皮肤或衣物上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液,以防灼伤皮肤。
浓硫酸是危险品,保管和使用都要格外小心。
浓硫酸稀释方法:
把浓硫酸沿着烧杯壁缓缓注入盛有水的烧杯中,并用玻璃棒不断搅拌。
切记:不可将水倒进浓硫酸里
思考:稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着器壁慢慢注入水中,而且还不断搅拌?
水的密度较浓硫酸小,当水滴入浓硫酸溶解时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险!
而将密度大的浓硫酸缓慢地注入水中,及时搅拌,使产生的热得以迅速扩散,操作安全!
二、酸的化学性质
实验探究:酸的化学性质
实验探究1 分别取少量稀盐酸、稀硫酸,滴入石蕊试液 分别取少量稀盐酸、稀硫酸,滴入酚酞试液
现象
溶液变红
不变色
结论:盐酸和硫酸都可以使石蕊试液变红。
实验探究2:酸与金属的反应
实验内容 现象 化学方程式
将镁分别与稀盐酸、稀硫酸反应
都有气泡产生
①Mg + 2HCl === MgCl2 + H2↑
②Mg + H2SO4 === MgSO4 + H2↑
结论:酸 + 金属 → 盐 + 氢气。
盐:由金属阳离子和酸根阴离子构成的化合物,如MgCl2
实验探究3:酸与金属氧化物反应
实验内容 现象 化学方程式
分别向两支盛有生满铁锈的铁钉的试管中滴加稀盐酸、稀硫酸
①Fe2O3+6HCl == 2FeCl3+ 3H2O
②Fe2O3+3H2SO4 == Fe2(SO4)3 + 3H2O
铁锈溶解,溶液变黄
结论:酸 + 金属氧化物 → 盐 + 水。
实验探究4:酸与盐反应
实验内容 现象 化学方程式
稀盐酸与硝酸银
稀盐酸与碳酸钠
稀硫酸与氯化钡
AgNO3+HCl==AgCl↓+HNO3
有白色沉淀生成
有气体生成
Na2CO3+2HCl==2NaCl+H2O+CO2↑
H2SO4+BaCl2==BaSO4↓+2HCl
结论:酸 + 盐 → 新酸 + 新盐
有白色沉淀生成
酸与盐之间发生反应的特点:参加反应的两种化合物相互交换成分生成另外两种化合物。
像这类由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
AB + CD == AD + CB
AgNO3 + HCl == AgCl ↓ + HNO3
由于酸在溶于水时,都能解离出共同的阳离子——氢离子,导致它们具有相似的化学性质,称为酸的通性。
1.能使紫色石蕊试液变红;
2.能与某些金属氧化物反应,生成盐和水;
3.能与某些金属反应,生成盐和氢气;
4.能与部分盐反应,生成新盐和新酸。
注意:由于不同的酸溶于水时解离出的酸根阴离子不同,其性质也存在差异。
H2SO4 + BaCl2 == BaSO4↓ + 2HCl
例:硫酸能与氯化钡反应,生成白色的硫酸钡沉淀,而盐酸不能与氯化钡发生反应。
名称 主要用途
浓硫酸
浓盐酸
浓硝酸
制药、作除锈剂等
70%以上用于生产化肥,其余用于农药、炸药、染料以及冶金、石油化工、轻工、纺织等领域
生产化肥、炸药、染料、医药、橡胶、塑料及冶金、化工等领域
常见酸的主要用途
经典例题
知识点1:常见的酸
下列物质质量置于空气中,一段时间后,质量减小的是( )
A.碳酸钙 B.氯化钠
C.浓盐酸 D.氢氧化钠
C
知识点2:酸的化学性质
盐酸或稀硫酸常用作金属表面的清洁剂是利用了它们化学性质中的( )
A.能与碱反应
B.能与金属反应
C.能与某些金属氧化物反应
D.能与紫色石蕊试液反应
C
知能训练
1.酸具有酸的通性的原因是( )
A.酸都能电离出H+
B.酸都含有酸根
C.酸中都含有氢元素
D.酸中都含有氧元素
A
2.将浓盐酸和浓硫酸分别暴露在空气中,变化的结果是容器内( )
A.两瓶酸溶液质量都减小
B.两瓶酸溶液质量都增大
C.两瓶酸中溶质的质量分数都减小
D.两瓶酸中溶质的质量分数都增大
C
3.在实验室制备氢气可以用( )
A.炭粒跟水起反应
B.铁屑跟盐酸起反应
C.锌粒跟硝酸起反应
D.氧化锌跟盐酸起反应
B
谢 谢
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
