11-12版高中化学课时讲练通配套课件:4硫、氮和可持续发展(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:4硫、氮和可持续发展(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览






文档简介
(共29张PPT)
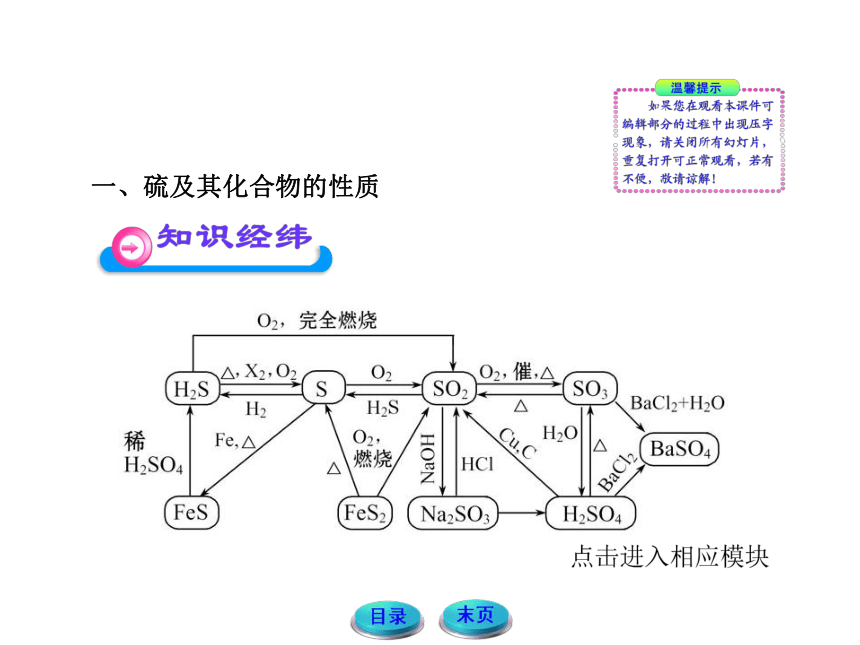
一、硫及其化合物的性质
1.当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降。
(1)相邻价态之间不能发生氧化还原反应,如S和H2S、S和SO2、SO2和H2SO4之间都不能发生氧化还原反应。
(2)当-2价的S和0价的S遇到强氧化剂时,也可发生跳位氧化,也就是说,当遇到强氧化剂时,-2价的S和0价的S也可被氧化到更高的价态。
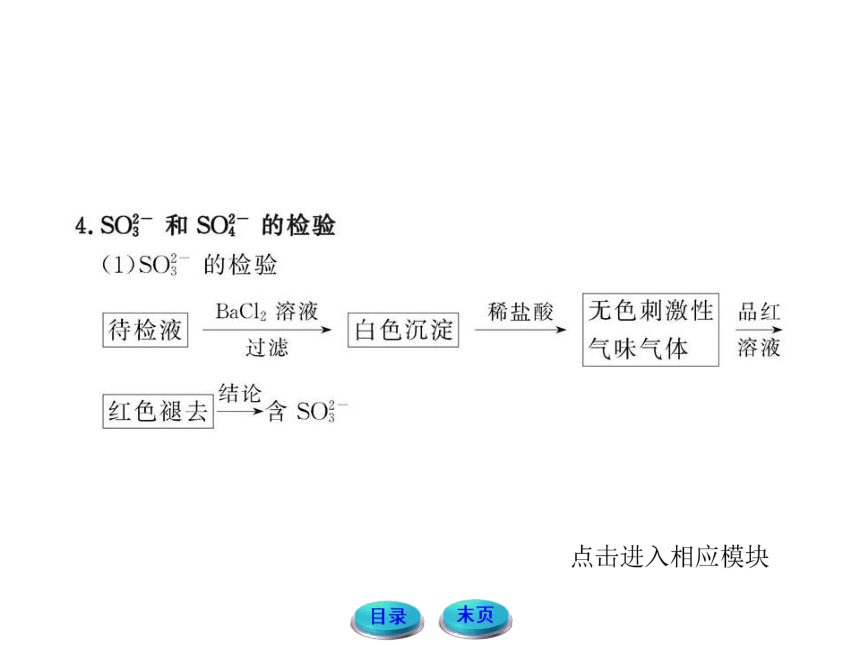
3.SO2的鉴别
(1)利用二氧化硫的刺激性气味和通入澄清石灰水先变浑浊再变澄清;
(2)利用二氧化硫的还原性,用酸性高锰酸钾溶液或溴水是否褪色鉴别;
(3)利用二氧化硫的漂白性,用品红溶液鉴别。
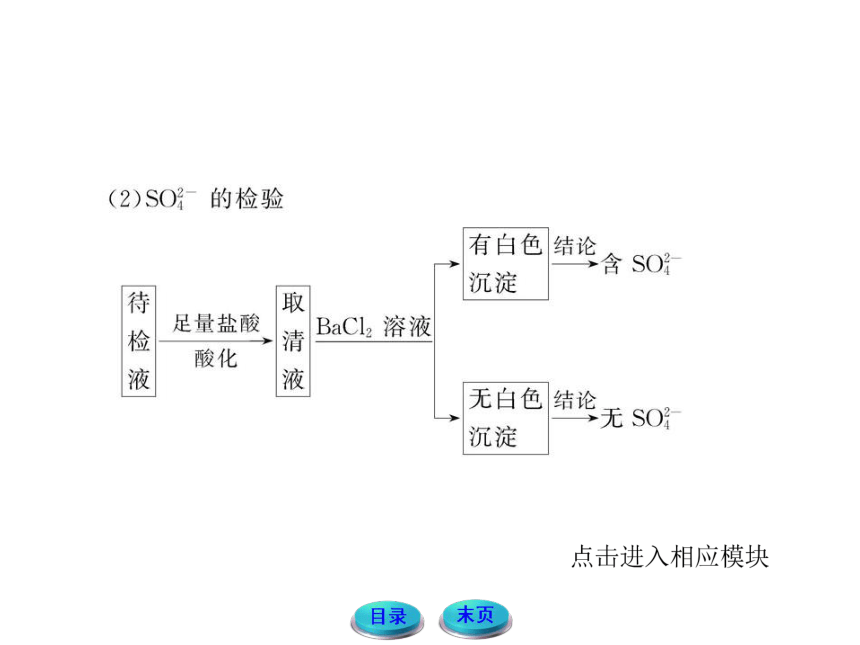
应用以上实验设计检测溶液中SO42-的存在时要防止其他离子的干扰。
①不能直接加入BaCl2溶液。
直接加入BaCl2溶液,无法排除Ag+或CO32-、SO32-等离子的干扰。会因为Ag++Cl-====AgCl↓或Ba2++CO32-====BaCO3↓,SO32-+Ba2+====BaSO3↓等白色沉淀的产生对SO42-的检验造成干扰,且AgCl不溶于酸。
②不能用HNO3酸化。
因为当溶液中含SO32-时,会被HNO3氧化成SO42-而对SO42-的检验造成干扰。
③所用钡盐也不能用Ba(NO3)2溶液。
因为在酸性条件下,溶液中残存的SO2(先加入盐酸后)等会被溶液中的NO3-氧化为SO42-,从而也会对SO42-的检验造成干扰。
5.金属和硫酸反应的规律及分析计算
(1)稀硫酸
稀硫酸具有弱氧化性,和金属活动顺序表中H前的金属发生置换反应生成相应的硫酸盐和氢气,和金属活动顺序表中H后的金属不能反应。
(2)浓硫酸
浓硫酸具有强氧化性,能够和除Au、Pt以外的大多数金属
发生反应。
①和金属活动顺序表中H后的金属常温下不能反应,加热才
能反应,一般生成相应的硫酸盐和SO2。当随着反应的进
行,浓硫酸变成稀硫酸时,反应自行停止。如
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。当浓硫酸足量
时,每2 mol浓硫酸能得到1 mol SO2,而当Cu足量时,
2 mol 浓硫酸不能完全反应,得到的SO2的物质的量小于
1 mol。
△
====
②在常温下,和金属活动顺序表中H前的金属(Al、Fe除外)发生反应,当还是浓硫酸时,H2SO4的还原产物是SO2,当浓硫酸变成稀硫酸时,H2SO4的还原产物是H2。如Zn在常温下和浓硫酸反应的过程依次为:Zn+2H2SO4(浓)====ZnSO4+
SO2↑+2H2O和Zn+H2SO4 ==== ZnSO4+H2↑。
③常温下,浓硫酸能够使Al和Fe发生钝化,但是在加热时能够剧烈反应生成SO2,如2Al+6H2SO4(浓) Al2(SO4)3+
3SO2↑+6H2O。
△
====
二、氮及其化合物的性质
1.氮的氧化物溶于水的计算
(1)基本反应式
①2NO+O2====2NO2
②3NO2+H2O====2HNO3+NO
③4NO2+O2+2H2O====4HNO3
④4NO+3O2+2H2O====4HNO3
2.氨气的三种实验室制法
(1)加热固态铵盐和碱的混合物
(2)加热浓氨水
原理:NH3 H2O NH3↑+H2O
装置:
△
====
(3)浓氨水中加入碱性物质
反应原理:浓氨水中存在以下平衡:NH3+H2O NH3·H2O
NH4++OH-,加入固态碱性物质(如CaO、NaOH、碱石灰等),消耗水且使c(OH-)增大,使平衡逆向移动,同时反应放热,促进NH3·H2O的分解。
装置:
3.铵盐的共性
(1)均易溶于水。
(2)受热易分解。
(3)与碱反应生成NH3。
4.硝酸与金属反应的定量计算及产物的推断
硝酸与金属反应时:
(1)金属的还原能力不同,硝酸被还原的价态不同。
(2)同种金属与不同浓度的硝酸反应时,硝酸越稀,被还原的价态越低。
(3)有些反应起始时硝酸浓度较大,被还原放出NO2气体,随着反应的进行,硝酸的浓度逐渐减小,渐渐地放出NO气体。因此,有些金属与硝酸的反应过程,硝酸被还原的产物可能不止一种。
(4)铁、铝等金属遇到浓硝酸会产生钝化现象(表面被氧化成一层致密的氧化物薄膜,阻碍了反应的进行,保护了内部金属不参加反应)。
(5)不活泼金属(如Cu、Ag等)与稀硝酸反应,稀硝酸的还原产物一般是NO,且在参加反应的HNO3中,被还原的HNO3和未被还原的HNO3的物质的量之比一般为1∶3。
(6)不活泼金属(如Cu、Ag等)与浓硝酸反应,浓硝酸的还原产物一般是NO2,且在参加反应的HNO3中,被还原的HNO3和未被还原的HNO3的物质的量之比一般为1∶1。
5.氧化还原反应方程式的配平
(1)配平原则
③求总数:根据元素化合价升、降数的最小公倍数,确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。
3Cu+2HNO3(稀)——3Cu(NO3)2+2NO↑+H2O
④配系数:用观察法配平其他物质的化学计量数。
3Cu+8HNO3(稀)——3Cu(NO3)2+2NO↑+4H2O
⑤细检查:根据“配平原则”检查,将短线改为长等号。
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
一、硫及其化合物的性质
1.当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降。
(1)相邻价态之间不能发生氧化还原反应,如S和H2S、S和SO2、SO2和H2SO4之间都不能发生氧化还原反应。
(2)当-2价的S和0价的S遇到强氧化剂时,也可发生跳位氧化,也就是说,当遇到强氧化剂时,-2价的S和0价的S也可被氧化到更高的价态。
3.SO2的鉴别
(1)利用二氧化硫的刺激性气味和通入澄清石灰水先变浑浊再变澄清;
(2)利用二氧化硫的还原性,用酸性高锰酸钾溶液或溴水是否褪色鉴别;
(3)利用二氧化硫的漂白性,用品红溶液鉴别。
应用以上实验设计检测溶液中SO42-的存在时要防止其他离子的干扰。
①不能直接加入BaCl2溶液。
直接加入BaCl2溶液,无法排除Ag+或CO32-、SO32-等离子的干扰。会因为Ag++Cl-====AgCl↓或Ba2++CO32-====BaCO3↓,SO32-+Ba2+====BaSO3↓等白色沉淀的产生对SO42-的检验造成干扰,且AgCl不溶于酸。
②不能用HNO3酸化。
因为当溶液中含SO32-时,会被HNO3氧化成SO42-而对SO42-的检验造成干扰。
③所用钡盐也不能用Ba(NO3)2溶液。
因为在酸性条件下,溶液中残存的SO2(先加入盐酸后)等会被溶液中的NO3-氧化为SO42-,从而也会对SO42-的检验造成干扰。
5.金属和硫酸反应的规律及分析计算
(1)稀硫酸
稀硫酸具有弱氧化性,和金属活动顺序表中H前的金属发生置换反应生成相应的硫酸盐和氢气,和金属活动顺序表中H后的金属不能反应。
(2)浓硫酸
浓硫酸具有强氧化性,能够和除Au、Pt以外的大多数金属
发生反应。
①和金属活动顺序表中H后的金属常温下不能反应,加热才
能反应,一般生成相应的硫酸盐和SO2。当随着反应的进
行,浓硫酸变成稀硫酸时,反应自行停止。如
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。当浓硫酸足量
时,每2 mol浓硫酸能得到1 mol SO2,而当Cu足量时,
2 mol 浓硫酸不能完全反应,得到的SO2的物质的量小于
1 mol。
△
====
②在常温下,和金属活动顺序表中H前的金属(Al、Fe除外)发生反应,当还是浓硫酸时,H2SO4的还原产物是SO2,当浓硫酸变成稀硫酸时,H2SO4的还原产物是H2。如Zn在常温下和浓硫酸反应的过程依次为:Zn+2H2SO4(浓)====ZnSO4+
SO2↑+2H2O和Zn+H2SO4 ==== ZnSO4+H2↑。
③常温下,浓硫酸能够使Al和Fe发生钝化,但是在加热时能够剧烈反应生成SO2,如2Al+6H2SO4(浓) Al2(SO4)3+
3SO2↑+6H2O。
△
====
二、氮及其化合物的性质
1.氮的氧化物溶于水的计算
(1)基本反应式
①2NO+O2====2NO2
②3NO2+H2O====2HNO3+NO
③4NO2+O2+2H2O====4HNO3
④4NO+3O2+2H2O====4HNO3
2.氨气的三种实验室制法
(1)加热固态铵盐和碱的混合物
(2)加热浓氨水
原理:NH3 H2O NH3↑+H2O
装置:
△
====
(3)浓氨水中加入碱性物质
反应原理:浓氨水中存在以下平衡:NH3+H2O NH3·H2O
NH4++OH-,加入固态碱性物质(如CaO、NaOH、碱石灰等),消耗水且使c(OH-)增大,使平衡逆向移动,同时反应放热,促进NH3·H2O的分解。
装置:
3.铵盐的共性
(1)均易溶于水。
(2)受热易分解。
(3)与碱反应生成NH3。
4.硝酸与金属反应的定量计算及产物的推断
硝酸与金属反应时:
(1)金属的还原能力不同,硝酸被还原的价态不同。
(2)同种金属与不同浓度的硝酸反应时,硝酸越稀,被还原的价态越低。
(3)有些反应起始时硝酸浓度较大,被还原放出NO2气体,随着反应的进行,硝酸的浓度逐渐减小,渐渐地放出NO气体。因此,有些金属与硝酸的反应过程,硝酸被还原的产物可能不止一种。
(4)铁、铝等金属遇到浓硝酸会产生钝化现象(表面被氧化成一层致密的氧化物薄膜,阻碍了反应的进行,保护了内部金属不参加反应)。
(5)不活泼金属(如Cu、Ag等)与稀硝酸反应,稀硝酸的还原产物一般是NO,且在参加反应的HNO3中,被还原的HNO3和未被还原的HNO3的物质的量之比一般为1∶3。
(6)不活泼金属(如Cu、Ag等)与浓硝酸反应,浓硝酸的还原产物一般是NO2,且在参加反应的HNO3中,被还原的HNO3和未被还原的HNO3的物质的量之比一般为1∶1。
5.氧化还原反应方程式的配平
(1)配平原则
③求总数:根据元素化合价升、降数的最小公倍数,确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。
3Cu+2HNO3(稀)——3Cu(NO3)2+2NO↑+H2O
④配系数:用观察法配平其他物质的化学计量数。
3Cu+8HNO3(稀)——3Cu(NO3)2+2NO↑+4H2O
⑤细检查:根据“配平原则”检查,将短线改为长等号。
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
