11-12版高中化学课时讲练通配套课件:3从矿物到基础物质
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:3从矿物到基础物质 |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览




文档简介
(共33张PPT)
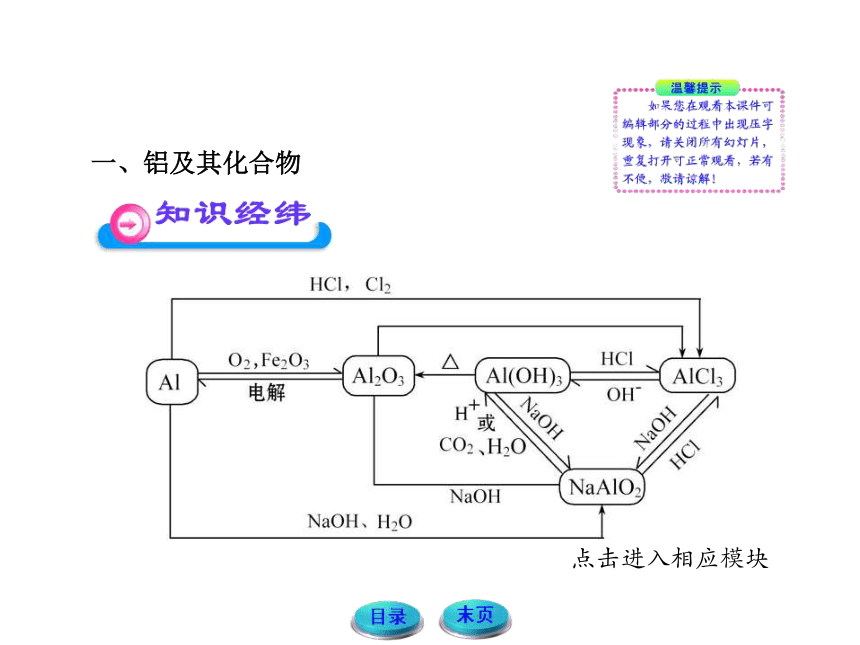
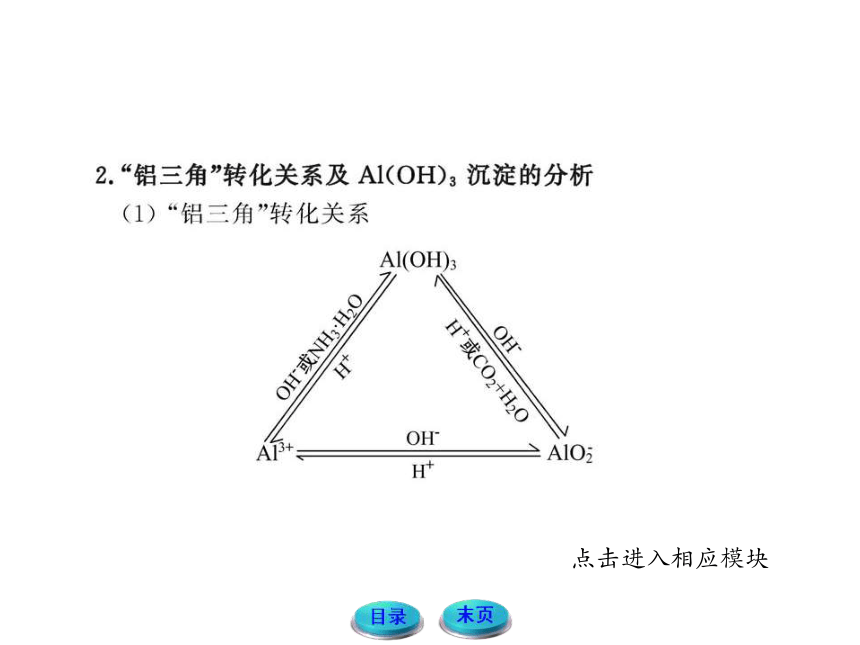
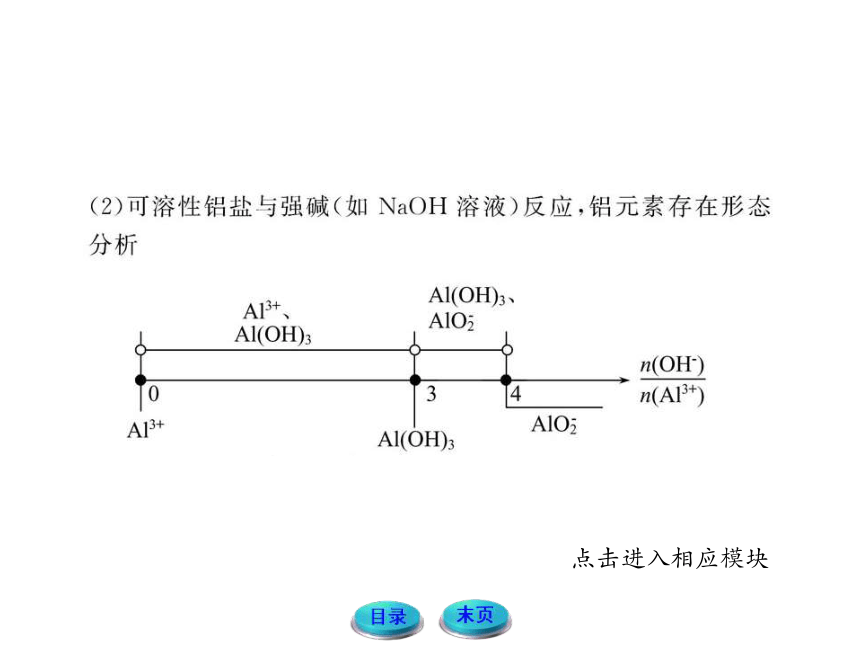
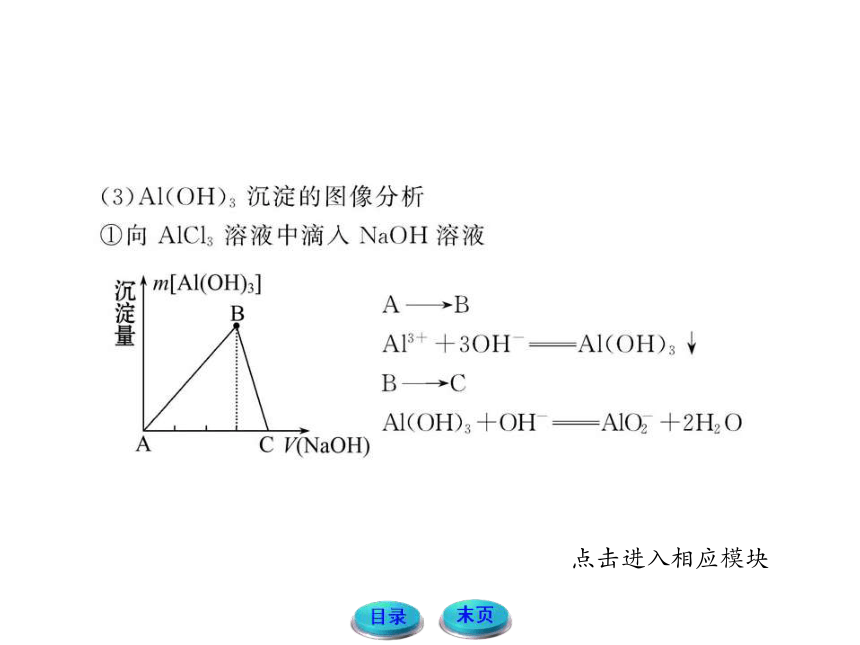
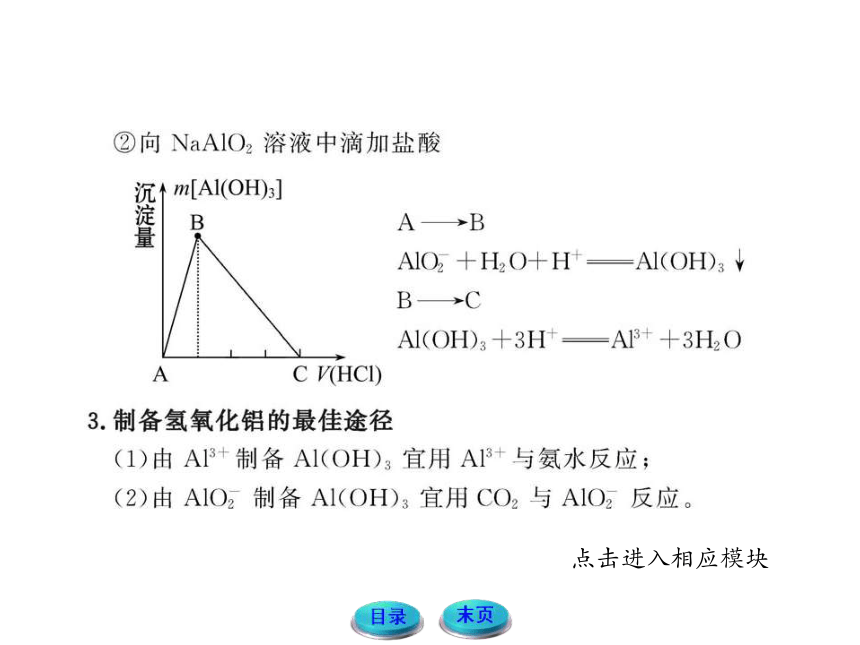
一、铝及其化合物
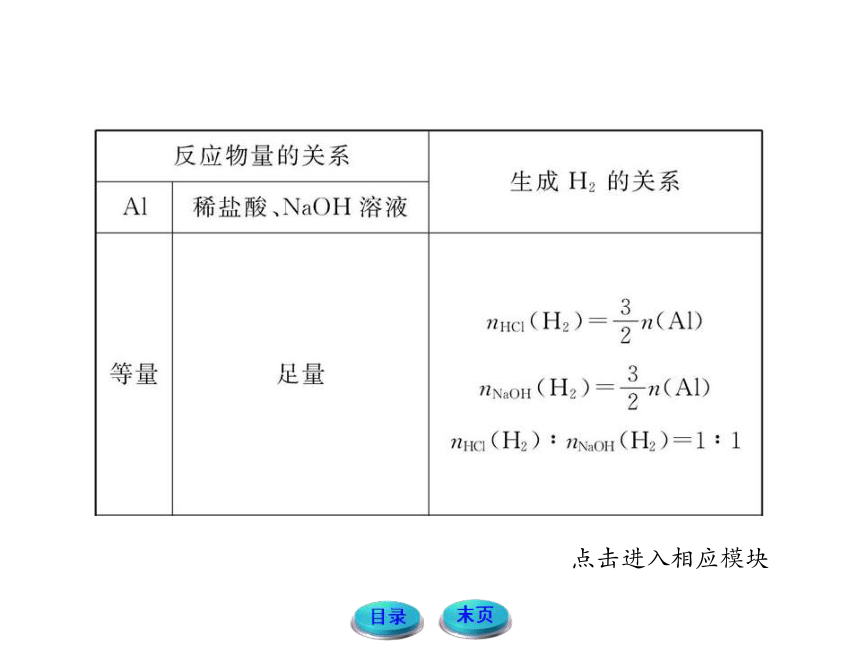
1.铝与酸或碱反应生成氢气的量的关系
铝粉与盐酸、氢氧化钠溶液反应的原理
2Al+6HCl====2AlCl3+3H2↑
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
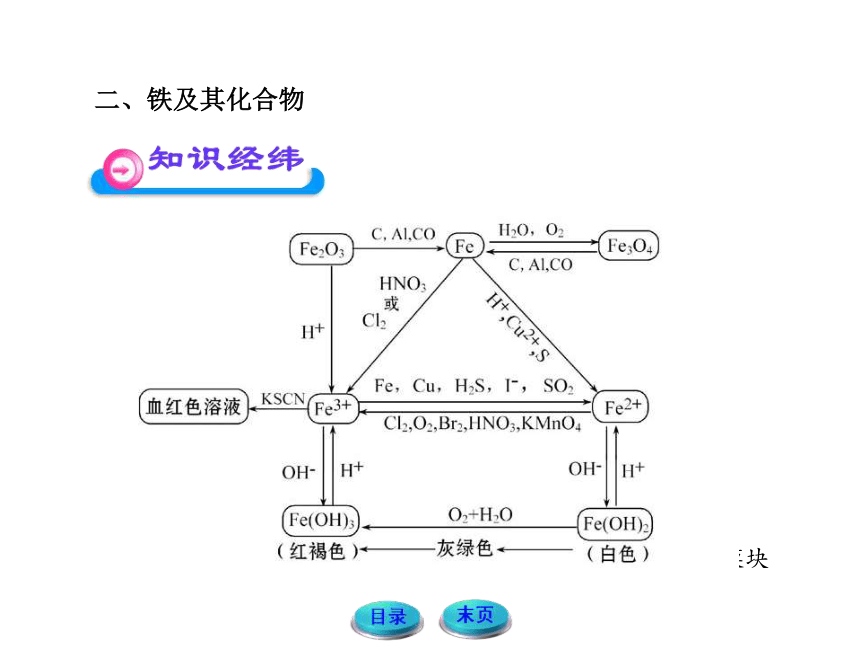
二、铁及其化合物
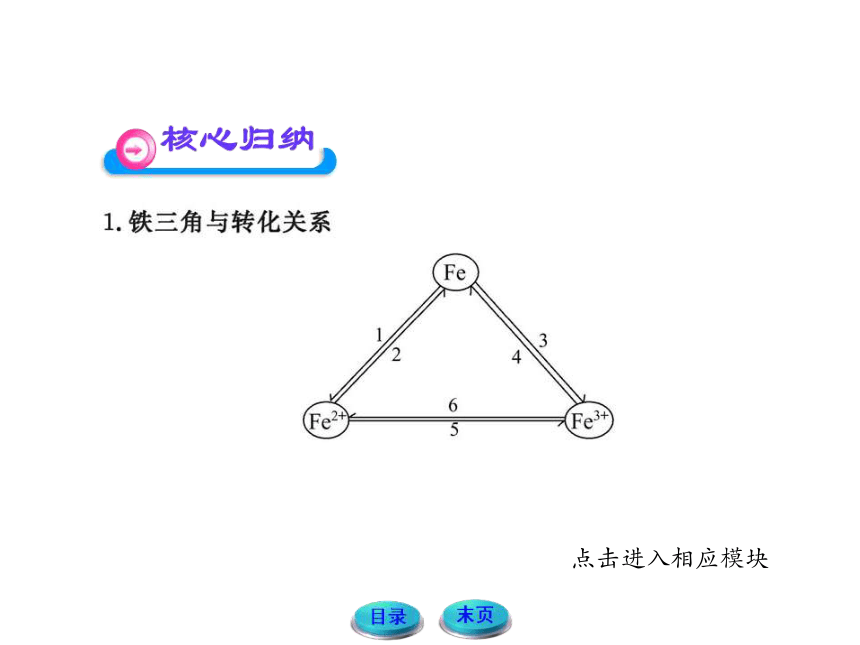
(1) Fe Fe2+
铁与氧化性比较弱的非金属(如S、I2),非氧化性酸(如盐酸、稀硫酸),不活泼金属的盐溶液(如CuSO4溶液)反应,都可实现这种转化。例如:Fe+S FeS;
Fe+CuSO4 ==== Cu+FeSO4;Fe+2FeCl3====3FeCl2;Fe+2H+
====Fe2++H2↑。
(2)Fe2+ Fe
比较活泼的金属(如Al、Zn)、CO、H2、C等能从亚铁化合物中置换出铁来。例如:FeCl2+Zn====ZnCl2+Fe;FeO+H2
Fe+H2O。
△
====
△
====
(3)Fe Fe3+
铁与强氧化剂,如Cl2、H2O2、KMnO4(H+)、HNO3、浓硫酸在一定条件下反应都会实现这种转化。例如:
2Fe+3Cl2 2FeCl3。
(4)Fe3+ Fe
可通过较强还原剂实现,如Al、CO等。例如:
Fe2O3+3CO 2Fe+3CO2;
Fe2O3+2Al 2Fe+Al2O3。
△
====
高温
====
点燃
====
(5)Fe2+ Fe3+
亚铁盐与强氧化剂反应,如Cl2、Br2、HNO3、浓硫酸、KMnO4(H+)、H2O2等。例如:2FeCl2+Cl2 ==== 2FeCl3。
(6)Fe3+ Fe2+
铁盐溶液与比较强的还原剂反应,如Fe、Cu、碘化物、硫化物等。例如:
2Fe3++S2- ==== 2Fe2++S↓;2Fe3++Cu ==== 2Fe2++Cu2+;
2Fe3++Fe ==== 3Fe2+;2Fe3++2I- ==== 2Fe2++I2。
2.Fe2+和Fe3+的检验
(1)溶液颜色
含有Fe2+的溶液显浅绿色
含有Fe3+的溶液显棕黄色
(2)用KSCN溶液和氯水
流程:
有关反应:Fe3++3SCN-====Fe(SCN)3(血红色)
2Fe2++Cl2====2Fe3++2Cl-
(3)用NaOH溶液
流程:
有关反应:Fe3++3OH-====Fe(OH)3↓(红褐色)
Fe2++2OH-====Fe(OH)2↓(白色沉淀)
4Fe(OH)2+O2+2H2O====4Fe(OH)3
3.铁的化合物的颜色
FeO——黑色 Fe2O3——红棕色
Fe3O4——黑色 Fe(OH)2——白色
Fe(OH)3——红褐色 FeCl3溶液——棕黄色
FeSO4溶液——浅绿色 FeSO4·7H2O——浅绿色
FeS——黑色 Fe(SCN)3——血红色
三、铜及其化合物
2.铁和铜间彼此反应的计算和讨论
Fe3+和Cu、Cu2+和Fe之间的反应是我们学习过程中的一个非常重要的知识点,掌握彼此间的转化及计算,对培养我们的综合能力是十分必要的。现讨论如下:
将a mol Fe3+、b mol Cu2+、c mol Fe和d mol Cu混合于同一反应体系中充分反应。可能发生的反应有:①2Fe3++Fe====3Fe2+ ②2Fe3++Cu====Cu2++2Fe2+ ③Fe+Cu2+
====Cu+Fe2+
现从以下角度进行讨论:
(1)从发生的化学反应来讨论
①无论a、b、c、d取何值,反应①、②、③不可能均发生。
②当c= 时,只发生①,因为Fe3+的氧化性最强。
③当c> 时,发生的反应是先①后③。
④当c< 时,发生的反应是先①后②。
(2)从反应后不溶物的成分来看溶液中的成分
不溶物的成分无非只有Fe,或只有Cu,或Fe、Cu都有,下面逐一进行讨论:
①若不溶物是Fe和Cu,则溶液中一定有Fe2+,一定无Fe3+和Cu2+。
②若不溶物只有Cu,则溶液中一定无Fe3+,一定有Fe2+,其物质的量为(a+c)mol,可能有Cu2+。
(3)从反应后溶液的成分来看不溶物的成分及含量
①若溶液中有Fe3+,必定还有Cu2+和Fe2+,则反应后无不溶物。
②若溶液中只有Cu2+和Fe2+,则不溶物中一定无Fe,可能有Cu。
③若溶液中只有Fe2+,则反应后的不溶物中一定有Cu,其量为(b+d)mol,可能有Fe。
四、硅及其化合物
一、铝及其化合物
1.铝与酸或碱反应生成氢气的量的关系
铝粉与盐酸、氢氧化钠溶液反应的原理
2Al+6HCl====2AlCl3+3H2↑
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
二、铁及其化合物
(1) Fe Fe2+
铁与氧化性比较弱的非金属(如S、I2),非氧化性酸(如盐酸、稀硫酸),不活泼金属的盐溶液(如CuSO4溶液)反应,都可实现这种转化。例如:Fe+S FeS;
Fe+CuSO4 ==== Cu+FeSO4;Fe+2FeCl3====3FeCl2;Fe+2H+
====Fe2++H2↑。
(2)Fe2+ Fe
比较活泼的金属(如Al、Zn)、CO、H2、C等能从亚铁化合物中置换出铁来。例如:FeCl2+Zn====ZnCl2+Fe;FeO+H2
Fe+H2O。
△
====
△
====
(3)Fe Fe3+
铁与强氧化剂,如Cl2、H2O2、KMnO4(H+)、HNO3、浓硫酸在一定条件下反应都会实现这种转化。例如:
2Fe+3Cl2 2FeCl3。
(4)Fe3+ Fe
可通过较强还原剂实现,如Al、CO等。例如:
Fe2O3+3CO 2Fe+3CO2;
Fe2O3+2Al 2Fe+Al2O3。
△
====
高温
====
点燃
====
(5)Fe2+ Fe3+
亚铁盐与强氧化剂反应,如Cl2、Br2、HNO3、浓硫酸、KMnO4(H+)、H2O2等。例如:2FeCl2+Cl2 ==== 2FeCl3。
(6)Fe3+ Fe2+
铁盐溶液与比较强的还原剂反应,如Fe、Cu、碘化物、硫化物等。例如:
2Fe3++S2- ==== 2Fe2++S↓;2Fe3++Cu ==== 2Fe2++Cu2+;
2Fe3++Fe ==== 3Fe2+;2Fe3++2I- ==== 2Fe2++I2。
2.Fe2+和Fe3+的检验
(1)溶液颜色
含有Fe2+的溶液显浅绿色
含有Fe3+的溶液显棕黄色
(2)用KSCN溶液和氯水
流程:
有关反应:Fe3++3SCN-====Fe(SCN)3(血红色)
2Fe2++Cl2====2Fe3++2Cl-
(3)用NaOH溶液
流程:
有关反应:Fe3++3OH-====Fe(OH)3↓(红褐色)
Fe2++2OH-====Fe(OH)2↓(白色沉淀)
4Fe(OH)2+O2+2H2O====4Fe(OH)3
3.铁的化合物的颜色
FeO——黑色 Fe2O3——红棕色
Fe3O4——黑色 Fe(OH)2——白色
Fe(OH)3——红褐色 FeCl3溶液——棕黄色
FeSO4溶液——浅绿色 FeSO4·7H2O——浅绿色
FeS——黑色 Fe(SCN)3——血红色
三、铜及其化合物
2.铁和铜间彼此反应的计算和讨论
Fe3+和Cu、Cu2+和Fe之间的反应是我们学习过程中的一个非常重要的知识点,掌握彼此间的转化及计算,对培养我们的综合能力是十分必要的。现讨论如下:
将a mol Fe3+、b mol Cu2+、c mol Fe和d mol Cu混合于同一反应体系中充分反应。可能发生的反应有:①2Fe3++Fe====3Fe2+ ②2Fe3++Cu====Cu2++2Fe2+ ③Fe+Cu2+
====Cu+Fe2+
现从以下角度进行讨论:
(1)从发生的化学反应来讨论
①无论a、b、c、d取何值,反应①、②、③不可能均发生。
②当c= 时,只发生①,因为Fe3+的氧化性最强。
③当c> 时,发生的反应是先①后③。
④当c< 时,发生的反应是先①后②。
(2)从反应后不溶物的成分来看溶液中的成分
不溶物的成分无非只有Fe,或只有Cu,或Fe、Cu都有,下面逐一进行讨论:
①若不溶物是Fe和Cu,则溶液中一定有Fe2+,一定无Fe3+和Cu2+。
②若不溶物只有Cu,则溶液中一定无Fe3+,一定有Fe2+,其物质的量为(a+c)mol,可能有Cu2+。
(3)从反应后溶液的成分来看不溶物的成分及含量
①若溶液中有Fe3+,必定还有Cu2+和Fe2+,则反应后无不溶物。
②若溶液中只有Cu2+和Fe2+,则不溶物中一定无Fe,可能有Cu。
③若溶液中只有Fe2+,则反应后的不溶物中一定有Cu,其量为(b+d)mol,可能有Fe。
四、硅及其化合物
