11-12版高中化学课时讲练通配套课件:1.1.1物质的分类与转化(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:1.1.1物质的分类与转化(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览








文档简介
(共69张PPT)
1.在日常生活中,常会接触到下列物质:空气、乙醇、固体硫酸铵、铜、稀硫酸、氢气、石墨、食盐水,依据不同的分类标准,可以对上述物质进行不同的分类,试分析下列条件下的分类情况:
(1)根据物质的状态,应如何分类?
提示:固体:硫酸铵、铜、石墨
液体:乙醇、食盐水、稀硫酸
气体:空气、氢气
(2)根据物质的导电性,应如何分类?
提示:可导电物质:铜、石墨、食盐水、稀硫酸
不导电物质:空气、乙醇、固体硫酸铵、氢气
(3)根据物质的溶解性,应如何分类?
提示:可溶性物质:乙醇、固体硫酸铵
难溶性物质:空气、铜、氢气、石墨
(4)根据物质的组成,应如何分类?
提示:混合物:空气、食盐水、稀硫酸
纯净物:乙醇、固体硫酸铵、铜、氢气、石墨
2.实验室中有下列物质,请根据物质组成对它们进行分类:
①钠(Na) ②氯气(Cl2) ③氯化铁(FeCl3)溶液
④硫酸(H2SO4) ⑤碳酸钙(CaCO3) ⑥氧化钙(CaO)
⑦氢氧化钠(NaOH) ⑧葡萄糖(C6H12O6)
⑨醋酸(C2H4O2) ⑩二氧化碳(CO2)
(1)属于混合物的有哪些物质?
提示:属于混合物的有:③
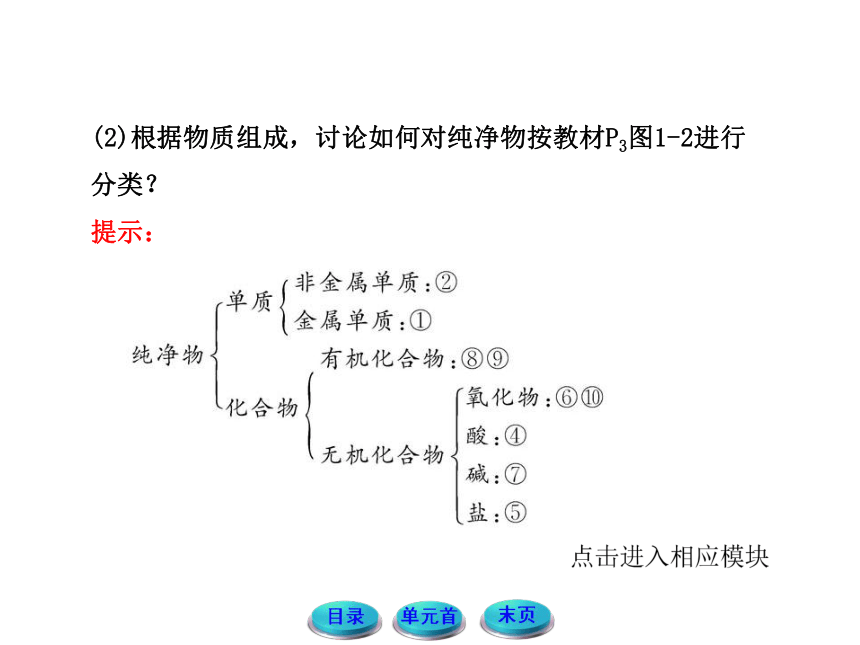
(2)根据物质组成,讨论如何对纯净物按教材P3图1-2进行分类?
提示:
例1 经分析,某种物质只含有一种元素,则此物质
A.一定是一种单质
B.一定是纯净物
C.一定是混合物
D.可能是纯净物,也可能是混合物
【规范解答】选D。物质分为纯净物和混合物。若纯净物只含一种元素,一定是单质而不是化合物,如H2;但若为只含有一种元素的混合物,则可能是由两种单质或多种单质组成,如金刚石和石墨、O2和O3等。
【互动探究】若将原题中“只含有一种元素”改为“只含有一种分子”,则答案应为哪个选项?
提示:选B。分子是保持物质化学性质的最小微粒,若某物质只含有一种分子,则此物质一定为纯净物,可能为单质,也可能为化合物。
1.纯净物和混合物的区别
2.氧化物的分类
(1)酸性氧化物可能是非金属氧化物,也可能是金属氧化物;
(2)碱性氧化物一定是金属氧化物。
1.结合学过的化学反应,试举例探究生成盐的方法。请写出符合条件的化学方程式。
(1)由单质生成盐
(4)由盐生成盐:盐+盐 新盐+另一种新盐
请举三例
提示:Na2CO3+CaCl2====CaCO3↓+2NaCl,
Ba(NO3)2+K2SO4====BaSO4↓+2KNO3,
BaCl2+2AgNO3====2AgCl↓+Ba(NO3)2
2.某同学学习了本节内容后,对学过的下列化学反应进行了分类,试探究其对化学反应分类的依据。
(1)硫在氧气里燃烧 (2)红磷在氧气里燃烧
(3)铁丝在氧气里燃烧 (4)铝箔在氧气里燃烧
(5)酒精燃烧 (6)高温煅烧石灰石
(7)电解水制氢气
提示:Ⅰ.(1)(2)(3)(4)均为单质在氧气中燃烧的反应,且均为化合反应
Ⅱ.(1)(2)反应物为非金属与氧气;(3)(4)反应物为金属与氧气
Ⅲ.(6)(7)均为分解反应
Ⅳ.(1)(2)(3)(4)(5)(7)反应均有化合价的变化,为氧化还原反应
例2 很多食品的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可作干燥剂的理由是什么?(用化学方程式表示)
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4)小纸袋中的物质能否长期持续地作干燥剂?为什么?
(5)在你所认识的化学物质中,还有哪些物质可以用作干燥剂?
【规范解答】(1)生石灰属于哪种类别的物质可以从组成、属类、状态等方面分类。(2)生石灰可作干燥剂的原因是氧化钙与水反应,有吸水作用。(3)生石灰作为碱性氧化物具有碱性氧化物的通性。(4)生石灰吸水后生成Ca(OH)2,失去吸水能力。
答案:(1)化合物、金属氧化物、固态物质等。
(2)CaO+H2O====Ca(OH)2。
(3)与酸反应:CaO+2HCl====CaCl2+H2O;
与非金属氧化物反应:CaO+CO2====CaCO3。
(4)不能,因为生石灰全部变为Ca(OH)2后,就不能再起到干燥作用。
(5)浓硫酸、CaCl2、P2O5、碱石灰等。
【互动探究】在气体的除杂操作中经常使用到干燥剂,请举几例,并对其分类。
提示:常见的干燥剂有CaCl2、P2O5、浓硫酸、碱石灰等。
分类:CaCl2为盐酸盐或钙盐、P2O5为酸性氧化物、浓硫酸为含氧酸、碱石灰为混合物
氧化还原反应与四种基本反应类型之间的关系
氧化还原反应的特点是反应前后有元素化合价的变化。氧化还原反应与四种基本反应类型间的关系可以用下图表示:
探究:试根据学过的反应实例进行探究讨论。
1.试总结分析氧化还原反应与四种基本反应类型之间的关系图示的涵义。
提示:有单质参加的化合反应一定是氧化还原反应;有单质生成的分解反应一定是氧化还原反应;置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应。
2.什么样的化合反应是氧化还原反应?什么样的分解反应是氧化还原反应?
提示:CO2+H2O====H2CO3是化合反应,但反应前后没有元素化合价的变化,故该反应不是氧化还原反应;2H2+O2
2H2O是化合反应,反应前后H、O元素化合价发生变化,故该反应是氧化还原反应。故有单质参加的化合反应是氧化还原反应;CaCO3 CO2↑+CaO是分解反应,但反应前后没有元素化合价的变化,该反应不是氧化还原反应;2H2O 2H2↑+O2↑是分解反应,反应前后H、O元素化合价发生变化,该反应是氧化还原反应。故有单质生成的分解反应是氧化还原反应。
点燃
====
高温
====
通电
====
3.为什么置换反应一定是氧化还原反应?
提示:置换反应是一种单质和一种化合物生成另一种单质和另一种化合物的反应,反应过程中肯定有元素化合价的变化,所以一定是氧化还原反应。
4.试分析复分解反应与氧化还原反应的关系。
提示:复分解反应可以用“AB+CD====AD+CB”形象的表示,表示反应过程中相互交换成分,不会发生元素化合价的变化,一定不是氧化还原反应。
5.有单质参加或生成的反应肯定是氧化还原反应吗?
提示:3O2====2O3的反应有单质参加,也有单质生成,但由于反应前后氧元素均为0价,反应过程没有元素化合价的变化,故该反应不是氧化还原反应,故有单质参加或生成的反应不一定是氧化还原反应。
1.下列物质属于纯净物的是( )
A.冰水混合物
B.水煤气
C.天然气
D.纯净的无污染的空气
【解析】选A。冰和水仅是聚集状态不同,分子组成均为H2O,冰水混合物应为纯净物,A正确;水煤气是一氧化碳和氢气的混合气体,B错;天然气的主要成分是甲烷,还有其他杂质气体,C错;纯净的空气本身就是氮气、氧气等组成的混合物,D错。
2.(2011·佛山高一检测)将下列物质按酸、碱、盐分类顺序排列,正确的是( )
A.硫酸、烧碱、纯碱
B.硫酸、纯碱、食盐
C.碳酸、乙醇、高锰酸钾
D.磷酸、熟石灰、生石灰
【解析】选A。纯碱是盐;乙醇不属于酸、碱、盐中的任意一种;熟石灰是氢氧化钙属于碱,而生石灰是氧化钙属于氧化物。
3.用如图表示的一些物质或概念间的从属关系中不正确的是( )
【解析】选B。食盐水是溶液,属于混合物,不是化合物。
4.(2011·南京高一检测)小美在奥运五连环中填入了5种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反应类型是( )
A.分解反应 B.复分解反应
C.化合反应 D.置换反应
【解析】选A。相连环的物质间所发生反应的化学方程式及反应类型如下表:
5.(2011·池州高一检测)下列4组物质均有一种物质的类别与其他3种不同
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
(1)以上四组物质中类别不同的物质依次是(填化学式)
A_______________________________________________;
B_______________________________________________;
C_______________________________________________;
D_______________________________________________。
(2)这四种物质相互作用可生成一种新物质[碱式碳酸铜,化学式Cu2(OH)2CO3],该反应_____(填“是”或“否”)氧化还原反应。
【解析】A组中CO2为非金属氧化物,其余物质均为金属氧化物;B组中Cu为金属单质,其余物质为非金属单质;C组中O2为非金属单质,其余物质为金属单质;D组中H2O为非金属氧化物,其余物质均为酸。
(2)四种物质发生反应CO2+2Cu+O2+H2O====Cu2(OH)2CO3,该反应有元素化合价的变化,是氧化还原反应。
答案:(1)CO2 Cu O2 H2O (2)是
6.近年来,科学家在氦的气氛中给石墨电极通电,石墨挥发,在其挥发产生的黑烟中发现了C60。C60的金属渗入物具有超导性能,北京大学首先将C60渗入锡,获得超导转变温度为37 K的好成绩。
(1)C60和石墨都属于碳元素的_________,若要确定其元素的组成,可将它在足量的氧气中燃烧,再用_______来检验生成的_______气体,现象是______________。
(2)在舞台或银幕上往往会看到“云雾缭绕”的场面或镜头,这是释放了一种俗称干冰的物质而形成的,干冰是固体二氧化碳。请回答下列问题:
①干冰属于哪种类别的物质
②干冰可与哪些类别的物质发生化学反应 试任意列举两例,并写出反应的化学方程式。
【解析】(1)信息给予题多结合化学前沿的信息考查中学化学的基础知识。因此,一方面要学好基础知识,提高信息接受和处理能力,以便顺利解题;另一方面要通过题目信息来接触高新科技,扩充自己的知识储备。C60是一种分子,与金刚石、石墨一样,属于碳的一种单质。其燃烧产物为CO2,只要验证CO2的存在,就可确定其组成元素。
(2)CO2属于酸性氧化物,可与水、碱、碱性氧化物发生反应。
答案:(1)单质 澄清石灰水 二氧化碳 澄清石灰水变浑浊
(2)①从元素组成上看干冰属于氧化物,从性质上看干冰属于酸性氧化物。
②例:与水反应生成对应的酸:CO2+H2O====H2CO3
与碱反应生成盐和水:CO2+2NaOH====Na2CO3+H2O
与碱性氧化物反应生成盐:CO2+Na2O====Na2CO3(合理即可)
一、选择题(本题包括6小题,每小题4分,共24分)
1.石墨烯是由碳原子按六边形晶格整齐排布而成的,是已知材料中最薄的,在室温下传递电子的速度比已知导体都快。下列关于石墨烯的说法正确的是( )
A.石墨烯是新发明的一种化合物
B.石墨烯属于盐
C.石墨烯具有与石墨相同的性质
D.石墨烯属于单质
【解析】选D。由题目信息可知石墨烯是由碳原子构成的,是不同于石墨的单质,性质与石墨不同。
2.下列物质中符合如图中阴影部分表示的分类标准的是( )
A.K2CO3 B.Na2CO3
C.NaCl D.NaHCO3
【解析】选B。阴影部分的物质应符合碳酸盐、正盐和钠盐,K2CO3是钾盐,A错;NaCl不是碳酸盐,C错;NaHCO3不是正盐,D错。
3.(2011·福建师大附中高一检测)下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4====FeSO4+Cu
B.AgNO3+NaCl====AgCl↓+NaNO3
C.3CO+Fe2O3 2Fe+3CO2
D.2KMnO4 K2MnO4+MnO2+O2↑
【解析】选C。根据化学反应分类依据,氧化还原反应是指有化合价变化的反应,A、C、D均有化合价变化,但A属于置换反应,D属于分解反应,C反应不属于四种基本反应类型。
高温
====
△
====
4.盐是一类常见物质,下列物质可直接反应生成盐的是( )
①金属单质 ②碱性氧化物
③碱 ④非金属单质
⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有①④⑥
C.只有②⑤⑥ D.全部
【解析】选D。根据物质间的转化关系分析可知以上物质均可直接反应生成盐。
5.关于氧化物下列说法不正确的是( )
A.氧化物可分为金属氧化物和非金属氧化物
B.CO2既是酸性氧化物又是非金属氧化物
C.Na2O既是金属氧化物,又是碱性氧化物
D.一种氧化物不是酸性氧化物就是碱性氧化物
【解析】选D。氧化物是由氧元素和另外一种元素共同组成的化合物,除氧之外的另一种元素一定是金属元素或非金属元素,由金属元素与氧元素形成的化合物是金属氧化物,由非金属元素与氧元素形成的化合物为非金属氧化物,故A正确;CO2是非金属氧化物,也能与碱反应生成盐,故也是酸性氧化物,B正确;Na2O是金属氧化物,又能与酸反应生成盐,也是碱性氧化物,C正确;CO既不能与酸反应,也不能与碱反应,故CO既不是酸性氧化物也不是碱性氧化物,D错。
【规律方法】判断氧化物类别的注意事项
判断氧化物所属类别时,一定要注意以下几点:
(1)酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,也是酸性氧化物;
(2)非金属氧化物也不一定是酸性氧化物,如CO;
(3)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物。
6.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是( )
A.BaCl2、Na2CO3、AgNO3、盐酸
B.BaCl2、Na2CO3、盐酸、AgNO3
C.Na2CO3、盐酸、AgNO3、BaCl2
D.AgNO3、盐酸、BaCl2、Na2CO3
【解析】选A。四种物质中只有Na2CO3和盐酸能够反应生成无色无味气体(CO2),所以乙和丁中,一种是Na2CO3,另一种是盐酸。而Na2CO3能够和剩余两种物质反应生成沉淀,盐酸只能和AgNO3反应生成沉淀,由此可以确定乙是Na2CO3,丁是盐酸。既能和Na2CO3又能和盐酸反应生成沉淀的物质只有AgNO3,所以丙是AgNO3,甲为BaCl2。
【举一反三】现有四种无色溶液,分别是稀硫酸、盐酸、BaCl2溶液、纯碱溶液,不用其他试剂,能否将它们区别开来?
提示:能区别。将四种溶液分别两两反应,能和一种反应形成沉淀,和另两种反应均产生无色气体的是Na2CO3溶液,能和两种溶液反应产生沉淀的是BaCl2溶液,则与Na2CO3产生气体,与BaCl2产生沉淀的是稀硫酸,余下的一种是盐酸。
二、非选择题(本题包括2小题,共26分)
7.(16分)(2011·福州高一检测)有以下5个反应(反应条件略):
A.Na2O+CO2====Na2CO3
B.CH4+2O2====CO2+2H2O
C.2KClO3====2KCl+3O2↑
D.2Na+2H2O====2NaOH+H2↑
E.CaCO3+2HCl====CaCl2+H2O+CO2↑
属于化合反应的有______(填编号,下同),属于分解反应的有______,属于置换反应的有_____,属于复分解反应的有_____,属于氧化还原反应的有_____。
【解析】A.属于化合反应,但不是氧化还原反应;B.不属于四种基本反应类型,但是氧化还原反应;C.属于分解反应,也是氧化还原反应;D.属于置换反应,也是氧化还原反应;E.属于复分解反应,不是氧化还原反应。
答案:A C D E B、C、D
8.(10分)有下列物质:①铜、②氧气、③稀硫酸、④稀盐酸、⑤碳酸钙、⑥NaOH溶液、⑦AgNO3溶液。
(1)按物质的组成对上述物质进行分类。
(2)利用上述物质,如何制取CuSO4溶液,用化学方程式表示。
(3)怎样利用上述物质制取纯碱溶液,写出反应的化学方程式。
【解析】(1)题给物质中铜、氧气是单质,碳酸钙是盐,以上3种物质属于纯净物;稀硫酸、稀盐酸、NaOH溶液、AgNO3溶液分别是酸、碱、盐的水溶液,但它们都是混合物。
(2)铜不能置换酸中的氢,无法和稀硫酸反应,但把铜转化为氧化铜后,利用碱性氧化物和酸反应生成盐和水的性质,就可制得CuSO4溶液。
(3)碳酸钙是难溶于水的盐,不能直接与NaOH溶液反应,但利用碳酸钙和稀盐酸反应先制取CO2,再利用CO2和足量的NaOH溶液反应,就能制得Na2CO3溶液。
答案:(1)
(2)2Cu+O2 2CuO,
CuO+H2SO4====CuSO4+H2O
(3)先利用稀盐酸和碳酸钙反应制取CO2,然后用CO2和NaOH溶液反应制取纯碱溶液
CaCO3+2HCl====CaCl2+CO2↑+H2O
CO2+2NaOH====Na2CO3+H2O
△
====
1.在日常生活中,常会接触到下列物质:空气、乙醇、固体硫酸铵、铜、稀硫酸、氢气、石墨、食盐水,依据不同的分类标准,可以对上述物质进行不同的分类,试分析下列条件下的分类情况:
(1)根据物质的状态,应如何分类?
提示:固体:硫酸铵、铜、石墨
液体:乙醇、食盐水、稀硫酸
气体:空气、氢气
(2)根据物质的导电性,应如何分类?
提示:可导电物质:铜、石墨、食盐水、稀硫酸
不导电物质:空气、乙醇、固体硫酸铵、氢气
(3)根据物质的溶解性,应如何分类?
提示:可溶性物质:乙醇、固体硫酸铵
难溶性物质:空气、铜、氢气、石墨
(4)根据物质的组成,应如何分类?
提示:混合物:空气、食盐水、稀硫酸
纯净物:乙醇、固体硫酸铵、铜、氢气、石墨
2.实验室中有下列物质,请根据物质组成对它们进行分类:
①钠(Na) ②氯气(Cl2) ③氯化铁(FeCl3)溶液
④硫酸(H2SO4) ⑤碳酸钙(CaCO3) ⑥氧化钙(CaO)
⑦氢氧化钠(NaOH) ⑧葡萄糖(C6H12O6)
⑨醋酸(C2H4O2) ⑩二氧化碳(CO2)
(1)属于混合物的有哪些物质?
提示:属于混合物的有:③
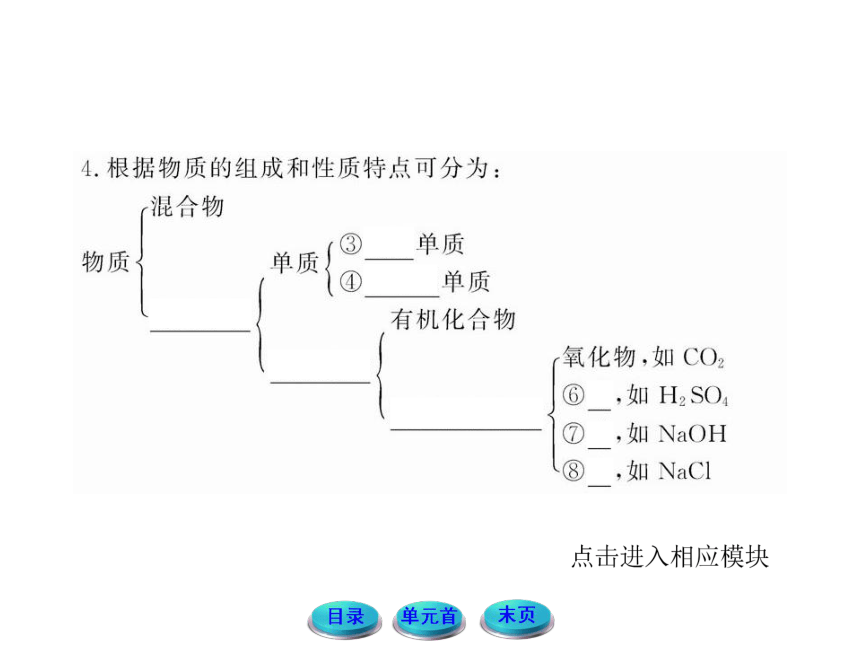
(2)根据物质组成,讨论如何对纯净物按教材P3图1-2进行分类?
提示:
例1 经分析,某种物质只含有一种元素,则此物质
A.一定是一种单质
B.一定是纯净物
C.一定是混合物
D.可能是纯净物,也可能是混合物
【规范解答】选D。物质分为纯净物和混合物。若纯净物只含一种元素,一定是单质而不是化合物,如H2;但若为只含有一种元素的混合物,则可能是由两种单质或多种单质组成,如金刚石和石墨、O2和O3等。
【互动探究】若将原题中“只含有一种元素”改为“只含有一种分子”,则答案应为哪个选项?
提示:选B。分子是保持物质化学性质的最小微粒,若某物质只含有一种分子,则此物质一定为纯净物,可能为单质,也可能为化合物。
1.纯净物和混合物的区别
2.氧化物的分类
(1)酸性氧化物可能是非金属氧化物,也可能是金属氧化物;
(2)碱性氧化物一定是金属氧化物。
1.结合学过的化学反应,试举例探究生成盐的方法。请写出符合条件的化学方程式。
(1)由单质生成盐
(4)由盐生成盐:盐+盐 新盐+另一种新盐
请举三例
提示:Na2CO3+CaCl2====CaCO3↓+2NaCl,
Ba(NO3)2+K2SO4====BaSO4↓+2KNO3,
BaCl2+2AgNO3====2AgCl↓+Ba(NO3)2
2.某同学学习了本节内容后,对学过的下列化学反应进行了分类,试探究其对化学反应分类的依据。
(1)硫在氧气里燃烧 (2)红磷在氧气里燃烧
(3)铁丝在氧气里燃烧 (4)铝箔在氧气里燃烧
(5)酒精燃烧 (6)高温煅烧石灰石
(7)电解水制氢气
提示:Ⅰ.(1)(2)(3)(4)均为单质在氧气中燃烧的反应,且均为化合反应
Ⅱ.(1)(2)反应物为非金属与氧气;(3)(4)反应物为金属与氧气
Ⅲ.(6)(7)均为分解反应
Ⅳ.(1)(2)(3)(4)(5)(7)反应均有化合价的变化,为氧化还原反应
例2 很多食品的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可作干燥剂的理由是什么?(用化学方程式表示)
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4)小纸袋中的物质能否长期持续地作干燥剂?为什么?
(5)在你所认识的化学物质中,还有哪些物质可以用作干燥剂?
【规范解答】(1)生石灰属于哪种类别的物质可以从组成、属类、状态等方面分类。(2)生石灰可作干燥剂的原因是氧化钙与水反应,有吸水作用。(3)生石灰作为碱性氧化物具有碱性氧化物的通性。(4)生石灰吸水后生成Ca(OH)2,失去吸水能力。
答案:(1)化合物、金属氧化物、固态物质等。
(2)CaO+H2O====Ca(OH)2。
(3)与酸反应:CaO+2HCl====CaCl2+H2O;
与非金属氧化物反应:CaO+CO2====CaCO3。
(4)不能,因为生石灰全部变为Ca(OH)2后,就不能再起到干燥作用。
(5)浓硫酸、CaCl2、P2O5、碱石灰等。
【互动探究】在气体的除杂操作中经常使用到干燥剂,请举几例,并对其分类。
提示:常见的干燥剂有CaCl2、P2O5、浓硫酸、碱石灰等。
分类:CaCl2为盐酸盐或钙盐、P2O5为酸性氧化物、浓硫酸为含氧酸、碱石灰为混合物
氧化还原反应与四种基本反应类型之间的关系
氧化还原反应的特点是反应前后有元素化合价的变化。氧化还原反应与四种基本反应类型间的关系可以用下图表示:
探究:试根据学过的反应实例进行探究讨论。
1.试总结分析氧化还原反应与四种基本反应类型之间的关系图示的涵义。
提示:有单质参加的化合反应一定是氧化还原反应;有单质生成的分解反应一定是氧化还原反应;置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应。
2.什么样的化合反应是氧化还原反应?什么样的分解反应是氧化还原反应?
提示:CO2+H2O====H2CO3是化合反应,但反应前后没有元素化合价的变化,故该反应不是氧化还原反应;2H2+O2
2H2O是化合反应,反应前后H、O元素化合价发生变化,故该反应是氧化还原反应。故有单质参加的化合反应是氧化还原反应;CaCO3 CO2↑+CaO是分解反应,但反应前后没有元素化合价的变化,该反应不是氧化还原反应;2H2O 2H2↑+O2↑是分解反应,反应前后H、O元素化合价发生变化,该反应是氧化还原反应。故有单质生成的分解反应是氧化还原反应。
点燃
====
高温
====
通电
====
3.为什么置换反应一定是氧化还原反应?
提示:置换反应是一种单质和一种化合物生成另一种单质和另一种化合物的反应,反应过程中肯定有元素化合价的变化,所以一定是氧化还原反应。
4.试分析复分解反应与氧化还原反应的关系。
提示:复分解反应可以用“AB+CD====AD+CB”形象的表示,表示反应过程中相互交换成分,不会发生元素化合价的变化,一定不是氧化还原反应。
5.有单质参加或生成的反应肯定是氧化还原反应吗?
提示:3O2====2O3的反应有单质参加,也有单质生成,但由于反应前后氧元素均为0价,反应过程没有元素化合价的变化,故该反应不是氧化还原反应,故有单质参加或生成的反应不一定是氧化还原反应。
1.下列物质属于纯净物的是( )
A.冰水混合物
B.水煤气
C.天然气
D.纯净的无污染的空气
【解析】选A。冰和水仅是聚集状态不同,分子组成均为H2O,冰水混合物应为纯净物,A正确;水煤气是一氧化碳和氢气的混合气体,B错;天然气的主要成分是甲烷,还有其他杂质气体,C错;纯净的空气本身就是氮气、氧气等组成的混合物,D错。
2.(2011·佛山高一检测)将下列物质按酸、碱、盐分类顺序排列,正确的是( )
A.硫酸、烧碱、纯碱
B.硫酸、纯碱、食盐
C.碳酸、乙醇、高锰酸钾
D.磷酸、熟石灰、生石灰
【解析】选A。纯碱是盐;乙醇不属于酸、碱、盐中的任意一种;熟石灰是氢氧化钙属于碱,而生石灰是氧化钙属于氧化物。
3.用如图表示的一些物质或概念间的从属关系中不正确的是( )
【解析】选B。食盐水是溶液,属于混合物,不是化合物。
4.(2011·南京高一检测)小美在奥运五连环中填入了5种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反应类型是( )
A.分解反应 B.复分解反应
C.化合反应 D.置换反应
【解析】选A。相连环的物质间所发生反应的化学方程式及反应类型如下表:
5.(2011·池州高一检测)下列4组物质均有一种物质的类别与其他3种不同
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
(1)以上四组物质中类别不同的物质依次是(填化学式)
A_______________________________________________;
B_______________________________________________;
C_______________________________________________;
D_______________________________________________。
(2)这四种物质相互作用可生成一种新物质[碱式碳酸铜,化学式Cu2(OH)2CO3],该反应_____(填“是”或“否”)氧化还原反应。
【解析】A组中CO2为非金属氧化物,其余物质均为金属氧化物;B组中Cu为金属单质,其余物质为非金属单质;C组中O2为非金属单质,其余物质为金属单质;D组中H2O为非金属氧化物,其余物质均为酸。
(2)四种物质发生反应CO2+2Cu+O2+H2O====Cu2(OH)2CO3,该反应有元素化合价的变化,是氧化还原反应。
答案:(1)CO2 Cu O2 H2O (2)是
6.近年来,科学家在氦的气氛中给石墨电极通电,石墨挥发,在其挥发产生的黑烟中发现了C60。C60的金属渗入物具有超导性能,北京大学首先将C60渗入锡,获得超导转变温度为37 K的好成绩。
(1)C60和石墨都属于碳元素的_________,若要确定其元素的组成,可将它在足量的氧气中燃烧,再用_______来检验生成的_______气体,现象是______________。
(2)在舞台或银幕上往往会看到“云雾缭绕”的场面或镜头,这是释放了一种俗称干冰的物质而形成的,干冰是固体二氧化碳。请回答下列问题:
①干冰属于哪种类别的物质
②干冰可与哪些类别的物质发生化学反应 试任意列举两例,并写出反应的化学方程式。
【解析】(1)信息给予题多结合化学前沿的信息考查中学化学的基础知识。因此,一方面要学好基础知识,提高信息接受和处理能力,以便顺利解题;另一方面要通过题目信息来接触高新科技,扩充自己的知识储备。C60是一种分子,与金刚石、石墨一样,属于碳的一种单质。其燃烧产物为CO2,只要验证CO2的存在,就可确定其组成元素。
(2)CO2属于酸性氧化物,可与水、碱、碱性氧化物发生反应。
答案:(1)单质 澄清石灰水 二氧化碳 澄清石灰水变浑浊
(2)①从元素组成上看干冰属于氧化物,从性质上看干冰属于酸性氧化物。
②例:与水反应生成对应的酸:CO2+H2O====H2CO3
与碱反应生成盐和水:CO2+2NaOH====Na2CO3+H2O
与碱性氧化物反应生成盐:CO2+Na2O====Na2CO3(合理即可)
一、选择题(本题包括6小题,每小题4分,共24分)
1.石墨烯是由碳原子按六边形晶格整齐排布而成的,是已知材料中最薄的,在室温下传递电子的速度比已知导体都快。下列关于石墨烯的说法正确的是( )
A.石墨烯是新发明的一种化合物
B.石墨烯属于盐
C.石墨烯具有与石墨相同的性质
D.石墨烯属于单质
【解析】选D。由题目信息可知石墨烯是由碳原子构成的,是不同于石墨的单质,性质与石墨不同。
2.下列物质中符合如图中阴影部分表示的分类标准的是( )
A.K2CO3 B.Na2CO3
C.NaCl D.NaHCO3
【解析】选B。阴影部分的物质应符合碳酸盐、正盐和钠盐,K2CO3是钾盐,A错;NaCl不是碳酸盐,C错;NaHCO3不是正盐,D错。
3.(2011·福建师大附中高一检测)下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4====FeSO4+Cu
B.AgNO3+NaCl====AgCl↓+NaNO3
C.3CO+Fe2O3 2Fe+3CO2
D.2KMnO4 K2MnO4+MnO2+O2↑
【解析】选C。根据化学反应分类依据,氧化还原反应是指有化合价变化的反应,A、C、D均有化合价变化,但A属于置换反应,D属于分解反应,C反应不属于四种基本反应类型。
高温
====
△
====
4.盐是一类常见物质,下列物质可直接反应生成盐的是( )
①金属单质 ②碱性氧化物
③碱 ④非金属单质
⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有①④⑥
C.只有②⑤⑥ D.全部
【解析】选D。根据物质间的转化关系分析可知以上物质均可直接反应生成盐。
5.关于氧化物下列说法不正确的是( )
A.氧化物可分为金属氧化物和非金属氧化物
B.CO2既是酸性氧化物又是非金属氧化物
C.Na2O既是金属氧化物,又是碱性氧化物
D.一种氧化物不是酸性氧化物就是碱性氧化物
【解析】选D。氧化物是由氧元素和另外一种元素共同组成的化合物,除氧之外的另一种元素一定是金属元素或非金属元素,由金属元素与氧元素形成的化合物是金属氧化物,由非金属元素与氧元素形成的化合物为非金属氧化物,故A正确;CO2是非金属氧化物,也能与碱反应生成盐,故也是酸性氧化物,B正确;Na2O是金属氧化物,又能与酸反应生成盐,也是碱性氧化物,C正确;CO既不能与酸反应,也不能与碱反应,故CO既不是酸性氧化物也不是碱性氧化物,D错。
【规律方法】判断氧化物类别的注意事项
判断氧化物所属类别时,一定要注意以下几点:
(1)酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,也是酸性氧化物;
(2)非金属氧化物也不一定是酸性氧化物,如CO;
(3)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物。
6.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是( )
A.BaCl2、Na2CO3、AgNO3、盐酸
B.BaCl2、Na2CO3、盐酸、AgNO3
C.Na2CO3、盐酸、AgNO3、BaCl2
D.AgNO3、盐酸、BaCl2、Na2CO3
【解析】选A。四种物质中只有Na2CO3和盐酸能够反应生成无色无味气体(CO2),所以乙和丁中,一种是Na2CO3,另一种是盐酸。而Na2CO3能够和剩余两种物质反应生成沉淀,盐酸只能和AgNO3反应生成沉淀,由此可以确定乙是Na2CO3,丁是盐酸。既能和Na2CO3又能和盐酸反应生成沉淀的物质只有AgNO3,所以丙是AgNO3,甲为BaCl2。
【举一反三】现有四种无色溶液,分别是稀硫酸、盐酸、BaCl2溶液、纯碱溶液,不用其他试剂,能否将它们区别开来?
提示:能区别。将四种溶液分别两两反应,能和一种反应形成沉淀,和另两种反应均产生无色气体的是Na2CO3溶液,能和两种溶液反应产生沉淀的是BaCl2溶液,则与Na2CO3产生气体,与BaCl2产生沉淀的是稀硫酸,余下的一种是盐酸。
二、非选择题(本题包括2小题,共26分)
7.(16分)(2011·福州高一检测)有以下5个反应(反应条件略):
A.Na2O+CO2====Na2CO3
B.CH4+2O2====CO2+2H2O
C.2KClO3====2KCl+3O2↑
D.2Na+2H2O====2NaOH+H2↑
E.CaCO3+2HCl====CaCl2+H2O+CO2↑
属于化合反应的有______(填编号,下同),属于分解反应的有______,属于置换反应的有_____,属于复分解反应的有_____,属于氧化还原反应的有_____。
【解析】A.属于化合反应,但不是氧化还原反应;B.不属于四种基本反应类型,但是氧化还原反应;C.属于分解反应,也是氧化还原反应;D.属于置换反应,也是氧化还原反应;E.属于复分解反应,不是氧化还原反应。
答案:A C D E B、C、D
8.(10分)有下列物质:①铜、②氧气、③稀硫酸、④稀盐酸、⑤碳酸钙、⑥NaOH溶液、⑦AgNO3溶液。
(1)按物质的组成对上述物质进行分类。
(2)利用上述物质,如何制取CuSO4溶液,用化学方程式表示。
(3)怎样利用上述物质制取纯碱溶液,写出反应的化学方程式。
【解析】(1)题给物质中铜、氧气是单质,碳酸钙是盐,以上3种物质属于纯净物;稀硫酸、稀盐酸、NaOH溶液、AgNO3溶液分别是酸、碱、盐的水溶液,但它们都是混合物。
(2)铜不能置换酸中的氢,无法和稀硫酸反应,但把铜转化为氧化铜后,利用碱性氧化物和酸反应生成盐和水的性质,就可制得CuSO4溶液。
(3)碳酸钙是难溶于水的盐,不能直接与NaOH溶液反应,但利用碳酸钙和稀盐酸反应先制取CO2,再利用CO2和足量的NaOH溶液反应,就能制得Na2CO3溶液。
答案:(1)
(2)2Cu+O2 2CuO,
CuO+H2SO4====CuSO4+H2O
(3)先利用稀盐酸和碳酸钙反应制取CO2,然后用CO2和NaOH溶液反应制取纯碱溶液
CaCO3+2HCl====CaCl2+CO2↑+H2O
CO2+2NaOH====Na2CO3+H2O
△
====
