11-12版高中化学课时讲练通配套课件:1.1.2物质的量(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:1.1.2物质的量(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览










文档简介
(共61张PPT)
1.试讨论:硫酸的“物质的量”能简化为“硫酸的量”吗?能不能写成硫酸的“物质量”?
提示:不能。物质的量是一个专有名词,由四个字组成,是一个整体,不能分割,也不可加字、减字。
2.讨论下面叙述是否正确。
(1)摩尔是七个基本物理量之一。
提示:错。物质的量是七个基本物理量之一 ,摩尔是物质的量的单位。
(2)摩尔是物质的质量的单位。
提示:错。摩尔是物质的量的单位,质量的单位为g或kg等。
(3)1摩尔大米含有 6.02×1023个米粒。
提示:错。物质的量只适用于微观粒子,不能用来说明宏观物质。
3.能否说“阿伏加德罗常数就是6.02×1023”?
提示:不能。阿伏加德罗常数是指1 mol某种微粒集合体中所含的微粒数,它与0.012 kg C-12所含的原子数相同,在数值上约为6.02×1023,其单位为mol-1。
例1 (双选)下列关于物质的量的叙述正确的是
A.摩尔是一个基本物理量,表示物质所含粒子的多少
B.1 mol任何物质都含有6.02×1023个分子
C.0.012 kg C-12中含有约6.02×1023个C
D.1 mol H2O的质量等于NA个水分子质量的总和(NA表示阿伏加德罗常数)
【规范解答】选C、D。物质的量是一个基本物理量,摩尔是物质的量的单位,A项错;因为有些物质是由分子组成(例如水、硫酸等),有些物质是由离子组成[例如NaCl、Ca(OH)2等],还有些物质是由原子直接构成的(例如金刚石等),所以B项错;根据规定,0.012 kg C-12中所含的碳原子数即为阿伏加德罗常数,其近似值为6.02×1023 mol-1,C正确; 1 mol H2O中含NA个水分子,1 mol H2O的质量就等于NA个水分子质量的总和,D项正确。
【互动探究】1 mol H2O的质量等于1 mol H 原子和
1 mol O 原子的质量之和吗?
提示:不等于。1 mol H2O中含有2 mol H原子和1 mol O原子,故1 mol H2O的质量等于2 mol H 原子和1 mol O原子的质量之和。
使用物质的量时应该注意的问题
(1)物质的量是以0.012 kg C-12中所含的碳原子数目为标准来衡量其他微粒集合体所含微粒多少的物理量,是一个专有名词,不能理解成“物质的质量”、“物质的数量”。
(2)物质的量的单位摩尔,只适用于微观微粒,不适用于宏观物质。
(3)在使用“摩尔”表示物质的量时,应具体指明粒子的种类,如1 mol H2;若写成1 mol氢,则指代不明确。因为1 mol氢可以理解为1 mol氢原子、1 mol氢离子或者是1 mol氢分子。
(4)对于用化学式表示的微观粒子或它们的特定组合还应明确微粒间的内在联系。如含1 mol Al2(SO4)3的溶液中含2 mol Al3+和3 mol SO42-;1 mol Na+中含11 mol质子和10 mol电子。
1.请分析下表列出的有关数据,讨论下列问题:
1 mol不同物质的质量
(1)1 mol微观粒子的质量在数值上有何特点?
提示:1 mol微观粒子的质量在以克为单位时,在数值上等于该粒子的相对原子质量或相对分子质量。
(2)物质的摩尔质量在数值上有什么特点?
提示:物质的摩尔质量在以g/mol为单位时,在数值上等于该物质的相对原子质量或相对分子质量。
2.请结合所学知识讨论:摩尔质量与物质的质量的不同点体现在哪些方面?
提示:(1)概念不同。摩尔质量是指单位物质的量的物质所具有的质量,而质量是指物体所含物质多少的物理量。
(2)数值不同。对于给定的物质,其摩尔质量的数值是固定不变的,而物质质量的数值是任意的。
(3)单位不同。摩尔质量的单位是g·mol-1或kg·mol-1,而物质质量的单位是g或kg。
例2 下列叙述中正确的是
A.硝酸的摩尔质量是63 g
B.1 mol CO的质量是28 g
C.4 g氢气对应的摩尔质量是2 g氢气对应的摩尔质量的2倍
D.铁的摩尔质量在数值上等于铁原子的相对原子质量
【规范解答】选B。摩尔质量的单位为g·mol-1,因此A选项错误;1 mol CO的质量是28 g ,B选项正确;物质的摩尔质量在以g/mol为单位时,其数值等于该物质对应的相对原子质量或相对分子质量,氢气的摩尔质量为2 g·mol-1,C选项错误;D选项铁的摩尔质量以g/mol为单位时,在数值上等于铁原子的相对原子质量,D选项错误。
【互动探究】Fe2+ 与Fe3+的摩尔质量相同吗?
提示:1 mol离子的摩尔质量在以g·mol-1为单位时,在数值上等于该离子对应的原子的相对原子质量,故Fe2+ 与Fe3+的摩尔质量相同,均为56 g·mol-1。
理解“摩尔质量”的注意点
1.摩尔质量与1 mol粒子的质量含义不同,但有一定的联系。例如,H2O的摩尔质量为18 g·mol-1,1 mol H2O的质量是18 g。
2.摩尔质量只与物质的种类有关,与物质的量、物质的质量无关。
写出下列反应的化学方程式,并说明反应中反应物和生成物的物质的量的关系。
(1)氢氧化钠和硫酸的反应
___________________________________________
(2)氧化铁在高温下与一氧化碳的反应
___________________________________________
(3)氯酸钾(KClO3)加热分解生成氧气和氯化钾的反应
___________________________________________
(4)过氧化氢(H2O2)分解成氧气和水的反应。___________________________________________
提示:(1)2NaOH+H2SO4====Na2SO4+2H2O,
反应物与生成物的物质的量之比为2∶1∶1∶2
(2)Fe2O3+3CO 2Fe+3CO2,
反应物与生成物的物质的量之比为1∶3∶2∶3
(3)2KClO3 2KCl+3O2↑,
反应物与生成物的物质的量之比为2∶2∶3
(4)2H2O2 2H2O+O2↑,
反应物与生成物的物质的量之比为2∶2∶1
高温
====
MnO2
△
====
催化剂
====
例3 已知2KClO3 2KCl+3O2↑,则12.25 g KClO3完全分解,可制得氧气的物质的量最多为多少?
【规范解答】KClO3的相对分子质量为122.5,摩尔质量为122.5 g·mol-1,
MnO2
△
====
答案:
【互动探究】制得的氧气中含有氧原子的个数是多少?
提示:n(O)=2n(O2)=2×0.15 mol=0.3 mol
N(O)=n(O)·NA
=0.3 mol×6.02×1023 mol-1
=1.806×1023
使用方程式计算的注意点
(1)对应关系
2H2+ O2 2H2O
化学计量数: 2 1 2
粒子数(N/个): 2 1 2
NA·N(个): 2NA 1NA 2NA
物质的量(n/mol): 2 1 2
质量(m/g): 4 32 36
化学方程式中的各物质化学计量数之比等于各物质的物质的量之比。
点燃
====
(2)列化学方程式中的对应关系时,注意“左右对应,上下相同”,即表示同一种物质的物理量相同,表示不同物质的物理量对应。
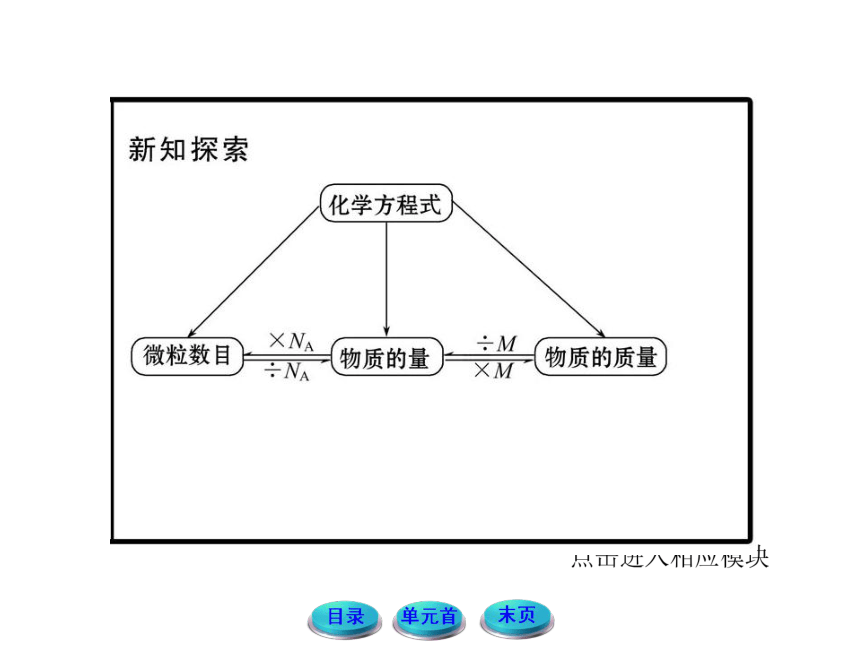
摩尔质量、质量、物质的量、粒子数之间的关系
人们常把物质的量形容成一座桥梁,它通过摩尔质量、阿伏加德罗常数把宏观物质的质量和微观物质所含微粒数联系起来。
探究:
1.请分析19.6 g H2SO4中所含分子数目是多少 含H原子数目是多少?
提示:H2SO4的相对分子质量为98,摩尔质量为98 g·mol-1。
硫酸分子数目:N(H2SO4)= ·NA
=0.2NA
一个硫酸分子中有2个氢原子
则氢原子数目:N(H)=2×0.2NA=0.4NA。
2.含有NA个H原子的H2SO4的质量是多少?
提示:H2SO4的相对分子质量为98,摩尔质量为98 g·mol-1。
由于一个H2SO4中含两个氢原子,则 NA个H2SO4中含NA个氢原子。
即N(H2SO4)= NA
m(H2SO4)=n(H2SO4)·M(H2SO4)= ·M(H2SO4)
= mol×98 g·mol-1=49 g。
3.相同质量的O2与O3,其分子数之比为多少?原子数之比呢?试总结存在什么规律?
提示:设O2与O3的质量均为1 g,则
因O2与O3均由氧原子构成,故相同质量的O2与O3所含氧原子数相同,即氧原子数之比为1∶1。
规律:① 即微粒数之比等于物质的量之比。
②同种原子组成的相同质量的不同物质原子个数相同。
③相同质量的不同物质其分子数之比为
即分子数之比等于摩尔质量的反比。
1.(2011·东莞高一检测)下列理解正确的是( )
A.摩尔是国际单位制中七个基本物理量之一
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.国际上规定,0.012 kg碳原子中所含有的碳原子数目为1摩
【解析】选B。摩尔是物质的量的单位,物质的量是国际单位制中七个基本物理量之一,A错;摩尔是物质的量的单位,物质的量是把可称量的宏观物质与微观粒子联系起来的物理量,C错;国际上规定,0.012 kg C-12中所含有的碳原子数目为1摩。
2.下列关于阿伏加德罗常数的认识正确的是( )
A.阿伏加德罗常数就是6.02×1023
B.1 mol任何物质都含有约6.02×1023个原子
C.0.012 kg C-12含有约6.02×1023个碳原子
D.1 mol H2SO4中含有NA个H2
【解析】选C。阿伏加德罗常数是0.012 kg C-12中所含的原子数,约为6.02×1023 mol-1,6.02×1023是其常用数值,A错;物质的组成微粒不一定是原子,可能是分子或离子,B错;0.012 kg C-12含有约6.02×1023个碳原子,C正确;1 mol H2SO4 是由H2SO4分子组成的,不存在H2,D错。
3.0.8 g某物质含有3.01×1022个分子,该物质的相对分子质量约为( )
A.8 B.16 C.64 D.160
【解析】选B。由题意可得n=N/NA=3.01×1022/(6.02×
1023)mol-1=5×10-2 mol
M=m/n=0.8 g/5×10-2 mol=16 g·mol-1,Mr=16。
4.关于质量相同的NO2和N2O4,下列说法正确的是( )
A.所含分子数相同
B.所含原子数不同
C.所含原子数相同
D.N2O4中所含氧原子数较多
【解析】选C。设NO2和N2O4质量均为m,则n(NO2)= mol,
n(N2O4) = mol,则n(NO2)∶n(N2O4)=2∶1,原子数的物质的量之比为2×3∶1×6=1∶1。所含氧原子数之比为2×2∶1×4=1∶1。
5.(1)9.03×1023个氨分子含_____mol氨分子,_____mol氢原子。
(2)0.5 mol Al2(SO4)3有_____mol Al3+,_____个SO42-。
(3)4.5 g水与_____g硫酸所含的分子数相等,它们所含氧原子数之比是_____,其中氢原子数之比是_____。
【解析】本题综合利用公式,进行换算,(1)利用微粒数求物质的量,(2)根据化学式求离子物质的量、离子个数, (3)利用质量求分子数、原子数。
答案:(1)1.5 4.5 (2)1 1.5NA (3)24.5 1∶4 1∶1
一、选择题(本题包括6小题,每小题4分,共24分)
1.(2011·宿州高一检测)下列说法正确的是( )
A.1 mol氧含有6.02×1023个微粒
B.阿伏加德罗常数数值约等于6.02×1023
C.钠的摩尔质量等于它的相对原子质量
D.1 mol任何气体所含的气体分子数目不一定都相等
【解析】选B。A项错在使用摩尔时没有指明微粒的名称,或为1 mol氧气或为1 mol氧原子,使用mol表示物质时,必须指明微粒的种类;C项错在把摩尔质量与相对原子质量混同,应为当摩尔质量以g/mol为单位时在数值上等于它的相对原子质量;D项1 mol任何气体所含的气体分子数目都相等,均为阿伏加德罗常数个分子,D项错。
2.(2011·三明高一检测)下列叙述正确的是( )
A.同质量的H2与Cl2相比,H2的分子数多
B.H2SO4的摩尔质量为98 g
C.摩尔是用来衡量微观粒子多少的一种物理量
D.0.1 mol H2SO4含有的氢原子数约为6.02×1022
【解析】选A。同质量的H2与Cl2相比, 分子数之比等于摩尔质量的反比,即摩尔质量越大,分子数越少,故A正确;H2SO4的摩尔质量为98 g·mol-1,B错;物质的量是用来衡量微观粒子多少的一种物理量,C错;0.1 mol H2SO4含有氢原子的物质的量为0.2 mol,氢原子数为1.204×1023,D错。
3.x g H2O中含有y个氢原子,则阿伏加德罗常数为( )
A.9x/y mol-1 B.9y/x mol-1
C.x/y mol-1 D.y/x mol-1
【解析】选B。根据阿伏加德罗常数的意义,先求出x g H2O的物质的量,进而确定所含氢原子的物质的量,即可求出阿伏加德罗常数。
根据n=m/M得,x g H2O的物质的量为:n(H2O)=x/18 mol,
因为1 mol H2O中含有2 mol氢原子,则x g H2O中含氢原子的物质的量为x/9 mol。根据NA= ,阿伏加德罗常数NA为:9y/x mol-1。
4.对于相同物质的量的SO2和SO3,下列说法正确的是( )
A.硫元素的质量比为5∶4
B.分子数之比为1∶1
C.原子总数之比为4∶3
D.质量之比为1∶1
【解析】选B。可以假设SO2和SO3的物质的量均为1 mol,则它们具有相同物质的量的硫元素,硫元素的质量比为1∶1;SO2和SO3的物质的量相同,则分子数也相同,分子数之比为1∶1;原子总数之比为3∶4;质量之比为64∶80。
【举一反三】若为等质量的SO2和SO3,则答案如何?
提示:设SO2和SO3的质量均为1 g,则n(SO2)=1/64 mol,
n(SO3)=1/80 mol,即n(SO2)∶n(SO3)=5∶4,则硫元素的质量之比为5∶4,分子数之比为5∶4,原子总数之比为15∶16,质量之比为1∶1,应选A、D。
【规律方法】(1)由N=n·NA可知:
(2)由m= n·M可知:
①等物质的量的不同物质
②等质量的不同物质
5.(双选)设NA代表阿伏加德罗常数,下列说法正确的是( )
A.9.8 g H2SO4和9.8 g H3PO4含有相同的分子数和原子数
B.2 g氢气所含原子数目为NA
C.3.01×1023个氮分子所含的原子数目在数值上与NA近似相等
D.17 g氨气所含原子数目为4NA
【解析】选C、D。H2SO4和H3PO4的摩尔质量相同,等质量的H2SO4和H3PO4的物质的量相等,但原子数不相等,故A错;B中H2为双原子分子,2 g氢气即1 mol H2,应含有2 mol H,原子个数为2NA,故B错;C中N2为双原子分子,3.01×1023个氮分子所含原子数应为2×3.01×1023,在数值上与NA近似相等,故C正确;D中17 g NH3的物质的量为1 mol,1个NH3含有4个原子,1 mol NH3含有的原子数为4NA,D正确。
6.(2011·福州高一检测)科学家刚刚发现的某种元素的一个原子,其质量是a g,一个12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.该原子的摩尔质量是aNA g·mol-1
B.W g该原子的物质的量是 mol
C.W g该原子中含有 个原子
D.由已知信息可得:NA=
【解析】选C。摩尔质量为单位物质的量的物质所具有的质
量,即1 mol物质的质量,该原子的质量是a g,则1 mol该原
子的质量为aNA g,摩尔质量为aNA g·mol-1,A正确;W g
该原子的物质的量n= B正确;一个原子的
质量是a g,W g该原子中含有 个原子,C错;该原子的相
对原子质量还可以表示为 ,故该原子的摩尔质量还可以
表示为 g·mol-1,故 =aNA,则NA= 。
二、非选择题(本题包括2小题,共26分)
7.(14分)有4种物质:A.6 g H2 B.0.5 mol CO2
C.1.204×1024个氯化氢分子 D.147 g硫酸,试比较:
(1)它们的物质的量最大的是_____(填序号,下同)。
(2)所含分子数最多的是_____。
(3)含原子个数最多的是_____。
(4)质量最大的是_____。
【解析】利用公式先计算其物质的量,然后由物质的量逐一计算分子数、原子个数、质量等。
答案:(1)A (2)A
(3)D (4)D
8.(12分)实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
取8.7 g的MnO2与足量的浓盐酸发生反应制取氯气。计算:
(1)参加反应的HCl有_____mol,生成Cl2_____mol。
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4 g,计算原浓盐酸中所含HCl的物质的量。
△
====
【解析】(1)MnO2的相对分子质量为87,则M(MnO2)=87 g·mol-1,
答案:
1.试讨论:硫酸的“物质的量”能简化为“硫酸的量”吗?能不能写成硫酸的“物质量”?
提示:不能。物质的量是一个专有名词,由四个字组成,是一个整体,不能分割,也不可加字、减字。
2.讨论下面叙述是否正确。
(1)摩尔是七个基本物理量之一。
提示:错。物质的量是七个基本物理量之一 ,摩尔是物质的量的单位。
(2)摩尔是物质的质量的单位。
提示:错。摩尔是物质的量的单位,质量的单位为g或kg等。
(3)1摩尔大米含有 6.02×1023个米粒。
提示:错。物质的量只适用于微观粒子,不能用来说明宏观物质。
3.能否说“阿伏加德罗常数就是6.02×1023”?
提示:不能。阿伏加德罗常数是指1 mol某种微粒集合体中所含的微粒数,它与0.012 kg C-12所含的原子数相同,在数值上约为6.02×1023,其单位为mol-1。
例1 (双选)下列关于物质的量的叙述正确的是
A.摩尔是一个基本物理量,表示物质所含粒子的多少
B.1 mol任何物质都含有6.02×1023个分子
C.0.012 kg C-12中含有约6.02×1023个C
D.1 mol H2O的质量等于NA个水分子质量的总和(NA表示阿伏加德罗常数)
【规范解答】选C、D。物质的量是一个基本物理量,摩尔是物质的量的单位,A项错;因为有些物质是由分子组成(例如水、硫酸等),有些物质是由离子组成[例如NaCl、Ca(OH)2等],还有些物质是由原子直接构成的(例如金刚石等),所以B项错;根据规定,0.012 kg C-12中所含的碳原子数即为阿伏加德罗常数,其近似值为6.02×1023 mol-1,C正确; 1 mol H2O中含NA个水分子,1 mol H2O的质量就等于NA个水分子质量的总和,D项正确。
【互动探究】1 mol H2O的质量等于1 mol H 原子和
1 mol O 原子的质量之和吗?
提示:不等于。1 mol H2O中含有2 mol H原子和1 mol O原子,故1 mol H2O的质量等于2 mol H 原子和1 mol O原子的质量之和。
使用物质的量时应该注意的问题
(1)物质的量是以0.012 kg C-12中所含的碳原子数目为标准来衡量其他微粒集合体所含微粒多少的物理量,是一个专有名词,不能理解成“物质的质量”、“物质的数量”。
(2)物质的量的单位摩尔,只适用于微观微粒,不适用于宏观物质。
(3)在使用“摩尔”表示物质的量时,应具体指明粒子的种类,如1 mol H2;若写成1 mol氢,则指代不明确。因为1 mol氢可以理解为1 mol氢原子、1 mol氢离子或者是1 mol氢分子。
(4)对于用化学式表示的微观粒子或它们的特定组合还应明确微粒间的内在联系。如含1 mol Al2(SO4)3的溶液中含2 mol Al3+和3 mol SO42-;1 mol Na+中含11 mol质子和10 mol电子。
1.请分析下表列出的有关数据,讨论下列问题:
1 mol不同物质的质量
(1)1 mol微观粒子的质量在数值上有何特点?
提示:1 mol微观粒子的质量在以克为单位时,在数值上等于该粒子的相对原子质量或相对分子质量。
(2)物质的摩尔质量在数值上有什么特点?
提示:物质的摩尔质量在以g/mol为单位时,在数值上等于该物质的相对原子质量或相对分子质量。
2.请结合所学知识讨论:摩尔质量与物质的质量的不同点体现在哪些方面?
提示:(1)概念不同。摩尔质量是指单位物质的量的物质所具有的质量,而质量是指物体所含物质多少的物理量。
(2)数值不同。对于给定的物质,其摩尔质量的数值是固定不变的,而物质质量的数值是任意的。
(3)单位不同。摩尔质量的单位是g·mol-1或kg·mol-1,而物质质量的单位是g或kg。
例2 下列叙述中正确的是
A.硝酸的摩尔质量是63 g
B.1 mol CO的质量是28 g
C.4 g氢气对应的摩尔质量是2 g氢气对应的摩尔质量的2倍
D.铁的摩尔质量在数值上等于铁原子的相对原子质量
【规范解答】选B。摩尔质量的单位为g·mol-1,因此A选项错误;1 mol CO的质量是28 g ,B选项正确;物质的摩尔质量在以g/mol为单位时,其数值等于该物质对应的相对原子质量或相对分子质量,氢气的摩尔质量为2 g·mol-1,C选项错误;D选项铁的摩尔质量以g/mol为单位时,在数值上等于铁原子的相对原子质量,D选项错误。
【互动探究】Fe2+ 与Fe3+的摩尔质量相同吗?
提示:1 mol离子的摩尔质量在以g·mol-1为单位时,在数值上等于该离子对应的原子的相对原子质量,故Fe2+ 与Fe3+的摩尔质量相同,均为56 g·mol-1。
理解“摩尔质量”的注意点
1.摩尔质量与1 mol粒子的质量含义不同,但有一定的联系。例如,H2O的摩尔质量为18 g·mol-1,1 mol H2O的质量是18 g。
2.摩尔质量只与物质的种类有关,与物质的量、物质的质量无关。
写出下列反应的化学方程式,并说明反应中反应物和生成物的物质的量的关系。
(1)氢氧化钠和硫酸的反应
___________________________________________
(2)氧化铁在高温下与一氧化碳的反应
___________________________________________
(3)氯酸钾(KClO3)加热分解生成氧气和氯化钾的反应
___________________________________________
(4)过氧化氢(H2O2)分解成氧气和水的反应。___________________________________________
提示:(1)2NaOH+H2SO4====Na2SO4+2H2O,
反应物与生成物的物质的量之比为2∶1∶1∶2
(2)Fe2O3+3CO 2Fe+3CO2,
反应物与生成物的物质的量之比为1∶3∶2∶3
(3)2KClO3 2KCl+3O2↑,
反应物与生成物的物质的量之比为2∶2∶3
(4)2H2O2 2H2O+O2↑,
反应物与生成物的物质的量之比为2∶2∶1
高温
====
MnO2
△
====
催化剂
====
例3 已知2KClO3 2KCl+3O2↑,则12.25 g KClO3完全分解,可制得氧气的物质的量最多为多少?
【规范解答】KClO3的相对分子质量为122.5,摩尔质量为122.5 g·mol-1,
MnO2
△
====
答案:
【互动探究】制得的氧气中含有氧原子的个数是多少?
提示:n(O)=2n(O2)=2×0.15 mol=0.3 mol
N(O)=n(O)·NA
=0.3 mol×6.02×1023 mol-1
=1.806×1023
使用方程式计算的注意点
(1)对应关系
2H2+ O2 2H2O
化学计量数: 2 1 2
粒子数(N/个): 2 1 2
NA·N(个): 2NA 1NA 2NA
物质的量(n/mol): 2 1 2
质量(m/g): 4 32 36
化学方程式中的各物质化学计量数之比等于各物质的物质的量之比。
点燃
====
(2)列化学方程式中的对应关系时,注意“左右对应,上下相同”,即表示同一种物质的物理量相同,表示不同物质的物理量对应。
摩尔质量、质量、物质的量、粒子数之间的关系
人们常把物质的量形容成一座桥梁,它通过摩尔质量、阿伏加德罗常数把宏观物质的质量和微观物质所含微粒数联系起来。
探究:
1.请分析19.6 g H2SO4中所含分子数目是多少 含H原子数目是多少?
提示:H2SO4的相对分子质量为98,摩尔质量为98 g·mol-1。
硫酸分子数目:N(H2SO4)= ·NA
=0.2NA
一个硫酸分子中有2个氢原子
则氢原子数目:N(H)=2×0.2NA=0.4NA。
2.含有NA个H原子的H2SO4的质量是多少?
提示:H2SO4的相对分子质量为98,摩尔质量为98 g·mol-1。
由于一个H2SO4中含两个氢原子,则 NA个H2SO4中含NA个氢原子。
即N(H2SO4)= NA
m(H2SO4)=n(H2SO4)·M(H2SO4)= ·M(H2SO4)
= mol×98 g·mol-1=49 g。
3.相同质量的O2与O3,其分子数之比为多少?原子数之比呢?试总结存在什么规律?
提示:设O2与O3的质量均为1 g,则
因O2与O3均由氧原子构成,故相同质量的O2与O3所含氧原子数相同,即氧原子数之比为1∶1。
规律:① 即微粒数之比等于物质的量之比。
②同种原子组成的相同质量的不同物质原子个数相同。
③相同质量的不同物质其分子数之比为
即分子数之比等于摩尔质量的反比。
1.(2011·东莞高一检测)下列理解正确的是( )
A.摩尔是国际单位制中七个基本物理量之一
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.国际上规定,0.012 kg碳原子中所含有的碳原子数目为1摩
【解析】选B。摩尔是物质的量的单位,物质的量是国际单位制中七个基本物理量之一,A错;摩尔是物质的量的单位,物质的量是把可称量的宏观物质与微观粒子联系起来的物理量,C错;国际上规定,0.012 kg C-12中所含有的碳原子数目为1摩。
2.下列关于阿伏加德罗常数的认识正确的是( )
A.阿伏加德罗常数就是6.02×1023
B.1 mol任何物质都含有约6.02×1023个原子
C.0.012 kg C-12含有约6.02×1023个碳原子
D.1 mol H2SO4中含有NA个H2
【解析】选C。阿伏加德罗常数是0.012 kg C-12中所含的原子数,约为6.02×1023 mol-1,6.02×1023是其常用数值,A错;物质的组成微粒不一定是原子,可能是分子或离子,B错;0.012 kg C-12含有约6.02×1023个碳原子,C正确;1 mol H2SO4 是由H2SO4分子组成的,不存在H2,D错。
3.0.8 g某物质含有3.01×1022个分子,该物质的相对分子质量约为( )
A.8 B.16 C.64 D.160
【解析】选B。由题意可得n=N/NA=3.01×1022/(6.02×
1023)mol-1=5×10-2 mol
M=m/n=0.8 g/5×10-2 mol=16 g·mol-1,Mr=16。
4.关于质量相同的NO2和N2O4,下列说法正确的是( )
A.所含分子数相同
B.所含原子数不同
C.所含原子数相同
D.N2O4中所含氧原子数较多
【解析】选C。设NO2和N2O4质量均为m,则n(NO2)= mol,
n(N2O4) = mol,则n(NO2)∶n(N2O4)=2∶1,原子数的物质的量之比为2×3∶1×6=1∶1。所含氧原子数之比为2×2∶1×4=1∶1。
5.(1)9.03×1023个氨分子含_____mol氨分子,_____mol氢原子。
(2)0.5 mol Al2(SO4)3有_____mol Al3+,_____个SO42-。
(3)4.5 g水与_____g硫酸所含的分子数相等,它们所含氧原子数之比是_____,其中氢原子数之比是_____。
【解析】本题综合利用公式,进行换算,(1)利用微粒数求物质的量,(2)根据化学式求离子物质的量、离子个数, (3)利用质量求分子数、原子数。
答案:(1)1.5 4.5 (2)1 1.5NA (3)24.5 1∶4 1∶1
一、选择题(本题包括6小题,每小题4分,共24分)
1.(2011·宿州高一检测)下列说法正确的是( )
A.1 mol氧含有6.02×1023个微粒
B.阿伏加德罗常数数值约等于6.02×1023
C.钠的摩尔质量等于它的相对原子质量
D.1 mol任何气体所含的气体分子数目不一定都相等
【解析】选B。A项错在使用摩尔时没有指明微粒的名称,或为1 mol氧气或为1 mol氧原子,使用mol表示物质时,必须指明微粒的种类;C项错在把摩尔质量与相对原子质量混同,应为当摩尔质量以g/mol为单位时在数值上等于它的相对原子质量;D项1 mol任何气体所含的气体分子数目都相等,均为阿伏加德罗常数个分子,D项错。
2.(2011·三明高一检测)下列叙述正确的是( )
A.同质量的H2与Cl2相比,H2的分子数多
B.H2SO4的摩尔质量为98 g
C.摩尔是用来衡量微观粒子多少的一种物理量
D.0.1 mol H2SO4含有的氢原子数约为6.02×1022
【解析】选A。同质量的H2与Cl2相比, 分子数之比等于摩尔质量的反比,即摩尔质量越大,分子数越少,故A正确;H2SO4的摩尔质量为98 g·mol-1,B错;物质的量是用来衡量微观粒子多少的一种物理量,C错;0.1 mol H2SO4含有氢原子的物质的量为0.2 mol,氢原子数为1.204×1023,D错。
3.x g H2O中含有y个氢原子,则阿伏加德罗常数为( )
A.9x/y mol-1 B.9y/x mol-1
C.x/y mol-1 D.y/x mol-1
【解析】选B。根据阿伏加德罗常数的意义,先求出x g H2O的物质的量,进而确定所含氢原子的物质的量,即可求出阿伏加德罗常数。
根据n=m/M得,x g H2O的物质的量为:n(H2O)=x/18 mol,
因为1 mol H2O中含有2 mol氢原子,则x g H2O中含氢原子的物质的量为x/9 mol。根据NA= ,阿伏加德罗常数NA为:9y/x mol-1。
4.对于相同物质的量的SO2和SO3,下列说法正确的是( )
A.硫元素的质量比为5∶4
B.分子数之比为1∶1
C.原子总数之比为4∶3
D.质量之比为1∶1
【解析】选B。可以假设SO2和SO3的物质的量均为1 mol,则它们具有相同物质的量的硫元素,硫元素的质量比为1∶1;SO2和SO3的物质的量相同,则分子数也相同,分子数之比为1∶1;原子总数之比为3∶4;质量之比为64∶80。
【举一反三】若为等质量的SO2和SO3,则答案如何?
提示:设SO2和SO3的质量均为1 g,则n(SO2)=1/64 mol,
n(SO3)=1/80 mol,即n(SO2)∶n(SO3)=5∶4,则硫元素的质量之比为5∶4,分子数之比为5∶4,原子总数之比为15∶16,质量之比为1∶1,应选A、D。
【规律方法】(1)由N=n·NA可知:
(2)由m= n·M可知:
①等物质的量的不同物质
②等质量的不同物质
5.(双选)设NA代表阿伏加德罗常数,下列说法正确的是( )
A.9.8 g H2SO4和9.8 g H3PO4含有相同的分子数和原子数
B.2 g氢气所含原子数目为NA
C.3.01×1023个氮分子所含的原子数目在数值上与NA近似相等
D.17 g氨气所含原子数目为4NA
【解析】选C、D。H2SO4和H3PO4的摩尔质量相同,等质量的H2SO4和H3PO4的物质的量相等,但原子数不相等,故A错;B中H2为双原子分子,2 g氢气即1 mol H2,应含有2 mol H,原子个数为2NA,故B错;C中N2为双原子分子,3.01×1023个氮分子所含原子数应为2×3.01×1023,在数值上与NA近似相等,故C正确;D中17 g NH3的物质的量为1 mol,1个NH3含有4个原子,1 mol NH3含有的原子数为4NA,D正确。
6.(2011·福州高一检测)科学家刚刚发现的某种元素的一个原子,其质量是a g,一个12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.该原子的摩尔质量是aNA g·mol-1
B.W g该原子的物质的量是 mol
C.W g该原子中含有 个原子
D.由已知信息可得:NA=
【解析】选C。摩尔质量为单位物质的量的物质所具有的质
量,即1 mol物质的质量,该原子的质量是a g,则1 mol该原
子的质量为aNA g,摩尔质量为aNA g·mol-1,A正确;W g
该原子的物质的量n= B正确;一个原子的
质量是a g,W g该原子中含有 个原子,C错;该原子的相
对原子质量还可以表示为 ,故该原子的摩尔质量还可以
表示为 g·mol-1,故 =aNA,则NA= 。
二、非选择题(本题包括2小题,共26分)
7.(14分)有4种物质:A.6 g H2 B.0.5 mol CO2
C.1.204×1024个氯化氢分子 D.147 g硫酸,试比较:
(1)它们的物质的量最大的是_____(填序号,下同)。
(2)所含分子数最多的是_____。
(3)含原子个数最多的是_____。
(4)质量最大的是_____。
【解析】利用公式先计算其物质的量,然后由物质的量逐一计算分子数、原子个数、质量等。
答案:(1)A (2)A
(3)D (4)D
8.(12分)实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
取8.7 g的MnO2与足量的浓盐酸发生反应制取氯气。计算:
(1)参加反应的HCl有_____mol,生成Cl2_____mol。
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4 g,计算原浓盐酸中所含HCl的物质的量。
△
====
【解析】(1)MnO2的相对分子质量为87,则M(MnO2)=87 g·mol-1,
答案:
