11-12版高中化学课时讲练通配套课件:1.2.1物质的分离与提纯(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:1.2.1物质的分离与提纯(苏教版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览









文档简介
(共62张PPT)
1.现有只含泥沙的粗食盐,试设计由粗食盐提纯NaCl的实验方案
提示:实验方案:
2.加热蒸发KCl溶液得到纯净的KCl的过程中,请讨论加热时应该注意什么问题?
提示:先大火加热,使水大量蒸发,蒸发过程中要不断搅拌,当有大量晶体析出时,停止加热,用余热蒸干。
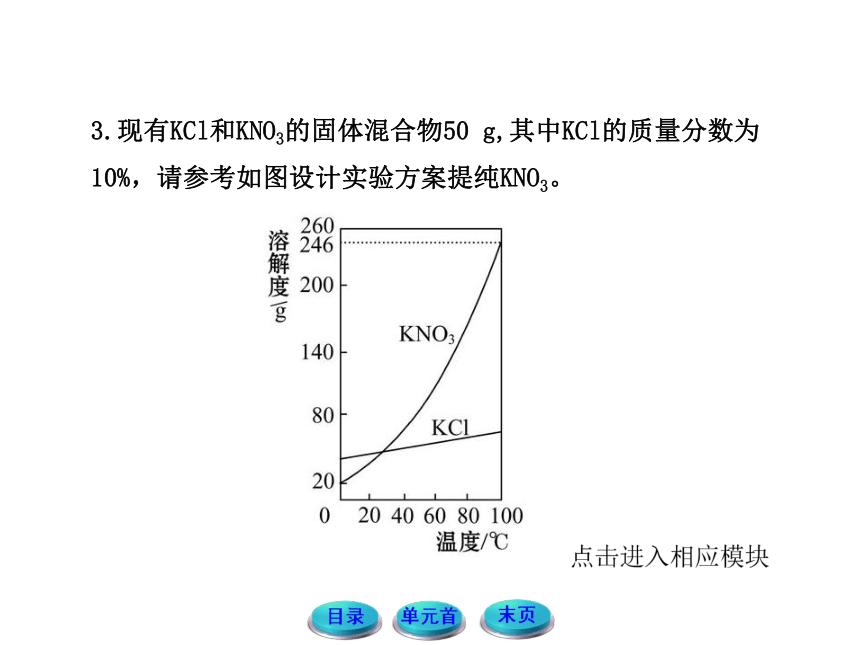
3.现有KCl和KNO3的固体混合物50 g,其中KCl的质量分数为10%,请参考如图设计实验方案提纯KNO3。
提示:①溶解:将50 g KCl和KNO3的混合物放入烧杯中,加入约18.3 mL的100 ℃的热水,用玻璃棒搅拌,使固体完全溶解。
②将所得溶液静置、冷却,降温至30 ℃左右,析出晶体。
③过滤得到晶体。
④重结晶,得到更为纯净的KNO3。
例1 分离NaCl、FeCl3和BaSO4的混合物,应选用的一组试剂是
A.H2O、AgNO3、HNO3
B.H2O、NaOH、HNO3
C.H2O、NaOH、HCl
D.H2O、KOH、HNO3
【规范解答】选C。此题中,因NaCl 、FeCl3均溶于水,BaSO4难溶于水,所以先用水溶解,利用溶解性差异过滤分离,然后用NaOH溶液与滤液反应,NaCl未变化,FeCl3被转化为Fe(OH)3沉淀,通过过滤分别得到滤液和沉淀,将滤液蒸发结晶可得纯净的NaCl,将沉淀与HCl溶液反应,可使转化为Fe(OH)3的FeCl3得以复原。所以选C。
【互动探究】在本题中加入试剂时要注意什么问题?
提示:在分离操作中同样要遵循不能引入新杂质的原则,即加入的酸必须含有Cl-;加入的阳离子必须为Na+,而不能引入其他杂质阳离子。
1.沉淀的洗涤
向过滤器中加蒸馏水,使水没过沉淀。待溶液全部滤出后,重复操作2~3次。
2.分离与提纯操作的注意点
(1)分离与提纯的比较
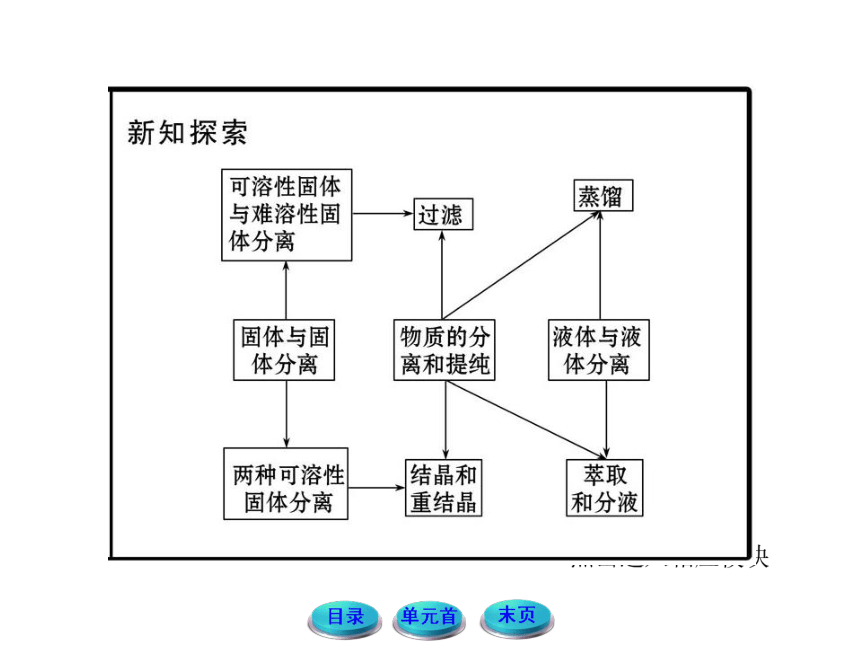
①物质的分离是将两种或多种物质的混合物彼此分开,得到几种纯净物的过程;
②物质的提纯是除去物质中混有的少量杂质而得到纯净的物质;
(2)分离、提纯的基本原则
①不增(不引入新杂质)
②不减(不减少被提纯物)
③易分离(被提纯物与杂质易分离)
④易复原(被提纯物易复原)
(3)注意事项
①除杂试剂须过量
②过量试剂须除尽
③除去多种杂质时要考虑加入试剂的顺序
④选择最佳的除杂途径
1.在萃取分液的实验中振荡时,要不时旋开活塞放气;分液时,要将玻璃塞打开(或使塞上的凹槽或小孔对准漏斗上的小孔),二者的原理一样吗?
提示:二者的原理是相同的,都是保证分液漏斗内与外界大气相通,使内外压强相等,具体而言,前者的目的是防止分液漏斗内压强过大引起危险,后者的目的则是保证液体顺利流下。
2.试讨论分液操作应注意的问题:
(1)振荡完后立即将液体分离吗?
提示:不是。应充分静置。
(2)分离出下层液体如何操作?
提示:漏斗颈紧靠烧杯内壁,慢慢打开活塞,当下层液体放尽时,及时关闭活塞。
3.请思考在蒸馏实验中使用温度计的目的是什么?温度计水银球应该处在什么位置?
提示:在蒸馏实验中某种物质达到沸点时转化为蒸气从而使它从原混合物中分离出来,所以温度计的作用是测量蒸气的温度,且温度计水银球的上端与蒸馏烧瓶支管的下边缘在同一水平线上。
4.结合蒸馏的原理,分析能否用实验室制取蒸馏水的装置分离互溶的多种液体?若能,应对该装置作何改进?
提示:能。利用蒸馏的方法分离互溶的多种液体时应将圆底烧瓶换为蒸馏烧瓶且使用温度计,并使温度计的水银球在蒸馏烧瓶的支管口处。
例2 下列分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用分液的方法分离食盐水和汽油的混合物
【规范解答】选C。过滤可以分离固体和液体的混合物,
A正确;用蒸馏方法可以制取蒸馏水,B正确;酒精能溶于水,不能用于萃取碘水中的碘,可以用与水互不相溶的CCl4或苯萃取,C错误;汽油与水互不相溶,可以用分液的方法分离,D正确。
【互动探究】若食盐水中混有少量NaOH,则使用上述分离方法能达到除杂目的吗?
提示:食盐水中混有NaOH,不能通过过滤、蒸馏、萃取或分液的方法除杂,应加入适量的盐酸,使其与NaOH发生反应而将NaOH除去。
1.萃取剂的选择原则
(1)萃取剂与原溶剂不互溶、不反应,密度相差较大;
(2)溶质在萃取剂中的溶解度比在原溶剂中大得多;
(3)溶质不与萃取剂发生任何化学反应。
2.蒸馏时的注意事项
(1)蒸馏烧瓶中放少量碎瓷片,防止暴沸;
(2)温度计水银球的位置应在蒸馏烧瓶支管口处;
(3)蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于1/3;
(4)冷凝管中冷却水下进上出。
探究:以CCl4萃取饱和碘水中的I2为例,思考下列问题:
1.操作③中将分液漏斗倒转过来用力振荡并及时旋开活塞放气的目的是什么?
提示:用力振荡是使CCl4与碘水充分混合;及时放气是为了防止分液漏斗内压强过大引起危险。
2.操作⑤中如何实现分液漏斗内外气压相等?
提示:将分液漏斗的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗上的小孔。
3.操作⑥中上下层液体怎样转移至烧杯中?
提示:下层液体由下口放入烧杯中,上层液体由上口倒入另一只烧杯中。
4.操作⑥如何使液体顺利流入烧杯中?
提示:使漏斗下端管口紧贴烧杯内壁。
1.分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A.氧化铜、木炭
B.碳酸钙、氯化钠
C.硝酸钾、氯化钠
D.乙醇、水
【解析】选B。氧化铜、木炭均难溶于水,A错;碳酸钙难溶于水,氯化钠易溶于水,溶解、过滤可得碳酸钙,将溶液蒸发可得氯化钠,B正确;硝酸钾、氯化钠均易溶于水,过滤分离不开,C错;乙醇溶于水,过滤分离不开,D错。
2.实验室进行NaCl溶液蒸发时,一般有以下操作过程:
①放置酒精灯;②固定铁圈的位置;③放上蒸发皿;④加热搅拌;⑤停止加热、余热蒸干。其正确的操作顺序是( )
A.①②③④
B.①②③④⑤
C.②③①④⑤
D.②①③④⑤
【解析】选B。本题考查学生对蒸发、结晶操作的掌握情况。蒸发、结晶是在蒸发皿中进行的。蒸发过程中先放置酒精灯,然后根据酒精灯火焰的高度固定铁圈的位置,再放上蒸发皿即可进行蒸发了。蒸发过程中要用玻璃棒不停地进行搅拌,最后蒸干时应利用余热将溶液蒸干。
3.在自来水蒸馏实验中,下列操作叙述不正确的是( )
A.在蒸馏烧瓶中盛约1/3体积的自来水,并放入几粒沸石
B.将温度计水银球插到蒸馏烧瓶自来水中
C.冷水从冷凝管下口入,上口出
D.收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象
【解析】选B。A、C、D均正确;蒸馏操作时,温度计的水银球应置于蒸馏烧瓶的支管口处,B项不正确。
4.现有三组溶液:
①汽油和氯化钠溶液
②39%的乙醇溶液
③碘的水溶液,
分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.分液、蒸馏、萃取
C.萃取、蒸馏、分液
D.蒸馏、萃取、分液
【解析】选B。汽油和氯化钠溶液互不相溶且密度相差较大,应该用分液的方法进行分离;乙醇溶液应该加入生石灰后进行蒸馏操作;碘的水溶液应该用苯或者四氯化碳进行萃取,B项正确。
5.(2011·黄冈高一检测)如图为实验室制取蒸馏水的装置示意图。
根据图示回答下列问题。
(1)A仪器的名称是_____,B仪器的名称是_____。
(2)图中有两处明显的错误是:
①____________________________________________;
②____________________________________________。
(3)实验时A中除加入少量自来水外,还需要加入少量的_____,其作用是_______________________________。
【解析】(2)①蒸馏过程中,温度计要测量蒸馏出蒸汽的温度,而不是要测量混合液体的温度。温度计的水银球未与支管口下边缘持平,此乃错误之一。
②冷凝管中,水流方向应该是下进上出,这样,可以保证冷凝管中始终充满水,冷却效果好,故冷凝管中进出水方向颠倒是错误之二。
(3)加热液体和液体的混合物,要加入少量沸石(或碎瓷片),防止混合液在受热时剧烈跳动(即防止暴沸)而发生危险。
答案:(1)蒸馏烧瓶 冷凝管
(2)①温度计水银球未在烧瓶支管口处
②冷却水进出口反了
(3)沸石(或碎瓷片) 防止液体暴沸
一、选择题(本题包括6小题,每小题4分,共24分)
1.如果你家里的食用花生油中混有水分,你将采用下列何种方法分离( )
A.过滤 B.蒸馏
C.分液 D.萃取
【解析】选C。食用花生油与水互不相溶,可采用分液的方法分离。
2.(2011·宁波高一检测)选择萃取剂将碘水中的碘萃取出来,这种萃取剂必须具备的性质是( )
A.不溶于水,但比水更易溶解碘
B.不溶于水,但必须与碘发生反应
C.不溶于水,且密度必须比水的大
D.不溶于水,且密度必须比水小
【解析】选A。萃取剂的选择原则为(1)萃取剂与原溶剂不混溶、不反应,密度相差较大;(2)溶质在萃取剂中的溶解度比在原溶剂中大得多; (3)溶质不与萃取剂发生任何反应。故选A。
3.(2011·福州高一检测)下列分离方法正确的是( )
A.分离汽油和水可以用结晶的方法
B.除去氯化钠溶液中的泥沙用分液的方法
C.分离乙酸(沸点118 ℃)与乙酸乙酯(沸点77.1 ℃)用蒸馏的方法
D.从含有少量氯化钠的硝酸钾溶液中提取硝酸钾用过滤的方法
【解析】选C。汽油和水互不相溶,二者的混合物静置分层,可以用分液的方法分离,A错;液体与不溶性的固体应采用过滤的方法分离,故除去氯化钠溶液中的泥沙用过滤的方法,B错;乙酸(沸点118 ℃)与乙酸乙酯(沸点77.1 ℃)互溶但沸点相差较大,应采用蒸馏的方法分离,C正确;氯化钠与硝酸钾均为易溶性的固体,二者随温度升高溶解度的变化不同,故应采用结晶的方法分离,D错。
【举一反三】有以下几种混合物,各用什么方法分离:
(1)铝粉中混有铁屑;
(2)蔗糖中混有沙子;(3)从海水中提取淡水。
提示:(1)用磁铁吸
(2)溶解、过滤、蒸发、结晶 (3)蒸馏
4.下列各组仪器常用于物质分离的是( )
A.①③⑥ B.②④⑥
C.②③⑥ D.②③⑤
【解析】选C。①为量筒,用于量取一定体积的液体。②为漏斗,常用于分离一种易溶和一种难溶的混合物。③为分液漏斗,常用于分离两种互不相溶的液体混合物。④为托盘天平,只能用于称量一定质量的固体,不能用于分离物质。⑤为研钵,常用于将固体物质研磨成粉末状物质,不能用于分离物质。⑥为蒸馏烧瓶,常用于分离两种沸点差距大且相互混溶的液体混合物。
5.(双选)下列实验操作错误的是( )
A.使用分液漏斗分液时,应将漏斗颈上的玻璃塞打开
B.蒸馏实验必须使用温度计
C.用CCl4萃取碘水中的碘
D.过滤(如图)时,可将悬浊液从烧杯直接倒入漏斗中
【解析】选B、D。蒸馏实验不一定使用温度计,如制备蒸馏水可以不用温度计;过滤时倾倒液体需要用玻璃棒引流。
【规律方法】物质的分离提纯规律
6.下列除去杂质的实验方法正确的是( )
A.除去CO中少量O2:通过灼热的铜网后再收集气体
B.除去CuO固体中少量Cu:置于坩埚中加热
C.除去NaCl中少量Na2CO3:加入适量的稀硝酸
D.除去生石灰中少量的石灰石:加入稍过量的稀盐酸
【解析】选B。A会混有二氧化碳杂质气体,不正确;B项正确;C会混有硝酸钠杂质;D中的生石灰也会被反应掉。
二、非选择题(本题包括2小题,共26分)
7.(12分)下图所示是分离混合物时常用的仪器,回答下列问题:
(1)写出仪器C、E的名称_____、_____
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
粗盐和泥沙:_____;花生油和水:_____。
【解析】(1)各仪器的名称依次是:蒸馏烧瓶、(普通)漏斗、分液漏斗、蒸发皿和冷凝管;(2)分离粗盐和泥沙,可以先加水溶解,然后过滤即可除去泥沙,将滤液加热蒸发即可得到纯净的食盐;花生油和水互不相溶,可以用分液漏斗进行分液,下层是水层,上层是油层。
答案:(1)分液漏斗 冷凝管 (2)B(或B、D) C
8.(14分)(2011·中山高一检测)(1)现有一瓶A和B的混合液,已知它们的性质如下表。
据此分析,将A和B相互分离的常用方法是_____(填“过滤”、“蒸发”、“萃取”、“分液”、“蒸馏”等)。
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为:_____、蒸发、结晶、_____。
(3)除去KCl溶液中的K2SO4,依次加入的溶液为(填溶质的化学式):_______________________________________。
【解析】(1)A、B两种液体相互溶解且沸点差别较大,应选择蒸馏的方法将二者分离。
(2)NaNO3和KNO3均是易溶于水的固体,因此考虑结晶法分离。将混合物在较高温度下溶于水,得到NaNO3的饱和溶液,然后蒸发,使溶剂水减少,因为KNO3的量少还没有达到饱和,不会析出KNO3,而NaNO3已达到了饱和,将析出NaNO3,趁热过滤,就能将两者分开。
(3)除去KCl溶液中的K2SO4,即要除去SO42-而不能引入新的杂质离子,因此要加入过量BaCl2[或Ba(OH)2]溶液,然后再加入K2CO3溶液除去过量的BaCl2[或Ba(OH)2],最后加盐酸将过量的K2CO3转变为KCl。
答案:(1)蒸馏 (2)溶解 过滤
(3)BaCl2[或Ba(OH)2]、K2CO3、HCl
1.现有只含泥沙的粗食盐,试设计由粗食盐提纯NaCl的实验方案
提示:实验方案:
2.加热蒸发KCl溶液得到纯净的KCl的过程中,请讨论加热时应该注意什么问题?
提示:先大火加热,使水大量蒸发,蒸发过程中要不断搅拌,当有大量晶体析出时,停止加热,用余热蒸干。
3.现有KCl和KNO3的固体混合物50 g,其中KCl的质量分数为10%,请参考如图设计实验方案提纯KNO3。
提示:①溶解:将50 g KCl和KNO3的混合物放入烧杯中,加入约18.3 mL的100 ℃的热水,用玻璃棒搅拌,使固体完全溶解。
②将所得溶液静置、冷却,降温至30 ℃左右,析出晶体。
③过滤得到晶体。
④重结晶,得到更为纯净的KNO3。
例1 分离NaCl、FeCl3和BaSO4的混合物,应选用的一组试剂是
A.H2O、AgNO3、HNO3
B.H2O、NaOH、HNO3
C.H2O、NaOH、HCl
D.H2O、KOH、HNO3
【规范解答】选C。此题中,因NaCl 、FeCl3均溶于水,BaSO4难溶于水,所以先用水溶解,利用溶解性差异过滤分离,然后用NaOH溶液与滤液反应,NaCl未变化,FeCl3被转化为Fe(OH)3沉淀,通过过滤分别得到滤液和沉淀,将滤液蒸发结晶可得纯净的NaCl,将沉淀与HCl溶液反应,可使转化为Fe(OH)3的FeCl3得以复原。所以选C。
【互动探究】在本题中加入试剂时要注意什么问题?
提示:在分离操作中同样要遵循不能引入新杂质的原则,即加入的酸必须含有Cl-;加入的阳离子必须为Na+,而不能引入其他杂质阳离子。
1.沉淀的洗涤
向过滤器中加蒸馏水,使水没过沉淀。待溶液全部滤出后,重复操作2~3次。
2.分离与提纯操作的注意点
(1)分离与提纯的比较
①物质的分离是将两种或多种物质的混合物彼此分开,得到几种纯净物的过程;
②物质的提纯是除去物质中混有的少量杂质而得到纯净的物质;
(2)分离、提纯的基本原则
①不增(不引入新杂质)
②不减(不减少被提纯物)
③易分离(被提纯物与杂质易分离)
④易复原(被提纯物易复原)
(3)注意事项
①除杂试剂须过量
②过量试剂须除尽
③除去多种杂质时要考虑加入试剂的顺序
④选择最佳的除杂途径
1.在萃取分液的实验中振荡时,要不时旋开活塞放气;分液时,要将玻璃塞打开(或使塞上的凹槽或小孔对准漏斗上的小孔),二者的原理一样吗?
提示:二者的原理是相同的,都是保证分液漏斗内与外界大气相通,使内外压强相等,具体而言,前者的目的是防止分液漏斗内压强过大引起危险,后者的目的则是保证液体顺利流下。
2.试讨论分液操作应注意的问题:
(1)振荡完后立即将液体分离吗?
提示:不是。应充分静置。
(2)分离出下层液体如何操作?
提示:漏斗颈紧靠烧杯内壁,慢慢打开活塞,当下层液体放尽时,及时关闭活塞。
3.请思考在蒸馏实验中使用温度计的目的是什么?温度计水银球应该处在什么位置?
提示:在蒸馏实验中某种物质达到沸点时转化为蒸气从而使它从原混合物中分离出来,所以温度计的作用是测量蒸气的温度,且温度计水银球的上端与蒸馏烧瓶支管的下边缘在同一水平线上。
4.结合蒸馏的原理,分析能否用实验室制取蒸馏水的装置分离互溶的多种液体?若能,应对该装置作何改进?
提示:能。利用蒸馏的方法分离互溶的多种液体时应将圆底烧瓶换为蒸馏烧瓶且使用温度计,并使温度计的水银球在蒸馏烧瓶的支管口处。
例2 下列分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用分液的方法分离食盐水和汽油的混合物
【规范解答】选C。过滤可以分离固体和液体的混合物,
A正确;用蒸馏方法可以制取蒸馏水,B正确;酒精能溶于水,不能用于萃取碘水中的碘,可以用与水互不相溶的CCl4或苯萃取,C错误;汽油与水互不相溶,可以用分液的方法分离,D正确。
【互动探究】若食盐水中混有少量NaOH,则使用上述分离方法能达到除杂目的吗?
提示:食盐水中混有NaOH,不能通过过滤、蒸馏、萃取或分液的方法除杂,应加入适量的盐酸,使其与NaOH发生反应而将NaOH除去。
1.萃取剂的选择原则
(1)萃取剂与原溶剂不互溶、不反应,密度相差较大;
(2)溶质在萃取剂中的溶解度比在原溶剂中大得多;
(3)溶质不与萃取剂发生任何化学反应。
2.蒸馏时的注意事项
(1)蒸馏烧瓶中放少量碎瓷片,防止暴沸;
(2)温度计水银球的位置应在蒸馏烧瓶支管口处;
(3)蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于1/3;
(4)冷凝管中冷却水下进上出。
探究:以CCl4萃取饱和碘水中的I2为例,思考下列问题:
1.操作③中将分液漏斗倒转过来用力振荡并及时旋开活塞放气的目的是什么?
提示:用力振荡是使CCl4与碘水充分混合;及时放气是为了防止分液漏斗内压强过大引起危险。
2.操作⑤中如何实现分液漏斗内外气压相等?
提示:将分液漏斗的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗上的小孔。
3.操作⑥中上下层液体怎样转移至烧杯中?
提示:下层液体由下口放入烧杯中,上层液体由上口倒入另一只烧杯中。
4.操作⑥如何使液体顺利流入烧杯中?
提示:使漏斗下端管口紧贴烧杯内壁。
1.分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A.氧化铜、木炭
B.碳酸钙、氯化钠
C.硝酸钾、氯化钠
D.乙醇、水
【解析】选B。氧化铜、木炭均难溶于水,A错;碳酸钙难溶于水,氯化钠易溶于水,溶解、过滤可得碳酸钙,将溶液蒸发可得氯化钠,B正确;硝酸钾、氯化钠均易溶于水,过滤分离不开,C错;乙醇溶于水,过滤分离不开,D错。
2.实验室进行NaCl溶液蒸发时,一般有以下操作过程:
①放置酒精灯;②固定铁圈的位置;③放上蒸发皿;④加热搅拌;⑤停止加热、余热蒸干。其正确的操作顺序是( )
A.①②③④
B.①②③④⑤
C.②③①④⑤
D.②①③④⑤
【解析】选B。本题考查学生对蒸发、结晶操作的掌握情况。蒸发、结晶是在蒸发皿中进行的。蒸发过程中先放置酒精灯,然后根据酒精灯火焰的高度固定铁圈的位置,再放上蒸发皿即可进行蒸发了。蒸发过程中要用玻璃棒不停地进行搅拌,最后蒸干时应利用余热将溶液蒸干。
3.在自来水蒸馏实验中,下列操作叙述不正确的是( )
A.在蒸馏烧瓶中盛约1/3体积的自来水,并放入几粒沸石
B.将温度计水银球插到蒸馏烧瓶自来水中
C.冷水从冷凝管下口入,上口出
D.收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象
【解析】选B。A、C、D均正确;蒸馏操作时,温度计的水银球应置于蒸馏烧瓶的支管口处,B项不正确。
4.现有三组溶液:
①汽油和氯化钠溶液
②39%的乙醇溶液
③碘的水溶液,
分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.分液、蒸馏、萃取
C.萃取、蒸馏、分液
D.蒸馏、萃取、分液
【解析】选B。汽油和氯化钠溶液互不相溶且密度相差较大,应该用分液的方法进行分离;乙醇溶液应该加入生石灰后进行蒸馏操作;碘的水溶液应该用苯或者四氯化碳进行萃取,B项正确。
5.(2011·黄冈高一检测)如图为实验室制取蒸馏水的装置示意图。
根据图示回答下列问题。
(1)A仪器的名称是_____,B仪器的名称是_____。
(2)图中有两处明显的错误是:
①____________________________________________;
②____________________________________________。
(3)实验时A中除加入少量自来水外,还需要加入少量的_____,其作用是_______________________________。
【解析】(2)①蒸馏过程中,温度计要测量蒸馏出蒸汽的温度,而不是要测量混合液体的温度。温度计的水银球未与支管口下边缘持平,此乃错误之一。
②冷凝管中,水流方向应该是下进上出,这样,可以保证冷凝管中始终充满水,冷却效果好,故冷凝管中进出水方向颠倒是错误之二。
(3)加热液体和液体的混合物,要加入少量沸石(或碎瓷片),防止混合液在受热时剧烈跳动(即防止暴沸)而发生危险。
答案:(1)蒸馏烧瓶 冷凝管
(2)①温度计水银球未在烧瓶支管口处
②冷却水进出口反了
(3)沸石(或碎瓷片) 防止液体暴沸
一、选择题(本题包括6小题,每小题4分,共24分)
1.如果你家里的食用花生油中混有水分,你将采用下列何种方法分离( )
A.过滤 B.蒸馏
C.分液 D.萃取
【解析】选C。食用花生油与水互不相溶,可采用分液的方法分离。
2.(2011·宁波高一检测)选择萃取剂将碘水中的碘萃取出来,这种萃取剂必须具备的性质是( )
A.不溶于水,但比水更易溶解碘
B.不溶于水,但必须与碘发生反应
C.不溶于水,且密度必须比水的大
D.不溶于水,且密度必须比水小
【解析】选A。萃取剂的选择原则为(1)萃取剂与原溶剂不混溶、不反应,密度相差较大;(2)溶质在萃取剂中的溶解度比在原溶剂中大得多; (3)溶质不与萃取剂发生任何反应。故选A。
3.(2011·福州高一检测)下列分离方法正确的是( )
A.分离汽油和水可以用结晶的方法
B.除去氯化钠溶液中的泥沙用分液的方法
C.分离乙酸(沸点118 ℃)与乙酸乙酯(沸点77.1 ℃)用蒸馏的方法
D.从含有少量氯化钠的硝酸钾溶液中提取硝酸钾用过滤的方法
【解析】选C。汽油和水互不相溶,二者的混合物静置分层,可以用分液的方法分离,A错;液体与不溶性的固体应采用过滤的方法分离,故除去氯化钠溶液中的泥沙用过滤的方法,B错;乙酸(沸点118 ℃)与乙酸乙酯(沸点77.1 ℃)互溶但沸点相差较大,应采用蒸馏的方法分离,C正确;氯化钠与硝酸钾均为易溶性的固体,二者随温度升高溶解度的变化不同,故应采用结晶的方法分离,D错。
【举一反三】有以下几种混合物,各用什么方法分离:
(1)铝粉中混有铁屑;
(2)蔗糖中混有沙子;(3)从海水中提取淡水。
提示:(1)用磁铁吸
(2)溶解、过滤、蒸发、结晶 (3)蒸馏
4.下列各组仪器常用于物质分离的是( )
A.①③⑥ B.②④⑥
C.②③⑥ D.②③⑤
【解析】选C。①为量筒,用于量取一定体积的液体。②为漏斗,常用于分离一种易溶和一种难溶的混合物。③为分液漏斗,常用于分离两种互不相溶的液体混合物。④为托盘天平,只能用于称量一定质量的固体,不能用于分离物质。⑤为研钵,常用于将固体物质研磨成粉末状物质,不能用于分离物质。⑥为蒸馏烧瓶,常用于分离两种沸点差距大且相互混溶的液体混合物。
5.(双选)下列实验操作错误的是( )
A.使用分液漏斗分液时,应将漏斗颈上的玻璃塞打开
B.蒸馏实验必须使用温度计
C.用CCl4萃取碘水中的碘
D.过滤(如图)时,可将悬浊液从烧杯直接倒入漏斗中
【解析】选B、D。蒸馏实验不一定使用温度计,如制备蒸馏水可以不用温度计;过滤时倾倒液体需要用玻璃棒引流。
【规律方法】物质的分离提纯规律
6.下列除去杂质的实验方法正确的是( )
A.除去CO中少量O2:通过灼热的铜网后再收集气体
B.除去CuO固体中少量Cu:置于坩埚中加热
C.除去NaCl中少量Na2CO3:加入适量的稀硝酸
D.除去生石灰中少量的石灰石:加入稍过量的稀盐酸
【解析】选B。A会混有二氧化碳杂质气体,不正确;B项正确;C会混有硝酸钠杂质;D中的生石灰也会被反应掉。
二、非选择题(本题包括2小题,共26分)
7.(12分)下图所示是分离混合物时常用的仪器,回答下列问题:
(1)写出仪器C、E的名称_____、_____
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
粗盐和泥沙:_____;花生油和水:_____。
【解析】(1)各仪器的名称依次是:蒸馏烧瓶、(普通)漏斗、分液漏斗、蒸发皿和冷凝管;(2)分离粗盐和泥沙,可以先加水溶解,然后过滤即可除去泥沙,将滤液加热蒸发即可得到纯净的食盐;花生油和水互不相溶,可以用分液漏斗进行分液,下层是水层,上层是油层。
答案:(1)分液漏斗 冷凝管 (2)B(或B、D) C
8.(14分)(2011·中山高一检测)(1)现有一瓶A和B的混合液,已知它们的性质如下表。
据此分析,将A和B相互分离的常用方法是_____(填“过滤”、“蒸发”、“萃取”、“分液”、“蒸馏”等)。
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为:_____、蒸发、结晶、_____。
(3)除去KCl溶液中的K2SO4,依次加入的溶液为(填溶质的化学式):_______________________________________。
【解析】(1)A、B两种液体相互溶解且沸点差别较大,应选择蒸馏的方法将二者分离。
(2)NaNO3和KNO3均是易溶于水的固体,因此考虑结晶法分离。将混合物在较高温度下溶于水,得到NaNO3的饱和溶液,然后蒸发,使溶剂水减少,因为KNO3的量少还没有达到饱和,不会析出KNO3,而NaNO3已达到了饱和,将析出NaNO3,趁热过滤,就能将两者分开。
(3)除去KCl溶液中的K2SO4,即要除去SO42-而不能引入新的杂质离子,因此要加入过量BaCl2[或Ba(OH)2]溶液,然后再加入K2CO3溶液除去过量的BaCl2[或Ba(OH)2],最后加盐酸将过量的K2CO3转变为KCl。
答案:(1)蒸馏 (2)溶解 过滤
(3)BaCl2[或Ba(OH)2]、K2CO3、HCl
