11-12版高中化学课时讲练通配套课件:1.2.2常见物质的检验(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:1.2.2常见物质的检验(苏教版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览








文档简介
(共64张PPT)
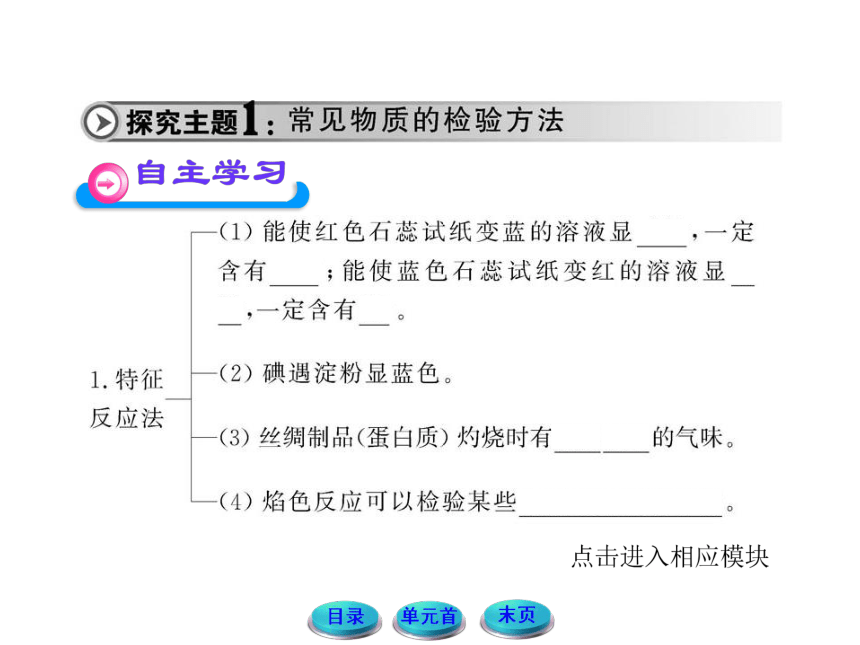
1.如何检验某白色固体是纯碱还是淀粉?
提示:可取固体少量置于试管中。
方法Ⅰ:加入适量食醋,若有气泡产生,则为Na2CO3;无气泡产生则为淀粉。
方法Ⅱ:滴加碘水,若溶液变蓝,则为淀粉,否则为Na2CO3。
2.如何判断衣料是蚕丝制品还是人造纤维制品?
提示:蚕丝的主要成分是蛋白质,蛋白质燃烧时产生烧焦羽毛的气味,而人造纤维却没有此气味,因此可以抽一根线点燃进行验证。
例1 下列判断中正确的是
A.可用pH试纸检验一种溶液是否为食盐溶液
B.已知酒精不与硫酸铜反应,故可用无水硫酸铜检验酒精中是否含有少量水
C.通过灼热的CuO能使固体由黑变红的气体一定是H2
D.用蓝色石蕊试纸来鉴别盐酸和醋酸
【规范解答】选B。食盐溶液为中性溶液,用pH试纸检测时pH为7, 但用pH试纸检测时pH为7的中性溶液未必为食盐溶液,如酒精、纯水等,A错;已知酒精不与硫酸铜反应,故将无水硫酸铜白色粉末加入酒精中,若白色粉末变蓝,则酒精含水,反之则无水,B正确;CO通过灼热的CuO也能使其变红,C错;盐酸和醋酸滴在蓝色石蕊试纸上均能使其变红,无法鉴别。D错。
【互动探究】如何检验某气体是否为氢气?
提示:将气体收集在小试管中,用拇指堵住试管口,靠近酒精灯火焰,松开拇指,若听到噗的一声或尖锐的爆鸣声,则证明气体为氢气。
物质检验的步骤
(1)先对试样进行外观观察,注意特征性质,确定其状态、颜色、气味等。
(2)然后准备试样(如当试样是固体时,应先取少量试样配成溶液,注意观察试样是否溶解,在溶解过程中有无气体产生等,以初步判断试样可能会是哪类物质)。
(3)再结合物质的性质进一步进行特征反应,每次均取少量(1~2 mL)溶液进行检验,(绝对不能将检测试样直接加入到全部的待测溶液中)观察有无气体、沉淀产生、有无发生颜色的变化。最后判定物质的成分。
1.实验台上放着一种白色晶体,可能为氯化钠,如何检验?
提示:将白色晶体溶于水,取样,滴加AgNO3溶液和硝酸,若产生白色沉淀,证明有Cl-;再取样,用铂丝蘸取少量溶液,放在火焰上灼烧,观察火焰的颜色为黄色,证明存在Na+,则该晶体是氯化钠。
2.用焰色反应检验钠、钾,当不用蓝色钴玻璃时,焰色反应为黄色,能否说明有钠无钾?
提示:若钾盐中混有钠离子,在灼烧时产生的黄色火焰能够遮盖钾的紫色火焰,使用蓝色钴玻璃可以将黄光过滤掉,避免钠元素的干扰,所以不能说明有钠无钾。
3.请设计实验鉴别NaCl、KCl、Na2CO3、K2SO4四种物质。
提示:取四种待测液少许,分别做以下实验:
(1)做焰色反应,可分为两组
①焰色为黄色的:NaCl、Na2CO3。
②透过蓝色钴玻璃焰色为紫色的:KCl、K2SO4。
(2)向①组的两种溶液中分别加入稀盐酸,有无色气体生成的是Na2CO3,无明显现象的是NaCl;向②组的两种溶液中分别加入BaCl2溶液,产生白色沉淀的为K2SO4,无明显变化的为KCl。
【例2】如图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是
A.甲:熟石灰; 乙:稀盐酸
B.甲:水; 乙:氢氧化钠溶液
C.甲:氯化钠溶液; 乙:稀硫酸
D.甲:稀盐酸; 乙:氯化钠溶液
【规范解答】选A。在三种物质中加入试剂甲时,有氨味产生,说明产生了氨气,铵盐和碱反应生成氨气,所以试剂甲为碱;NH4HCO3和NH4Cl组成上的差别在于阴离子不同,
HCO3-能够和酸反应放出二氧化碳气体,而Cl-不能,所以试剂乙为酸;符合这两个条件的只有A选项。
【互动探究】若加入的试剂甲和乙不限制在四个选项中,则选择的试剂还可以是什么?
提示:强碱均可以与铵盐在加热条件下反应放出氨气,故不选择熟石灰,还可以选择氢氧化钠或氢氧化钾溶液;常见的酸均可以与NH4HCO3反应放出CO2气体,故不选择稀盐酸,还可以选择醋酸、稀硫酸或稀硝酸等。
物质检验的基本要求
(1)反应要有明显的现象,如颜色的变化、沉淀的生成或溶解、气体的生成等。
(2)试剂易得,用量要少;方法易行,操作简单,反应条件容易做到。
(3)排除干扰物的影响:需要检验的物质中如果有干扰物存在,则需要选择试剂对干扰物进行排除;要注意加入不同的鉴别试剂进行检验时,要排除前次加入试剂可能引起的干扰。
探究:
1.向溶液中加入Ba(NO3)2溶液,产生白色沉淀,能否说明溶液中一定有SO42-?试分析检验SO42-时应如何操作?
提示:不能。检验SO42-时,加入Ba(NO3)2溶液,CO32-也能与Ba2+结合生成白色沉淀,故应先加入盐酸排除CO32-存在的可能。
2.向某溶液中加入硝酸银溶液,产生白色沉淀,则该溶液一定含有Cl-吗?若检验Cl-的存在,应如何操作?
提示:不能。CO32-也能与Ag+结合,生成白色沉淀,故应先加稀硝酸除去CO32-。
3.某溶液加入盐酸后,产生能够使澄清石灰水变浑浊的无色无味气体,能否说明该溶液中一定存在CO32- 如何补充实验证明溶液中一定有CO32-
提示:不能,还可能含有HCO3-取少量该溶液于洁净的试管中,加入氯化钙溶液,若产生白色沉淀,说明溶液中一定有CO32- 。
1.能用来区别BaCl2、NaCl、Na2CO3三种物质的试剂是( )
A.AgNO3 B.稀硫酸
C.稀盐酸 D.稀硝酸
【解析】选B。
2.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铁和硫酸铝溶液,这种试剂是( )
A.NaOH B.NH3·H2O
C.AgNO3 D.BaCl2
【解析】选A。向上述五种物质的溶液中分别加入NaOH并加热后其现象为:有气体放出;无变化;生成白色沉淀;生成红褐色沉淀;先生成白色沉淀后溶解。
3.(2011·上海高一检测)鉴定NaCl的最佳方法是( )
A.焰色反应呈黄色,加HNO3酸化的AgNO3有白色沉淀
B.焰色反应呈紫色,加盐酸酸化的AgNO3有白色沉淀
C.焰色反应呈黄色,加盐酸酸化的AgNO3有白色沉淀
D.焰色反应呈紫色,加HNO3酸化的AgNO3有白色沉淀
【解析】选A。钠的焰色反应呈黄色,氯离子的检验应用硝酸酸化的AgNO3,AgNO3溶液不能用盐酸酸化,用盐酸酸化会产生沉淀,无法用于Cl-的检验。
4.(2011·兰州高一检测)下列实验能达到预期目的的是( )
A.用铂丝蘸取待测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定含有K+
B.向待测液里加入过量的盐酸,若产生能使澄清石灰水变浑浊的无色无味气体,则表明待测液中肯定含有CO32-
C.向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42-
D.向待测液里加入过量的硝酸无现象,再加入硝酸银溶液,若产生白色沉淀,则表明待测液中肯定含有Cl-
【解析】选D。钠元素的焰色反应为黄色,故用铂丝蘸取待测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定含有Na+,A错;向待测液里加入过量的盐酸,若产生能使澄清石灰水变浑浊的无色无味的气体为CO2,则表明待测液中可能含有CO32-或HCO3-, B错;向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,该沉淀可能为AgCl或BaSO4,则表明待测液中可能含有
SO42-或Ag+,C错;向待测液里加入过量的硝酸无现象,再加入硝酸银溶液,若产生白色沉淀,则表明待测液中肯定含有Cl-,D正确。
5.溶液中可能有下列离子中的一种或几种:SO42-、HCO3-、
CO32-、NH4+。
(1)当溶液中有大量H+存在时,则不可能有_____存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能____有存在。
(3)当溶液中有_____和_____存在时,上述所有阴离子都不
可能存在。
【解析】当溶液中有大量H+存在时,H+与HCO3-、CO32-会生成气体CO2;当溶液中有大量Ba2+存在时,Ba2+可以分别和SO42-、CO32-生成沉淀物;OH-可与HCO3-、NH4+发生反应,如果溶液中既含有Ba2+又含有OH-时,上述所有阴离子都不可能存在。
答案:(1) HCO3- 、CO32-
(2)SO42-、CO32-
(3)Ba2+ OH-
一、选择题(本题包括6小题,每小题4分,共24分)
1.下列关于焰色反应的说法正确的是( )
A.某溶液的焰色反应为黄色,说明该溶液一定含有Na+,不含K+
B.做焰色反应的铂丝,每实验一种样品都需用水洗2~3次
C.没有铂丝,可用光洁无锈的铁丝来代替
D.焰色反应是某些金属离子的性质
【解析】选C。因为钾盐中常混有钠离子,在灼烧时,钠的黄色火焰会掩盖钾的紫色火焰。黄色火焰证明一定有Na+,但不能证明K+是否存在,故A项错;铂丝应用稀盐酸清洗,故B项错;金属单质或金属离子均有焰色反应,故D项错。
2.(2011·乌鲁木齐高一检测)符合下列实验现象,所加入的甲、乙、丙试剂分别是( )
A.BaCl2 、HCl、 CaCl2
B.Ca(OH)2、 HCl 、AgNO3
C.CaCl2 、H2SO4 、HCl
D.BaCl2、 H2SO4、 MgCl2
【解析】
3.不外加任何试剂,鉴别下列5种物质的先后顺序是( )
① NaOH溶液
② MgSO4溶液
③BaCl2溶液
④KNO3溶液
⑤CuCl2溶液
A.①②③④⑤
B.②③⑤④①
C.⑤①②③④
D.⑤③②①④
【解析】选C。不外加任何试剂,鉴别5种物质,首先可根据颜色推断出⑤CuCl2溶液,然后将CuCl2溶液与其他溶液混合,能产生蓝色沉淀的为①NaOH溶液,然后将NaOH溶液滴入其他溶液,能产生白色沉淀的为②MgSO4溶液,最后将MgSO4溶液滴入剩余溶液,能产生白色沉淀的为③BaCl2溶液,剩余为④KNO3溶液。
4.(2011·临沂高一检测)2010年11月12日第十六届亚洲运动会在广州隆重开幕,五彩缤纷的焰火给世人留下了深刻的印象,这些五彩缤纷的焰火与某些元素的焰色反应有关。下列说法错误的是( )
A.观察K2CO3的焰色应透过红色的玻璃
B.焰色反应实验中常用稀盐酸洗涤铂丝
C.可以用焰色反应来区别NaCl和KCl
D.Na与Na2SO4在灼烧时火焰颜色相同
【解析】选A。观察钾元素的焰色反应,必须透过蓝色的钴玻璃以过滤除去黄色光,否则不能看到紫色火焰。
【规律方法】焰色反应实验注意事项
(1)所用火焰本身颜色要浅,以防干扰实验现象,采用煤气灯较好。
(2)蘸取待测物的金属丝在火焰上灼烧时本身应无颜色,同时熔点要高,不易被氧化。用铂丝效果最好,也可用铁丝、镍丝、钨丝来代替。
(3)金属丝在使用前要用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至与原来火焰颜色相同。
(4)观察钾的焰色时,要透过蓝色的钴玻璃。因为钾中常混有钠的杂质,蓝色钴玻璃可以滤去黄光,以看清钾的紫色火焰。
5.(2011·福州高一检测)某溶液中含有较大量的Cl-、CO32- 、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液
②过滤
③滴加AgNO3溶液
④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
【解析】选B。根据三种离子的特性和逐一沉淀的思想,不能先滴加AgNO3,因AgNO3能沉淀三种离子,也不能先滴加Mg(NO3)2,因Mg(NO3)2能沉淀CO32- 、OH-,所以先滴加Ba(NO3)2沉淀CO32- ,过滤后用Mg(NO3)2沉淀OH-,再过滤,最后用AgNO3沉淀Cl-。
【举一反三】若将原溶液中的OH-换成SO42-,则实验操作顺序应怎样调整?
提示:Ba(NO3)2与CO32- 、SO42-均产生沉淀,故应先加入Mg(NO3)2,再加Ba(NO3)2,最后加AgNO3。操作顺序为①②④②③。
6.某同学想用实验证明硫酸铜溶液显蓝色与SO42-无关,进行下列实验无意义的是( )
A.观察硫酸钠溶液没有颜色
B.向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失
C.向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失
D.加水稀释硫酸铜溶液,溶液蓝色变浅
【解析】选D。观察硫酸钠溶液没有颜色,说明SO42-无色,A有意义;向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失,说明Cu2+为蓝色,SO42-无色,B有意义;向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失,说明Cu2+为蓝色,SO42-无色,C有意义;加水稀释硫酸铜溶液,溶液蓝色变浅,无法确定是Cu2+的颜色还是SO42-的颜色,D无意义。
二、非选择题(本题包括2小题,共26分)
7.(16分)某校化学课外活动小组对实验室两瓶失去标签的白色固体Na2SO4和NH4Cl进行鉴别,经讨论可行的实验方案有多种。请你设计四种实验方案加以鉴别。简要写出操作过程、现象和结论。
【解析】可用焰色反应检验Na+,用加碱加热的方法检验NH4+;也可检验阴离子,用Ba2+检验SO42-用Ag+检验Cl-,还可以根据NH4Cl受热分解来鉴别。
答案:
8.(10分)有标号为A、B、C、D的四种未知溶液,它们是
0.1 mol/L NaCl溶液、0.1 mol/L NaOH溶液、0.1 mol/L HCl 溶液、酚酞(0.1%),有人不用其他试剂就能把它们一一鉴别开来,其实验步骤如下:
(1)各取少量溶液两两混合,根据实验现象将四种物质分成两组。
(2)取一组混合液,不断滴入另一组中的一种未知液,据此可以鉴别出A和B。
(3)再取已鉴别出的A溶液2 mL,滴入3滴C溶液,再滴加D溶液4 mL,在这个过程中无明显现象。
综上所述,可以确定:A是_____,B是_____,C是_____,
D是_____。(写名称或化学式)
【解析】取各溶液分别两两混合,有明显现象的是NaOH溶液和酚酞,混合后变红色。由题(2)信息可知,该组为C和D,则另一组A、B应为盐酸、NaCl溶液,取红色的混合液,滴入A溶液中,若红色褪去,则A为盐酸;若红色不褪,则A为NaCl溶液。由题(3)信息分析可知A是盐酸;C是NaOH溶液,D为酚酞,则B为NaCl溶液。
答案:HCl NaCl NaOH 酚酞
1.如何检验某白色固体是纯碱还是淀粉?
提示:可取固体少量置于试管中。
方法Ⅰ:加入适量食醋,若有气泡产生,则为Na2CO3;无气泡产生则为淀粉。
方法Ⅱ:滴加碘水,若溶液变蓝,则为淀粉,否则为Na2CO3。
2.如何判断衣料是蚕丝制品还是人造纤维制品?
提示:蚕丝的主要成分是蛋白质,蛋白质燃烧时产生烧焦羽毛的气味,而人造纤维却没有此气味,因此可以抽一根线点燃进行验证。
例1 下列判断中正确的是
A.可用pH试纸检验一种溶液是否为食盐溶液
B.已知酒精不与硫酸铜反应,故可用无水硫酸铜检验酒精中是否含有少量水
C.通过灼热的CuO能使固体由黑变红的气体一定是H2
D.用蓝色石蕊试纸来鉴别盐酸和醋酸
【规范解答】选B。食盐溶液为中性溶液,用pH试纸检测时pH为7, 但用pH试纸检测时pH为7的中性溶液未必为食盐溶液,如酒精、纯水等,A错;已知酒精不与硫酸铜反应,故将无水硫酸铜白色粉末加入酒精中,若白色粉末变蓝,则酒精含水,反之则无水,B正确;CO通过灼热的CuO也能使其变红,C错;盐酸和醋酸滴在蓝色石蕊试纸上均能使其变红,无法鉴别。D错。
【互动探究】如何检验某气体是否为氢气?
提示:将气体收集在小试管中,用拇指堵住试管口,靠近酒精灯火焰,松开拇指,若听到噗的一声或尖锐的爆鸣声,则证明气体为氢气。
物质检验的步骤
(1)先对试样进行外观观察,注意特征性质,确定其状态、颜色、气味等。
(2)然后准备试样(如当试样是固体时,应先取少量试样配成溶液,注意观察试样是否溶解,在溶解过程中有无气体产生等,以初步判断试样可能会是哪类物质)。
(3)再结合物质的性质进一步进行特征反应,每次均取少量(1~2 mL)溶液进行检验,(绝对不能将检测试样直接加入到全部的待测溶液中)观察有无气体、沉淀产生、有无发生颜色的变化。最后判定物质的成分。
1.实验台上放着一种白色晶体,可能为氯化钠,如何检验?
提示:将白色晶体溶于水,取样,滴加AgNO3溶液和硝酸,若产生白色沉淀,证明有Cl-;再取样,用铂丝蘸取少量溶液,放在火焰上灼烧,观察火焰的颜色为黄色,证明存在Na+,则该晶体是氯化钠。
2.用焰色反应检验钠、钾,当不用蓝色钴玻璃时,焰色反应为黄色,能否说明有钠无钾?
提示:若钾盐中混有钠离子,在灼烧时产生的黄色火焰能够遮盖钾的紫色火焰,使用蓝色钴玻璃可以将黄光过滤掉,避免钠元素的干扰,所以不能说明有钠无钾。
3.请设计实验鉴别NaCl、KCl、Na2CO3、K2SO4四种物质。
提示:取四种待测液少许,分别做以下实验:
(1)做焰色反应,可分为两组
①焰色为黄色的:NaCl、Na2CO3。
②透过蓝色钴玻璃焰色为紫色的:KCl、K2SO4。
(2)向①组的两种溶液中分别加入稀盐酸,有无色气体生成的是Na2CO3,无明显现象的是NaCl;向②组的两种溶液中分别加入BaCl2溶液,产生白色沉淀的为K2SO4,无明显变化的为KCl。
【例2】如图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是
A.甲:熟石灰; 乙:稀盐酸
B.甲:水; 乙:氢氧化钠溶液
C.甲:氯化钠溶液; 乙:稀硫酸
D.甲:稀盐酸; 乙:氯化钠溶液
【规范解答】选A。在三种物质中加入试剂甲时,有氨味产生,说明产生了氨气,铵盐和碱反应生成氨气,所以试剂甲为碱;NH4HCO3和NH4Cl组成上的差别在于阴离子不同,
HCO3-能够和酸反应放出二氧化碳气体,而Cl-不能,所以试剂乙为酸;符合这两个条件的只有A选项。
【互动探究】若加入的试剂甲和乙不限制在四个选项中,则选择的试剂还可以是什么?
提示:强碱均可以与铵盐在加热条件下反应放出氨气,故不选择熟石灰,还可以选择氢氧化钠或氢氧化钾溶液;常见的酸均可以与NH4HCO3反应放出CO2气体,故不选择稀盐酸,还可以选择醋酸、稀硫酸或稀硝酸等。
物质检验的基本要求
(1)反应要有明显的现象,如颜色的变化、沉淀的生成或溶解、气体的生成等。
(2)试剂易得,用量要少;方法易行,操作简单,反应条件容易做到。
(3)排除干扰物的影响:需要检验的物质中如果有干扰物存在,则需要选择试剂对干扰物进行排除;要注意加入不同的鉴别试剂进行检验时,要排除前次加入试剂可能引起的干扰。
探究:
1.向溶液中加入Ba(NO3)2溶液,产生白色沉淀,能否说明溶液中一定有SO42-?试分析检验SO42-时应如何操作?
提示:不能。检验SO42-时,加入Ba(NO3)2溶液,CO32-也能与Ba2+结合生成白色沉淀,故应先加入盐酸排除CO32-存在的可能。
2.向某溶液中加入硝酸银溶液,产生白色沉淀,则该溶液一定含有Cl-吗?若检验Cl-的存在,应如何操作?
提示:不能。CO32-也能与Ag+结合,生成白色沉淀,故应先加稀硝酸除去CO32-。
3.某溶液加入盐酸后,产生能够使澄清石灰水变浑浊的无色无味气体,能否说明该溶液中一定存在CO32- 如何补充实验证明溶液中一定有CO32-
提示:不能,还可能含有HCO3-取少量该溶液于洁净的试管中,加入氯化钙溶液,若产生白色沉淀,说明溶液中一定有CO32- 。
1.能用来区别BaCl2、NaCl、Na2CO3三种物质的试剂是( )
A.AgNO3 B.稀硫酸
C.稀盐酸 D.稀硝酸
【解析】选B。
2.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铁和硫酸铝溶液,这种试剂是( )
A.NaOH B.NH3·H2O
C.AgNO3 D.BaCl2
【解析】选A。向上述五种物质的溶液中分别加入NaOH并加热后其现象为:有气体放出;无变化;生成白色沉淀;生成红褐色沉淀;先生成白色沉淀后溶解。
3.(2011·上海高一检测)鉴定NaCl的最佳方法是( )
A.焰色反应呈黄色,加HNO3酸化的AgNO3有白色沉淀
B.焰色反应呈紫色,加盐酸酸化的AgNO3有白色沉淀
C.焰色反应呈黄色,加盐酸酸化的AgNO3有白色沉淀
D.焰色反应呈紫色,加HNO3酸化的AgNO3有白色沉淀
【解析】选A。钠的焰色反应呈黄色,氯离子的检验应用硝酸酸化的AgNO3,AgNO3溶液不能用盐酸酸化,用盐酸酸化会产生沉淀,无法用于Cl-的检验。
4.(2011·兰州高一检测)下列实验能达到预期目的的是( )
A.用铂丝蘸取待测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定含有K+
B.向待测液里加入过量的盐酸,若产生能使澄清石灰水变浑浊的无色无味气体,则表明待测液中肯定含有CO32-
C.向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42-
D.向待测液里加入过量的硝酸无现象,再加入硝酸银溶液,若产生白色沉淀,则表明待测液中肯定含有Cl-
【解析】选D。钠元素的焰色反应为黄色,故用铂丝蘸取待测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定含有Na+,A错;向待测液里加入过量的盐酸,若产生能使澄清石灰水变浑浊的无色无味的气体为CO2,则表明待测液中可能含有CO32-或HCO3-, B错;向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,该沉淀可能为AgCl或BaSO4,则表明待测液中可能含有
SO42-或Ag+,C错;向待测液里加入过量的硝酸无现象,再加入硝酸银溶液,若产生白色沉淀,则表明待测液中肯定含有Cl-,D正确。
5.溶液中可能有下列离子中的一种或几种:SO42-、HCO3-、
CO32-、NH4+。
(1)当溶液中有大量H+存在时,则不可能有_____存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能____有存在。
(3)当溶液中有_____和_____存在时,上述所有阴离子都不
可能存在。
【解析】当溶液中有大量H+存在时,H+与HCO3-、CO32-会生成气体CO2;当溶液中有大量Ba2+存在时,Ba2+可以分别和SO42-、CO32-生成沉淀物;OH-可与HCO3-、NH4+发生反应,如果溶液中既含有Ba2+又含有OH-时,上述所有阴离子都不可能存在。
答案:(1) HCO3- 、CO32-
(2)SO42-、CO32-
(3)Ba2+ OH-
一、选择题(本题包括6小题,每小题4分,共24分)
1.下列关于焰色反应的说法正确的是( )
A.某溶液的焰色反应为黄色,说明该溶液一定含有Na+,不含K+
B.做焰色反应的铂丝,每实验一种样品都需用水洗2~3次
C.没有铂丝,可用光洁无锈的铁丝来代替
D.焰色反应是某些金属离子的性质
【解析】选C。因为钾盐中常混有钠离子,在灼烧时,钠的黄色火焰会掩盖钾的紫色火焰。黄色火焰证明一定有Na+,但不能证明K+是否存在,故A项错;铂丝应用稀盐酸清洗,故B项错;金属单质或金属离子均有焰色反应,故D项错。
2.(2011·乌鲁木齐高一检测)符合下列实验现象,所加入的甲、乙、丙试剂分别是( )
A.BaCl2 、HCl、 CaCl2
B.Ca(OH)2、 HCl 、AgNO3
C.CaCl2 、H2SO4 、HCl
D.BaCl2、 H2SO4、 MgCl2
【解析】
3.不外加任何试剂,鉴别下列5种物质的先后顺序是( )
① NaOH溶液
② MgSO4溶液
③BaCl2溶液
④KNO3溶液
⑤CuCl2溶液
A.①②③④⑤
B.②③⑤④①
C.⑤①②③④
D.⑤③②①④
【解析】选C。不外加任何试剂,鉴别5种物质,首先可根据颜色推断出⑤CuCl2溶液,然后将CuCl2溶液与其他溶液混合,能产生蓝色沉淀的为①NaOH溶液,然后将NaOH溶液滴入其他溶液,能产生白色沉淀的为②MgSO4溶液,最后将MgSO4溶液滴入剩余溶液,能产生白色沉淀的为③BaCl2溶液,剩余为④KNO3溶液。
4.(2011·临沂高一检测)2010年11月12日第十六届亚洲运动会在广州隆重开幕,五彩缤纷的焰火给世人留下了深刻的印象,这些五彩缤纷的焰火与某些元素的焰色反应有关。下列说法错误的是( )
A.观察K2CO3的焰色应透过红色的玻璃
B.焰色反应实验中常用稀盐酸洗涤铂丝
C.可以用焰色反应来区别NaCl和KCl
D.Na与Na2SO4在灼烧时火焰颜色相同
【解析】选A。观察钾元素的焰色反应,必须透过蓝色的钴玻璃以过滤除去黄色光,否则不能看到紫色火焰。
【规律方法】焰色反应实验注意事项
(1)所用火焰本身颜色要浅,以防干扰实验现象,采用煤气灯较好。
(2)蘸取待测物的金属丝在火焰上灼烧时本身应无颜色,同时熔点要高,不易被氧化。用铂丝效果最好,也可用铁丝、镍丝、钨丝来代替。
(3)金属丝在使用前要用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至与原来火焰颜色相同。
(4)观察钾的焰色时,要透过蓝色的钴玻璃。因为钾中常混有钠的杂质,蓝色钴玻璃可以滤去黄光,以看清钾的紫色火焰。
5.(2011·福州高一检测)某溶液中含有较大量的Cl-、CO32- 、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液
②过滤
③滴加AgNO3溶液
④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
【解析】选B。根据三种离子的特性和逐一沉淀的思想,不能先滴加AgNO3,因AgNO3能沉淀三种离子,也不能先滴加Mg(NO3)2,因Mg(NO3)2能沉淀CO32- 、OH-,所以先滴加Ba(NO3)2沉淀CO32- ,过滤后用Mg(NO3)2沉淀OH-,再过滤,最后用AgNO3沉淀Cl-。
【举一反三】若将原溶液中的OH-换成SO42-,则实验操作顺序应怎样调整?
提示:Ba(NO3)2与CO32- 、SO42-均产生沉淀,故应先加入Mg(NO3)2,再加Ba(NO3)2,最后加AgNO3。操作顺序为①②④②③。
6.某同学想用实验证明硫酸铜溶液显蓝色与SO42-无关,进行下列实验无意义的是( )
A.观察硫酸钠溶液没有颜色
B.向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失
C.向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失
D.加水稀释硫酸铜溶液,溶液蓝色变浅
【解析】选D。观察硫酸钠溶液没有颜色,说明SO42-无色,A有意义;向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失,说明Cu2+为蓝色,SO42-无色,B有意义;向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失,说明Cu2+为蓝色,SO42-无色,C有意义;加水稀释硫酸铜溶液,溶液蓝色变浅,无法确定是Cu2+的颜色还是SO42-的颜色,D无意义。
二、非选择题(本题包括2小题,共26分)
7.(16分)某校化学课外活动小组对实验室两瓶失去标签的白色固体Na2SO4和NH4Cl进行鉴别,经讨论可行的实验方案有多种。请你设计四种实验方案加以鉴别。简要写出操作过程、现象和结论。
【解析】可用焰色反应检验Na+,用加碱加热的方法检验NH4+;也可检验阴离子,用Ba2+检验SO42-用Ag+检验Cl-,还可以根据NH4Cl受热分解来鉴别。
答案:
8.(10分)有标号为A、B、C、D的四种未知溶液,它们是
0.1 mol/L NaCl溶液、0.1 mol/L NaOH溶液、0.1 mol/L HCl 溶液、酚酞(0.1%),有人不用其他试剂就能把它们一一鉴别开来,其实验步骤如下:
(1)各取少量溶液两两混合,根据实验现象将四种物质分成两组。
(2)取一组混合液,不断滴入另一组中的一种未知液,据此可以鉴别出A和B。
(3)再取已鉴别出的A溶液2 mL,滴入3滴C溶液,再滴加D溶液4 mL,在这个过程中无明显现象。
综上所述,可以确定:A是_____,B是_____,C是_____,
D是_____。(写名称或化学式)
【解析】取各溶液分别两两混合,有明显现象的是NaOH溶液和酚酞,混合后变红色。由题(2)信息可知,该组为C和D,则另一组A、B应为盐酸、NaCl溶液,取红色的混合液,滴入A溶液中,若红色褪去,则A为盐酸;若红色不褪,则A为NaCl溶液。由题(3)信息分析可知A是盐酸;C是NaOH溶液,D为酚酞,则B为NaCl溶液。
答案:HCl NaCl NaOH 酚酞
