11-12版高中化学课时讲练通配套课件:2.1.3溴、碘的提取(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:2.1.3溴、碘的提取(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览







文档简介
(共65张PPT)
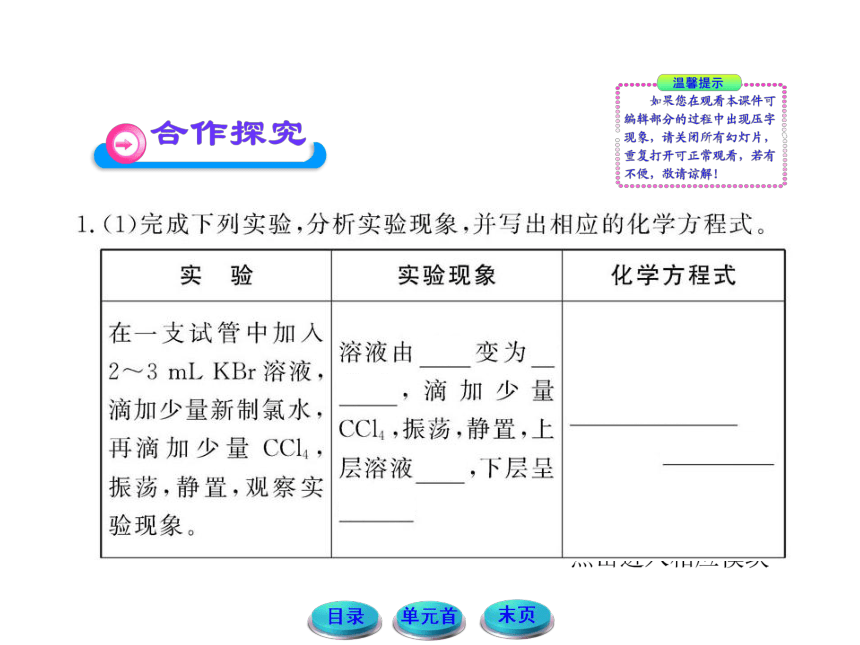
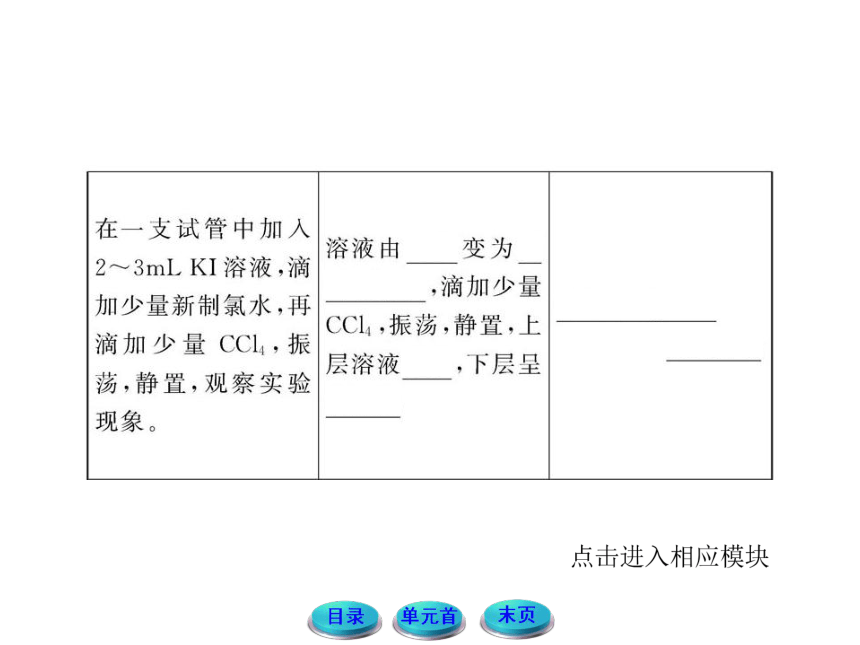
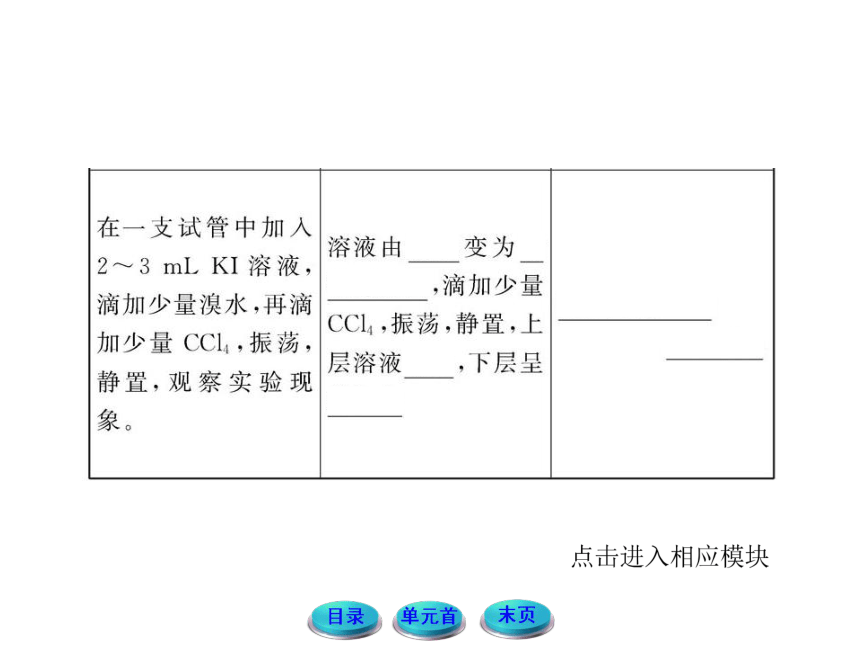
(2)在Cl2、Br2、I2的氧化性方面你可以得出什么结论?
提示:由上面实验现象和分析可知,氯、溴、碘的氧化性强弱顺序为Cl2> Br2 > I2。
2.实验室有NaCl、NaBr、KBr和KI四种无色溶液,现要将它们区别开来,你能设计出几种方案?
提示:鉴别原理:(1)用焰色反应区别钠盐和钾盐。
(2)用AgNO3溶液和稀硝酸区别Cl-、Br-和I-或通入Cl2,加入CCl4,根据溶液颜色变化区分Cl-、Br-和I-。
根据以上原理,可先将四种溶液分组,然后再逐一区分。
例1 甲、乙、丙三溶液各含有一种X-(X-为Cl-、Br-或I-),向甲中加入淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有
A.Br-、I-、Cl- B.Br-、Cl-、I-
C.I-、Br-、Cl- D.Cl-、I-、Br-
【规范解答】选A。甲溶液中加入淀粉溶液和氯水,溶液变橙色,说明甲溶液含Br-,加入氯水后,置换出Br2,再加丙溶液,颜色无明显变化,说明丙溶液中不含I-,故丙中含Cl-,则乙中含有I-。
【互动探究】若原题改为“再加丙溶液,溶液颜色变为蓝色”,则答案有何变化?
提示:溶液变为蓝色,则证明有碘单质生成,故丙溶液中含有I-,则甲中含有Br-,乙中含有Cl-,答案选B。
1. 溴和碘的特殊性
溴是惟一的常温下呈液态的非金属单质,具有很强的挥发性和腐蚀性;碘易升华,可使淀粉溶液呈蓝色。
2.溴、碘的化学性质
溴、碘的化学性质与氯气相似,能与活泼金属、非金属、水和碱等发生反应,还具有较强的氧化性。
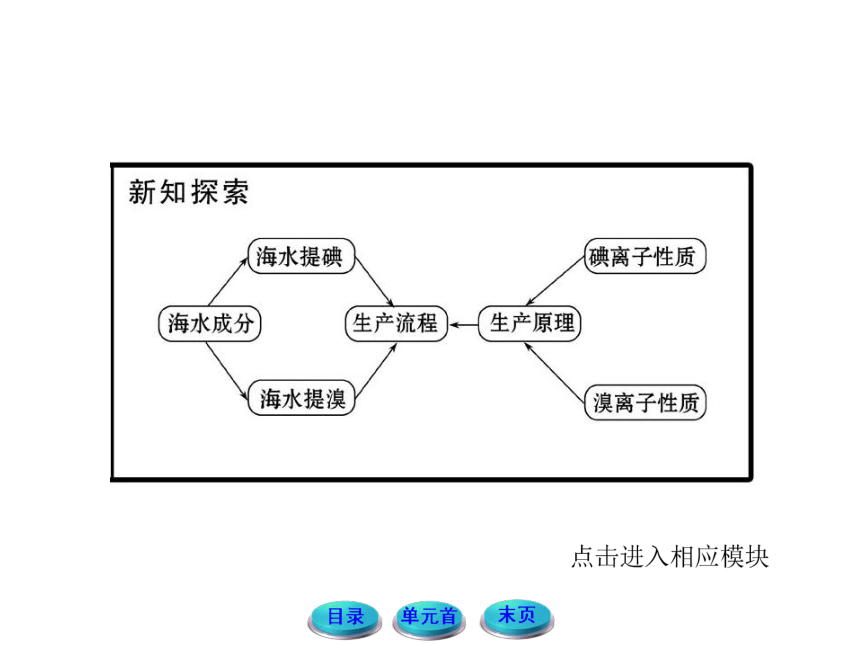
1.从海水中提取溴、碘的原理是怎样的?
提示:溴元素在海水中以溴离子(Br-)的形式存在,碘元素在海带中以碘离子(I-)的形式存在,从海水中提取溴、碘的原理是利用氧化还原反应,用氧化剂如氯气将Br-、 I-氧化成为溴单质和碘单质,再用物理方法提取出来。发生的反应为:2KBr+Cl2====2KCl+Br2,2KI+Cl2====2KCl+I2。
2.在海水提溴的过程中,为什么往溴水中鼓入热空气或水蒸气可获得粗溴?在实验室中怎样从溴水中提取溴?
提示:溴具有很强的挥发性,往溴水中鼓入热空气或水蒸气,溴即可挥发出来。在实验室中可以采用萃取的方法获得溴。
3. 从海水中提取溴、碘的操作有何不同?为什么会有这种差别?
提示:海水中溴元素(Br-)的含量丰富,从海水中提取溴是直接利用提取粗盐后的母液通入氯气进行处理,而海水中含碘总量虽大,但浓度较低,这给提取带来了麻烦,某些海藻具有富集碘的能力,如干海带,因此,利用浸泡液浸泡海带可制取碘。
4.课堂上老师演示萃取操作,用CCl4萃取溴水中的溴改为用CCl4萃取碘水中的碘有何优点?能否用酒精萃取碘水中的碘?
提示:溴易挥发且有毒,而碘不易挥发,故用CCl4萃取碘水中的碘更具有绿色化学的特点;酒精与水互溶,故不能用酒精萃取碘水中的碘。
例2 可通过以下步骤从干海带中提取碘:
回答下列问题:
(1)操作②的名称是 ______。
(2)向含I-(假设全部以NaI形式存在)的溶液中滴加适量氯水时反应的化学方程式为:___________________。
(3)进行操作①的过程中,会用到的仪器有(选填下列仪器的编号) __________。
(4)请从上图中选取必要的仪器,画出操作③的装置图(支持仪器和热源不必画出)。
【规范解答】(1)从干海带中提取碘,先要将干海带灼烧灰化,需要用酒精灯、坩埚、三脚架、泥三角和坩埚钳等仪器;然后将海带灰溶于水过滤,使I-进入溶液中,需要烧杯、漏斗、玻璃棒等仪器;再向滤液中通入Cl2将I-氧化成I2。从碘水中提取I2有两种方法:一是加有机溶剂萃取分液,得到I2的有机溶剂溶液,然后利用有机溶剂的挥发性(沸点低)通过蒸馏的方法将有机溶剂除去;二是将碘水加热蒸发结晶,得到碘和固体杂质的混合物,再利用碘易升华的性质,在密闭容器中用加热法先将碘变成碘蒸气,和固体杂质分离,再用冷却法将碘蒸气冷凝成碘晶体。
答案:(1)萃取、分液
(2)Cl2+2NaI====2NaCl+I2
(3)A、F、G (4)装置如图
【互动探究】以用CCl4从碘水中萃取碘为例,说明应该如何进行萃取操作?
提示:(1)用量筒量取碘水,倒入分液漏斗,然后再注入4mL四氯化碳,盖好玻璃塞,发现溶液分层,四氯化碳在下层。
(2)用右手压住分液漏斗口部,左手握住活塞部分。把分液漏斗倒转过来振荡。使两种液体充分接触。
(3)将分液漏斗放在铁架台上静置,液体分层。上层为水层,无色;下层为碘的四氯化碳溶液,显紫红色。
(4)待液体分层后,将分液漏斗上的玻璃塞打开(或使塞上的凹槽对准漏斗上的小孔),再将分液漏斗下面的活塞拧开,使下层液体沿烧杯壁流下。上层液体从分液漏斗上口倒出。
1.从海水中提取溴和碘
用Cl2将Br-、I-氧化成Br2、I2,用物理方法提取出来,经精制得到纯Br2、I2。
2.萃取剂的选择原则
(1)萃取剂与原溶剂互不相溶且密度有差异。
(2)溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
(3)溶质不与萃取剂发生任何反应。
1.从海水中获得的在常温下是液体的单质是( )
A.Mg B.K C.Br2 D.I2
【解析】选C。溴是惟一的在常温下呈液态的非金属单质;汞是惟一的在常温下呈液态的金属单质。
2.下列物质对应的用途不正确的是( )
A.用漂白精作消毒剂
B.用氯化银作胶片感光材料
C.碘化银用于人工降雨
D.干冰用于人工降雨
【解析】选B。常用溴化银作胶片感光材料。
3.为了保存液溴,可以在试剂瓶中加一些( )
A.汽油 B.水
C.四氯化碳 D.氢氧化钠溶液
【解析】选B。溴容易挥发,保存液溴时可以在其液面上加一层液体液封。不可加入有机溶剂,因为Br2在有机溶剂中溶解度大,对Br2的挥发起不到封盖作用,况且CCl4密度大,沉在液体底部。更不能加入NaOH溶液,因为Br2易与NaOH反应:2NaOH+Br2====NaBr+NaBrO+H2O,所以应加入少量水。
4.在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图现象,正确的结论是( )
A.①加CCl4 ②加苯 ③加酒精
B.①加酒精 ②加CCl4 ③加苯
C.①加苯 ②加CCl4 ③加酒精
D.①加苯 ②加酒精 ③加CCl4
【解析】选C。ρ(苯)<ρ(水),ρ(CCl4)>ρ(水),酒精和水混溶;Br2在水中的溶解度比在有机溶剂中的溶解度小得多;苯和CCl4萃取了溴水中的溴并和水分层,而酒精不能从溴水中萃取Br2。
5.某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。
(1)能选用四氯化碳在碘水中萃取碘的原因是_____。
(2)其实验操作可分为如下几步:
A.把盛有溶液的漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时的旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.放开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔;
H.静置、分层。
就此实验,完成下列填空:
①正确操作步骤的顺序是:_____(用上述各操作的编号字母填写)。
②下列物质,不能作为从溴水中萃取溴的萃取剂的是_____。
A.苯 B.酒精 C.四氯化碳
【解析】(1)萃取剂的选择原则有四条:一是溶质在萃取剂中的溶解度比在水中要大得多;二是萃取剂与水互不溶解能分成两层;三是萃取剂与水的密度差别较大;四是萃取剂与溶质不会发生反应。(2)萃取(分液操作)正确操作顺序应把检验分液漏斗活塞和上口玻璃塞是否有漏液现象放在最前面;然后再倒入溶液和萃取剂,经过振荡,使两种液体充分接触,溶质从一种溶剂进入另一种溶剂中,再经过静置、分层,将两种液体分开,从分液漏斗下端管口放出下层液体,从上口倒出上层液体。酒精和水互相溶解,不分层,不能作为萃取剂。
答案:(1)碘在四氯化碳中的溶解度比在水中大得多,而且四氯化碳与水不互溶
(2)①CBDAGH(或HG)EF ②B
一、选择题(本题包括6小题,每小题4分,共24分)
1.海带中含碘元素,从海带中提取碘有如下步骤:
①通入足量Cl2
②将海带焙烧成灰后加水搅拌
③加CCl4振荡
④用分液漏斗分液
⑤过滤
合理的操作顺序是( )
A.①②③④⑤
B.②⑤①③④
C.①③⑤②④
D.②①③⑤④
【解析】选B。海带中含碘元素(I-),从海带中提取碘,即是将I-利用氧化剂氧化为碘单质,并将碘单质提取出来的过程。
2.(2011·郑州高一检测)向NaI和NaBr的混合溶液中通入过量的Cl2 ,充分反应后将溶液蒸干,灼烧残余物,最后剩下的物质是( )
A.NaCl、I2、Cl2
B.NaCl、I2
C.NaCl、NaBr
D.NaCl
【解析】选D。向NaI和NaBr的混合溶液中通入过量的Cl2 ,发生反应Cl2+2NaI====I2+2NaCl和Cl2+2NaBr====
Br2+2NaCl,充分反应后将溶液蒸干,灼烧,溴和碘分别挥发和升华,剩余NaCl。
3.(2011·承德高一检测)下列实验现象描述正确的是( )
A.碘水中加入少量苯振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的雾
C.电解氯化钠饱和溶液,将阴极气体产物通入碘化钾淀粉溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳溶液振荡,静置后上层颜色变浅,下层颜色变为橙红色
【解析】选D。A项中苯的密度比水小,应浮在水的上层,溶解碘之后颜色变为紫红色,A错;B项铜丝在氯气中燃烧产生的氯化铜是烟而不是雾,B错;C项阳极产生Cl2,通入碘化钾淀粉溶液中,溶液变蓝,阴极产生氢气,通入碘化钾淀粉溶液中,无明显变化,C错。D项发生反应Cl2+2NaBr
====2NaCl+Br2,加入少量四氯化碳溶液振荡,静置后上层为水层,颜色变浅,下层为四氯化碳层,颜色变为橙红色,D正确。
4.某同学向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):a.KI溶液;b.淀粉溶液;c.NaOH溶液;d.稀硫酸溶液;e.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。依据溶液颜色的变化,加入以上药品的顺序是( )
A.a→b→e→c→d
B.a→e→b→c→d
C.b→e→a→d→c
D.a→d→b→e→c
【解析】选B。溶液由无色变成棕黄色,只有发生下列反应2KI+Cl2====2KCl+I2才能有该现象发生,所以先加KI溶液,再加氯水,生成的I2使淀粉变成蓝色,I2和NaOH反应生成NaI和NaIO,最后加入硫酸,溶液又变成蓝色,说明又有I2生成,其反应的离子方程式为:I-+IO-+2H+====I2+H2O。
【规律方法】物质的鉴别、鉴定与推断
(1)鉴别:利用不同物质的性质差异,通过实验,将它们区别开来。
(2)鉴定:根据物质的特性,通过实验,确定该物质的成分。如鉴定NH4Cl,既要检验出NH4+,又要检验出Cl-。
(3)推断:根据已知实验及现象,分析判断被检验的是什么物质,并指出可能存在什么物质,不可能存在什么物质。
物质检验的一般要求:①反应要有良好的选择性、反应速率要快,并且能够完全反应。②反应要有明显的外部特征,如溶液颜色的改变、沉淀的生成或溶解、气体的产生等。③要排除干扰物质的影响,用Ba2+检验SO42-的存在,要排除CO32-、SO32-、PO43-等离子的干扰,用Ag+检验Cl-、Br-、I-的存在,要排除CO32-、PO43-等离子的干扰。④反应要在适宜的酸碱度、浓度和温度下进行。
5.a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中任意一种气体,若a、d两瓶气体混合见光爆炸,a、b两瓶气体混合瓶壁出现棕红色小液滴,则c瓶装的气体是( )
A.HBr B.HCl
C.Cl2 D.H2
【解析】选B。a、d两瓶气体混合见光爆炸,必为Cl2和H2,而a、b两瓶气体混合瓶壁出现棕红色小液滴(液溴),必为Cl2和HBr(发生了Cl2+2HBr====2HCl+Br2的反应)。则c中必盛有HCl,同时推出a中为Cl2,b中为HBr,d中为H2。
6.溴(Br)与氯同属“卤族”元素,其单质在性质上具有很大的相似性,但Cl2比Br2的活泼性更强,下面是根据氯的性质对溴的性质的预测,其中错误的是( )
A.溴单质溶于水时,部分与H2O反应生成HBrO和HBr
B.溴单质只具有氧化性
C.溴原子最外层有7个电子,在化学反应中容易得1个电子,表现氧化性
D.溴蒸气与氢气在加热条件下反应生成HBr
【解析】选B。采用类比法,Br2的性质和Cl2相似,A、C选项正确;溴元素最高价为+7价,最低价为-1价,所以Br2既有氧化性又有还原性,B选项错误;Br2不如Cl2活泼,所以和H2反应条件要求较高,D选项正确。
【举一反三】
若已知HBrO的酸性比碳酸的弱,则向碳酸钠溶液中加入溴水,会产生什么现象?
提示:Br2溶于水时,部分与H2O反应生成HBrO和HBr,HBr是强酸,能够和碳酸钠溶液反应放出CO2气体。
二、非选择题(本题包括2小题,共26分)
7.(14分)(2011·杭州高一检测)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_____(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿
D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤中,某学生选择用苯来提取碘是因为________
_____________、_________________。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:_____________________________。
【解析】(1)灼烧海带时,除需要三脚架外,还需要用到的实验仪器是坩埚、泥三角、酒精灯;(2)将海带灰的悬浊液中的固体除去所用的操作为过滤,从含碘苯溶液中分离出单质碘和回收苯,应使用蒸馏的方法分离;(3)萃取剂的选择应不溶于水;而且溶质在萃取剂中的溶解度比在水中大得多,不与溶质反应;(4)利用碘遇淀粉变蓝的性质检验。
答案:(1)B、D、E (2)过滤 蒸馏
(3)苯不溶于水 碘在苯中的溶解度比在水中大得多,且碘与苯不反应
(4)取萃取后下层液体加淀粉溶液,若显蓝色则含单质碘,若无明显现象则不含单质碘(需说明下层液体,否则错误)
8.(12分)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
(1)图中仪器B的名称是_____。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为_______________________________。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:____________________________。
(4)C中液体产物颜色为_____,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________________________。
(5)D装置的作用是____________________________。
【解析】图中从工业溴中提纯溴的方法是蒸馏法,先将烧瓶在热水浴中加热到59 ℃,此时液体溴变成溴蒸气,经过冷凝管冷却得到液溴。因为溴有强腐蚀性,所以装置中仪器连接均不能用橡胶塞和橡胶管;因为溴易挥发而且有毒性,所以D装置是尾气吸收装置,目的是除去少量有毒性的溴蒸气,防止污染空气。向残留有少量Cl2的液溴中加入NaBr溶液,发生如下反应:Cl2+2NaBr====2NaCl+Br2,然后加入苯或四氯化碳等有机溶剂萃取、分液即可得到溴的有机溶剂溶液,然后用图中的装置再进行一次蒸馏将溴和有机溶剂分离,这样得到的溴纯度更高。
答案:(1)冷凝管
(2)Br2有强腐蚀性,会腐蚀橡胶
(3)控制温度计b的温度,并收集59 ℃时的蒸馏物
(4)深红棕色 萃取、分液、蒸馏(或直接蒸馏)
(5)除去少量有毒性的溴蒸气,防止污染空气
(2)在Cl2、Br2、I2的氧化性方面你可以得出什么结论?
提示:由上面实验现象和分析可知,氯、溴、碘的氧化性强弱顺序为Cl2> Br2 > I2。
2.实验室有NaCl、NaBr、KBr和KI四种无色溶液,现要将它们区别开来,你能设计出几种方案?
提示:鉴别原理:(1)用焰色反应区别钠盐和钾盐。
(2)用AgNO3溶液和稀硝酸区别Cl-、Br-和I-或通入Cl2,加入CCl4,根据溶液颜色变化区分Cl-、Br-和I-。
根据以上原理,可先将四种溶液分组,然后再逐一区分。
例1 甲、乙、丙三溶液各含有一种X-(X-为Cl-、Br-或I-),向甲中加入淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有
A.Br-、I-、Cl- B.Br-、Cl-、I-
C.I-、Br-、Cl- D.Cl-、I-、Br-
【规范解答】选A。甲溶液中加入淀粉溶液和氯水,溶液变橙色,说明甲溶液含Br-,加入氯水后,置换出Br2,再加丙溶液,颜色无明显变化,说明丙溶液中不含I-,故丙中含Cl-,则乙中含有I-。
【互动探究】若原题改为“再加丙溶液,溶液颜色变为蓝色”,则答案有何变化?
提示:溶液变为蓝色,则证明有碘单质生成,故丙溶液中含有I-,则甲中含有Br-,乙中含有Cl-,答案选B。
1. 溴和碘的特殊性
溴是惟一的常温下呈液态的非金属单质,具有很强的挥发性和腐蚀性;碘易升华,可使淀粉溶液呈蓝色。
2.溴、碘的化学性质
溴、碘的化学性质与氯气相似,能与活泼金属、非金属、水和碱等发生反应,还具有较强的氧化性。
1.从海水中提取溴、碘的原理是怎样的?
提示:溴元素在海水中以溴离子(Br-)的形式存在,碘元素在海带中以碘离子(I-)的形式存在,从海水中提取溴、碘的原理是利用氧化还原反应,用氧化剂如氯气将Br-、 I-氧化成为溴单质和碘单质,再用物理方法提取出来。发生的反应为:2KBr+Cl2====2KCl+Br2,2KI+Cl2====2KCl+I2。
2.在海水提溴的过程中,为什么往溴水中鼓入热空气或水蒸气可获得粗溴?在实验室中怎样从溴水中提取溴?
提示:溴具有很强的挥发性,往溴水中鼓入热空气或水蒸气,溴即可挥发出来。在实验室中可以采用萃取的方法获得溴。
3. 从海水中提取溴、碘的操作有何不同?为什么会有这种差别?
提示:海水中溴元素(Br-)的含量丰富,从海水中提取溴是直接利用提取粗盐后的母液通入氯气进行处理,而海水中含碘总量虽大,但浓度较低,这给提取带来了麻烦,某些海藻具有富集碘的能力,如干海带,因此,利用浸泡液浸泡海带可制取碘。
4.课堂上老师演示萃取操作,用CCl4萃取溴水中的溴改为用CCl4萃取碘水中的碘有何优点?能否用酒精萃取碘水中的碘?
提示:溴易挥发且有毒,而碘不易挥发,故用CCl4萃取碘水中的碘更具有绿色化学的特点;酒精与水互溶,故不能用酒精萃取碘水中的碘。
例2 可通过以下步骤从干海带中提取碘:
回答下列问题:
(1)操作②的名称是 ______。
(2)向含I-(假设全部以NaI形式存在)的溶液中滴加适量氯水时反应的化学方程式为:___________________。
(3)进行操作①的过程中,会用到的仪器有(选填下列仪器的编号) __________。
(4)请从上图中选取必要的仪器,画出操作③的装置图(支持仪器和热源不必画出)。
【规范解答】(1)从干海带中提取碘,先要将干海带灼烧灰化,需要用酒精灯、坩埚、三脚架、泥三角和坩埚钳等仪器;然后将海带灰溶于水过滤,使I-进入溶液中,需要烧杯、漏斗、玻璃棒等仪器;再向滤液中通入Cl2将I-氧化成I2。从碘水中提取I2有两种方法:一是加有机溶剂萃取分液,得到I2的有机溶剂溶液,然后利用有机溶剂的挥发性(沸点低)通过蒸馏的方法将有机溶剂除去;二是将碘水加热蒸发结晶,得到碘和固体杂质的混合物,再利用碘易升华的性质,在密闭容器中用加热法先将碘变成碘蒸气,和固体杂质分离,再用冷却法将碘蒸气冷凝成碘晶体。
答案:(1)萃取、分液
(2)Cl2+2NaI====2NaCl+I2
(3)A、F、G (4)装置如图
【互动探究】以用CCl4从碘水中萃取碘为例,说明应该如何进行萃取操作?
提示:(1)用量筒量取碘水,倒入分液漏斗,然后再注入4mL四氯化碳,盖好玻璃塞,发现溶液分层,四氯化碳在下层。
(2)用右手压住分液漏斗口部,左手握住活塞部分。把分液漏斗倒转过来振荡。使两种液体充分接触。
(3)将分液漏斗放在铁架台上静置,液体分层。上层为水层,无色;下层为碘的四氯化碳溶液,显紫红色。
(4)待液体分层后,将分液漏斗上的玻璃塞打开(或使塞上的凹槽对准漏斗上的小孔),再将分液漏斗下面的活塞拧开,使下层液体沿烧杯壁流下。上层液体从分液漏斗上口倒出。
1.从海水中提取溴和碘
用Cl2将Br-、I-氧化成Br2、I2,用物理方法提取出来,经精制得到纯Br2、I2。
2.萃取剂的选择原则
(1)萃取剂与原溶剂互不相溶且密度有差异。
(2)溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
(3)溶质不与萃取剂发生任何反应。
1.从海水中获得的在常温下是液体的单质是( )
A.Mg B.K C.Br2 D.I2
【解析】选C。溴是惟一的在常温下呈液态的非金属单质;汞是惟一的在常温下呈液态的金属单质。
2.下列物质对应的用途不正确的是( )
A.用漂白精作消毒剂
B.用氯化银作胶片感光材料
C.碘化银用于人工降雨
D.干冰用于人工降雨
【解析】选B。常用溴化银作胶片感光材料。
3.为了保存液溴,可以在试剂瓶中加一些( )
A.汽油 B.水
C.四氯化碳 D.氢氧化钠溶液
【解析】选B。溴容易挥发,保存液溴时可以在其液面上加一层液体液封。不可加入有机溶剂,因为Br2在有机溶剂中溶解度大,对Br2的挥发起不到封盖作用,况且CCl4密度大,沉在液体底部。更不能加入NaOH溶液,因为Br2易与NaOH反应:2NaOH+Br2====NaBr+NaBrO+H2O,所以应加入少量水。
4.在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图现象,正确的结论是( )
A.①加CCl4 ②加苯 ③加酒精
B.①加酒精 ②加CCl4 ③加苯
C.①加苯 ②加CCl4 ③加酒精
D.①加苯 ②加酒精 ③加CCl4
【解析】选C。ρ(苯)<ρ(水),ρ(CCl4)>ρ(水),酒精和水混溶;Br2在水中的溶解度比在有机溶剂中的溶解度小得多;苯和CCl4萃取了溴水中的溴并和水分层,而酒精不能从溴水中萃取Br2。
5.某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。
(1)能选用四氯化碳在碘水中萃取碘的原因是_____。
(2)其实验操作可分为如下几步:
A.把盛有溶液的漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时的旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.放开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔;
H.静置、分层。
就此实验,完成下列填空:
①正确操作步骤的顺序是:_____(用上述各操作的编号字母填写)。
②下列物质,不能作为从溴水中萃取溴的萃取剂的是_____。
A.苯 B.酒精 C.四氯化碳
【解析】(1)萃取剂的选择原则有四条:一是溶质在萃取剂中的溶解度比在水中要大得多;二是萃取剂与水互不溶解能分成两层;三是萃取剂与水的密度差别较大;四是萃取剂与溶质不会发生反应。(2)萃取(分液操作)正确操作顺序应把检验分液漏斗活塞和上口玻璃塞是否有漏液现象放在最前面;然后再倒入溶液和萃取剂,经过振荡,使两种液体充分接触,溶质从一种溶剂进入另一种溶剂中,再经过静置、分层,将两种液体分开,从分液漏斗下端管口放出下层液体,从上口倒出上层液体。酒精和水互相溶解,不分层,不能作为萃取剂。
答案:(1)碘在四氯化碳中的溶解度比在水中大得多,而且四氯化碳与水不互溶
(2)①CBDAGH(或HG)EF ②B
一、选择题(本题包括6小题,每小题4分,共24分)
1.海带中含碘元素,从海带中提取碘有如下步骤:
①通入足量Cl2
②将海带焙烧成灰后加水搅拌
③加CCl4振荡
④用分液漏斗分液
⑤过滤
合理的操作顺序是( )
A.①②③④⑤
B.②⑤①③④
C.①③⑤②④
D.②①③⑤④
【解析】选B。海带中含碘元素(I-),从海带中提取碘,即是将I-利用氧化剂氧化为碘单质,并将碘单质提取出来的过程。
2.(2011·郑州高一检测)向NaI和NaBr的混合溶液中通入过量的Cl2 ,充分反应后将溶液蒸干,灼烧残余物,最后剩下的物质是( )
A.NaCl、I2、Cl2
B.NaCl、I2
C.NaCl、NaBr
D.NaCl
【解析】选D。向NaI和NaBr的混合溶液中通入过量的Cl2 ,发生反应Cl2+2NaI====I2+2NaCl和Cl2+2NaBr====
Br2+2NaCl,充分反应后将溶液蒸干,灼烧,溴和碘分别挥发和升华,剩余NaCl。
3.(2011·承德高一检测)下列实验现象描述正确的是( )
A.碘水中加入少量苯振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的雾
C.电解氯化钠饱和溶液,将阴极气体产物通入碘化钾淀粉溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳溶液振荡,静置后上层颜色变浅,下层颜色变为橙红色
【解析】选D。A项中苯的密度比水小,应浮在水的上层,溶解碘之后颜色变为紫红色,A错;B项铜丝在氯气中燃烧产生的氯化铜是烟而不是雾,B错;C项阳极产生Cl2,通入碘化钾淀粉溶液中,溶液变蓝,阴极产生氢气,通入碘化钾淀粉溶液中,无明显变化,C错。D项发生反应Cl2+2NaBr
====2NaCl+Br2,加入少量四氯化碳溶液振荡,静置后上层为水层,颜色变浅,下层为四氯化碳层,颜色变为橙红色,D正确。
4.某同学向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):a.KI溶液;b.淀粉溶液;c.NaOH溶液;d.稀硫酸溶液;e.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。依据溶液颜色的变化,加入以上药品的顺序是( )
A.a→b→e→c→d
B.a→e→b→c→d
C.b→e→a→d→c
D.a→d→b→e→c
【解析】选B。溶液由无色变成棕黄色,只有发生下列反应2KI+Cl2====2KCl+I2才能有该现象发生,所以先加KI溶液,再加氯水,生成的I2使淀粉变成蓝色,I2和NaOH反应生成NaI和NaIO,最后加入硫酸,溶液又变成蓝色,说明又有I2生成,其反应的离子方程式为:I-+IO-+2H+====I2+H2O。
【规律方法】物质的鉴别、鉴定与推断
(1)鉴别:利用不同物质的性质差异,通过实验,将它们区别开来。
(2)鉴定:根据物质的特性,通过实验,确定该物质的成分。如鉴定NH4Cl,既要检验出NH4+,又要检验出Cl-。
(3)推断:根据已知实验及现象,分析判断被检验的是什么物质,并指出可能存在什么物质,不可能存在什么物质。
物质检验的一般要求:①反应要有良好的选择性、反应速率要快,并且能够完全反应。②反应要有明显的外部特征,如溶液颜色的改变、沉淀的生成或溶解、气体的产生等。③要排除干扰物质的影响,用Ba2+检验SO42-的存在,要排除CO32-、SO32-、PO43-等离子的干扰,用Ag+检验Cl-、Br-、I-的存在,要排除CO32-、PO43-等离子的干扰。④反应要在适宜的酸碱度、浓度和温度下进行。
5.a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中任意一种气体,若a、d两瓶气体混合见光爆炸,a、b两瓶气体混合瓶壁出现棕红色小液滴,则c瓶装的气体是( )
A.HBr B.HCl
C.Cl2 D.H2
【解析】选B。a、d两瓶气体混合见光爆炸,必为Cl2和H2,而a、b两瓶气体混合瓶壁出现棕红色小液滴(液溴),必为Cl2和HBr(发生了Cl2+2HBr====2HCl+Br2的反应)。则c中必盛有HCl,同时推出a中为Cl2,b中为HBr,d中为H2。
6.溴(Br)与氯同属“卤族”元素,其单质在性质上具有很大的相似性,但Cl2比Br2的活泼性更强,下面是根据氯的性质对溴的性质的预测,其中错误的是( )
A.溴单质溶于水时,部分与H2O反应生成HBrO和HBr
B.溴单质只具有氧化性
C.溴原子最外层有7个电子,在化学反应中容易得1个电子,表现氧化性
D.溴蒸气与氢气在加热条件下反应生成HBr
【解析】选B。采用类比法,Br2的性质和Cl2相似,A、C选项正确;溴元素最高价为+7价,最低价为-1价,所以Br2既有氧化性又有还原性,B选项错误;Br2不如Cl2活泼,所以和H2反应条件要求较高,D选项正确。
【举一反三】
若已知HBrO的酸性比碳酸的弱,则向碳酸钠溶液中加入溴水,会产生什么现象?
提示:Br2溶于水时,部分与H2O反应生成HBrO和HBr,HBr是强酸,能够和碳酸钠溶液反应放出CO2气体。
二、非选择题(本题包括2小题,共26分)
7.(14分)(2011·杭州高一检测)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_____(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿
D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤中,某学生选择用苯来提取碘是因为________
_____________、_________________。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:_____________________________。
【解析】(1)灼烧海带时,除需要三脚架外,还需要用到的实验仪器是坩埚、泥三角、酒精灯;(2)将海带灰的悬浊液中的固体除去所用的操作为过滤,从含碘苯溶液中分离出单质碘和回收苯,应使用蒸馏的方法分离;(3)萃取剂的选择应不溶于水;而且溶质在萃取剂中的溶解度比在水中大得多,不与溶质反应;(4)利用碘遇淀粉变蓝的性质检验。
答案:(1)B、D、E (2)过滤 蒸馏
(3)苯不溶于水 碘在苯中的溶解度比在水中大得多,且碘与苯不反应
(4)取萃取后下层液体加淀粉溶液,若显蓝色则含单质碘,若无明显现象则不含单质碘(需说明下层液体,否则错误)
8.(12分)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
(1)图中仪器B的名称是_____。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为_______________________________。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:____________________________。
(4)C中液体产物颜色为_____,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________________________。
(5)D装置的作用是____________________________。
【解析】图中从工业溴中提纯溴的方法是蒸馏法,先将烧瓶在热水浴中加热到59 ℃,此时液体溴变成溴蒸气,经过冷凝管冷却得到液溴。因为溴有强腐蚀性,所以装置中仪器连接均不能用橡胶塞和橡胶管;因为溴易挥发而且有毒性,所以D装置是尾气吸收装置,目的是除去少量有毒性的溴蒸气,防止污染空气。向残留有少量Cl2的液溴中加入NaBr溶液,发生如下反应:Cl2+2NaBr====2NaCl+Br2,然后加入苯或四氯化碳等有机溶剂萃取、分液即可得到溴的有机溶剂溶液,然后用图中的装置再进行一次蒸馏将溴和有机溶剂分离,这样得到的溴纯度更高。
答案:(1)冷凝管
(2)Br2有强腐蚀性,会腐蚀橡胶
(3)控制温度计b的温度,并收集59 ℃时的蒸馏物
(4)深红棕色 萃取、分液、蒸馏(或直接蒸馏)
(5)除去少量有毒性的溴蒸气,防止污染空气
