11-12版高中化学课时讲练通配套课件:2.2.4镁的提取及应用(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:2.2.4镁的提取及应用(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览









文档简介
(共58张PPT)
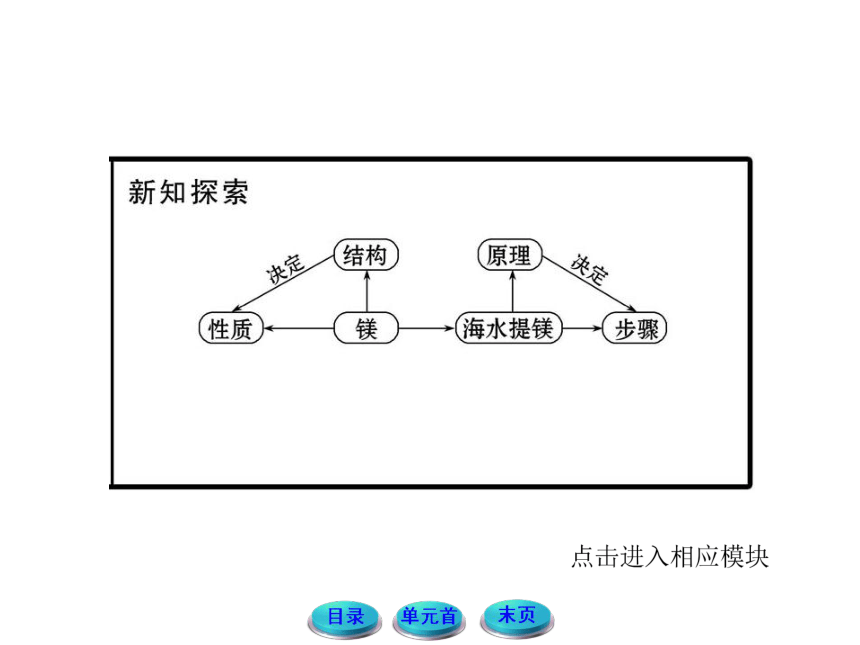
1.海水中含有大量的NaCl、MgCl2、CaCl2、KCl等氯化物,能否从海水中直接得到镁?
提示:不能。海水中的Mg2+ 的浓度很小,必须让海水中的镁离子富集。
2.如何实现Mg2+的富集和分离?试探究应如何选择加入的试剂。
提示:先海水晒盐使海水浓缩,再加入一种试剂使Mg2+沉淀,如加碱。NaOH价格较高,而CaO价格较低,从当地资源利用来讲,煅烧贝壳比煅烧石灰石要经济,这体现了就地取材、综合利用、节约成本的原则。
3.由MgCl2到Mg究竟用还原法好还是电解法好?
提示:由于镁本身比较活泼,用还原法比较困难,工业上常使用电解熔融的氯化镁得到镁。
4.试探究镁在纯氧中燃烧和在空气中燃烧的区别。
(1)二者所发生的变化一样吗?
提示:镁在纯氧中燃烧只发生反应:
2Mg+O2 2MgO
镁在空气中燃烧发生反应:
①2Mg+O2 2MgO
②3Mg+N2 Mg3N2
③2Mg+CO2 2MgO+C
点燃
====
点燃
====
点燃
====
点燃
====
(2)等量的镁在二者中燃烧所得固体物质的质量是否相同?
提示:根据气体在空气中的含量,主要发生反应(1)(2),
6Mg~6MgO~3O2~Δm=96
6Mg ~2Mg3N2~2N2~Δm=56
故等量的镁在纯氧中燃烧比在空气中燃烧所得固体质量大。
5.某同学通过发散思维总结出镁
及其化合物的转化关系图,请写
出对应序号的转化方程式,能写
成离子方程式的用离子方程式表
示。
提示:①2Mg+O2 2MgO或
2Mg+CO2 2MgO+C
②MgCO3 MgO+CO2↑
③Mg(OH)2 MgO+H2O
④MgO+2H+====Mg2++H2O
⑤Mg+2H+====Mg2++H2↑
⑥MgCl2(熔融) Mg+Cl2↑
⑦Mg2++2OH-====Mg(OH)2↓
⑧Mg(OH)2+2H+ ====Mg2++2H2O
通电
====
点燃
====
点燃
====
△
====
△
====
例题 海水是镁的主要来源之一。从海水中提取镁可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物。
(1)以上提取镁的全过程中,没有涉及的化学反应类型是_____(填序号)。
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
(2)下列关于提取镁的说法中,不正确的是_____(填序号)。
A.此法的优点之一是原料来自大海
B.进行①②③步骤的目的是富集MgCl2
C.工业上可用电解熔融氧化镁的方法制取镁
D.电解冶炼镁要消耗大量电能
【规范解答】(1)根据镁的提取过程:
(2)由于MgO的熔点高,工业上不能使用电解熔融MgO的方法冶炼Mg。
答案:(1)C (2)C
【互动探究】工业制造镁粉是将镁蒸气在某冷却剂中冷却,可以选择的冷却剂有哪些?
提示:将镁蒸气冷却,应选择不与之反应的物质,如惰性气体和氢气等,常用作保护气的氮气、二氧化碳不能用作冷却镁蒸气的保护气。
1.从海水中提取镁的过程中,要注意用Mg(OH)2制得无水MgCl2的方法:先加盐酸反应,再加热浓缩得MgCl2·6H2O晶体,然后再将MgCl2·6H2O晶体在HCl气氛中加热脱水即可得无水MgCl2。
2.镁的化学性质
镁能够和氧气、氮气、氯气、硫等非金属单质化合。还能够从比它不活泼的金属的盐溶液中置换出不活泼金属。
1.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘
B.钠、镁、铝
C.烧碱、氢气
D.食盐、淡水
【解析】选D。从海水中提取Cl2、Br2、I2、Na、Mg、Al、NaOH、H2等物质都需要经过化学变化,多数需用电解的方法。
2.工业上从海水中提取镁,正确的方法是( )
【解析】选D。镁是由电解熔融的MgCl2得到的,还要知道实际生产中从海水中提取MgCl2的途径及原料的合理使用(用石灰乳而不用NaOH)。
3.下列有关镁的叙述,不正确的是( )
A.空气中点燃镁条,有耀眼白光,故用作制照明弹材料
B.镁条着火,可使用泡沫灭火器灭火
C.MgO虽然密度小,但熔点很高
D.镁能与热水反应,反应程度不如钠剧烈
【解析】选B。金属镁能与CO2和H2O反应,故镁条着火,不可使用泡沫灭火器灭火。
4.下列物质相互反应能得到氯化镁的是( )
①镁和氯气 ②镁和盐酸 ③氧化镁和氯化铜 ④氢氧化镁和碳酸钠 ⑤氯化钡和硫酸镁 ⑥碳酸镁和氯化钙
A.全部
B.①②⑤⑥
C.①②④⑤
D.①②
【解析】选B。MgO和CuCl2不反应,Mg(OH)2与Na2CO3也不会有氯化镁产生;碳酸镁微溶,而碳酸钙难溶,所以MgCO3与CaCl2反应生成CaCO3和MgCl2。
5.(2011·三明高一检测)将质量为64 g的某种镁铁合金投入到足量的稀盐酸中生成气体在标准状况下的体积为44.8 L,求:该合金中含有镁和铁的质量分别为多少?
【解析】设合金中铁和镁的物质的量分别是a、b。
Mg+2HCl====MgCl2+H2↑
1 mol 1 mol
b b
Fe+2HCl====FeCl2+H2↑
1 mol 1 mol
a a
n(H2)=44.8 L/22.4 L·mol-1=2 mol
①a+b=2 mol
②56 g·mol-1·a+24 g·mol-1·b=64 g
联立①②方程可解得a=0.5 mol,b=1.5 mol
m(Fe)=28 g ,m(Mg)=36 g。
答案:镁、铁的质量分别为36 g、28 g。
一、选择题(本题包括6小题,每小题4分,共24分)
1.用于飞机制造业的重要材料有( )
A.镁铝合金
B.铜锌合金
C.铝铁合金
D.不锈钢
【解析】选A。飞机制造业的材料要求质轻坚固,镁铝合金符合要求。
2.(2011·桐乡高一检测)燃着的镁条在下列气体中不能继续燃烧的是( )
A.CO2 B.N2
C.Cl2 D.He
【解析】选D。由反应可知:3Mg+N2 Mg3N2,2Mg+CO2
2MgO+C,Mg+Cl2 MgCl2,稀有气体性质稳定,与Mg不发生化学反应。
点燃
====
点燃
====
点燃
====
3.已知锂和镁的单质及其化合物在很多性质上具有相似性,由此可以推断下列关于锂及其化合物的叙述中,正确的是( )
A.LiOH加热时,不会分解
B.Li2CO3加热时,不会分解
C.Li在氧气中燃烧生成Li2O2
D.Li与稀硫酸反应生成Li2SO4
【解析】选D。类比镁及其化合物的性质:Mg(OH)2和MgCO3受热都容易分解,LiOH与Li2CO3受热也容易分解,A和B选项错误。Mg在氧气中燃烧生成普通的氧化物MgO,所以Li在氧气中燃烧生成Li2O,C选项错误;Mg与稀硫酸反应生成MgSO4和氢气,Li与稀硫酸反应生成Li2SO4和氢气,D选项正确。
【举一反三】金属锂能否在氮气中燃烧?如能,请写出其反应的化学方程式。
提示:能。因为Mg与N2反应生成Mg3N2,所以Li与N2反应可以生成Li3N,其反应的化学方程式为:6Li+N2 2Li3N。
点燃
====
4.(双选)(2011·苏州高一检测)为了除去粗盐中的CaCl2、MgSO4及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量的NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量的BaCl2溶液。正确的操作顺序是
( )
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.⑤②④①③
【解析】选C、D。除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新杂质,后面加入的试剂要能除去前面加入的试剂引入的杂质离子。本题加入试剂或操作的顺序可以是:②⑤④①③或⑤②④①③。
【规律方法】物质的分离和提纯的常用化学方法
(1)加热法
混合物中混有热稳定性差的物质时,可直接加热,使热稳定性差的物质分离出去。例如:食盐中混有氯化铵,纯碱中混有小苏打等均可直接加热除去杂质。
(2)沉淀法
在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该方法一定要注意不能引入新的杂质。若使用多种试剂将溶液中不同微粒逐步沉淀时,应注意后加试剂能将前面所加试剂的过量部分除去,最后加的试剂不引入新的杂质。例如,加适量BaCl2溶液可除去NaCl中混有的Na2SO4。
(3)转化法
不能通过一次反应达到分离的目的时,要经过转化为其他物质才能分离,然后要将转化物质恢复为原物质。注意转化过程中尽量减少被分离物质的损失,而且转化物质要易恢复为原物质。
(4)酸碱法
被提纯物质不与酸碱反应,而杂质可与酸碱发生反应,用酸碱作除杂试剂。例如:用盐酸除去SiO2中的石灰石,用氢氧化钠溶液除去铁粉中的铝粉等。
(5)氧化还原法
①对混合物中混有的还原性杂质,可加入适当的氧化剂使其被氧化为被提纯物质。
②对混合物中混有的氧化性杂质,可加入适当的还原剂将其还原为被提纯物质。
5.一定量的Mg和MgO的混合物投入100 mL 2 mol/L的稀HCl中完全溶解后,再向反应后的溶液中加入4 mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是( )
A.100 mL B.50 mL
C.25 mL D.无法判断
【解析】选B。Mg元素全部沉淀后,溶液中只有NaCl,其中Na+全部来自于NaOH溶液,Cl-全部来自于稀盐酸,且有n(NaOH)=n(HCl)=0.100 L×2 mol/L=0.2 mol=
c(NaOH)·V(NaOH),所以V(NaOH)= =0.05 L=
50 mL。
6.下列有关镁及其化合物的离子方程式书写正确的是( )
A.MgCO3与盐酸反应:CO32-+2H+====CO2↑+2H2O
B.Mg(OH)2和H2SO4反应:
Mg2++2OH-+2H++SO42-====MgSO4↓+2H2O
C.工业上以海水为原料制取Mg(OH)2:
Ca(OH)2+Mg2+====Mg(OH)2+Ca2+
D.镁与醋酸反应:Mg+2H+====Mg2++H2↑
【解析】选C。MgCO3和Mg(OH)2都是微溶性物质,醋酸为弱电解质,在写离子方程式时不能拆成离子形式,故A、B、D选项错误;工业上以海水为原料制取Mg(OH)2时,在海水中加入石灰乳,所以Ca(OH)2不能拆成离子的形式。
二、非选择题(本题包括2小题,共26分)
7.(12分)如图所示,
甲、乙、丙是三种常见单质,X、Y、Z是三种常见化合物。它们之间有如下转化关系:
若甲是金属单质,丙是一种常见的黑色固体,试推断:
(1)X、Y、Z中含有丙元素的是_____(填写物质的化学式);
(2)写出X、Y、Z的分子式(或化学式)
X_____________________,
Y_____________________,
Z_____________________;
(3)Z是__________气的主要成分;
(4)X与甲反应的化学方程式是________________。
【解析】根据图示X+甲 Y+丙是置换反应,甲为金属
单质,丙是常见的黑色固体单质,可以推知:X为CO2,Y为
MgO,Z为CO,甲为Mg,乙为O2,丙为C(碳)。
答案:(1)CO、CO2 (2)CO2 MgO CO (3)水煤
(4)2Mg+CO2 2MgO+C
点燃
====
8.(14分)目前世界上60%的镁是从海水中提取的。学生就这个课题展开了讨论。已知海水提镁的主要步骤如下:
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?
有三个学生提出自己的观点。
学生1的观点:直接往海水中加入沉淀剂。
学生2的观点:高温加热蒸发海水后,再加入沉淀剂。
学生3的观点:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否恰当(填“是”或“否”),并简述理由。
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是_____(填化学式)。
(2)加入的足量试剂②是_____(填化学式)。
(3)试从节约能源,提高金属镁的纯度分析,以下适宜冶炼镁的方法是_____。
【解析】(一)海水中镁的总量虽然多,但是镁离子浓度却很小,若直接往海水中加入沉淀剂,则所需要的沉淀剂用量大,不经济。高温加热蒸发海水,固然可以提高镁离子浓度,降低使用沉淀剂的成本,却消耗了大量能源,大大增加了成本。海水晒盐时,利用了太阳能,在得到食盐的同时,增大了镁离子浓度,剩余苦卤水得到了合理利用,降低了成本。
(二)(1)为了使镁离子沉淀下来,应该加入碱,若加入石灰乳,则还会得到CaSO4沉淀,所以在该题中应该选择加入NaOH溶液。(2)将氢氧化镁沉淀变成MgCl2溶液,可以加入盐酸。(3)氢氧化镁灼烧分解需要吸收热量,电解熔融的MgO需要2 852 ℃的高温,这些因素都需要消耗大量的能量,用C或活泼金属还原MgO或MgCl2时,可能会带入C或金属还原剂等杂质,会降低镁的纯度,所以最好用电解熔融的MgCl2制取金属镁。
答案:(一)
(二)(1)NaOH(合理即可) (2)HCl (3)C
1.海水中含有大量的NaCl、MgCl2、CaCl2、KCl等氯化物,能否从海水中直接得到镁?
提示:不能。海水中的Mg2+ 的浓度很小,必须让海水中的镁离子富集。
2.如何实现Mg2+的富集和分离?试探究应如何选择加入的试剂。
提示:先海水晒盐使海水浓缩,再加入一种试剂使Mg2+沉淀,如加碱。NaOH价格较高,而CaO价格较低,从当地资源利用来讲,煅烧贝壳比煅烧石灰石要经济,这体现了就地取材、综合利用、节约成本的原则。
3.由MgCl2到Mg究竟用还原法好还是电解法好?
提示:由于镁本身比较活泼,用还原法比较困难,工业上常使用电解熔融的氯化镁得到镁。
4.试探究镁在纯氧中燃烧和在空气中燃烧的区别。
(1)二者所发生的变化一样吗?
提示:镁在纯氧中燃烧只发生反应:
2Mg+O2 2MgO
镁在空气中燃烧发生反应:
①2Mg+O2 2MgO
②3Mg+N2 Mg3N2
③2Mg+CO2 2MgO+C
点燃
====
点燃
====
点燃
====
点燃
====
(2)等量的镁在二者中燃烧所得固体物质的质量是否相同?
提示:根据气体在空气中的含量,主要发生反应(1)(2),
6Mg~6MgO~3O2~Δm=96
6Mg ~2Mg3N2~2N2~Δm=56
故等量的镁在纯氧中燃烧比在空气中燃烧所得固体质量大。
5.某同学通过发散思维总结出镁
及其化合物的转化关系图,请写
出对应序号的转化方程式,能写
成离子方程式的用离子方程式表
示。
提示:①2Mg+O2 2MgO或
2Mg+CO2 2MgO+C
②MgCO3 MgO+CO2↑
③Mg(OH)2 MgO+H2O
④MgO+2H+====Mg2++H2O
⑤Mg+2H+====Mg2++H2↑
⑥MgCl2(熔融) Mg+Cl2↑
⑦Mg2++2OH-====Mg(OH)2↓
⑧Mg(OH)2+2H+ ====Mg2++2H2O
通电
====
点燃
====
点燃
====
△
====
△
====
例题 海水是镁的主要来源之一。从海水中提取镁可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物。
(1)以上提取镁的全过程中,没有涉及的化学反应类型是_____(填序号)。
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
(2)下列关于提取镁的说法中,不正确的是_____(填序号)。
A.此法的优点之一是原料来自大海
B.进行①②③步骤的目的是富集MgCl2
C.工业上可用电解熔融氧化镁的方法制取镁
D.电解冶炼镁要消耗大量电能
【规范解答】(1)根据镁的提取过程:
(2)由于MgO的熔点高,工业上不能使用电解熔融MgO的方法冶炼Mg。
答案:(1)C (2)C
【互动探究】工业制造镁粉是将镁蒸气在某冷却剂中冷却,可以选择的冷却剂有哪些?
提示:将镁蒸气冷却,应选择不与之反应的物质,如惰性气体和氢气等,常用作保护气的氮气、二氧化碳不能用作冷却镁蒸气的保护气。
1.从海水中提取镁的过程中,要注意用Mg(OH)2制得无水MgCl2的方法:先加盐酸反应,再加热浓缩得MgCl2·6H2O晶体,然后再将MgCl2·6H2O晶体在HCl气氛中加热脱水即可得无水MgCl2。
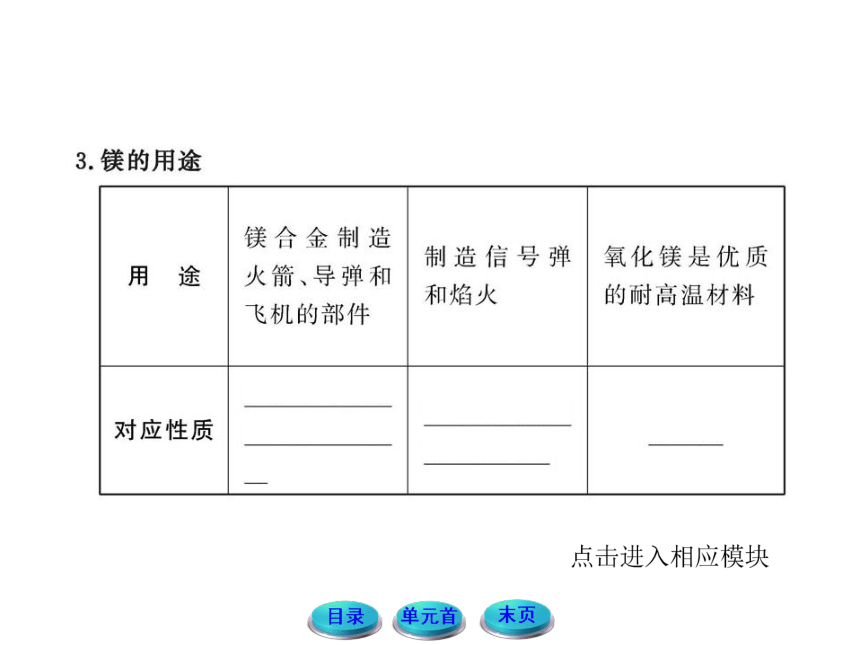
2.镁的化学性质
镁能够和氧气、氮气、氯气、硫等非金属单质化合。还能够从比它不活泼的金属的盐溶液中置换出不活泼金属。
1.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘
B.钠、镁、铝
C.烧碱、氢气
D.食盐、淡水
【解析】选D。从海水中提取Cl2、Br2、I2、Na、Mg、Al、NaOH、H2等物质都需要经过化学变化,多数需用电解的方法。
2.工业上从海水中提取镁,正确的方法是( )
【解析】选D。镁是由电解熔融的MgCl2得到的,还要知道实际生产中从海水中提取MgCl2的途径及原料的合理使用(用石灰乳而不用NaOH)。
3.下列有关镁的叙述,不正确的是( )
A.空气中点燃镁条,有耀眼白光,故用作制照明弹材料
B.镁条着火,可使用泡沫灭火器灭火
C.MgO虽然密度小,但熔点很高
D.镁能与热水反应,反应程度不如钠剧烈
【解析】选B。金属镁能与CO2和H2O反应,故镁条着火,不可使用泡沫灭火器灭火。
4.下列物质相互反应能得到氯化镁的是( )
①镁和氯气 ②镁和盐酸 ③氧化镁和氯化铜 ④氢氧化镁和碳酸钠 ⑤氯化钡和硫酸镁 ⑥碳酸镁和氯化钙
A.全部
B.①②⑤⑥
C.①②④⑤
D.①②
【解析】选B。MgO和CuCl2不反应,Mg(OH)2与Na2CO3也不会有氯化镁产生;碳酸镁微溶,而碳酸钙难溶,所以MgCO3与CaCl2反应生成CaCO3和MgCl2。
5.(2011·三明高一检测)将质量为64 g的某种镁铁合金投入到足量的稀盐酸中生成气体在标准状况下的体积为44.8 L,求:该合金中含有镁和铁的质量分别为多少?
【解析】设合金中铁和镁的物质的量分别是a、b。
Mg+2HCl====MgCl2+H2↑
1 mol 1 mol
b b
Fe+2HCl====FeCl2+H2↑
1 mol 1 mol
a a
n(H2)=44.8 L/22.4 L·mol-1=2 mol
①a+b=2 mol
②56 g·mol-1·a+24 g·mol-1·b=64 g
联立①②方程可解得a=0.5 mol,b=1.5 mol
m(Fe)=28 g ,m(Mg)=36 g。
答案:镁、铁的质量分别为36 g、28 g。
一、选择题(本题包括6小题,每小题4分,共24分)
1.用于飞机制造业的重要材料有( )
A.镁铝合金
B.铜锌合金
C.铝铁合金
D.不锈钢
【解析】选A。飞机制造业的材料要求质轻坚固,镁铝合金符合要求。
2.(2011·桐乡高一检测)燃着的镁条在下列气体中不能继续燃烧的是( )
A.CO2 B.N2
C.Cl2 D.He
【解析】选D。由反应可知:3Mg+N2 Mg3N2,2Mg+CO2
2MgO+C,Mg+Cl2 MgCl2,稀有气体性质稳定,与Mg不发生化学反应。
点燃
====
点燃
====
点燃
====
3.已知锂和镁的单质及其化合物在很多性质上具有相似性,由此可以推断下列关于锂及其化合物的叙述中,正确的是( )
A.LiOH加热时,不会分解
B.Li2CO3加热时,不会分解
C.Li在氧气中燃烧生成Li2O2
D.Li与稀硫酸反应生成Li2SO4
【解析】选D。类比镁及其化合物的性质:Mg(OH)2和MgCO3受热都容易分解,LiOH与Li2CO3受热也容易分解,A和B选项错误。Mg在氧气中燃烧生成普通的氧化物MgO,所以Li在氧气中燃烧生成Li2O,C选项错误;Mg与稀硫酸反应生成MgSO4和氢气,Li与稀硫酸反应生成Li2SO4和氢气,D选项正确。
【举一反三】金属锂能否在氮气中燃烧?如能,请写出其反应的化学方程式。
提示:能。因为Mg与N2反应生成Mg3N2,所以Li与N2反应可以生成Li3N,其反应的化学方程式为:6Li+N2 2Li3N。
点燃
====
4.(双选)(2011·苏州高一检测)为了除去粗盐中的CaCl2、MgSO4及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量的NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量的BaCl2溶液。正确的操作顺序是
( )
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.⑤②④①③
【解析】选C、D。除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新杂质,后面加入的试剂要能除去前面加入的试剂引入的杂质离子。本题加入试剂或操作的顺序可以是:②⑤④①③或⑤②④①③。
【规律方法】物质的分离和提纯的常用化学方法
(1)加热法
混合物中混有热稳定性差的物质时,可直接加热,使热稳定性差的物质分离出去。例如:食盐中混有氯化铵,纯碱中混有小苏打等均可直接加热除去杂质。
(2)沉淀法
在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该方法一定要注意不能引入新的杂质。若使用多种试剂将溶液中不同微粒逐步沉淀时,应注意后加试剂能将前面所加试剂的过量部分除去,最后加的试剂不引入新的杂质。例如,加适量BaCl2溶液可除去NaCl中混有的Na2SO4。
(3)转化法
不能通过一次反应达到分离的目的时,要经过转化为其他物质才能分离,然后要将转化物质恢复为原物质。注意转化过程中尽量减少被分离物质的损失,而且转化物质要易恢复为原物质。
(4)酸碱法
被提纯物质不与酸碱反应,而杂质可与酸碱发生反应,用酸碱作除杂试剂。例如:用盐酸除去SiO2中的石灰石,用氢氧化钠溶液除去铁粉中的铝粉等。
(5)氧化还原法
①对混合物中混有的还原性杂质,可加入适当的氧化剂使其被氧化为被提纯物质。
②对混合物中混有的氧化性杂质,可加入适当的还原剂将其还原为被提纯物质。
5.一定量的Mg和MgO的混合物投入100 mL 2 mol/L的稀HCl中完全溶解后,再向反应后的溶液中加入4 mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是( )
A.100 mL B.50 mL
C.25 mL D.无法判断
【解析】选B。Mg元素全部沉淀后,溶液中只有NaCl,其中Na+全部来自于NaOH溶液,Cl-全部来自于稀盐酸,且有n(NaOH)=n(HCl)=0.100 L×2 mol/L=0.2 mol=
c(NaOH)·V(NaOH),所以V(NaOH)= =0.05 L=
50 mL。
6.下列有关镁及其化合物的离子方程式书写正确的是( )
A.MgCO3与盐酸反应:CO32-+2H+====CO2↑+2H2O
B.Mg(OH)2和H2SO4反应:
Mg2++2OH-+2H++SO42-====MgSO4↓+2H2O
C.工业上以海水为原料制取Mg(OH)2:
Ca(OH)2+Mg2+====Mg(OH)2+Ca2+
D.镁与醋酸反应:Mg+2H+====Mg2++H2↑
【解析】选C。MgCO3和Mg(OH)2都是微溶性物质,醋酸为弱电解质,在写离子方程式时不能拆成离子形式,故A、B、D选项错误;工业上以海水为原料制取Mg(OH)2时,在海水中加入石灰乳,所以Ca(OH)2不能拆成离子的形式。
二、非选择题(本题包括2小题,共26分)
7.(12分)如图所示,
甲、乙、丙是三种常见单质,X、Y、Z是三种常见化合物。它们之间有如下转化关系:
若甲是金属单质,丙是一种常见的黑色固体,试推断:
(1)X、Y、Z中含有丙元素的是_____(填写物质的化学式);
(2)写出X、Y、Z的分子式(或化学式)
X_____________________,
Y_____________________,
Z_____________________;
(3)Z是__________气的主要成分;
(4)X与甲反应的化学方程式是________________。
【解析】根据图示X+甲 Y+丙是置换反应,甲为金属
单质,丙是常见的黑色固体单质,可以推知:X为CO2,Y为
MgO,Z为CO,甲为Mg,乙为O2,丙为C(碳)。
答案:(1)CO、CO2 (2)CO2 MgO CO (3)水煤
(4)2Mg+CO2 2MgO+C
点燃
====
8.(14分)目前世界上60%的镁是从海水中提取的。学生就这个课题展开了讨论。已知海水提镁的主要步骤如下:
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?
有三个学生提出自己的观点。
学生1的观点:直接往海水中加入沉淀剂。
学生2的观点:高温加热蒸发海水后,再加入沉淀剂。
学生3的观点:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否恰当(填“是”或“否”),并简述理由。
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是_____(填化学式)。
(2)加入的足量试剂②是_____(填化学式)。
(3)试从节约能源,提高金属镁的纯度分析,以下适宜冶炼镁的方法是_____。
【解析】(一)海水中镁的总量虽然多,但是镁离子浓度却很小,若直接往海水中加入沉淀剂,则所需要的沉淀剂用量大,不经济。高温加热蒸发海水,固然可以提高镁离子浓度,降低使用沉淀剂的成本,却消耗了大量能源,大大增加了成本。海水晒盐时,利用了太阳能,在得到食盐的同时,增大了镁离子浓度,剩余苦卤水得到了合理利用,降低了成本。
(二)(1)为了使镁离子沉淀下来,应该加入碱,若加入石灰乳,则还会得到CaSO4沉淀,所以在该题中应该选择加入NaOH溶液。(2)将氢氧化镁沉淀变成MgCl2溶液,可以加入盐酸。(3)氢氧化镁灼烧分解需要吸收热量,电解熔融的MgO需要2 852 ℃的高温,这些因素都需要消耗大量的能量,用C或活泼金属还原MgO或MgCl2时,可能会带入C或金属还原剂等杂质,会降低镁的纯度,所以最好用电解熔融的MgCl2制取金属镁。
答案:(一)
(二)(1)NaOH(合理即可) (2)HCl (3)C
