11-12版高中化学课时讲练通配套课件:3.1.2铝及铝合金(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:3.1.2铝及铝合金(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览








文档简介
(共52张PPT)
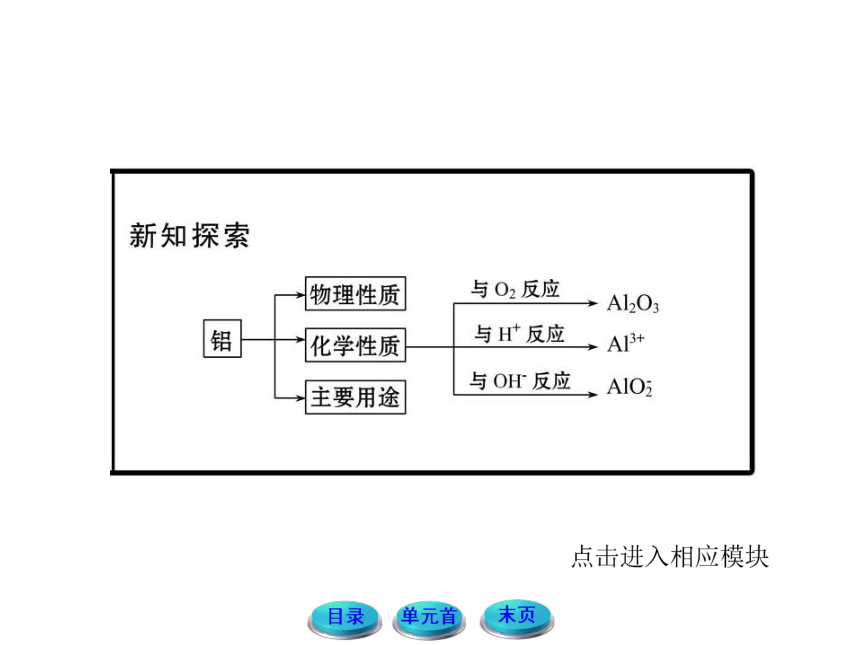
1.铝在常温下就能和空气中的氧气反应,为什么铝制品在生活中却随处可见?
提示:因为常温下铝和空气中的氧气反应生成一层致密的氧化膜,牢固地附着在铝的表面,阻止内部的铝与空气接触,因此具有良好的抗腐蚀性,故铝制品在生活中随处可见。
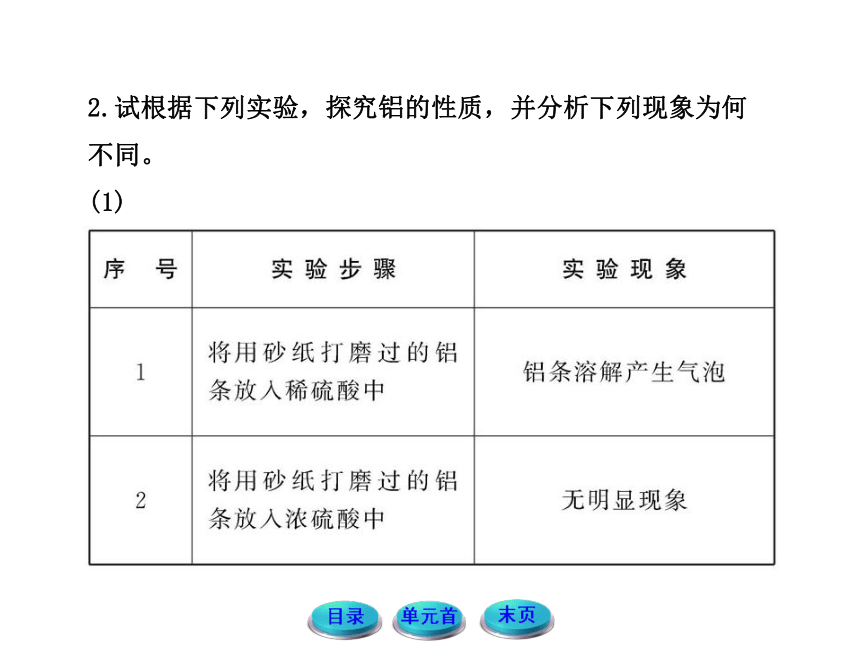
2.试根据下列实验,探究铝的性质,并分析下列现象为何不同。
(1)
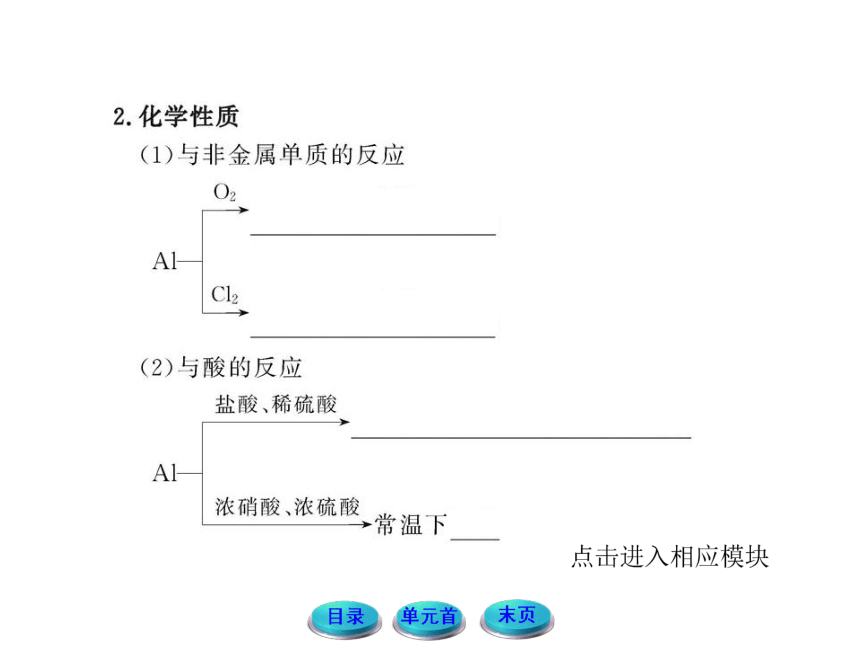
提示:铝是活泼金属,与H+反应产生H2;常温下铝在浓硫酸中钝化,无明显现象。
(2)
提示:金属铝只与强碱如NaOH、Ba(OH)2等发生反应,不与弱碱反应。
3.如何除去镁粉中含有的少量铝粉?
提示:将混合物加入足量的氢氧化钠溶液中,充分反应后过滤。其反应为:2Al+2NaOH+2H2O====2NaAlO2+3H2↑。
4.是否只有铝与三氧化二铁的反应才叫铝热反应 铝热反应都有哪些用途?
提示:铝粉与某些(活泼性比铝差的)金属氧化物之间发生反应,放出大量热的反应都称为铝热反应。并不是只有铝与三氧化二铁的反应才叫铝热反应。铝热反应常用来冶炼熔点较高的金属如铬、锰等,也可以焊接钢轨。
如2Al+3WO3 Al2O3+3W
高温
====
例题 一定质量的铝与氧化亚铁的混合物溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况)气体;用同样质量的该混合物完全溶于盐酸中,消耗1.8 mol·L-1的盐酸500 mL,则该混合物中铝与氧化亚铁的物质的量之比为
A.1∶3 B.1∶2
C.2∶1 D.3∶1
【规范解答】选A。铝与NaOH溶液反应2Al~2OH-~3H2,故
产生H23.36 L时,消耗铝的物质的量为 =
0.1 mol,即混合物中含铝0.1 mol,氧化亚铁的物质的量为
【互动探究】用同样质量的该混合物加足量盐酸,产生标准状况下氢气的体积是多少?
提示:加入盐酸,只有铝与盐酸反应放出H2,故与加入NaOH溶液产生的氢气相同,均为3.36 L。
1.金属铝既可以与酸反应,又可与强碱反应,因此金属铝既具有一定的金属性,又具有一定的非金属性。
2.铝热反应是利用铝较强的还原性把不如铝活泼的金属置换出来的反应。因此比Al活泼的金属无法通过铝热反应制取。
3.有关铝与强碱或酸反应的计算,要注意守恒思想的应用,如电子守恒、质量守恒等。
铝与强酸或强碱溶液反应放出氢气的有关计算
反应原理
1.铝和强酸溶液反应:
2Al+6H+====2Al3++3H2↑
2.铝和强碱溶液反应:
2Al+2OH-+2H2O====2AlO2-+3H2↑
探究:
1.等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗的盐酸和氢氧化钠的物质的量有何关系?
提示:由铝与二者反应的离子方程式:
2Al+6H+====2Al3++3H2↑
2Al+2OH-+2H2O====2AlO2-+3H2↑
2.等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生的氢气体积有何关系?
提示:由电子守恒可知:只要消耗的铝的量相同,放出的氢气的体积必然相同。
3.足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产生氢气的体积有何关系?
提示:由上面反应的离子方程式可得出6 mol盐酸产生的氢气为3 mol,而若换成6 mol氢氧化钠的话,产生的氢气为 9 mol,由此可知,等物质的量的盐酸和氢氧化钠与足量的铝反应所得氢气的体积的关系为:1∶3。
4.一定量的铝分别和同浓度同体积的盐酸、NaOH溶液反应时,若产生氢气的体积比大于 且小于1,则铝与酸、碱反应的情况如何?
提示:若在题干条件下产生的气体体积比为大于1/3且小于1,则铝在与酸或碱反应时,铝的量对于酸或碱来说,有一个不足量,有一个过量。因2Al~6H+,2Al~2OH-即等量铝消耗H+比消耗OH-多,故铝与酸反应时铝过量,与碱反应时铝不足。
1.铝合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )
A.不易生锈 B.导电性好
C.密度小 D.强度高
【解析】选B。由题中所给铝合金因坚硬、轻巧、美观、洁净、易于加工可知,无关的是其导电性好。
2.铝粉跟下列氧化物形成的混合物,不能发生铝热反应的是( )
A.MnO2 B.Fe2O3
C.Cr2O3 D.MgO
【解析】选D。铝热反应是置换反应,银将不如铝活泼的金属置换出来,镁比铝活泼,故选D。
3.(2011·海淀高一检测)下列关于铝的叙述中,不正确的是( )
A.铝是地壳里含量最多的金属元素
B.常温下铝不能与氧气反应
C.铝是一种比较活泼的金属
D.在化学反应中,铝容易失去电子,作还原剂
【解析】选B。常温下铝可与空气中的氧气反应生成致密的氧化膜。
4.写出下列离子反应的离子方程式:
(1)铝片与稀硫酸反应_____________________________。
(2)铝片与氢氧化钾溶液反应______________________。
(3)铝热剂是_______和________的混合物。写出铝粉和氧化铁的混合物在高温下反应的化学方程式:___________。
铝热反应可用于______________________。反应中铝表现
______________________________________________。
【解析】写离子方程式时,一定要分清哪些化学式可拆,哪些不能拆。在写铝和氢氧化钾溶液反应的离子方程式时,产物中的偏铝酸钠是强电解质,应写成离子形式。
答案:(1)2Al+6H+====2Al3++3H2↑
(2)2Al+2OH-+2H2O====2AlO2-+3H2↑
(3)铝粉 在金属活动性顺序表中排在铝后面的金属氧化物2Al+Fe2O3 Al2O3+2Fe
焊接钢轨、冶炼难熔金属 强还原性
高温
====
5.某镁铝合金0.2 g完全溶于盐酸中,加入过量的NaOH溶液,得到白色沉淀,将此沉淀洗净后,溶于25 mL 0.2 mo1·L-1的盐酸中。再用0.05 mo1·L-1的NaOH溶液中和过量的酸时,共用去18 mL碱液。求合金中镁的质量分数。
【解析】0.2 g合金溶于盐酸与过量NaOH溶液反应沉淀为Mg(OH)2,而25 mL 0.2 mol·L-1的盐酸有两个用途,一是溶解Mg(OH)2,一是中和18 mL 0.05 mol·L-1的NaOH。所以:n〔Mg(OH)2〕=(25 mL×0.2 mo1·L-1-18 mL×
0.05 mol·L-1)÷2=2.05 mmol=0.00 205 mol
即:w(Mg)=
答案:24.6%
一、选择题(本题包括6小题,每小题4分,共24分)
1.用铝热法还原下列化合物,制得金属各1 mol,消耗铝最少的是( )
A.MnO2 B.WO3 C.Co3O4 D.Cr2O3
【解析】选C。由题意可得,得1 mol金属时,对Mn、W、Co、Cr这四种金属来说,依次需得电子为:4 mol、6 mol、
mol、3 mol,所需的铝依次为: mol、2 mol、 mol、
1 mol,所以选C。
2.足量的铝分别与等物质的量的稀硫酸和NaOH溶液反应,在同温同压下产生气体的体积比为( )
A.1∶3 B.2∶3 C.1∶1 D.1∶2
【解析】选B。由Al分别与稀硫酸和NaOH溶液的反应:2Al+3H2SO4====Al2(SO4)3+3H2↑,2Al+2NaOH+2H2O====
2NaAlO2+3H2↑可知,当H2SO4和NaOH物质的量相等时,与足量的铝反应,放出H2在同温同压下体积比为2∶3。
【规律方法】根据物质的分类和性质,试总结都有哪些物质既能与酸反应,又能与碱反应?
提示:①某些单质:如Zn、Al、S、Si等(当然Si只与HF反应、S只与强氧化性酸反应)。
②两性氧化物,如Al2O3等。
③两性氢氧化物,如Al(OH)3、Zn(OH)2等。
④弱酸的铵盐,如CH3COONH4、(NH4)2S等。
⑤多元弱酸的酸式盐,如NaHCO3、NaH2PO4等。
3.用于飞机制造的材料应具备高比强度(断裂强度/密度),还应具备密度小,质地轻的特点。你认为下列材料中哪种可用于飞机制造业( )
A.Mg——Al合金 B.黄铜(Cu——Zn合金)
C.Na——K合金 D.生铁(Fe——C合金)
【解析】选A。制造飞机的材料要求密度小、强度大。黄铜、生铁密度太大,而Na——K合金强度太小,故选A。
4.等质量的Mg、Al、Fe三种金属分别跟同浓度、同体积的稀盐酸反应时,放出的氢气质量相等,则下列说法中正确的是( )
A.三种金属的物质的量相等 B.三种金属均过量
C.三种金属的质量相等 D.盐酸均过量
【解析】选B。由题意可知,对于本题中金属的质量是相同的,而所给酸的物质的量也是相同的,那么要想放出等量的氢气,只有酸的量对三种金属来说都不足量,如果是金属的量不足,那放出的H2的体积一定不相同,所以答案选B。
5.某无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出。该溶液中可能大量存在的一组离子是( )
A.K+、H+、NO3-、Na+
B.H+、Br-、SO42-、NO3-
C.SO42-、Br-、OH-、Fe2+
D.OH-、Br-、SO42-、K+
【解析】选D。由题意可知,溶液无色,一些有颜色的离子不能存在,如Cu2+、Fe3+、Fe2+、 等;加入氯水呈橙黄色,说明有Br-存在,而加入BaCl2溶液出现白色沉淀,说明溶液中有SO42-,而加入铝粉有气体放出,说明有H+或OH-存在,而B选项中,加入铝粉不会放出H2,因为里面有NO3-存在,所以答案应选D。
6.镁粉中混进少量铝粉,将铝粉除去,可选用的试剂是
( )
A.盐酸 B.CuSO4溶液
C.NaOH溶液 D.H2O
【解析】选C。由题意可知,镁粉中混有铝粉,若要除掉铝粉,则应选择能与铝反应而不与镁反应的物质,则可得出为NaOH溶液。
【举一反三】若炭粉中混入少量铝粉,则答案有何变化
提示:炭粉不与CuSO4溶液、盐酸和NaOH溶液反应,而铝与CuSO4反应会生成铜引入新的杂质,故应选择A、C。
二、非选择题(本题包括2小题,共26分)
7.(12分)有以下6种物质,结合相关问题填空:
①Al ②FeCl3溶液 ③SO2
④碱石灰 ⑤液氨 ⑥NaOH固体
(1)能导电的是_____;属于非电解质的是_____。
(2)碱石灰常用作干燥剂,其不能干燥下列_____气体(以上各空用相关编号填写)。
A.H2 B.NH3 C.CO2 D.O2
(3)①与⑥溶液反应的产物中Al的化合价为_______价;其反应的化学方程式为:____________________________。
【解析】由题意可知,能导电的物质有金属或电解质溶液或熔融电解质,所以选①②;根据电解质的定义可以得出,非电解质为③⑤;碱石灰为碱性干燥剂,不能用来干燥酸性气体,所以选CO2;而铝的化合价只有0价和+3价。
答案:(1) ①② ③⑤
(2)C (3)+3
2Al+2H2O+2NaOH====2NaAlO2+3H2↑
8.(14分)(2011·吉安高一检测)某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:(已知硅不溶于盐酸)
(1)补全上述①②③④各步反应的离子方程式
①Mg+2H+====Mg2++H2↑,__________________________
②_________________________________________,
___________________________________________,
Mg2++2OH-====Mg(OH)2↓
③_________________________________________,
CO2+2H2O+AlO2-====Al(OH)3↓+ HCO3-
④2Al(OH)3 Al2O3+3H2O
△
====
(2)该样品中铝的质量分数是_____。
(3)第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果_____,第④步对沉淀灼烧不充分时,会使测定结果_____。(填“A”、“B”或“C”)
A.偏高 B.偏低 C.不影响
【解析】(1)①步反应后,过滤得到的固体是铜、硅,滤液则为氯化镁、氯化铝及剩余盐酸的混合溶液;②步反应后,过滤得到的固体为氢氧化镁,滤液为偏铝酸钠与剩余氢氧化钠、氯化钠的混合溶液。
(2)由转化图可得知产生的Al2O3固体为b g,则由铝元素守恒可得以下关系:
2Al ~ Al2O3
54 102
X b g
则硬铝中铝的质量为x= g,
该样品中铝的质量分数是
(3)沉淀没有用蒸馏水洗涤及沉淀灼烧不充分时,都会导致最后Al2O3固体的质量偏大,进而使硬铝中铝的质量偏大,使测定结果偏高。
答案:(1)2Al+6H+====2Al3++3H2↑
H++OH-====H2O
Al3++4OH-====AlO2-+2H2O
CO2+OH-==== HCO3-
(2) (3)A A
1.铝在常温下就能和空气中的氧气反应,为什么铝制品在生活中却随处可见?
提示:因为常温下铝和空气中的氧气反应生成一层致密的氧化膜,牢固地附着在铝的表面,阻止内部的铝与空气接触,因此具有良好的抗腐蚀性,故铝制品在生活中随处可见。
2.试根据下列实验,探究铝的性质,并分析下列现象为何不同。
(1)
提示:铝是活泼金属,与H+反应产生H2;常温下铝在浓硫酸中钝化,无明显现象。
(2)
提示:金属铝只与强碱如NaOH、Ba(OH)2等发生反应,不与弱碱反应。
3.如何除去镁粉中含有的少量铝粉?
提示:将混合物加入足量的氢氧化钠溶液中,充分反应后过滤。其反应为:2Al+2NaOH+2H2O====2NaAlO2+3H2↑。
4.是否只有铝与三氧化二铁的反应才叫铝热反应 铝热反应都有哪些用途?
提示:铝粉与某些(活泼性比铝差的)金属氧化物之间发生反应,放出大量热的反应都称为铝热反应。并不是只有铝与三氧化二铁的反应才叫铝热反应。铝热反应常用来冶炼熔点较高的金属如铬、锰等,也可以焊接钢轨。
如2Al+3WO3 Al2O3+3W
高温
====
例题 一定质量的铝与氧化亚铁的混合物溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况)气体;用同样质量的该混合物完全溶于盐酸中,消耗1.8 mol·L-1的盐酸500 mL,则该混合物中铝与氧化亚铁的物质的量之比为
A.1∶3 B.1∶2
C.2∶1 D.3∶1
【规范解答】选A。铝与NaOH溶液反应2Al~2OH-~3H2,故
产生H23.36 L时,消耗铝的物质的量为 =
0.1 mol,即混合物中含铝0.1 mol,氧化亚铁的物质的量为
【互动探究】用同样质量的该混合物加足量盐酸,产生标准状况下氢气的体积是多少?
提示:加入盐酸,只有铝与盐酸反应放出H2,故与加入NaOH溶液产生的氢气相同,均为3.36 L。
1.金属铝既可以与酸反应,又可与强碱反应,因此金属铝既具有一定的金属性,又具有一定的非金属性。
2.铝热反应是利用铝较强的还原性把不如铝活泼的金属置换出来的反应。因此比Al活泼的金属无法通过铝热反应制取。
3.有关铝与强碱或酸反应的计算,要注意守恒思想的应用,如电子守恒、质量守恒等。
铝与强酸或强碱溶液反应放出氢气的有关计算
反应原理
1.铝和强酸溶液反应:
2Al+6H+====2Al3++3H2↑
2.铝和强碱溶液反应:
2Al+2OH-+2H2O====2AlO2-+3H2↑
探究:
1.等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗的盐酸和氢氧化钠的物质的量有何关系?
提示:由铝与二者反应的离子方程式:
2Al+6H+====2Al3++3H2↑
2Al+2OH-+2H2O====2AlO2-+3H2↑
2.等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生的氢气体积有何关系?
提示:由电子守恒可知:只要消耗的铝的量相同,放出的氢气的体积必然相同。
3.足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产生氢气的体积有何关系?
提示:由上面反应的离子方程式可得出6 mol盐酸产生的氢气为3 mol,而若换成6 mol氢氧化钠的话,产生的氢气为 9 mol,由此可知,等物质的量的盐酸和氢氧化钠与足量的铝反应所得氢气的体积的关系为:1∶3。
4.一定量的铝分别和同浓度同体积的盐酸、NaOH溶液反应时,若产生氢气的体积比大于 且小于1,则铝与酸、碱反应的情况如何?
提示:若在题干条件下产生的气体体积比为大于1/3且小于1,则铝在与酸或碱反应时,铝的量对于酸或碱来说,有一个不足量,有一个过量。因2Al~6H+,2Al~2OH-即等量铝消耗H+比消耗OH-多,故铝与酸反应时铝过量,与碱反应时铝不足。
1.铝合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )
A.不易生锈 B.导电性好
C.密度小 D.强度高
【解析】选B。由题中所给铝合金因坚硬、轻巧、美观、洁净、易于加工可知,无关的是其导电性好。
2.铝粉跟下列氧化物形成的混合物,不能发生铝热反应的是( )
A.MnO2 B.Fe2O3
C.Cr2O3 D.MgO
【解析】选D。铝热反应是置换反应,银将不如铝活泼的金属置换出来,镁比铝活泼,故选D。
3.(2011·海淀高一检测)下列关于铝的叙述中,不正确的是( )
A.铝是地壳里含量最多的金属元素
B.常温下铝不能与氧气反应
C.铝是一种比较活泼的金属
D.在化学反应中,铝容易失去电子,作还原剂
【解析】选B。常温下铝可与空气中的氧气反应生成致密的氧化膜。
4.写出下列离子反应的离子方程式:
(1)铝片与稀硫酸反应_____________________________。
(2)铝片与氢氧化钾溶液反应______________________。
(3)铝热剂是_______和________的混合物。写出铝粉和氧化铁的混合物在高温下反应的化学方程式:___________。
铝热反应可用于______________________。反应中铝表现
______________________________________________。
【解析】写离子方程式时,一定要分清哪些化学式可拆,哪些不能拆。在写铝和氢氧化钾溶液反应的离子方程式时,产物中的偏铝酸钠是强电解质,应写成离子形式。
答案:(1)2Al+6H+====2Al3++3H2↑
(2)2Al+2OH-+2H2O====2AlO2-+3H2↑
(3)铝粉 在金属活动性顺序表中排在铝后面的金属氧化物2Al+Fe2O3 Al2O3+2Fe
焊接钢轨、冶炼难熔金属 强还原性
高温
====
5.某镁铝合金0.2 g完全溶于盐酸中,加入过量的NaOH溶液,得到白色沉淀,将此沉淀洗净后,溶于25 mL 0.2 mo1·L-1的盐酸中。再用0.05 mo1·L-1的NaOH溶液中和过量的酸时,共用去18 mL碱液。求合金中镁的质量分数。
【解析】0.2 g合金溶于盐酸与过量NaOH溶液反应沉淀为Mg(OH)2,而25 mL 0.2 mol·L-1的盐酸有两个用途,一是溶解Mg(OH)2,一是中和18 mL 0.05 mol·L-1的NaOH。所以:n〔Mg(OH)2〕=(25 mL×0.2 mo1·L-1-18 mL×
0.05 mol·L-1)÷2=2.05 mmol=0.00 205 mol
即:w(Mg)=
答案:24.6%
一、选择题(本题包括6小题,每小题4分,共24分)
1.用铝热法还原下列化合物,制得金属各1 mol,消耗铝最少的是( )
A.MnO2 B.WO3 C.Co3O4 D.Cr2O3
【解析】选C。由题意可得,得1 mol金属时,对Mn、W、Co、Cr这四种金属来说,依次需得电子为:4 mol、6 mol、
mol、3 mol,所需的铝依次为: mol、2 mol、 mol、
1 mol,所以选C。
2.足量的铝分别与等物质的量的稀硫酸和NaOH溶液反应,在同温同压下产生气体的体积比为( )
A.1∶3 B.2∶3 C.1∶1 D.1∶2
【解析】选B。由Al分别与稀硫酸和NaOH溶液的反应:2Al+3H2SO4====Al2(SO4)3+3H2↑,2Al+2NaOH+2H2O====
2NaAlO2+3H2↑可知,当H2SO4和NaOH物质的量相等时,与足量的铝反应,放出H2在同温同压下体积比为2∶3。
【规律方法】根据物质的分类和性质,试总结都有哪些物质既能与酸反应,又能与碱反应?
提示:①某些单质:如Zn、Al、S、Si等(当然Si只与HF反应、S只与强氧化性酸反应)。
②两性氧化物,如Al2O3等。
③两性氢氧化物,如Al(OH)3、Zn(OH)2等。
④弱酸的铵盐,如CH3COONH4、(NH4)2S等。
⑤多元弱酸的酸式盐,如NaHCO3、NaH2PO4等。
3.用于飞机制造的材料应具备高比强度(断裂强度/密度),还应具备密度小,质地轻的特点。你认为下列材料中哪种可用于飞机制造业( )
A.Mg——Al合金 B.黄铜(Cu——Zn合金)
C.Na——K合金 D.生铁(Fe——C合金)
【解析】选A。制造飞机的材料要求密度小、强度大。黄铜、生铁密度太大,而Na——K合金强度太小,故选A。
4.等质量的Mg、Al、Fe三种金属分别跟同浓度、同体积的稀盐酸反应时,放出的氢气质量相等,则下列说法中正确的是( )
A.三种金属的物质的量相等 B.三种金属均过量
C.三种金属的质量相等 D.盐酸均过量
【解析】选B。由题意可知,对于本题中金属的质量是相同的,而所给酸的物质的量也是相同的,那么要想放出等量的氢气,只有酸的量对三种金属来说都不足量,如果是金属的量不足,那放出的H2的体积一定不相同,所以答案选B。
5.某无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出。该溶液中可能大量存在的一组离子是( )
A.K+、H+、NO3-、Na+
B.H+、Br-、SO42-、NO3-
C.SO42-、Br-、OH-、Fe2+
D.OH-、Br-、SO42-、K+
【解析】选D。由题意可知,溶液无色,一些有颜色的离子不能存在,如Cu2+、Fe3+、Fe2+、 等;加入氯水呈橙黄色,说明有Br-存在,而加入BaCl2溶液出现白色沉淀,说明溶液中有SO42-,而加入铝粉有气体放出,说明有H+或OH-存在,而B选项中,加入铝粉不会放出H2,因为里面有NO3-存在,所以答案应选D。
6.镁粉中混进少量铝粉,将铝粉除去,可选用的试剂是
( )
A.盐酸 B.CuSO4溶液
C.NaOH溶液 D.H2O
【解析】选C。由题意可知,镁粉中混有铝粉,若要除掉铝粉,则应选择能与铝反应而不与镁反应的物质,则可得出为NaOH溶液。
【举一反三】若炭粉中混入少量铝粉,则答案有何变化
提示:炭粉不与CuSO4溶液、盐酸和NaOH溶液反应,而铝与CuSO4反应会生成铜引入新的杂质,故应选择A、C。
二、非选择题(本题包括2小题,共26分)
7.(12分)有以下6种物质,结合相关问题填空:
①Al ②FeCl3溶液 ③SO2
④碱石灰 ⑤液氨 ⑥NaOH固体
(1)能导电的是_____;属于非电解质的是_____。
(2)碱石灰常用作干燥剂,其不能干燥下列_____气体(以上各空用相关编号填写)。
A.H2 B.NH3 C.CO2 D.O2
(3)①与⑥溶液反应的产物中Al的化合价为_______价;其反应的化学方程式为:____________________________。
【解析】由题意可知,能导电的物质有金属或电解质溶液或熔融电解质,所以选①②;根据电解质的定义可以得出,非电解质为③⑤;碱石灰为碱性干燥剂,不能用来干燥酸性气体,所以选CO2;而铝的化合价只有0价和+3价。
答案:(1) ①② ③⑤
(2)C (3)+3
2Al+2H2O+2NaOH====2NaAlO2+3H2↑
8.(14分)(2011·吉安高一检测)某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:(已知硅不溶于盐酸)
(1)补全上述①②③④各步反应的离子方程式
①Mg+2H+====Mg2++H2↑,__________________________
②_________________________________________,
___________________________________________,
Mg2++2OH-====Mg(OH)2↓
③_________________________________________,
CO2+2H2O+AlO2-====Al(OH)3↓+ HCO3-
④2Al(OH)3 Al2O3+3H2O
△
====
(2)该样品中铝的质量分数是_____。
(3)第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果_____,第④步对沉淀灼烧不充分时,会使测定结果_____。(填“A”、“B”或“C”)
A.偏高 B.偏低 C.不影响
【解析】(1)①步反应后,过滤得到的固体是铜、硅,滤液则为氯化镁、氯化铝及剩余盐酸的混合溶液;②步反应后,过滤得到的固体为氢氧化镁,滤液为偏铝酸钠与剩余氢氧化钠、氯化钠的混合溶液。
(2)由转化图可得知产生的Al2O3固体为b g,则由铝元素守恒可得以下关系:
2Al ~ Al2O3
54 102
X b g
则硬铝中铝的质量为x= g,
该样品中铝的质量分数是
(3)沉淀没有用蒸馏水洗涤及沉淀灼烧不充分时,都会导致最后Al2O3固体的质量偏大,进而使硬铝中铝的质量偏大,使测定结果偏高。
答案:(1)2Al+6H+====2Al3++3H2↑
H++OH-====H2O
Al3++4OH-====AlO2-+2H2O
CO2+OH-==== HCO3-
(2) (3)A A
