11-12版高中化学课时讲练通配套课件:3.1.1从铝土矿中提取铝 铝的氧化物与氢氧化物(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:3.1.1从铝土矿中提取铝 铝的氧化物与氢氧化物(苏教版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 00:00:00 | ||
图片预览










文档简介
(共67张PPT)
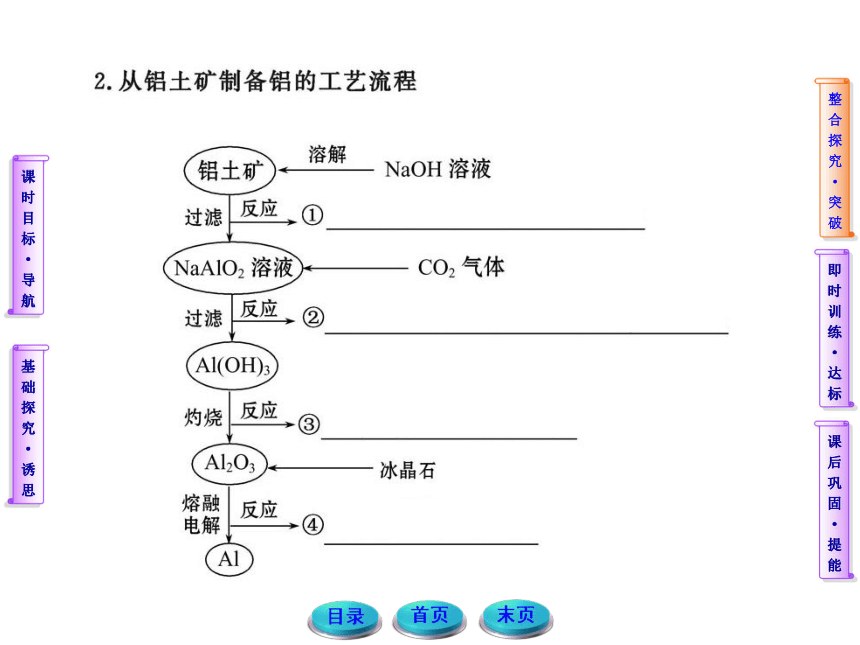
1.铝土矿在酸化过程中,为什么要通入过量的CO2而不是加入过量的盐酸?
提示:通入过量的CO2,目的是使溶液中的NaAlO2完全转化为Al(OH)3,不用盐酸是因为盐酸是强酸,能与Al(OH)3进一步反应而生成AlCl3,导致加入酸的量不好控制。
2.在整个铝土矿提纯的过程中,有两次过滤,这两次过滤的目的有何不同?这两次过滤能合并吗?
提示:在整个过程中,第一次过滤是为了除去不溶性杂质(如Fe2O3等)而得到NaAlO2溶液。第二次过滤是为了得到Al(OH)3固体。这两次过滤的作用不同,所以不能合并,否则就达不到提纯的目的。
例1 有一包某混合物A,含有AlCl3、Al2O3和SiO2,按以下实验进行转化(已知SiO2不溶于水和强酸性溶液)。
Ⅰ.先将混合物溶于水后过滤,得溶液B和沉淀C。
Ⅱ.后向溶液B中加入过量的氨水,得溶液D和沉淀E。
Ⅲ.将沉淀C用过量的盐酸溶解后过滤,得沉淀F和溶液B,向溶液B中加入过量的氨水,得沉淀E和溶液D,过滤,将两部分E合并后,加热灼烧得固体J。
据此回答下列问题:
(1)在以上过程中将溶液和沉淀分离所采取的方法是
________________________________________________。
(2)根据以上所述,写出下列物质的化学式:
溶液D中的溶质______________,固体J_____________。
(3)写出过程Ⅲ的三个化学方程式:
______________________________________________;
______________________________________________;
______________________________________________。
【规范解答】本题是利用三种物质的性质,首先利用Al2O3和SiO2不溶于水把它们与AlCl3分离开,再利用Al2O3能与盐酸反应,而SiO2不能,将二者分离开,再利用Al3+与氨水反应,将其转化为Al(OH)3,最终得到Al2O3。
答案:(1)过滤
(2)NH4Cl、NH3·H2O Al2O3
(3)Al2O3+6HCl====2AlCl3+3H2O
AlCl3+3NH3·H2O====Al(OH)3↓+3NH4Cl
2Al(OH)3 Al2O3+3H2O
△
====
【互动探究】将AlCl3和Al2O3分别换成MgCl2、MgO,操作步骤不变,则溶液D的溶质,沉淀E和固体J的成分各是什么?
提示:将AlCl3和Al2O3分别换成MgCl2、MgO,加水后MgCl2溶于水中而MgO和SiO2形成沉淀,MgCl2溶液中加过量的氨水生成Mg(OH)2沉淀,MgO和SiO2在盐酸中,MgO溶解,SiO2形成沉淀,溶液中加入过量的氨水后,也生成Mg(OH)2沉淀,Mg(OH)2沉淀灼烧后得MgO。所以溶液D的溶质为NH4Cl和NH3·H2O,沉淀E为Mg(OH)2而固体J为MgO。
1.请讨论总结Al(OH)3的制备方法,并探究各制备方法中选择试剂时要注意的问题。
提示:(1)如果所给试剂为可溶性铝盐溶液,可以让其与过量的氨水反应,使之全部转化为Al(OH)3沉淀。(注意:切不可用NaOH等强碱与之反应,因为Al(OH)3能与强碱反应生成偏铝酸盐,致使所得Al(OH)3的量不容易控制)
(2)如果所给的试剂为NaAlO2溶液,则可向溶液中通入过量的CO2,使之全部转化为Al(OH)3沉淀。(注意:切不可使用盐酸等强酸,因所得Al(OH)3沉淀能与盐酸等强酸反应,使所得沉淀量减少或使之沉淀不完全,不容易控制)
2.如果有一份混合溶液,里面的阳离子既有Fe3+,又有Al3+,想将二者分离开来应该如何去做?
提示:可向溶液中加入稍过量的NaOH溶液,过滤出沉淀,将沉淀洗涤后,加相应的酸将其溶解,然后向滤液中通入过量的CO2,将生成的沉淀滤出,洗涤干净后,再加入相应的酸即可。
例2 (双选)向20 mL 1 mol·L-1的Al2(SO4)3溶液中加入
30 mL KOH溶液,充分反应得到0.78 g沉淀,则KOH溶液的物质的量浓度可能是
A.1 mol·L-1 B.3 mol·L-1
C.5 mol·L-1 D.7 mol·L-1
【规范解答】本题从Al3+的物质的量与沉淀Al(OH)3的物质的量比较可推测KOH的两种情况:
①量不足时,n(KOH)=3n〔Al(OH)3〕。
②KOH过量时,n(KOH)=4n(Al3+)-n〔Al(OH)3〕
解题过程可分以下两步进行
(1)求Al3+和Al(OH)3沉淀的物质的量
n(Al3+)=2×0.02 L×1 mol·L-1=0.04 mol,
n〔Al(OH)3〕= =0.01 mol。
(2)①当KOH不足时:
n(KOH)=3n〔Al(OH)3〕=0.03 mol
c= =1 mol·L-1
②当KOH过量时:
n(KOH)=4n(Al3+)-n〔Al(OH)3〕=0.16 mol-0.01 mol=0.15 mol。
c= =5 mol·L-1
答案:A、C
【互动探究】将NaOH逐渐滴入AlCl3溶液中,铝元素将以何种形式存在于反应体系中?
提示:加入NaOH溶液后,开始时,Al3+与OH-反应生成Al(OH)3,当加入的NaOH溶液过量后,Al(OH)3会与NaOH继续反应生成AlO2-,所以加入NaOH溶液后,如NaOH量不足,铝元素将以Al3+和Al(OH)3的形式存在于体系中,如NaOH过量,则铝元素将以Al(OH)3和AlO2-或只以AlO2-的形式存在于反应体系中。
“铝三角”及其之间的相互转化
1.Al3+ Al(OH)3
(1)可溶性铝盐和少量强碱溶液反应:
Al3++3OH-(少量)====Al(OH)3↓
(2)可溶性铝盐和氨水反应:
Al3++3NH3 H2O====Al(OH)3↓+3NH4+
2.Al(OH)3 Al3+
Al(OH)3溶于强酸溶液:
Al(OH)3+3H+====Al3++3H2O
3.Al3+ AlO2-
可溶性铝盐和过量强碱溶液反应:
Al3++4OH-====AlO2-+2H2O
4.AlO2- Al3+
偏铝酸盐溶液与足量的强酸溶液反应:
AlO2-+4H+(过量)====Al3++2H2O
5.AlO2- Al(OH)3
(1)偏铝酸盐溶液与少量的强酸溶液反应:
AlO2-+H2O+H+(少量)====Al(OH)3↓
(2)偏铝酸盐溶液中通入CO2气体:
2AlO2-+3H2O+CO2(少量)====2Al(OH)3↓+CO32-
AlO2-+2H2O+CO2(过量)====Al(OH)3↓+HCO3-
6.Al(OH)3 AlO2-
Al(OH)3溶于强碱溶液:
Al(OH)3+OH-====AlO2-+2H2O
含铝化合物的图像分析
铝的化合物相互转化的图像分析利用数形结合思想,能把复杂问题简单化。例如我们可以用数形结合思想来解决Al3+ Al(OH)3 AlO2-三者转化时的用量关系,通过对图像分析来简化问题。
探究:
1.向100 mL 0.1 mol/L AlCl3溶液中滴加0.1 mol/L NaOH溶液至过量,请结合有关化学方程式,尝试画出
n[Al(OH)3]和V(NaOH)变化图:
提示:作图时要先确定三点,即“起点”、“终点”、“拐点”。在AlCl3中加入极少量NaOH,立刻有沉淀产生,则起点为原点。终点:加入过量NaOH时,Al(OH)3最终消失,则终点在横坐标轴上,通过相应的化学方程式,计算NaOH消耗的体积;“拐点”即图像中拐弯的点,也就是生成沉淀最大量所需V(NaOH)的值。
当Al3+全部转化为Al(OH)3,n[Al(OH)3]值最大,
n[Al(OH)3]=n(Al3+)=0.1 L×0.1 mol/L=0.01 mol。V(NaOH)=
溶解0.01 mol Al(OH)3所需NaOH的体积:V′(NaOH)=
=0.1 L=100 mL,由三点可以确定图像:
2.若向100 mL 0.1 mol/L NaAlO2溶液滴加0.1 mol/L盐酸至过量,试画出沉淀的物质的量和盐酸的体积变化图像,比较和探究1中图像有何不同?
提示:通过化学方程式确定起点、拐点、终点。NaAlO2+HCl+H2O====Al(OH)3↓+NaCl。当盐酸体积为
100 mL,NaAlO2全部转化为Al(OH)3,沉淀的物质的量为
0.1 L×0.1 mol/L=0.01 mol
Al(OH)3+3HCl====AlCl3+3H2O,当盐酸体积为400 mL,Al(OH)3全部溶解。
3.向40 mL 1 mol/L的NaAlO2溶液中加入50 mL盐酸溶液,充分反应得到1.56 g沉淀,盐酸的物质的量浓度可能是多少?(请用数形结合思想解答)
提示:用纵坐标表示生成Al(OH)3的物质的量,横坐标表示盐酸的物质的量,找出起点、拐点、终点作图如下:
1.铝土矿的主要成分是Al2O3,还含有少量杂质,要得到高纯度的Al2O3,下列操作顺序正确的是( )
①加NaOH溶液溶解
②通入过量的CO2
③过滤
④加盐酸酸化
⑤灼烧
A.①②③⑤
B.①③②③⑤
C.①③④③⑤
D.①④③⑤
【解析】选B。用NaOH溶液溶解后再过滤,目的是防止残渣中物质溶于酸而引入其他阳离子。用CO2酸化是因为Al(OH)3不和CO2反应,但和盐酸反应,加入盐酸的量难以控制,故选B。
2.下列有关从铝土矿中提炼铝的说法不正确的是( )
A.铝土矿中的铝元素是以化合态存在的,需用化学方法把铝元素变成游离态
B.提炼过程中,先将铝土矿净化提取氧化铝,再进行冶炼
C.可用常见的还原剂把氧化铝中的铝还原出来
D.冶炼铝的方法同工业冶炼钠、镁相似, 可用电解法
【解析】选C。铝的化学性质非常活泼,在自然界中以化合态的形式存在,若要得到游离态的铝,需将铝用电解的方法将其从化合物中还原出来,而铝用一般的还原剂很难还原出来,要用电解的方法,钠和镁比铝还活泼,也要用电解的方法冶炼。
3.下列各种物质既能与强酸反应,又能与强碱反应的是
( )
①AlCl3 ②NaAlO2
③Al2O3 ④Al(OH)3
⑤NaHCO3
A.①②③④⑤ B.①③④⑤
C.③④⑤ D.①③⑤
【解析】选C。既能与强酸反应,又能与强碱反应的物质主要有两性氧化物、两性氢氧化物、弱酸的酸式盐、弱酸的铵盐、铝等。
4.下列属于碱性氧化物的是_____;属于酸性氧化物的是_____;属于两性氧化物的是_____。
A.CO2 B.Na2O
C.Al2O3 D.CO
【解析】A选项,CO2和H2O反应生成H2CO3,CO2是酸性氧化物。B选项,Na2O和水反应生成NaOH,所以Na2O是碱性氧化物。C选项,Al2O3既能和盐酸反应,又能和NaOH反应,Al2O3为两性氧化物。D选项,CO既不与酸反应,又不与碱反应,是不成盐氧化物。
答案:B A C
5.要除去下列物质中所含杂质(方括号内为杂质),请将选用的试剂及分离方法填在题后的横线上,并写出有关的化学方程式(是离子反应的写出离子方程式)。
(1)Al2O3[Al(OH)3]____________________________;
(2)Cu[Al(OH)3]_______________________________;
(3)Fe2O3[Al2O3]______________________________。
【解析】(1)利用Al(OH)3的不稳定性,受热易分解,采取加热的方法将其除去。
(2)Cu既不与盐酸反应,也不与NaOH反应,而Al(OH)3是两性氢氧化物,可用稀盐酸或NaOH溶液将其除去。
(3)Al2O3是两性氧化物,能与NaOH溶液反应,而Fe2O3与NaOH溶液不反应,可选用NaOH溶液。
答案:(1)加热;2Al(OH)3 Al2O3+3H2O
(2)稀盐酸(或NaOH溶液);过滤,洗涤;
Al(OH)3+3H+====Al3++3H2O
[或Al(OH)3+OH- ====AlO2-+2H2O]
(3)NaOH溶液;过滤,洗涤;
Al2O3+2OH- ====2AlO2- +H2O
△
====
一、选择题(本题包括6小题,每小题4分,共24分)
1.电解法冶炼铝时,冰晶石所起的作用是( )
A.助熔剂 B.催化剂
C.还原剂 D.氧化剂
【解析】选A。由于Al2O3的熔点很高,很难将其熔化,而加入冰晶石可以降低Al2O3的熔点,减少能耗,所以它所起的作用是助熔剂。
2.向下列溶液中通入过量CO2有沉淀生成的是( )
A.NaAlO2 溶液
B.澄清石灰水
C.CaCl2 溶液
D.硝酸银溶液
【解析】选A。向NaAlO2 溶液中通入CO2后二者发生反应生成Al(OH)3,而Al(OH)3只溶于强酸,不能与CO2发生反应,澄清石灰水中通入过量的CO2时,先生成CaCO3沉淀,而后又溶解生成Ca(HCO3)2,CaCl2 溶液和硝酸银溶液中通入CO2气体不会生成沉淀。
3.下列冶炼金属的反应原理中错误的是( )
A.MgCl2 Mg+Cl2↑
B.CuO+CO Cu+CO2
C.2AlCl3(熔融) 2Al+3Cl2↑
D.2Ag2O 4Ag+O2↑
【解析】选C。由所学知识可知,冶炼铝应为电解Al2O3,而不是电解AlCl3,AlCl3也不是离子化合物,熔融状态下也不导电,所以C不正确。
通电
====
通电
====
高温
====
△
====
4.将表面已经完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A.稀硝酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠
【解析】选C。铝条钝化后表面形成的致密的氧化物保护膜成分为Al2O3,为两性氧化物,既可与酸反应,也可与强碱反应,氧化膜被破坏后,铝可以继续反应,但Cu(NO3)2跟Al2O3不反应。故选C。
5.某溶液既能溶解Al(OH)3,又能使紫色石蕊试液变蓝,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42 -、Cl-、ClO-
C.H+、Mg2+、SO42 -、NO3-
D.Ag+、K+、NO3-、Na+
【解析】选B。由题意可得,既能溶解Al(OH)3,又能使紫
色石蕊试液变蓝,应该是强碱性溶液,在强碱性溶液中不能够共存的离子,A中有HCO3-,C中有H+和Mg2+,D中有Ag+,只有B中没有与OH-反应的离子。
【举一反三】将题干改为:使酚酞试液变红的无色溶液,在该溶液中能大量共存的离子组是
提示:使酚酞试液变红的无色溶液显碱性,与OH-反应的离子不符合题意,A项中的HCO3-、C项中的H+和Mg2+、D项中的Ag+均不可,只有B项符合。
6.(2011·新乡高一检测)在某无色溶液中缓慢滴加NaOH溶液直至过量,产生白色沉淀的质量与加入NaOH溶液的体积关系如图所示,由此确定,原溶液中含有的阳离子是( )
A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
【解析】选B。由图像可知,加入NaOH溶液后,开始时不生成沉淀,说明原溶液中有H+,沉淀部分溶解,说明原溶液中有Al3+,加入过量的NaOH后,仍有沉淀,说明溶液中有不溶于碱的沉淀,由此可得应选B。
【规律方法】解图像题三步曲:“一看”、“二想”、“三判断”
(1)“一看”(看图像)
①看面:弄清纵、横坐标的含义。②看线:弄清线的走向、变化趋势及线的陡与平。③看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、拐点、最高点与最低点等。④看量的变化:弄清是浓度变化、物质的量的变化还是转化率的变化。⑤看要不要作辅助线。
(2)“二想”
看完线后联想该物质所涉及的化学方程式。
(3)“三判断”
通过分析,依据化学方程式,作出正确判断。
二、非选择题(本题包括2小题,共26分)
7.(10分)有一瓶澄清溶液,其中可能有NH4+、CO32-、H+、NO3-、Na+、Cl-、Al3+。
(1)取pH试纸检测,溶液呈强酸性,则可以排除_____的存在。
(2)另取部分溶液逐滴滴加氢氧化钠溶液,使溶液从酸性逐渐变为碱性,反应过程中先产生白色沉淀,后白色沉淀消失,整个过程无气体产生,则溶液中肯定存在的离子是_____,可排除 ________的存在。请写出白色沉淀消失的离子方程式_______________________________________。
(3)另取部分溶液,加入少量金属铜粉,铜粉溶解,且有气泡冒出,则溶液中肯定存在的阴离子是_______________。
【解析】由题意可知,若溶液呈强酸性,说明含有H+,H+与
CO32-反应,所以CO32-不存在;另取部分溶液逐滴滴加氢氧化钠溶液,使溶液从酸性逐渐变为碱性,反应过程中先产生白色沉淀,后白色沉淀消失,整个过程无气体产生,说明溶液中应该有Al3+,没有NH4+生成的白色沉淀应该是Al(OH)3,会与氢氧化钠继续反应;另取部分溶液,加入少量金属铜粉,铜粉溶解,且有气泡冒出,说明原溶液中有NO3-,与H+一起组成稀硝酸,具有强氧化性,能与铜反应,生成气体,据此可得答案。
答案:(1)CO32-
(2)Al3+ NH4+
Al(OH)3+OH-====AlO2-+2H2O
(3)NO3-
8.(16分)已知明矾[KAl(SO4)2·12H2O]在水中可解离出K+、Al3+和SO42-,某学习小组为探究明矾中何种离子起净水作用,做如下实验,请你完成实验报告。
有同学认为以上方案中只是证明了Al2(SO4)3可以净水,K+没有净水作用,但Al3+和SO42-哪种微粒起作用无法证明,不够完善。请你仔细分析以上实验报告并将你完善实验所用的试剂及目的填入下表中:
【解析】由题意可得,该题目是一道实验探究题,该题的意图非常明显,采用了对比实验法,用Al2(SO4)3和KCl做对比实验,验证Al3+有净水作用而K+没有,但不能证明Al2(SO4)3净水就一定是Al3+的作用而不是SO42-的作用,所以要进一步进行下面的对比,选择无SO42-的铝盐和无Al3+的硫酸盐分别实验。
答案:烧杯中的水变澄清 K+不能起净水作用
AlCl3[或Al(NO3)3]
验证Al3+能否净水
Na2SO4
验证SO42-能否净水
1.铝土矿在酸化过程中,为什么要通入过量的CO2而不是加入过量的盐酸?
提示:通入过量的CO2,目的是使溶液中的NaAlO2完全转化为Al(OH)3,不用盐酸是因为盐酸是强酸,能与Al(OH)3进一步反应而生成AlCl3,导致加入酸的量不好控制。
2.在整个铝土矿提纯的过程中,有两次过滤,这两次过滤的目的有何不同?这两次过滤能合并吗?
提示:在整个过程中,第一次过滤是为了除去不溶性杂质(如Fe2O3等)而得到NaAlO2溶液。第二次过滤是为了得到Al(OH)3固体。这两次过滤的作用不同,所以不能合并,否则就达不到提纯的目的。
例1 有一包某混合物A,含有AlCl3、Al2O3和SiO2,按以下实验进行转化(已知SiO2不溶于水和强酸性溶液)。
Ⅰ.先将混合物溶于水后过滤,得溶液B和沉淀C。
Ⅱ.后向溶液B中加入过量的氨水,得溶液D和沉淀E。
Ⅲ.将沉淀C用过量的盐酸溶解后过滤,得沉淀F和溶液B,向溶液B中加入过量的氨水,得沉淀E和溶液D,过滤,将两部分E合并后,加热灼烧得固体J。
据此回答下列问题:
(1)在以上过程中将溶液和沉淀分离所采取的方法是
________________________________________________。
(2)根据以上所述,写出下列物质的化学式:
溶液D中的溶质______________,固体J_____________。
(3)写出过程Ⅲ的三个化学方程式:
______________________________________________;
______________________________________________;
______________________________________________。
【规范解答】本题是利用三种物质的性质,首先利用Al2O3和SiO2不溶于水把它们与AlCl3分离开,再利用Al2O3能与盐酸反应,而SiO2不能,将二者分离开,再利用Al3+与氨水反应,将其转化为Al(OH)3,最终得到Al2O3。
答案:(1)过滤
(2)NH4Cl、NH3·H2O Al2O3
(3)Al2O3+6HCl====2AlCl3+3H2O
AlCl3+3NH3·H2O====Al(OH)3↓+3NH4Cl
2Al(OH)3 Al2O3+3H2O
△
====
【互动探究】将AlCl3和Al2O3分别换成MgCl2、MgO,操作步骤不变,则溶液D的溶质,沉淀E和固体J的成分各是什么?
提示:将AlCl3和Al2O3分别换成MgCl2、MgO,加水后MgCl2溶于水中而MgO和SiO2形成沉淀,MgCl2溶液中加过量的氨水生成Mg(OH)2沉淀,MgO和SiO2在盐酸中,MgO溶解,SiO2形成沉淀,溶液中加入过量的氨水后,也生成Mg(OH)2沉淀,Mg(OH)2沉淀灼烧后得MgO。所以溶液D的溶质为NH4Cl和NH3·H2O,沉淀E为Mg(OH)2而固体J为MgO。
1.请讨论总结Al(OH)3的制备方法,并探究各制备方法中选择试剂时要注意的问题。
提示:(1)如果所给试剂为可溶性铝盐溶液,可以让其与过量的氨水反应,使之全部转化为Al(OH)3沉淀。(注意:切不可用NaOH等强碱与之反应,因为Al(OH)3能与强碱反应生成偏铝酸盐,致使所得Al(OH)3的量不容易控制)
(2)如果所给的试剂为NaAlO2溶液,则可向溶液中通入过量的CO2,使之全部转化为Al(OH)3沉淀。(注意:切不可使用盐酸等强酸,因所得Al(OH)3沉淀能与盐酸等强酸反应,使所得沉淀量减少或使之沉淀不完全,不容易控制)
2.如果有一份混合溶液,里面的阳离子既有Fe3+,又有Al3+,想将二者分离开来应该如何去做?
提示:可向溶液中加入稍过量的NaOH溶液,过滤出沉淀,将沉淀洗涤后,加相应的酸将其溶解,然后向滤液中通入过量的CO2,将生成的沉淀滤出,洗涤干净后,再加入相应的酸即可。
例2 (双选)向20 mL 1 mol·L-1的Al2(SO4)3溶液中加入
30 mL KOH溶液,充分反应得到0.78 g沉淀,则KOH溶液的物质的量浓度可能是
A.1 mol·L-1 B.3 mol·L-1
C.5 mol·L-1 D.7 mol·L-1
【规范解答】本题从Al3+的物质的量与沉淀Al(OH)3的物质的量比较可推测KOH的两种情况:
①量不足时,n(KOH)=3n〔Al(OH)3〕。
②KOH过量时,n(KOH)=4n(Al3+)-n〔Al(OH)3〕
解题过程可分以下两步进行
(1)求Al3+和Al(OH)3沉淀的物质的量
n(Al3+)=2×0.02 L×1 mol·L-1=0.04 mol,
n〔Al(OH)3〕= =0.01 mol。
(2)①当KOH不足时:
n(KOH)=3n〔Al(OH)3〕=0.03 mol
c= =1 mol·L-1
②当KOH过量时:
n(KOH)=4n(Al3+)-n〔Al(OH)3〕=0.16 mol-0.01 mol=0.15 mol。
c= =5 mol·L-1
答案:A、C
【互动探究】将NaOH逐渐滴入AlCl3溶液中,铝元素将以何种形式存在于反应体系中?
提示:加入NaOH溶液后,开始时,Al3+与OH-反应生成Al(OH)3,当加入的NaOH溶液过量后,Al(OH)3会与NaOH继续反应生成AlO2-,所以加入NaOH溶液后,如NaOH量不足,铝元素将以Al3+和Al(OH)3的形式存在于体系中,如NaOH过量,则铝元素将以Al(OH)3和AlO2-或只以AlO2-的形式存在于反应体系中。
“铝三角”及其之间的相互转化
1.Al3+ Al(OH)3
(1)可溶性铝盐和少量强碱溶液反应:
Al3++3OH-(少量)====Al(OH)3↓
(2)可溶性铝盐和氨水反应:
Al3++3NH3 H2O====Al(OH)3↓+3NH4+
2.Al(OH)3 Al3+
Al(OH)3溶于强酸溶液:
Al(OH)3+3H+====Al3++3H2O
3.Al3+ AlO2-
可溶性铝盐和过量强碱溶液反应:
Al3++4OH-====AlO2-+2H2O
4.AlO2- Al3+
偏铝酸盐溶液与足量的强酸溶液反应:
AlO2-+4H+(过量)====Al3++2H2O
5.AlO2- Al(OH)3
(1)偏铝酸盐溶液与少量的强酸溶液反应:
AlO2-+H2O+H+(少量)====Al(OH)3↓
(2)偏铝酸盐溶液中通入CO2气体:
2AlO2-+3H2O+CO2(少量)====2Al(OH)3↓+CO32-
AlO2-+2H2O+CO2(过量)====Al(OH)3↓+HCO3-
6.Al(OH)3 AlO2-
Al(OH)3溶于强碱溶液:
Al(OH)3+OH-====AlO2-+2H2O
含铝化合物的图像分析
铝的化合物相互转化的图像分析利用数形结合思想,能把复杂问题简单化。例如我们可以用数形结合思想来解决Al3+ Al(OH)3 AlO2-三者转化时的用量关系,通过对图像分析来简化问题。
探究:
1.向100 mL 0.1 mol/L AlCl3溶液中滴加0.1 mol/L NaOH溶液至过量,请结合有关化学方程式,尝试画出
n[Al(OH)3]和V(NaOH)变化图:
提示:作图时要先确定三点,即“起点”、“终点”、“拐点”。在AlCl3中加入极少量NaOH,立刻有沉淀产生,则起点为原点。终点:加入过量NaOH时,Al(OH)3最终消失,则终点在横坐标轴上,通过相应的化学方程式,计算NaOH消耗的体积;“拐点”即图像中拐弯的点,也就是生成沉淀最大量所需V(NaOH)的值。
当Al3+全部转化为Al(OH)3,n[Al(OH)3]值最大,
n[Al(OH)3]=n(Al3+)=0.1 L×0.1 mol/L=0.01 mol。V(NaOH)=
溶解0.01 mol Al(OH)3所需NaOH的体积:V′(NaOH)=
=0.1 L=100 mL,由三点可以确定图像:
2.若向100 mL 0.1 mol/L NaAlO2溶液滴加0.1 mol/L盐酸至过量,试画出沉淀的物质的量和盐酸的体积变化图像,比较和探究1中图像有何不同?
提示:通过化学方程式确定起点、拐点、终点。NaAlO2+HCl+H2O====Al(OH)3↓+NaCl。当盐酸体积为
100 mL,NaAlO2全部转化为Al(OH)3,沉淀的物质的量为
0.1 L×0.1 mol/L=0.01 mol
Al(OH)3+3HCl====AlCl3+3H2O,当盐酸体积为400 mL,Al(OH)3全部溶解。
3.向40 mL 1 mol/L的NaAlO2溶液中加入50 mL盐酸溶液,充分反应得到1.56 g沉淀,盐酸的物质的量浓度可能是多少?(请用数形结合思想解答)
提示:用纵坐标表示生成Al(OH)3的物质的量,横坐标表示盐酸的物质的量,找出起点、拐点、终点作图如下:
1.铝土矿的主要成分是Al2O3,还含有少量杂质,要得到高纯度的Al2O3,下列操作顺序正确的是( )
①加NaOH溶液溶解
②通入过量的CO2
③过滤
④加盐酸酸化
⑤灼烧
A.①②③⑤
B.①③②③⑤
C.①③④③⑤
D.①④③⑤
【解析】选B。用NaOH溶液溶解后再过滤,目的是防止残渣中物质溶于酸而引入其他阳离子。用CO2酸化是因为Al(OH)3不和CO2反应,但和盐酸反应,加入盐酸的量难以控制,故选B。
2.下列有关从铝土矿中提炼铝的说法不正确的是( )
A.铝土矿中的铝元素是以化合态存在的,需用化学方法把铝元素变成游离态
B.提炼过程中,先将铝土矿净化提取氧化铝,再进行冶炼
C.可用常见的还原剂把氧化铝中的铝还原出来
D.冶炼铝的方法同工业冶炼钠、镁相似, 可用电解法
【解析】选C。铝的化学性质非常活泼,在自然界中以化合态的形式存在,若要得到游离态的铝,需将铝用电解的方法将其从化合物中还原出来,而铝用一般的还原剂很难还原出来,要用电解的方法,钠和镁比铝还活泼,也要用电解的方法冶炼。
3.下列各种物质既能与强酸反应,又能与强碱反应的是
( )
①AlCl3 ②NaAlO2
③Al2O3 ④Al(OH)3
⑤NaHCO3
A.①②③④⑤ B.①③④⑤
C.③④⑤ D.①③⑤
【解析】选C。既能与强酸反应,又能与强碱反应的物质主要有两性氧化物、两性氢氧化物、弱酸的酸式盐、弱酸的铵盐、铝等。
4.下列属于碱性氧化物的是_____;属于酸性氧化物的是_____;属于两性氧化物的是_____。
A.CO2 B.Na2O
C.Al2O3 D.CO
【解析】A选项,CO2和H2O反应生成H2CO3,CO2是酸性氧化物。B选项,Na2O和水反应生成NaOH,所以Na2O是碱性氧化物。C选项,Al2O3既能和盐酸反应,又能和NaOH反应,Al2O3为两性氧化物。D选项,CO既不与酸反应,又不与碱反应,是不成盐氧化物。
答案:B A C
5.要除去下列物质中所含杂质(方括号内为杂质),请将选用的试剂及分离方法填在题后的横线上,并写出有关的化学方程式(是离子反应的写出离子方程式)。
(1)Al2O3[Al(OH)3]____________________________;
(2)Cu[Al(OH)3]_______________________________;
(3)Fe2O3[Al2O3]______________________________。
【解析】(1)利用Al(OH)3的不稳定性,受热易分解,采取加热的方法将其除去。
(2)Cu既不与盐酸反应,也不与NaOH反应,而Al(OH)3是两性氢氧化物,可用稀盐酸或NaOH溶液将其除去。
(3)Al2O3是两性氧化物,能与NaOH溶液反应,而Fe2O3与NaOH溶液不反应,可选用NaOH溶液。
答案:(1)加热;2Al(OH)3 Al2O3+3H2O
(2)稀盐酸(或NaOH溶液);过滤,洗涤;
Al(OH)3+3H+====Al3++3H2O
[或Al(OH)3+OH- ====AlO2-+2H2O]
(3)NaOH溶液;过滤,洗涤;
Al2O3+2OH- ====2AlO2- +H2O
△
====
一、选择题(本题包括6小题,每小题4分,共24分)
1.电解法冶炼铝时,冰晶石所起的作用是( )
A.助熔剂 B.催化剂
C.还原剂 D.氧化剂
【解析】选A。由于Al2O3的熔点很高,很难将其熔化,而加入冰晶石可以降低Al2O3的熔点,减少能耗,所以它所起的作用是助熔剂。
2.向下列溶液中通入过量CO2有沉淀生成的是( )
A.NaAlO2 溶液
B.澄清石灰水
C.CaCl2 溶液
D.硝酸银溶液
【解析】选A。向NaAlO2 溶液中通入CO2后二者发生反应生成Al(OH)3,而Al(OH)3只溶于强酸,不能与CO2发生反应,澄清石灰水中通入过量的CO2时,先生成CaCO3沉淀,而后又溶解生成Ca(HCO3)2,CaCl2 溶液和硝酸银溶液中通入CO2气体不会生成沉淀。
3.下列冶炼金属的反应原理中错误的是( )
A.MgCl2 Mg+Cl2↑
B.CuO+CO Cu+CO2
C.2AlCl3(熔融) 2Al+3Cl2↑
D.2Ag2O 4Ag+O2↑
【解析】选C。由所学知识可知,冶炼铝应为电解Al2O3,而不是电解AlCl3,AlCl3也不是离子化合物,熔融状态下也不导电,所以C不正确。
通电
====
通电
====
高温
====
△
====
4.将表面已经完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A.稀硝酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠
【解析】选C。铝条钝化后表面形成的致密的氧化物保护膜成分为Al2O3,为两性氧化物,既可与酸反应,也可与强碱反应,氧化膜被破坏后,铝可以继续反应,但Cu(NO3)2跟Al2O3不反应。故选C。
5.某溶液既能溶解Al(OH)3,又能使紫色石蕊试液变蓝,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42 -、Cl-、ClO-
C.H+、Mg2+、SO42 -、NO3-
D.Ag+、K+、NO3-、Na+
【解析】选B。由题意可得,既能溶解Al(OH)3,又能使紫
色石蕊试液变蓝,应该是强碱性溶液,在强碱性溶液中不能够共存的离子,A中有HCO3-,C中有H+和Mg2+,D中有Ag+,只有B中没有与OH-反应的离子。
【举一反三】将题干改为:使酚酞试液变红的无色溶液,在该溶液中能大量共存的离子组是
提示:使酚酞试液变红的无色溶液显碱性,与OH-反应的离子不符合题意,A项中的HCO3-、C项中的H+和Mg2+、D项中的Ag+均不可,只有B项符合。
6.(2011·新乡高一检测)在某无色溶液中缓慢滴加NaOH溶液直至过量,产生白色沉淀的质量与加入NaOH溶液的体积关系如图所示,由此确定,原溶液中含有的阳离子是( )
A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
【解析】选B。由图像可知,加入NaOH溶液后,开始时不生成沉淀,说明原溶液中有H+,沉淀部分溶解,说明原溶液中有Al3+,加入过量的NaOH后,仍有沉淀,说明溶液中有不溶于碱的沉淀,由此可得应选B。
【规律方法】解图像题三步曲:“一看”、“二想”、“三判断”
(1)“一看”(看图像)
①看面:弄清纵、横坐标的含义。②看线:弄清线的走向、变化趋势及线的陡与平。③看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、拐点、最高点与最低点等。④看量的变化:弄清是浓度变化、物质的量的变化还是转化率的变化。⑤看要不要作辅助线。
(2)“二想”
看完线后联想该物质所涉及的化学方程式。
(3)“三判断”
通过分析,依据化学方程式,作出正确判断。
二、非选择题(本题包括2小题,共26分)
7.(10分)有一瓶澄清溶液,其中可能有NH4+、CO32-、H+、NO3-、Na+、Cl-、Al3+。
(1)取pH试纸检测,溶液呈强酸性,则可以排除_____的存在。
(2)另取部分溶液逐滴滴加氢氧化钠溶液,使溶液从酸性逐渐变为碱性,反应过程中先产生白色沉淀,后白色沉淀消失,整个过程无气体产生,则溶液中肯定存在的离子是_____,可排除 ________的存在。请写出白色沉淀消失的离子方程式_______________________________________。
(3)另取部分溶液,加入少量金属铜粉,铜粉溶解,且有气泡冒出,则溶液中肯定存在的阴离子是_______________。
【解析】由题意可知,若溶液呈强酸性,说明含有H+,H+与
CO32-反应,所以CO32-不存在;另取部分溶液逐滴滴加氢氧化钠溶液,使溶液从酸性逐渐变为碱性,反应过程中先产生白色沉淀,后白色沉淀消失,整个过程无气体产生,说明溶液中应该有Al3+,没有NH4+生成的白色沉淀应该是Al(OH)3,会与氢氧化钠继续反应;另取部分溶液,加入少量金属铜粉,铜粉溶解,且有气泡冒出,说明原溶液中有NO3-,与H+一起组成稀硝酸,具有强氧化性,能与铜反应,生成气体,据此可得答案。
答案:(1)CO32-
(2)Al3+ NH4+
Al(OH)3+OH-====AlO2-+2H2O
(3)NO3-
8.(16分)已知明矾[KAl(SO4)2·12H2O]在水中可解离出K+、Al3+和SO42-,某学习小组为探究明矾中何种离子起净水作用,做如下实验,请你完成实验报告。
有同学认为以上方案中只是证明了Al2(SO4)3可以净水,K+没有净水作用,但Al3+和SO42-哪种微粒起作用无法证明,不够完善。请你仔细分析以上实验报告并将你完善实验所用的试剂及目的填入下表中:
【解析】由题意可得,该题目是一道实验探究题,该题的意图非常明显,采用了对比实验法,用Al2(SO4)3和KCl做对比实验,验证Al3+有净水作用而K+没有,但不能证明Al2(SO4)3净水就一定是Al3+的作用而不是SO42-的作用,所以要进一步进行下面的对比,选择无SO42-的铝盐和无Al3+的硫酸盐分别实验。
答案:烧杯中的水变澄清 K+不能起净水作用
AlCl3[或Al(NO3)3]
验证Al3+能否净水
Na2SO4
验证SO42-能否净水
