11-12版高中化学课时讲练通配套课件:3.2.2铁、铜的化合物的应用(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:3.2.2铁、铜的化合物的应用(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览



文档简介
(共60张PPT)
1.久置的FeSO4溶液为什么会略显黄色?如何除掉这种黄色?
提示:含Fe2+的溶液久置后容易被空气中的氧气氧化为Fe3+,可向溶液中加入少量的铁粉以除掉这种黄色并防止Fe2+被氧化。
2.工业上制作印刷线路时,通常用FeCl3溶液腐蚀铜板,其原理是什么?
提示:Fe3+具有较强的氧化性,能将铜氧化成Cu2+而洗去,反应的离子方程式是2Fe3++Cu====2Fe2++Cu2+。
3.在用NaOH溶液和FeSO4溶液制备Fe(OH)2时,为什么要将溶液提前加热煮沸?为什么要将胶头滴管插入液面以下?
提示:将溶液加热煮沸是为了除掉溶液中溶解的O2,防止生成的Fe(OH)2迅速被氧化。将胶头滴管插入液面以下也是为了防止生成的Fe(OH)2迅速被氧化。
4.已知Cu2O在酸性条件下可生成Cu2+和Cu,请思考怎样证明某CuO粉末中混有Cu2O?
提示:将粉末用足量的稀硫酸溶解,观察是否有红色的不溶物出现,若有红色沉淀,则说明有Cu2O存在,否则无Cu2O。
【例题】将FeO和Cu(NO3)2的混合物9.08 g全部溶解于含有0.3 mol HCl的某浓度的盐酸中(此时有部分Fe2+被酸性条件下的NO3-氧化:3Fe2++NO3-+4H+====3Fe3++NO↑+2H2O),当向溶液中通入一定量的氯气时,溶液中的Fe2+恰好被完全氧化,再向溶液中加入10 g过量的铁粉,充分反应后,放出标准状况下的氢气224 mL,过滤,得到不溶性固体6.72 g。问:
(1)在原混合物中FeO和Cu(NO3)2的物质的量各是多少?
(2)通入的氯气在标准状况下的体积是多少?
【规范解答】(1)设FeO和Cu(NO3)2的物质的量各是x和y,发生反应的先后顺序为:
FeO+2HCl====FeCl2+H2O
x 2x
3Fe2+ +NO3-+4H+====3Fe3++NO↑+2H2O
6y 2y 8y
亚铁离子与盐酸过量
2Fe2+ + Cl2====2Fe3++2Cl-
x-6y 0.5(x-6y)
2Fe3++Fe====3Fe2+
x 0.5x
Cu2++Fe====Cu+Fe2+
y y
Fe + 2HCl====FeCl2+H2↑
0.01 mol 0.02 mol 0.01 mol
72x+188y=9.08
根据HCl守恒:2x+8y+0.02=0.3
解之得:x=0.1 mol y=0.01 mol
(2)消耗氯气的体积为
0.5(x-6y)×22.4 L/mol=0.448 L
答案:(1)FeO:0.1 mol Cu(NO3)2:0.01 mol
(2)0.448 L
【互动探究】若不引进其他杂质,将Fe2+氧化为Fe3+最好的试剂是什么?
提示:一般情况下,是H2O2,如果是FeCl2则最好的是Cl2或氯水。
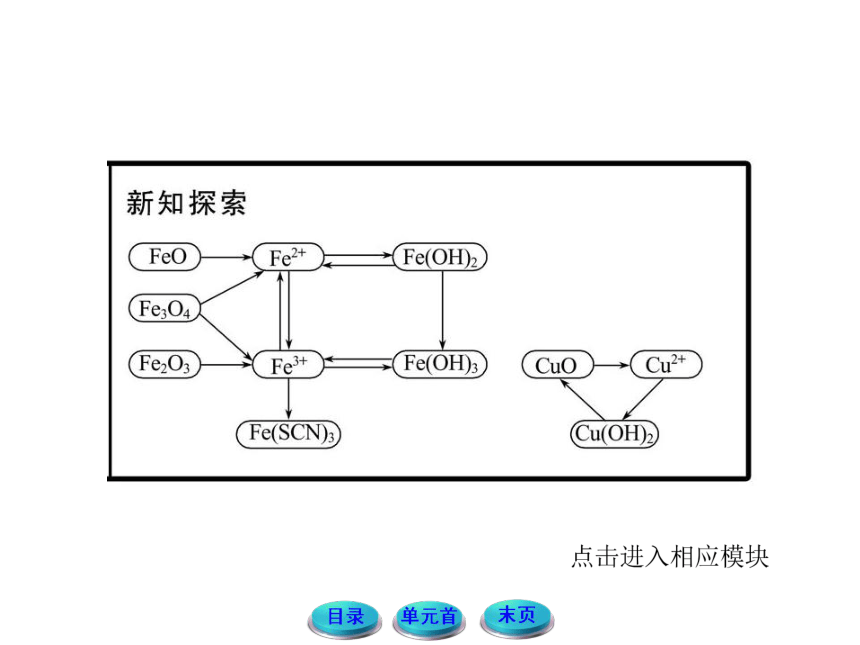
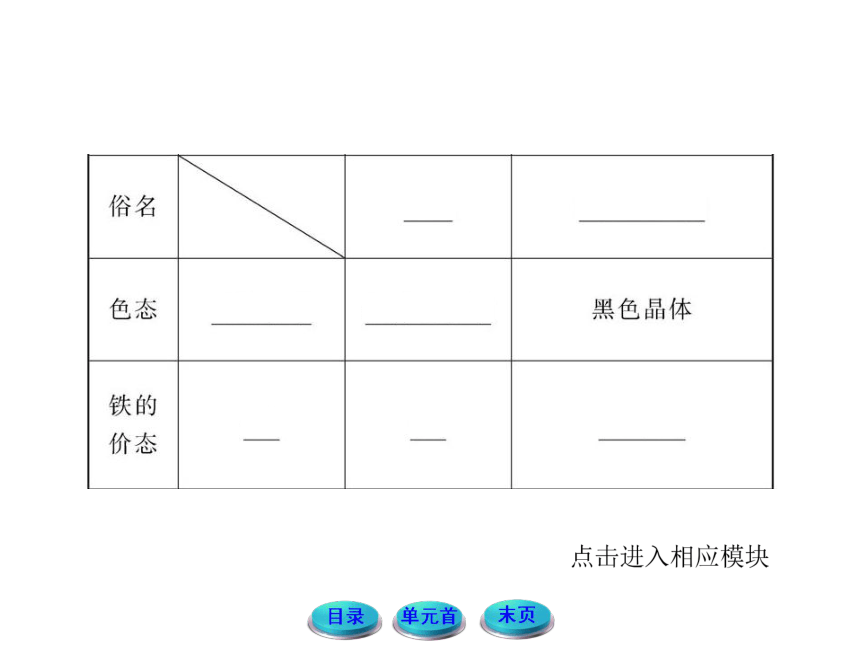
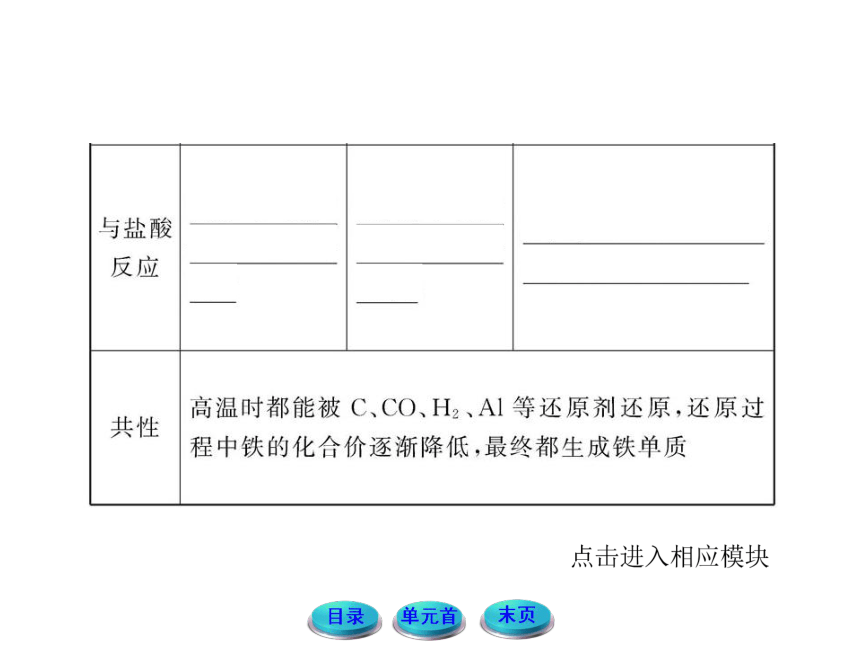
铁常见的三种价态的变化规律
铁常见的价态有0价、+2价和+3价三种价态
(1)Fe→Fe2+
Fe只有还原性,遇到一些弱氧化剂时会被氧化至+2价,如I2、S、Fe3+、Cu2+、H+等。
(2)Fe→Fe3+
Fe在一定条件下能被氧化到+3价,但所需要的氧化剂的氧化性比较强,如Cl2、Br2、足量稀硝酸、高锰酸钾等。
(3)Fe2+→Fe3+
当Fe2+遇到强氧化剂时,就会被氧化到+3价,如Cl2、Br2、足量稀硝酸、高锰酸钾等。
(4)Fe3+→Fe
Fe3+具有较强的氧化性,当遇到一些强还原剂时,会被还原至0价,如C、CO、Zn、Al等。
(5)Fe3+→Fe2+
当Fe3+遇到一些弱还原剂时,也会被还原到+2价,如Cu、Fe、I-等。
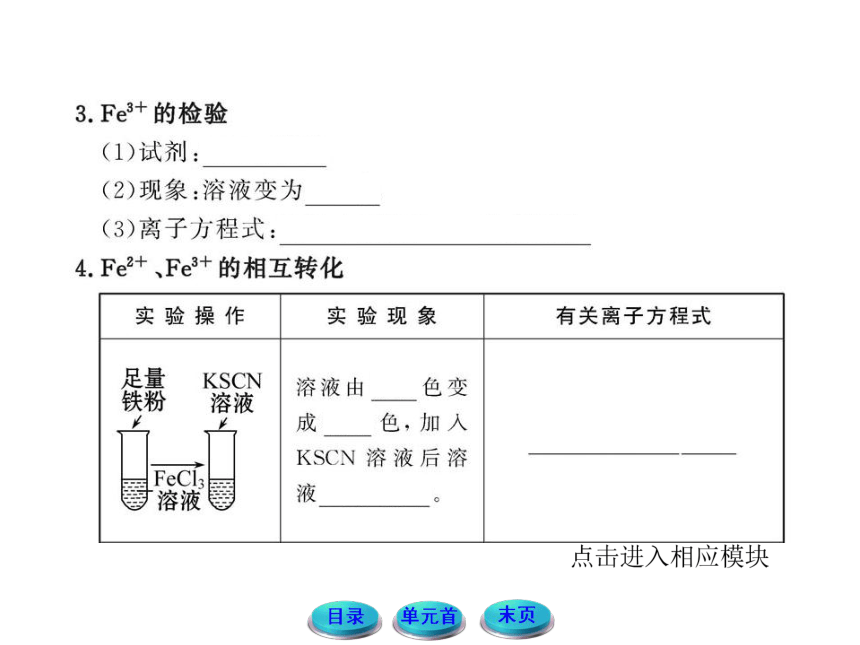
Fe2+、Fe3+的检验
Fe2+和Fe3+可以相互转化,在科学研究、生产活动中,人们常常遇到Fe2+、Fe3+的检验问题。
探究:
1.能否根据Fe2+和Fe3+颜色上的差异,鉴别Fe2+和Fe3+?
提示:含Fe2+的溶液呈浅绿色;含Fe3+的溶液呈黄色;用观察溶液颜色的方法即可鉴别Fe2+和Fe3+。
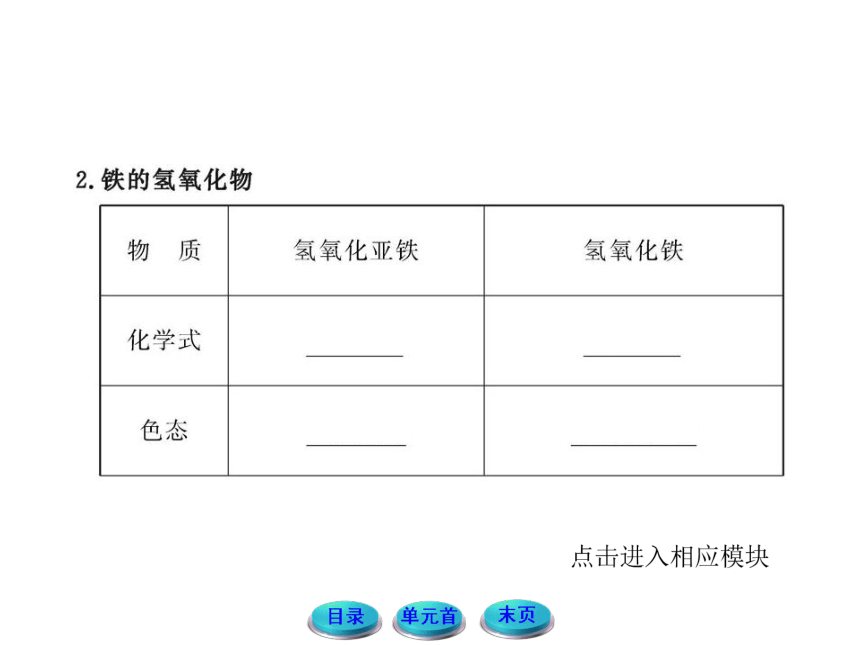
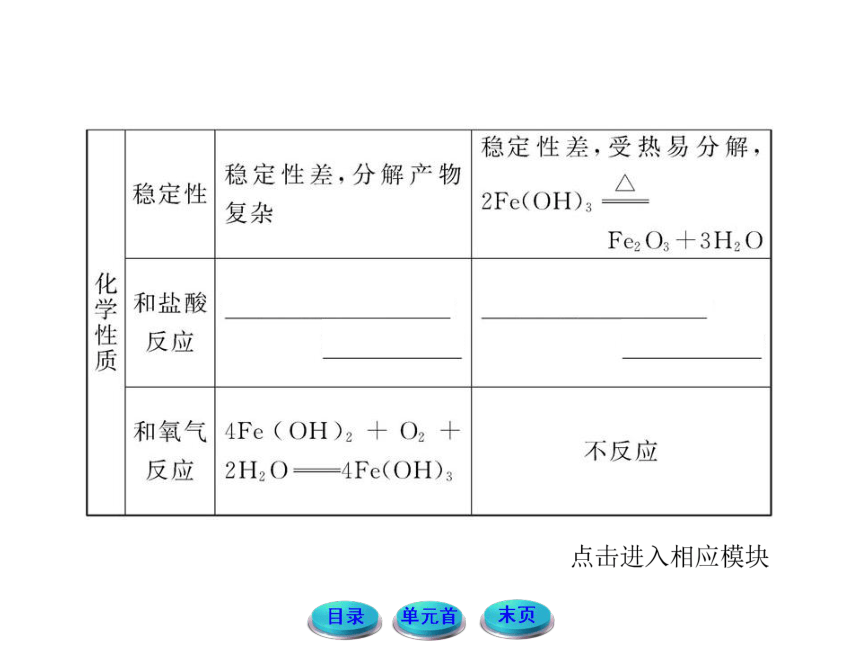
2.已知Fe(OH)2为白色固体,Fe(OH)3为红褐色固体,请思考:能否利用两种氢氧化物的颜色差异来鉴别Fe2+和Fe3+,应怎样操作?
提示:Fe2+的检验:向待检液中滴加NaOH溶液或氨水,产生白色絮状沉淀,露置在空气中一段时间后,沉淀变为灰绿色,最后变为红褐色,说明含Fe2+(适宜浓度较大的溶液)。
方程式:Fe2++2OH-====Fe(OH)2↓或
Fe2++2NH3 H2O====Fe(OH)2↓+2NH4+,4Fe(OH)2+O2+2H2O====4Fe(OH)3。
Fe3+的检验:向待检液中滴加NaOH溶液或氨水,产生红褐色沉淀,说明含Fe3+。
方程式:Fe3++3OH-====Fe(OH)3↓(红褐色)或Fe3++3NH3 H2O====Fe(OH)3↓+3NH4+。
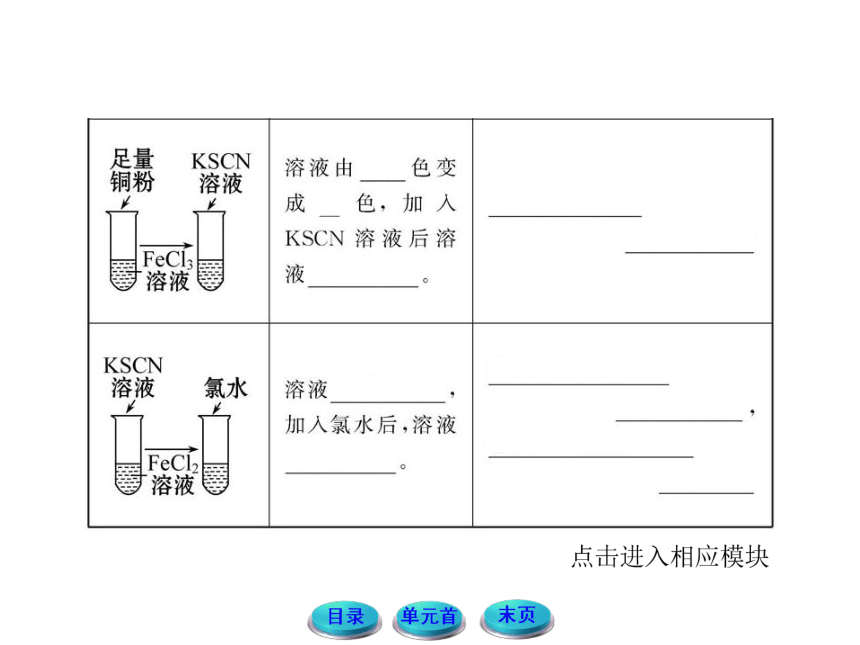
3.如何利用KSCN溶液鉴别Fe2+和Fe3+?
提示:Fe2+的检验:向待检液中先滴加KSCN溶液,无变化,再滴加新制的氯水,溶液显血红色,说明含Fe2+。有关的离子方程式为:
2Fe2++Cl2 ==== 2Fe3++2Cl-
Fe3++3SCN- ==== Fe(SCN)3(适宜一般溶液)。
Fe3+的检验:向待检液中滴加KSCN溶液,溶液呈血红色,说明含Fe3+。有关的离子方程式为:
Fe3++3SCN- ==== Fe(SCN)3
1.录音磁带是在醋酸纤维、聚酯纤维等纤维制成的片基上,均匀地涂上一层磁性材料——磁粉。制取磁粉的主要物质是( )
A.Fe2O3 B.Fe3O4
C.FeO D.Al2O3
【解析】选B。Fe3O4俗称磁性氧化铁,是磁铁矿的主要成分,可以作磁性材料。
2.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )
A.锌粉 B.镁粉
C.铁粉 D.铝粉
【解析】选C。加入锌粉、镁粉、铝粉会在溶液中增加Zn2+、Mg2+、Al3+等杂质离子。加入铁粉,发生如下反应:Fe2(SO4)3+Fe====3FeSO4、CuSO4+Fe====FeSO4+Cu,所以可以将杂质除去。
3.某溶液中,加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为血红色,说明原溶液中一定有( )
A.Fe3+ B.Fe2+
C.Cu2+ D.Zn2+
【解析】选B。由题意可得,加入KSCN溶液无明显现象,说明原溶液中无Fe3+,但加入氯水,溶液立即变为血红色,则说明溶液中又有了Fe3+,也就是说,原溶液中一定有Fe2+。
4.写出下列除杂所用试剂的化学式及反应的离子方程式。
(1)除去FeCl2溶液中的FeCl3,可加入_____,离子方程式为_____________________________。
(2)除去FeCl3溶液中的FeCl2,可加入_____,离子方程式为______________________________。
(3)除去FeCl2溶液中的CuCl2,可加入_____,离子方程式为________________________________。
【解析】由题意可知,除杂要根据主体物质和杂质的性质,将杂质除去。
答案:(1)铁粉 2Fe3++Fe====3Fe2+
(2)氯水(或通入Cl2) 2Fe2++Cl2====2Fe3++2Cl-
(3)铁粉 Fe+Cu2+====Fe2++Cu
5.(2011·莆田高一检测)为了“探究铁及其化合物的氧化性或还原性”,某同学甲设计了如下的实验方案。[已知H2O2中O的价态为-1价(为中间价态)具有很强的氧化性]。
(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是:_____________________。
(2)甲同学欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。
①若甲同学计划在0.1 mol·L-1 FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应是:_____(写离子方程式),现象是:溶液由浅绿色变为___色。
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选上述试剂中____滴入甲同学所得的混合液中,并通过_____现象,证明甲同学的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,甲同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为:______________________________。
【解析】(1)Fe2+中铁元素的化合价处于中间价态。
(2)①氯水中的氯气将FeCl2溶液中的Fe2+氧化成Fe3+。
②Fe3+一般用KSCN溶液检验,溶液呈血红色即可证明溶液中Fe3+的存在。③由题意,铜片与FeCl2溶液不反应,锌粒可与FeCl2溶液反应,再由还原剂的还原性大于还原产物的还原性即可得出结论。
答案:(1)因为Fe2+中铁元素的化合价处于中间价态,可以升高也可以降低
(2)①Cl2+2Fe2+====2Cl-+2Fe3+ 棕黄
②KSCN溶液 溶液呈血红色 ③Zn>Fe>Cu
一、选择题(本题包括6小题,每小题4分,共24分)
1.某工厂排放的酸性废水中含有较多的Cu2+,对农作物和人畜都有害,欲采用化学法除去有害成分,最好是加入下列物质中的( )
A.食盐、硫酸 B.胆矾、石灰水
C.铁粉、生石灰 D.苏打、盐酸
【解析】选C。A无法除去铜离子;B浪费胆矾;C可除去铜离子,又可以回收铜,C项正确;D无法除去铜离子。
2.某500 mL溶液中含0.1 mol Fe2+和0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全被还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A.0.4 mol·L-1 B.0.6 mol·L-1
C.0.8 mol·L-1 D.1.0 mol·L-1
【解析】选C。由题意可知,会发生2Fe3++Fe====3Fe2+的反应,则可得,0.2 mol Fe3+只能反应掉0.1 mol Fe,生成0.3 mol Fe2+,加上原有的0.1 mol Fe2+,反应完后溶液中共有Fe2+ 0.4 mol,则可得浓度为0.8mol·L-1。
3.向铁和Fe2O3的混合物中加入足量稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为4∶1时,反应中关系量正确的是( )
A.被氧化的铁与被还原的铁离子物质的量之比为1∶1
B.被氧化的铁与被还原的铁离子物质的量之比为2∶1
C.被氧化的铁与被还原的铁离子物质的量之比为1∶2
D.被氧化的铁与被还原的铁离子物质的量之比为1∶3
【解析】选A。由题意可知,加入足量稀硫酸后,会发生以下两个反应:Fe+2H+====Fe2++H2↑和2Fe3++Fe====3Fe2+。则由于生成的Fe2+和H2的物质的量之比为4∶1,那么,说明生成的H2为1 mol时,生成的Fe2+为4 mol,而对应H2所生成的Fe2+为1 mol,则铁与Fe3+反应所生成的Fe2+为3 mol,由反应所消耗的量可知,被氧化的铁和被还原的铁离子的物质的量之比应该为1∶1,即选A。
【举一反三】若将题目改为Fe、FeO和Fe2O3的混合物加入足量稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为4∶1时,被氧化的Fe和被还原的Fe3+的物质的量之比是?
提示:由题意可得,加不加FeO对这个题没有影响,故选A。
4.(双选)某溶液中有NH4+、Cu2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
A.Cu2+ B.NH4+ C.Al3+ D.Fe2+
【解析】选B、D。经过两次反应后Cu2+的量没有改变,A错误;微热时,氨气逸出,NH4+的量减少,B正确;经过两次反应后Al3+的量没有改变,C错误;微热时,氢氧化亚铁被氧化为氢氧化铁,和盐酸反应后生成Fe3+,所以Fe2+的量减少,D正确。
5.用足量CO还原32 g某种氧化物,将生成的气体通入足量的澄清石灰水中,得到60 g沉淀,则该氧化物是( )
A.FeO B.Fe2O3 C.CuO D.Cu2O
【解析】选B。此题可用原子守恒法来解。CO被氧化为CO2,增加的氧原子全部来自于金属氧化物,则n(O)=n(CO2)=n(CaCO3)= 则金属氧化物中金属的质量为32 g-0.6 mol×16 g·mol-1=22.4 g,也就得出,符合题意的只有B。
6.为确定下列置于空气中的物质是否变质,所选检验试剂
(括号内的物质)不能达到目的的是( )
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.HClO溶液(石蕊试液)
【解析】选A。Na2SO3 Na2SO4,遇到BaCl2均产生沉
淀,无法检验;FeCl2 FeCl3遇KSCN显血红色,可以
检验;KI I2,使淀粉变蓝色,可以检验;HClO
HCl,遇石蕊只变红不褪色,可以检验。
变质
变质
变质
变质
【规律方法】Fe2+和Fe3+在一些离子反应和离子共存中要注意的问题
一些离子反应和离子共存问题经常遇到Fe2+和Fe3+,它与很多离子之间易发生反应,生成沉淀,但Fe2+的还原性和Fe3+的氧化性很容易被人忘记,如Fe2+与H+、 NO3-在一起还有ClO-等一些强氧化性的离子,Fe3+和S2-、I-等之间也会发生氧化还原反应,有很多同学不注意这个问题,导致做题容易出错,还有SO32-也要注意,与Fe3+也会发生氧化还原反应。
二、非选择题(本题包括2小题,共26分)
7.(12分)(2011·广州高一检测)某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,得到了铁红、Al2O3和金属Cu,回答下列问题:
(1)固体A的成分是_____。(用化学式表示)
(2)写出B→D的离子方程式_____;该反应中氧化剂是_____;2 mol Cl2参加反应转移电子是_____mol。溶液D中滴加KSCN溶液的现象是________。
(3)溶液E焰色反应呈黄色,试剂H是__________(用化学式表示);D→E反应的离子方程式是__________。
(4)分别写出铁红和氧化铝在工业上的一种主要用途:铁红______;氧化铝______。
【解析】(1)加入废铁屑后发生如下反应:Fe+Cu2+ ==== Cu+Fe2+,又由于铁屑过量,所以固体A的成分为Fe和Cu。(2)溶液B中含有Fe2+、Al3+,加入足量氯水的目的是将Fe2+氧化为Fe3+;Cl2作为氧化剂参加反应,由0价变为-1价,所以2 mol Cl2转移电子为4 mol;溶液D中含有Fe3+,滴加KSCN溶液变血红色。(3)焰色反应呈黄色,说明溶液E中含有Na+,溶液H为NaOH溶液。D→E反应的离子方程式为Al3++4OH- ====AlO2-+2H2O。
答案:(1)Fe、Cu
(2)2Fe2++Cl2 ==== 2Fe3++2Cl- Cl2 4 溶液变血红色
(3)NaOH Al3++4OH- ==== AlO2-+2H2O
(4)红色油漆或涂料等 耐火材料
8.(14分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1的盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是__________。
(3)③中所发生的各反应的离子方程式是___________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为_____,c(Fe2+)为_____。
【解析】由题意可得,MgO和Fe2O3组成的混合物进行铝热反应,只有Fe2O3能反应,生成Fe,所以B是铁;而将A加入盐酸后再加Fe有气体生成,说明酸过量,MgO和Fe2O3会全部与盐酸反应,加入铁后有剩余,则说明Fe3+和H+已全部与铁反应,由题意,生成1.12 L H2后,Fe还有剩余,说明盐酸与混合物反应后,剩余的H+为0.1 mol,反应掉0.8 mol,由反应:MgO+2H+====Mg2++H2O;Fe2O3+6H+====2Fe3++3H2O可得。
设混合物中,MgO的物质的量为x,Fe2O3的物质的量为y,则可得出:
2x+6y=0.8 mol,40 g·mol-1·x+160 g·mol-1·y=20 g,
解之得x=y=0.1 mol,也就得出最后的溶液中,Mg2+的浓度为0.1/0.15=2/3(mol·L-1),剩余的氯离子全部与Fe2+结合,为0.7 mol,则得出Fe2+为0.35 mol,浓度为0.35/0.15=7/3(mol·L-1)。
答案:(1)铁
(2)MgO+2HCl====MgCl2+H2O、
Fe2O3+6HCl2====FeCl3+3H2O
(3)2Fe3++Fe====3Fe2+、Fe+2H+====Fe2++H2↑
(4)2/3 mol·L-1 7/3 mol·L-1
1.久置的FeSO4溶液为什么会略显黄色?如何除掉这种黄色?
提示:含Fe2+的溶液久置后容易被空气中的氧气氧化为Fe3+,可向溶液中加入少量的铁粉以除掉这种黄色并防止Fe2+被氧化。
2.工业上制作印刷线路时,通常用FeCl3溶液腐蚀铜板,其原理是什么?
提示:Fe3+具有较强的氧化性,能将铜氧化成Cu2+而洗去,反应的离子方程式是2Fe3++Cu====2Fe2++Cu2+。
3.在用NaOH溶液和FeSO4溶液制备Fe(OH)2时,为什么要将溶液提前加热煮沸?为什么要将胶头滴管插入液面以下?
提示:将溶液加热煮沸是为了除掉溶液中溶解的O2,防止生成的Fe(OH)2迅速被氧化。将胶头滴管插入液面以下也是为了防止生成的Fe(OH)2迅速被氧化。
4.已知Cu2O在酸性条件下可生成Cu2+和Cu,请思考怎样证明某CuO粉末中混有Cu2O?
提示:将粉末用足量的稀硫酸溶解,观察是否有红色的不溶物出现,若有红色沉淀,则说明有Cu2O存在,否则无Cu2O。
【例题】将FeO和Cu(NO3)2的混合物9.08 g全部溶解于含有0.3 mol HCl的某浓度的盐酸中(此时有部分Fe2+被酸性条件下的NO3-氧化:3Fe2++NO3-+4H+====3Fe3++NO↑+2H2O),当向溶液中通入一定量的氯气时,溶液中的Fe2+恰好被完全氧化,再向溶液中加入10 g过量的铁粉,充分反应后,放出标准状况下的氢气224 mL,过滤,得到不溶性固体6.72 g。问:
(1)在原混合物中FeO和Cu(NO3)2的物质的量各是多少?
(2)通入的氯气在标准状况下的体积是多少?
【规范解答】(1)设FeO和Cu(NO3)2的物质的量各是x和y,发生反应的先后顺序为:
FeO+2HCl====FeCl2+H2O
x 2x
3Fe2+ +NO3-+4H+====3Fe3++NO↑+2H2O
6y 2y 8y
亚铁离子与盐酸过量
2Fe2+ + Cl2====2Fe3++2Cl-
x-6y 0.5(x-6y)
2Fe3++Fe====3Fe2+
x 0.5x
Cu2++Fe====Cu+Fe2+
y y
Fe + 2HCl====FeCl2+H2↑
0.01 mol 0.02 mol 0.01 mol
72x+188y=9.08
根据HCl守恒:2x+8y+0.02=0.3
解之得:x=0.1 mol y=0.01 mol
(2)消耗氯气的体积为
0.5(x-6y)×22.4 L/mol=0.448 L
答案:(1)FeO:0.1 mol Cu(NO3)2:0.01 mol
(2)0.448 L
【互动探究】若不引进其他杂质,将Fe2+氧化为Fe3+最好的试剂是什么?
提示:一般情况下,是H2O2,如果是FeCl2则最好的是Cl2或氯水。
铁常见的三种价态的变化规律
铁常见的价态有0价、+2价和+3价三种价态
(1)Fe→Fe2+
Fe只有还原性,遇到一些弱氧化剂时会被氧化至+2价,如I2、S、Fe3+、Cu2+、H+等。
(2)Fe→Fe3+
Fe在一定条件下能被氧化到+3价,但所需要的氧化剂的氧化性比较强,如Cl2、Br2、足量稀硝酸、高锰酸钾等。
(3)Fe2+→Fe3+
当Fe2+遇到强氧化剂时,就会被氧化到+3价,如Cl2、Br2、足量稀硝酸、高锰酸钾等。
(4)Fe3+→Fe
Fe3+具有较强的氧化性,当遇到一些强还原剂时,会被还原至0价,如C、CO、Zn、Al等。
(5)Fe3+→Fe2+
当Fe3+遇到一些弱还原剂时,也会被还原到+2价,如Cu、Fe、I-等。
Fe2+、Fe3+的检验
Fe2+和Fe3+可以相互转化,在科学研究、生产活动中,人们常常遇到Fe2+、Fe3+的检验问题。
探究:
1.能否根据Fe2+和Fe3+颜色上的差异,鉴别Fe2+和Fe3+?
提示:含Fe2+的溶液呈浅绿色;含Fe3+的溶液呈黄色;用观察溶液颜色的方法即可鉴别Fe2+和Fe3+。
2.已知Fe(OH)2为白色固体,Fe(OH)3为红褐色固体,请思考:能否利用两种氢氧化物的颜色差异来鉴别Fe2+和Fe3+,应怎样操作?
提示:Fe2+的检验:向待检液中滴加NaOH溶液或氨水,产生白色絮状沉淀,露置在空气中一段时间后,沉淀变为灰绿色,最后变为红褐色,说明含Fe2+(适宜浓度较大的溶液)。
方程式:Fe2++2OH-====Fe(OH)2↓或
Fe2++2NH3 H2O====Fe(OH)2↓+2NH4+,4Fe(OH)2+O2+2H2O====4Fe(OH)3。
Fe3+的检验:向待检液中滴加NaOH溶液或氨水,产生红褐色沉淀,说明含Fe3+。
方程式:Fe3++3OH-====Fe(OH)3↓(红褐色)或Fe3++3NH3 H2O====Fe(OH)3↓+3NH4+。
3.如何利用KSCN溶液鉴别Fe2+和Fe3+?
提示:Fe2+的检验:向待检液中先滴加KSCN溶液,无变化,再滴加新制的氯水,溶液显血红色,说明含Fe2+。有关的离子方程式为:
2Fe2++Cl2 ==== 2Fe3++2Cl-
Fe3++3SCN- ==== Fe(SCN)3(适宜一般溶液)。
Fe3+的检验:向待检液中滴加KSCN溶液,溶液呈血红色,说明含Fe3+。有关的离子方程式为:
Fe3++3SCN- ==== Fe(SCN)3
1.录音磁带是在醋酸纤维、聚酯纤维等纤维制成的片基上,均匀地涂上一层磁性材料——磁粉。制取磁粉的主要物质是( )
A.Fe2O3 B.Fe3O4
C.FeO D.Al2O3
【解析】选B。Fe3O4俗称磁性氧化铁,是磁铁矿的主要成分,可以作磁性材料。
2.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )
A.锌粉 B.镁粉
C.铁粉 D.铝粉
【解析】选C。加入锌粉、镁粉、铝粉会在溶液中增加Zn2+、Mg2+、Al3+等杂质离子。加入铁粉,发生如下反应:Fe2(SO4)3+Fe====3FeSO4、CuSO4+Fe====FeSO4+Cu,所以可以将杂质除去。
3.某溶液中,加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为血红色,说明原溶液中一定有( )
A.Fe3+ B.Fe2+
C.Cu2+ D.Zn2+
【解析】选B。由题意可得,加入KSCN溶液无明显现象,说明原溶液中无Fe3+,但加入氯水,溶液立即变为血红色,则说明溶液中又有了Fe3+,也就是说,原溶液中一定有Fe2+。
4.写出下列除杂所用试剂的化学式及反应的离子方程式。
(1)除去FeCl2溶液中的FeCl3,可加入_____,离子方程式为_____________________________。
(2)除去FeCl3溶液中的FeCl2,可加入_____,离子方程式为______________________________。
(3)除去FeCl2溶液中的CuCl2,可加入_____,离子方程式为________________________________。
【解析】由题意可知,除杂要根据主体物质和杂质的性质,将杂质除去。
答案:(1)铁粉 2Fe3++Fe====3Fe2+
(2)氯水(或通入Cl2) 2Fe2++Cl2====2Fe3++2Cl-
(3)铁粉 Fe+Cu2+====Fe2++Cu
5.(2011·莆田高一检测)为了“探究铁及其化合物的氧化性或还原性”,某同学甲设计了如下的实验方案。[已知H2O2中O的价态为-1价(为中间价态)具有很强的氧化性]。
(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是:_____________________。
(2)甲同学欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。
①若甲同学计划在0.1 mol·L-1 FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应是:_____(写离子方程式),现象是:溶液由浅绿色变为___色。
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选上述试剂中____滴入甲同学所得的混合液中,并通过_____现象,证明甲同学的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,甲同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为:______________________________。
【解析】(1)Fe2+中铁元素的化合价处于中间价态。
(2)①氯水中的氯气将FeCl2溶液中的Fe2+氧化成Fe3+。
②Fe3+一般用KSCN溶液检验,溶液呈血红色即可证明溶液中Fe3+的存在。③由题意,铜片与FeCl2溶液不反应,锌粒可与FeCl2溶液反应,再由还原剂的还原性大于还原产物的还原性即可得出结论。
答案:(1)因为Fe2+中铁元素的化合价处于中间价态,可以升高也可以降低
(2)①Cl2+2Fe2+====2Cl-+2Fe3+ 棕黄
②KSCN溶液 溶液呈血红色 ③Zn>Fe>Cu
一、选择题(本题包括6小题,每小题4分,共24分)
1.某工厂排放的酸性废水中含有较多的Cu2+,对农作物和人畜都有害,欲采用化学法除去有害成分,最好是加入下列物质中的( )
A.食盐、硫酸 B.胆矾、石灰水
C.铁粉、生石灰 D.苏打、盐酸
【解析】选C。A无法除去铜离子;B浪费胆矾;C可除去铜离子,又可以回收铜,C项正确;D无法除去铜离子。
2.某500 mL溶液中含0.1 mol Fe2+和0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全被还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A.0.4 mol·L-1 B.0.6 mol·L-1
C.0.8 mol·L-1 D.1.0 mol·L-1
【解析】选C。由题意可知,会发生2Fe3++Fe====3Fe2+的反应,则可得,0.2 mol Fe3+只能反应掉0.1 mol Fe,生成0.3 mol Fe2+,加上原有的0.1 mol Fe2+,反应完后溶液中共有Fe2+ 0.4 mol,则可得浓度为0.8mol·L-1。
3.向铁和Fe2O3的混合物中加入足量稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为4∶1时,反应中关系量正确的是( )
A.被氧化的铁与被还原的铁离子物质的量之比为1∶1
B.被氧化的铁与被还原的铁离子物质的量之比为2∶1
C.被氧化的铁与被还原的铁离子物质的量之比为1∶2
D.被氧化的铁与被还原的铁离子物质的量之比为1∶3
【解析】选A。由题意可知,加入足量稀硫酸后,会发生以下两个反应:Fe+2H+====Fe2++H2↑和2Fe3++Fe====3Fe2+。则由于生成的Fe2+和H2的物质的量之比为4∶1,那么,说明生成的H2为1 mol时,生成的Fe2+为4 mol,而对应H2所生成的Fe2+为1 mol,则铁与Fe3+反应所生成的Fe2+为3 mol,由反应所消耗的量可知,被氧化的铁和被还原的铁离子的物质的量之比应该为1∶1,即选A。
【举一反三】若将题目改为Fe、FeO和Fe2O3的混合物加入足量稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为4∶1时,被氧化的Fe和被还原的Fe3+的物质的量之比是?
提示:由题意可得,加不加FeO对这个题没有影响,故选A。
4.(双选)某溶液中有NH4+、Cu2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
A.Cu2+ B.NH4+ C.Al3+ D.Fe2+
【解析】选B、D。经过两次反应后Cu2+的量没有改变,A错误;微热时,氨气逸出,NH4+的量减少,B正确;经过两次反应后Al3+的量没有改变,C错误;微热时,氢氧化亚铁被氧化为氢氧化铁,和盐酸反应后生成Fe3+,所以Fe2+的量减少,D正确。
5.用足量CO还原32 g某种氧化物,将生成的气体通入足量的澄清石灰水中,得到60 g沉淀,则该氧化物是( )
A.FeO B.Fe2O3 C.CuO D.Cu2O
【解析】选B。此题可用原子守恒法来解。CO被氧化为CO2,增加的氧原子全部来自于金属氧化物,则n(O)=n(CO2)=n(CaCO3)= 则金属氧化物中金属的质量为32 g-0.6 mol×16 g·mol-1=22.4 g,也就得出,符合题意的只有B。
6.为确定下列置于空气中的物质是否变质,所选检验试剂
(括号内的物质)不能达到目的的是( )
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.HClO溶液(石蕊试液)
【解析】选A。Na2SO3 Na2SO4,遇到BaCl2均产生沉
淀,无法检验;FeCl2 FeCl3遇KSCN显血红色,可以
检验;KI I2,使淀粉变蓝色,可以检验;HClO
HCl,遇石蕊只变红不褪色,可以检验。
变质
变质
变质
变质
【规律方法】Fe2+和Fe3+在一些离子反应和离子共存中要注意的问题
一些离子反应和离子共存问题经常遇到Fe2+和Fe3+,它与很多离子之间易发生反应,生成沉淀,但Fe2+的还原性和Fe3+的氧化性很容易被人忘记,如Fe2+与H+、 NO3-在一起还有ClO-等一些强氧化性的离子,Fe3+和S2-、I-等之间也会发生氧化还原反应,有很多同学不注意这个问题,导致做题容易出错,还有SO32-也要注意,与Fe3+也会发生氧化还原反应。
二、非选择题(本题包括2小题,共26分)
7.(12分)(2011·广州高一检测)某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,得到了铁红、Al2O3和金属Cu,回答下列问题:
(1)固体A的成分是_____。(用化学式表示)
(2)写出B→D的离子方程式_____;该反应中氧化剂是_____;2 mol Cl2参加反应转移电子是_____mol。溶液D中滴加KSCN溶液的现象是________。
(3)溶液E焰色反应呈黄色,试剂H是__________(用化学式表示);D→E反应的离子方程式是__________。
(4)分别写出铁红和氧化铝在工业上的一种主要用途:铁红______;氧化铝______。
【解析】(1)加入废铁屑后发生如下反应:Fe+Cu2+ ==== Cu+Fe2+,又由于铁屑过量,所以固体A的成分为Fe和Cu。(2)溶液B中含有Fe2+、Al3+,加入足量氯水的目的是将Fe2+氧化为Fe3+;Cl2作为氧化剂参加反应,由0价变为-1价,所以2 mol Cl2转移电子为4 mol;溶液D中含有Fe3+,滴加KSCN溶液变血红色。(3)焰色反应呈黄色,说明溶液E中含有Na+,溶液H为NaOH溶液。D→E反应的离子方程式为Al3++4OH- ====AlO2-+2H2O。
答案:(1)Fe、Cu
(2)2Fe2++Cl2 ==== 2Fe3++2Cl- Cl2 4 溶液变血红色
(3)NaOH Al3++4OH- ==== AlO2-+2H2O
(4)红色油漆或涂料等 耐火材料
8.(14分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1的盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是__________。
(3)③中所发生的各反应的离子方程式是___________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为_____,c(Fe2+)为_____。
【解析】由题意可得,MgO和Fe2O3组成的混合物进行铝热反应,只有Fe2O3能反应,生成Fe,所以B是铁;而将A加入盐酸后再加Fe有气体生成,说明酸过量,MgO和Fe2O3会全部与盐酸反应,加入铁后有剩余,则说明Fe3+和H+已全部与铁反应,由题意,生成1.12 L H2后,Fe还有剩余,说明盐酸与混合物反应后,剩余的H+为0.1 mol,反应掉0.8 mol,由反应:MgO+2H+====Mg2++H2O;Fe2O3+6H+====2Fe3++3H2O可得。
设混合物中,MgO的物质的量为x,Fe2O3的物质的量为y,则可得出:
2x+6y=0.8 mol,40 g·mol-1·x+160 g·mol-1·y=20 g,
解之得x=y=0.1 mol,也就得出最后的溶液中,Mg2+的浓度为0.1/0.15=2/3(mol·L-1),剩余的氯离子全部与Fe2+结合,为0.7 mol,则得出Fe2+为0.35 mol,浓度为0.35/0.15=7/3(mol·L-1)。
答案:(1)铁
(2)MgO+2HCl====MgCl2+H2O、
Fe2O3+6HCl2====FeCl3+3H2O
(3)2Fe3++Fe====3Fe2+、Fe+2H+====Fe2++H2↑
(4)2/3 mol·L-1 7/3 mol·L-1
