11-12版高中化学课时讲练通配套课件:3.2.1从自然界获取铁和铜 铁和铜的应用(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:3.2.1从自然界获取铁和铜 铁和铜的应用(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览








文档简介
(共82张PPT)
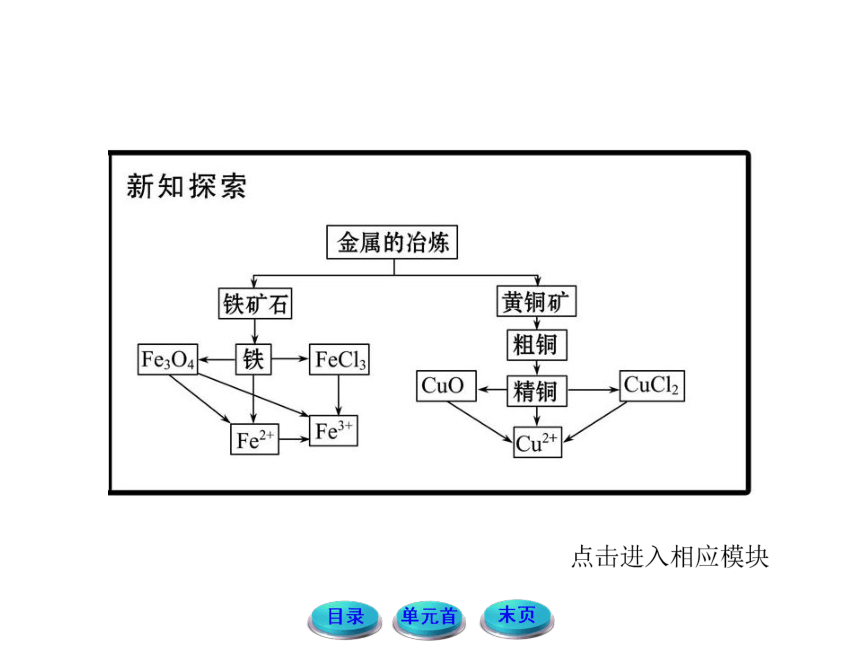
1.为什么在人类历史上会先出现青铜器时代而后出现铁器时代?
提示:由于铁比铜活泼,需要比较严格的条件和较高的温度才能将其从化合物中还原出来,也就是说,铁比铜难于冶炼,所以使用的历史比铜短。
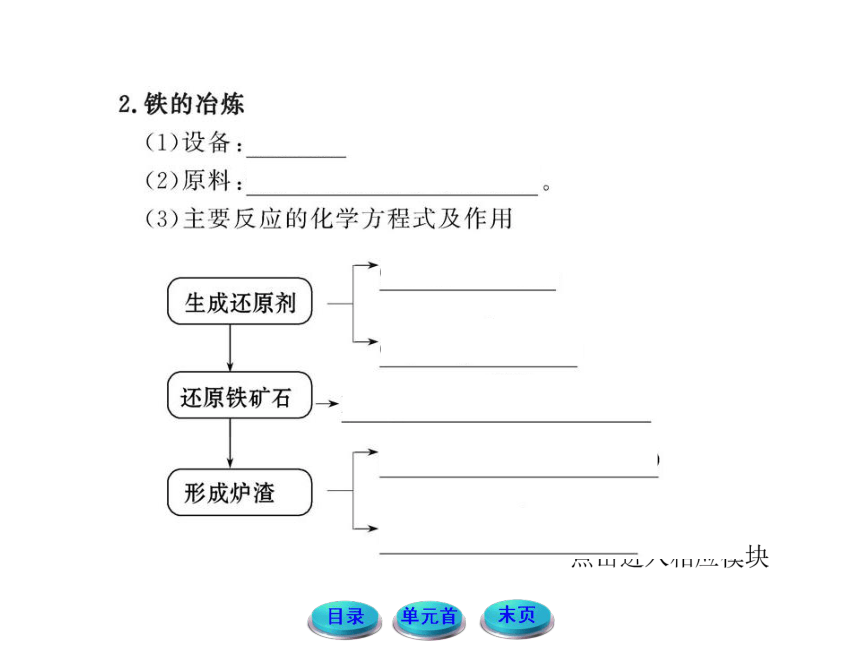
2.请结合工业炼铁的过程,思考并交流以下几个问题:
(1)焦炭也是很好的还原剂,那为什么在冶炼铁时,不直接用焦炭做还原剂来还原铁的氧化物?
提示:工业炼铁不用焦炭做还原剂是因为焦炭是固体,与铁矿石接触的面积有限,很难充分发生化学反应,而CO是气体,与铁矿石的接触面积很大,提高了反应速率和原料的利用率。
(2)铁矿石是如何被还原的?
提示:在炼铁高炉内部,先是C燃烧放出大量的热,并在高温条件下,使C与生成的CO2反应生成CO,在较高的温度下,铁矿石中的Fe2O3与CO反应生成铁单质,铁元素被还原。
(3)在炼铁的过程中,石灰石的作用是什么?
提示:石灰石的作用是除掉铁矿石中的杂质SiO2。
例1 冶炼金属一般有下列方法:①焦炭法 ②水煤气(或氢气,或一氧化碳)法 ③活泼金属置换法 ④电解法,这四种方法在工业上均有应用。
(1)请对下表中的金属冶炼方法进行分析,从上述四种方法中选择相应的序号填入表格中的空格中:
(2)请再列举出使用上述方法冶炼金属的例子各一个(用化学方程式表示):
①______________________________________________
②______________________________________________
③______________________________________________
④______________________________________________
(3)在工业炼铁的过程中,焦炭的作用是____________。
【规范解答】(1)火烧孔雀石炼铜是用C还原孔雀石分解得到的CuO,故选①;湿法炼铜和铝热法炼铬都是利用活泼金属置换较不活泼的金属,故选③;而光卤石炼镁的反应为MgCl2 Mg+Cl2↑,故选④。
(2)根据金属活动性较强的金属、活泼性介于Zn—Cu之间的金属、活泼性较弱的金属分别采用电解法、热还原法、热分解法。
(3)在炼铁的过程中,焦炭的作用有两个,一是燃烧提供反应所需要的能量,二是通过反应,给炼铁提供还原剂。
通电
====
答案:(1)① ③ ③ ④
(2)①2Fe2O3 +3C 4Fe+3CO2↑
②3H2+WO3 W+3H2O
③3MnO2+4Al 3Mn+2Al2O3
④2NaCl 2Na+Cl2↑
(3)①燃烧放热,为反应提供能量,
②与CO2反应生成CO为反应提供还原剂
高温
====
高温
====
高温
====
通电
====
【互动探究】炼铁后得到的生铁中往往含有碳等杂质,如何将碳除掉转化为含碳量更低的钢?
提示:由生铁转化为钢的方法是:将所得的生铁在高温下用氧化剂将碳等杂质氧化为气体或转变为炉渣除去。
金属的性质与冶炼方法之间的关系
金属冶炼实质就是将金属从其化合物中置换出来,得到其单质。那么,金属越活泼,其化合物就越稳定,金属就越难被还原出来。金属活泼性与金属冶炼方法之间的关系可总结为:
(1)活泼性很强的金属,很难用还原剂将其还原出来,该类金属一般采用电解的方法如:
2NaCl 2Na+Cl2↑ 2Al2O3 4Al+3O2↑
(2)较活泼的金属,其氧化物不易分解,可以用还原剂将其还原如:
Fe2O3 +3CO 2Fe+3CO2
2CuO+C 2Cu+CO2↑
高温
====
通电
====
高温
====
通电
====
(3)活动性弱的金属,其氧化物的稳定性比较差,受热容易分解,所以可用加热使其氧化物分解的方法来得到金属单质,如:2Ag2O 4Ag+O2↑。
(4)活泼性很差的金属,性质很稳定,在自然界中主要以单质的形式存在,所以这样的金属在冶炼时主要用物理法,如金。
△
====
1.已知2Fe+3Cl2 2FeCl3,
Fe+6HNO3====Fe(NO3)3+3NO2↑+3H2O
CuSO4+Fe====FeSO4+Cu,
2HCl+Fe====FeCl2+H2↑
试根据上述内容,依据氧化还原反应的特点分析,铁在化学反应中怎样才能生成+3价的化合物?什么时候才能生成+2价的化合物?
点燃
====
提示:铁是高中阶段所学的非常重要的变价金属,当遇到像Cl2、HNO3等强氧化剂时,铁会被氧化成+3价,而如果遇到Cu2+、Fe3+等一些氧化剂时,铁会被氧化为+2价离子。
2.工业上常用铁桶盛装浓硫酸,有人解释说“是因为浓硫酸与Fe不反应”,试分析此说法的正误。
提示:常温下铁遇浓硫酸、浓硝酸会发生钝化,钝化是指在常温下,铁、铝在遇到浓硫酸、浓硝酸时其表面的金属被氧化成为一层致密的氧化物薄膜,从而阻止内部金属进一步被氧化,但钝化不是不反应,而是表面上的少量金属被氧化,生成了其氧化物薄膜。
3.铜是一种较不活泼的金属,在与其他物质反应时,通常转化为+2价的离子,那么,是不是铜就是只有+2价这一种价态?
提示:不是,当铜与硫反应时,生成的是Cu2S,所以铜并不是一种只有+2价的金属,有时候也会生成+1价,其实有些铜的化合物中铜的+1价比+2价还稳定,如CuO在受热时,生成更稳定的+1价的Cu2O。
例2 在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应。应用下列装置,试探究反应的部分产物。在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO。干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物。
(1)实验前必须对整套装置进行气密性检查,操作方法是
_______________________________________________。
(2)圆底烧瓶中盛装_______,该装置受热后的主要作用是______;向烧瓶中放置了几片碎瓷片,其作用是_______。
(3)实验开始时应先点燃_______处(填“a”或“b”或“c”)的酒精灯。
(4)实验完成后将小试管A从装置中取下,用拇指堵住试管口,靠近酒精灯火焰,松开拇指,听到尖锐的爆鸣声,则试管内收集的气体为______,如果要在A玻璃管处点燃该气体,则必须对该气体进行___________________________。
(5)硬质玻璃管Ⅱ中的实验现象是_____,所发生的反应为__________________。
(6)干燥管Ⅰ中盛放的药品是_____,其作用是_____;干燥管Ⅱ中的实验现象是_____________________________。
(7)若通过检验硬质玻璃管Ⅰ中的产物只有Fe3O4,试写出反应方程式____________________________________。
【规范解答】(1)检查整套装置的气密性时,要特别注意由于整个装置容积比较大,所以不能用手捂热使空气膨胀的方法,而要用酒精灯微热或用热毛巾捂热;
(2)该反应目的为研究Fe与水的反应,故圆底烧瓶中应盛装水,加入碎瓷片是防止水暴沸;
(3)若先点燃酒精喷灯则Fe会与装置内的O2反应,所以应先点燃a处酒精灯使产生的水蒸气将装置内的空气排尽;先点燃c处酒精灯无意义。
(4)该反应现象为可燃性气体的点燃现象,故产生的气体为H2,点燃前必须验纯。
(5)H2与CuO在玻璃管Ⅱ处发生反应CuO+H2 Cu+H2O,故产生的水与无水硫酸铜结合生成蓝色的五水硫酸铜,同时硬质玻璃管内固体由黑变红。
(6)要验证生成的产物是H2,先要将玻璃管Ⅰ处没有参加反应的水蒸气除去,应使用固体干燥剂,如碱石灰等。
(7)由题目可知反应为Fe+H2O Fe3O4+H2,用观察法可配平。
△
====
答案:(1)在A处玻璃管口接一段乳胶管,乳胶管头上连一段玻璃管,并将管口浸入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到浸入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则表明该套装置气密性良好
(2)水 为硬质玻璃管内铁与水蒸气的反应提供持续不断的水蒸气 防止暴沸
(3)a
(4)H2 验纯
(5)黑色固体变红 H2+CuO Cu+H2O
(6)碱石灰
除去H2中混有的水蒸气
白色固体变蓝
(7)Fe3O4+4H2 3Fe+4H2O
高温
====
△
====
【变式训练】将表面被氧化的铜片和铁片,同时加入足量稀盐酸中,除尽氧化膜。再经充分反应后,溶液中一定含有的金属离子是( )
A.Fe3+和Cu2+ B.Fe2+和Cu2+
C.Fe2+ D.Fe2+和Fe3+
【解析】选C。铜片和铁片的表面的CuO和Fe2O3,加入足量的稀盐酸,先发生如下两个反应:CuO+2H+====Cu2++H2O、Fe2O3+6H+====2Fe3++3H2O,因为Fe比Cu活泼,Fe3+的氧化性比Cu2+的强,所以再发生:2Fe3++Fe====3Fe2+,若Fe3+过量,则接着发生2Fe3++Cu====2Fe2++Cu2+,若Fe过量,则还会发生Fe+Cu2+====Fe2++Cu,不论哪种情况溶液中都有Fe2+。
1.铁能被磁铁吸引,可用于物质的分离。
铜为紫红色金属,可用于物质推断。
2.铁、铜均为变价金属,与强氧化剂反应生成高价态物质,与弱氧化剂反应生成低价态物质。
1.工业上,下列各组金属氧化物可用CO将其还原成金属单质的一组是( )
A.MgO、Al2O3 B.Fe2O3、CuO
C.CaO、CuO D.MgO、Ag2O
【解析】选B。由金属的冶炼方法可以得知,在冶炼金属时,较活泼的金属才能用CO等还原剂将其从金属氧化物中还原出来,而排在金属活动性顺序表中活泼的金属(如K、Ca、Na、Mg、Al等)是不能被还原出来的,所以只有B项中的两种才能用CO将其从金属氧化物中还原出来。
2.下列铁的化合物中,铁的质量分数最高的是( )
A.FeS2 B.FeO C.Fe2O3 D.Fe3O4
【解析】选B。由题意可知,这四种物质中,铁的质量分数依次为:
3.9 g铁与某种金属的混合物跟足量的稀硫酸完全反应,生
成H22.8 L(标准状况),则混合物中的另一种金属是( )
A.Mg B.Al C.Zn D.Cu
【解析】选D。由题意可得,生成的H2的物质的量为
0.125 mol,如果这9 g金属全部是铁,则生成的H2应该是
mol≈0.16 mol>0.125 mol,如果这9 g金属全部是
Zn,则生成的H2是 mol≈0.138 mol>0.125 mol,而9 g
Mg和Al所生成的H2则更多,而Cu不与酸反应生成H2,所以
应该选D。
4.有一块铁、铝、铜的合金共8.94 g,投入200 mL的稀硫酸中,恰好完全反应,共收集到5 600 mL H2(标准状况下),并从溶液中滤出不反应的金属0.64 g,往溶液中加入过量的氢氧化钠溶液,产生沉淀,过滤,洗涤后经过高温干燥称得质量为8 g,根据题意回答下列问题:
(1)在上述过程中,所发生的反应有:__________________
________________________,其中铁与硫酸反应时,铁作______剂,生成_____价的物质。
(2)在所给的合金中,铁、铝、铜三种金属的物质的量之比为________,所加硫酸的物质的量浓度为____________。
【解析】(1)由所给题意可得,将合金加入硫酸中后,只有铁和铝能与硫酸发生反应,生成H2,由于铁与硫酸反应时,铁的价态升高,所以铁被氧化,自身是还原剂,反应后的溶液中再加足量NaOH溶液,Al3+转化为NaAlO2,Fe2+先生成Fe(OH)2,再转化为Fe(OH)3,过滤后高温干燥转化为Fe2O3, (2)方法一:铁在与硫酸反应时,被氧化成的是
+2价的Fe2+,铜全部剩余,不参加反应,加入的合金的量是8.94 g,而反应完全后,剩余的0.64 g全部是Cu,即为0.01 mol,也就是说,反应掉的铁和铝共8.3 g,据题意生成H2为5 600 mL,即0.25 mol,设铁的物质的量为x,铝的物质的量为y,则可得:
解之得x=y=0.1 mol 则可得三者的物质的量之比为0.1∶0.1∶0.01=10∶10∶1,也就可得出,200 mLH2SO4中的物质的量为0.25 mol,所以其物质的量浓度为:
方法二:原合金质量为8.94 g,不溶于稀硫酸的为Cu质量为0.64 g,向溶于硫酸后所得滤液中加足量NaOH溶液最后得
8 g Fe2O3,则原合金中含Fe的质量为8 g× =5.6 g,含Al的质量为8.94 g-0.64 g-5.6 g=2.7 g
则n(Fe)∶n(Al)∶n(Cu)=
=10∶10∶1
n(H2SO4)=n(Fe)+ n(Al)=0.25 mol
c(H2SO4)= =1.25 mol·L-1
答案:(1)2Al+3H2SO4(稀)====Al2(SO4)3+3H2↑、
Fe+H2SO4(稀)====FeSO4+ H2↑、
Al2(SO4)3+6NaOH====2Al(OH)3↓+3Na2SO4、
FeSO4+2NaOH====Fe(OH)2↓+Na2SO4、
Al(OH)3+NaOH====NaAlO2+2H2O、
4Fe(OH)2+O2+2H2O====4Fe(OH)3、
2Fe(OH)3 Fe2O3+3H2O 还原 +2
(2)10∶10∶1 1.25 mol/L
△
====
5.已知浓硝酸具有强氧化性,能将铜氧化到+2价,自身被还原为NO2,而稀硝酸也能将铜氧化到+2价,自身被还原为NO。现有1.92 g Cu,加入一定量的浓硝酸中,充分反应后,铜完全溶解,生成气体1.12 L(标准状况)。
(1)试写出Cu与浓硝酸反应的化学方程式______________
_______________________________________________。
(2)试计算,参加反应的硝酸的物质的量为________ mol。
【解析】由题意可知,Cu与浓硝酸反应生成物为Cu(NO3)2和NO2,同时还有水生成,即可得其方程式为Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O,但随着硝酸浓度的减小又生成NO,生成的NO和NO2的总量为1.12 L,生成的Cu(NO3)2与Cu的量应该相等,即为0.03 mol,根据氮原子守恒,被还原的硝酸为
参加反应的HNO3为0.03 mol×2+0.05 mol=0.11 mol
答案:(1) Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
(2)0.11
一、选择题(本题包括6小题,每小题4分,共24分)
1.下列物质混合时,铁能溶解但无气体产生的是( )
A.铁粉与盐酸 B.铁屑与稀硫酸
C.铁粉与硫酸铜溶液 D.铁钉浸入水中
【解析】选C。铁能溶解,说明二者能发生反应,但又不能生成气体,只有C选项符合。
2.(双选)高炉炼铁生产中,下列各说法正确的是( )
A.焦炭和一氧化碳都是还原剂
B.采用富氧空气可以得到纯铁
C.加石灰石的目的主要是得到CO2
D.用于冶炼生铁的矿石主要有磁铁矿和赤铁矿
【解析】选A、D。炼铁的原料是铁矿石(主要有磁铁矿和赤铁矿),焦炭,空气,石灰石原理:C+O2 CO2 CO2+C 2CO Fe2O3+3CO 2Fe+3CO2↑ 造渣:CaCO3 CaO+CO2↑
CaO+SiO2 CaSiO3。得到生铁和高炉炉渣,故选A、D。
点燃
====
高温
====
高温
====
高温
====
高温
====
3.在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④Fe2(SO4)3,铜粉可溶解的是( )
A.①② B.②④ C.②③ D.①④
【解析】选B。要使铜粉溶解,必须有强氧化性的物质存在。加入②后发生反应Fe2O3+3H2SO4 ==== Fe2(SO4)3+3H2O,生成Fe2(SO4)3和加入④后的Fe2(SO4)3都能将Cu氧化,发生2Fe3++Cu====2Fe2++Cu2+这一反应,使之溶解。
4.下列在炼铁高炉中所发生的反应及其作用与实际不相符的是( )
A.C+O2 ==== CO2 提供热量
B.CO2+C ==== 2CO 提供气体还原剂
C.CaO+SiO2 =====CaSiO3 向炼出的铁中加杂质
D.Fe2O3+3CO 2Fe+3CO2 还原铁矿石
【解析】选C。由教材内容可得,只有C中所说的作用是不正确的,因为C项反应的作用是除掉铁矿石中的脉石。
高温
====
【举一反三】为什么在炼铁时不直接将SiO2从铁矿石中分离出来?
提示:SiO2的熔点较高,很难能从铁矿石中分离出来,而将其转化成的硅酸钙的熔点较低,较容易地从矿石中分离出来,所以要向炼铁的高炉中加入一定量的CaCO3,将其转化为CaSiO3,便于分离。
5.用H2作还原剂和金属还原剂相比,制得的金属的纯度说法正确的是( )
A.用H2的高 B.用金属的高
C.二者相同 D.无法比较
【解析】选A。氢气和金属虽然都可作还原剂制得金属,但是金属作还原剂时的过量金属、氧化产物和还原产物多为固体,易使制得的金属中含有杂质,而H2的氧化产物为水,则不会引入杂质。
6.人体血红蛋白中含有Fe2+,如果误服亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力,服用维生素C可缓解亚硝酸盐中毒,这说明维生素C具有( )
A.酸性 B.碱性 C.氧化性 D.还原性
【解析】选D。Fe2+遇较强氧化剂可被氧化为Fe3+,而Fe3+遇较强还原剂则可被还原为Fe2+,故维生素C表现的是还原性,将Fe3+还原为Fe2+,即可缓解亚硝酸盐中毒。
二、非选择题(本题包括2小题,共26分)
7.(12分)(1)土壤中含铁。在烧制砖瓦时,用黏土做成的坯经过烘烧后,铁的化合物转化成_____而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的气体,化学方程式为:__________,它们把该红色物质还原成的黑色化合物是__________,同时还有未烧的碳颗粒,而制得青色砖瓦。
(2)用树枝火烧孔雀石[Cu2(OH)2CO3]冶炼金属铜,是古人冶炼铜的一种方法,该过程中,孔雀石受热先分解为黑色的__________,再与木炭反应得到铜,化学方程式为
________________________________________________。
【解析】(1)黏土烧制过程中,土壤中的铁转化成了Fe2O3,
因而得到红色砖瓦,在烘烧后期从窑顶慢慢浇水,会发生
C+H2O(g) CO+H2的反应,它们可以把红色的氧化铁还原
为黑色的FeO和Fe3O4而制得青色砖瓦。
高温
====
(2)孔雀石受热分解:Cu2(OH)2CO3 2CuO+CO2↑+H2O,黑色物质为CuO,再与木炭反应:CuO+C Cu+CO↑或2CuO+C
2Cu+CO2↑
答案:(1)Fe2O3 C+H2O(g) CO+H2 FeO和Fe3O4
(2)CuO
CuO+C Cu+CO↑或2CuO+C 2Cu+CO2↑
△
====
△
====
△
====
△
====
△
====
高温
====
8.(14分)在一定条件下可实现下图所示物质之间的变化
请填写以下空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。上图中的F是_____。
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式
_______________________________________________。
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式_________________________。
(4)每生成1 mol D同时生成___________________mol E。
【解析】由题意可知,上图中的A是偏铝酸盐溶液,F和G应为CuO和CO2,但能与A反应的应为CO2,所以F为CO2,与A反应得到的沉淀为Al(OH)3,受热分解得到B为Al2O3,电解得到的E和D应该为Al和O2,能与CuO反应的是Al,所以D为Al,E为O2。生成1 mol D转移3 mol电子,则生成O2 3/4 mol。
答案:(1)CO2 (2)Al3++4OH-====AlO2-+2H2O
(3) 2Al+3CuO Al2O3+3Cu (4)3/4
高温
====
【规律方法】框图推断题的解题方法
无机框图推断是对常见元素的单质及其重要化合物相互关系的考查,它融元素化合物、基本理论、计算于一体。侧重考查学生思维能力和综合应用的能力。
解决这类考题,首先要读懂题意和图意,找准突破口(题眼),从自己的记忆中搜寻典型的反应、事物或模型,然后大胆推测,只要符合框图关系的答案都是正确的。由于框图推断较好地考查了学生的直接思维品质,在很多考试中出现是理所当然的。
解推断题的基本思路如下:
1.正向思维,“顺藤摸瓜反应”
正向思维就是根据题设条件,结合有关的化学知识,依题意的层次结构,逐步推理,得出结论。
2.逆向思维,发挥联想
此种方法适用于物质间的相互转化为主要内容的推断题。解题时,以最终产物作为起点,层层逆推,形成思路,得出结论。
3.意向猜测,验证结论
“意向猜测,验证结论”的思维方法,就是先根据题意凭直觉初步作出结论,而后将结论代入到题述条件验证,若完全吻合,即为答案,这种方法常用于一些推理繁琐或一般方法不易解出的推断题。
1.为什么在人类历史上会先出现青铜器时代而后出现铁器时代?
提示:由于铁比铜活泼,需要比较严格的条件和较高的温度才能将其从化合物中还原出来,也就是说,铁比铜难于冶炼,所以使用的历史比铜短。
2.请结合工业炼铁的过程,思考并交流以下几个问题:
(1)焦炭也是很好的还原剂,那为什么在冶炼铁时,不直接用焦炭做还原剂来还原铁的氧化物?
提示:工业炼铁不用焦炭做还原剂是因为焦炭是固体,与铁矿石接触的面积有限,很难充分发生化学反应,而CO是气体,与铁矿石的接触面积很大,提高了反应速率和原料的利用率。
(2)铁矿石是如何被还原的?
提示:在炼铁高炉内部,先是C燃烧放出大量的热,并在高温条件下,使C与生成的CO2反应生成CO,在较高的温度下,铁矿石中的Fe2O3与CO反应生成铁单质,铁元素被还原。
(3)在炼铁的过程中,石灰石的作用是什么?
提示:石灰石的作用是除掉铁矿石中的杂质SiO2。
例1 冶炼金属一般有下列方法:①焦炭法 ②水煤气(或氢气,或一氧化碳)法 ③活泼金属置换法 ④电解法,这四种方法在工业上均有应用。
(1)请对下表中的金属冶炼方法进行分析,从上述四种方法中选择相应的序号填入表格中的空格中:
(2)请再列举出使用上述方法冶炼金属的例子各一个(用化学方程式表示):
①______________________________________________
②______________________________________________
③______________________________________________
④______________________________________________
(3)在工业炼铁的过程中,焦炭的作用是____________。
【规范解答】(1)火烧孔雀石炼铜是用C还原孔雀石分解得到的CuO,故选①;湿法炼铜和铝热法炼铬都是利用活泼金属置换较不活泼的金属,故选③;而光卤石炼镁的反应为MgCl2 Mg+Cl2↑,故选④。
(2)根据金属活动性较强的金属、活泼性介于Zn—Cu之间的金属、活泼性较弱的金属分别采用电解法、热还原法、热分解法。
(3)在炼铁的过程中,焦炭的作用有两个,一是燃烧提供反应所需要的能量,二是通过反应,给炼铁提供还原剂。
通电
====
答案:(1)① ③ ③ ④
(2)①2Fe2O3 +3C 4Fe+3CO2↑
②3H2+WO3 W+3H2O
③3MnO2+4Al 3Mn+2Al2O3
④2NaCl 2Na+Cl2↑
(3)①燃烧放热,为反应提供能量,
②与CO2反应生成CO为反应提供还原剂
高温
====
高温
====
高温
====
通电
====
【互动探究】炼铁后得到的生铁中往往含有碳等杂质,如何将碳除掉转化为含碳量更低的钢?
提示:由生铁转化为钢的方法是:将所得的生铁在高温下用氧化剂将碳等杂质氧化为气体或转变为炉渣除去。
金属的性质与冶炼方法之间的关系
金属冶炼实质就是将金属从其化合物中置换出来,得到其单质。那么,金属越活泼,其化合物就越稳定,金属就越难被还原出来。金属活泼性与金属冶炼方法之间的关系可总结为:
(1)活泼性很强的金属,很难用还原剂将其还原出来,该类金属一般采用电解的方法如:
2NaCl 2Na+Cl2↑ 2Al2O3 4Al+3O2↑
(2)较活泼的金属,其氧化物不易分解,可以用还原剂将其还原如:
Fe2O3 +3CO 2Fe+3CO2
2CuO+C 2Cu+CO2↑
高温
====
通电
====
高温
====
通电
====
(3)活动性弱的金属,其氧化物的稳定性比较差,受热容易分解,所以可用加热使其氧化物分解的方法来得到金属单质,如:2Ag2O 4Ag+O2↑。
(4)活泼性很差的金属,性质很稳定,在自然界中主要以单质的形式存在,所以这样的金属在冶炼时主要用物理法,如金。
△
====
1.已知2Fe+3Cl2 2FeCl3,
Fe+6HNO3====Fe(NO3)3+3NO2↑+3H2O
CuSO4+Fe====FeSO4+Cu,
2HCl+Fe====FeCl2+H2↑
试根据上述内容,依据氧化还原反应的特点分析,铁在化学反应中怎样才能生成+3价的化合物?什么时候才能生成+2价的化合物?
点燃
====
提示:铁是高中阶段所学的非常重要的变价金属,当遇到像Cl2、HNO3等强氧化剂时,铁会被氧化成+3价,而如果遇到Cu2+、Fe3+等一些氧化剂时,铁会被氧化为+2价离子。
2.工业上常用铁桶盛装浓硫酸,有人解释说“是因为浓硫酸与Fe不反应”,试分析此说法的正误。
提示:常温下铁遇浓硫酸、浓硝酸会发生钝化,钝化是指在常温下,铁、铝在遇到浓硫酸、浓硝酸时其表面的金属被氧化成为一层致密的氧化物薄膜,从而阻止内部金属进一步被氧化,但钝化不是不反应,而是表面上的少量金属被氧化,生成了其氧化物薄膜。
3.铜是一种较不活泼的金属,在与其他物质反应时,通常转化为+2价的离子,那么,是不是铜就是只有+2价这一种价态?
提示:不是,当铜与硫反应时,生成的是Cu2S,所以铜并不是一种只有+2价的金属,有时候也会生成+1价,其实有些铜的化合物中铜的+1价比+2价还稳定,如CuO在受热时,生成更稳定的+1价的Cu2O。
例2 在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应。应用下列装置,试探究反应的部分产物。在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO。干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物。
(1)实验前必须对整套装置进行气密性检查,操作方法是
_______________________________________________。
(2)圆底烧瓶中盛装_______,该装置受热后的主要作用是______;向烧瓶中放置了几片碎瓷片,其作用是_______。
(3)实验开始时应先点燃_______处(填“a”或“b”或“c”)的酒精灯。
(4)实验完成后将小试管A从装置中取下,用拇指堵住试管口,靠近酒精灯火焰,松开拇指,听到尖锐的爆鸣声,则试管内收集的气体为______,如果要在A玻璃管处点燃该气体,则必须对该气体进行___________________________。
(5)硬质玻璃管Ⅱ中的实验现象是_____,所发生的反应为__________________。
(6)干燥管Ⅰ中盛放的药品是_____,其作用是_____;干燥管Ⅱ中的实验现象是_____________________________。
(7)若通过检验硬质玻璃管Ⅰ中的产物只有Fe3O4,试写出反应方程式____________________________________。
【规范解答】(1)检查整套装置的气密性时,要特别注意由于整个装置容积比较大,所以不能用手捂热使空气膨胀的方法,而要用酒精灯微热或用热毛巾捂热;
(2)该反应目的为研究Fe与水的反应,故圆底烧瓶中应盛装水,加入碎瓷片是防止水暴沸;
(3)若先点燃酒精喷灯则Fe会与装置内的O2反应,所以应先点燃a处酒精灯使产生的水蒸气将装置内的空气排尽;先点燃c处酒精灯无意义。
(4)该反应现象为可燃性气体的点燃现象,故产生的气体为H2,点燃前必须验纯。
(5)H2与CuO在玻璃管Ⅱ处发生反应CuO+H2 Cu+H2O,故产生的水与无水硫酸铜结合生成蓝色的五水硫酸铜,同时硬质玻璃管内固体由黑变红。
(6)要验证生成的产物是H2,先要将玻璃管Ⅰ处没有参加反应的水蒸气除去,应使用固体干燥剂,如碱石灰等。
(7)由题目可知反应为Fe+H2O Fe3O4+H2,用观察法可配平。
△
====
答案:(1)在A处玻璃管口接一段乳胶管,乳胶管头上连一段玻璃管,并将管口浸入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到浸入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则表明该套装置气密性良好
(2)水 为硬质玻璃管内铁与水蒸气的反应提供持续不断的水蒸气 防止暴沸
(3)a
(4)H2 验纯
(5)黑色固体变红 H2+CuO Cu+H2O
(6)碱石灰
除去H2中混有的水蒸气
白色固体变蓝
(7)Fe3O4+4H2 3Fe+4H2O
高温
====
△
====
【变式训练】将表面被氧化的铜片和铁片,同时加入足量稀盐酸中,除尽氧化膜。再经充分反应后,溶液中一定含有的金属离子是( )
A.Fe3+和Cu2+ B.Fe2+和Cu2+
C.Fe2+ D.Fe2+和Fe3+
【解析】选C。铜片和铁片的表面的CuO和Fe2O3,加入足量的稀盐酸,先发生如下两个反应:CuO+2H+====Cu2++H2O、Fe2O3+6H+====2Fe3++3H2O,因为Fe比Cu活泼,Fe3+的氧化性比Cu2+的强,所以再发生:2Fe3++Fe====3Fe2+,若Fe3+过量,则接着发生2Fe3++Cu====2Fe2++Cu2+,若Fe过量,则还会发生Fe+Cu2+====Fe2++Cu,不论哪种情况溶液中都有Fe2+。
1.铁能被磁铁吸引,可用于物质的分离。
铜为紫红色金属,可用于物质推断。
2.铁、铜均为变价金属,与强氧化剂反应生成高价态物质,与弱氧化剂反应生成低价态物质。
1.工业上,下列各组金属氧化物可用CO将其还原成金属单质的一组是( )
A.MgO、Al2O3 B.Fe2O3、CuO
C.CaO、CuO D.MgO、Ag2O
【解析】选B。由金属的冶炼方法可以得知,在冶炼金属时,较活泼的金属才能用CO等还原剂将其从金属氧化物中还原出来,而排在金属活动性顺序表中活泼的金属(如K、Ca、Na、Mg、Al等)是不能被还原出来的,所以只有B项中的两种才能用CO将其从金属氧化物中还原出来。
2.下列铁的化合物中,铁的质量分数最高的是( )
A.FeS2 B.FeO C.Fe2O3 D.Fe3O4
【解析】选B。由题意可知,这四种物质中,铁的质量分数依次为:
3.9 g铁与某种金属的混合物跟足量的稀硫酸完全反应,生
成H22.8 L(标准状况),则混合物中的另一种金属是( )
A.Mg B.Al C.Zn D.Cu
【解析】选D。由题意可得,生成的H2的物质的量为
0.125 mol,如果这9 g金属全部是铁,则生成的H2应该是
mol≈0.16 mol>0.125 mol,如果这9 g金属全部是
Zn,则生成的H2是 mol≈0.138 mol>0.125 mol,而9 g
Mg和Al所生成的H2则更多,而Cu不与酸反应生成H2,所以
应该选D。
4.有一块铁、铝、铜的合金共8.94 g,投入200 mL的稀硫酸中,恰好完全反应,共收集到5 600 mL H2(标准状况下),并从溶液中滤出不反应的金属0.64 g,往溶液中加入过量的氢氧化钠溶液,产生沉淀,过滤,洗涤后经过高温干燥称得质量为8 g,根据题意回答下列问题:
(1)在上述过程中,所发生的反应有:__________________
________________________,其中铁与硫酸反应时,铁作______剂,生成_____价的物质。
(2)在所给的合金中,铁、铝、铜三种金属的物质的量之比为________,所加硫酸的物质的量浓度为____________。
【解析】(1)由所给题意可得,将合金加入硫酸中后,只有铁和铝能与硫酸发生反应,生成H2,由于铁与硫酸反应时,铁的价态升高,所以铁被氧化,自身是还原剂,反应后的溶液中再加足量NaOH溶液,Al3+转化为NaAlO2,Fe2+先生成Fe(OH)2,再转化为Fe(OH)3,过滤后高温干燥转化为Fe2O3, (2)方法一:铁在与硫酸反应时,被氧化成的是
+2价的Fe2+,铜全部剩余,不参加反应,加入的合金的量是8.94 g,而反应完全后,剩余的0.64 g全部是Cu,即为0.01 mol,也就是说,反应掉的铁和铝共8.3 g,据题意生成H2为5 600 mL,即0.25 mol,设铁的物质的量为x,铝的物质的量为y,则可得:
解之得x=y=0.1 mol 则可得三者的物质的量之比为0.1∶0.1∶0.01=10∶10∶1,也就可得出,200 mLH2SO4中的物质的量为0.25 mol,所以其物质的量浓度为:
方法二:原合金质量为8.94 g,不溶于稀硫酸的为Cu质量为0.64 g,向溶于硫酸后所得滤液中加足量NaOH溶液最后得
8 g Fe2O3,则原合金中含Fe的质量为8 g× =5.6 g,含Al的质量为8.94 g-0.64 g-5.6 g=2.7 g
则n(Fe)∶n(Al)∶n(Cu)=
=10∶10∶1
n(H2SO4)=n(Fe)+ n(Al)=0.25 mol
c(H2SO4)= =1.25 mol·L-1
答案:(1)2Al+3H2SO4(稀)====Al2(SO4)3+3H2↑、
Fe+H2SO4(稀)====FeSO4+ H2↑、
Al2(SO4)3+6NaOH====2Al(OH)3↓+3Na2SO4、
FeSO4+2NaOH====Fe(OH)2↓+Na2SO4、
Al(OH)3+NaOH====NaAlO2+2H2O、
4Fe(OH)2+O2+2H2O====4Fe(OH)3、
2Fe(OH)3 Fe2O3+3H2O 还原 +2
(2)10∶10∶1 1.25 mol/L
△
====
5.已知浓硝酸具有强氧化性,能将铜氧化到+2价,自身被还原为NO2,而稀硝酸也能将铜氧化到+2价,自身被还原为NO。现有1.92 g Cu,加入一定量的浓硝酸中,充分反应后,铜完全溶解,生成气体1.12 L(标准状况)。
(1)试写出Cu与浓硝酸反应的化学方程式______________
_______________________________________________。
(2)试计算,参加反应的硝酸的物质的量为________ mol。
【解析】由题意可知,Cu与浓硝酸反应生成物为Cu(NO3)2和NO2,同时还有水生成,即可得其方程式为Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O,但随着硝酸浓度的减小又生成NO,生成的NO和NO2的总量为1.12 L,生成的Cu(NO3)2与Cu的量应该相等,即为0.03 mol,根据氮原子守恒,被还原的硝酸为
参加反应的HNO3为0.03 mol×2+0.05 mol=0.11 mol
答案:(1) Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
(2)0.11
一、选择题(本题包括6小题,每小题4分,共24分)
1.下列物质混合时,铁能溶解但无气体产生的是( )
A.铁粉与盐酸 B.铁屑与稀硫酸
C.铁粉与硫酸铜溶液 D.铁钉浸入水中
【解析】选C。铁能溶解,说明二者能发生反应,但又不能生成气体,只有C选项符合。
2.(双选)高炉炼铁生产中,下列各说法正确的是( )
A.焦炭和一氧化碳都是还原剂
B.采用富氧空气可以得到纯铁
C.加石灰石的目的主要是得到CO2
D.用于冶炼生铁的矿石主要有磁铁矿和赤铁矿
【解析】选A、D。炼铁的原料是铁矿石(主要有磁铁矿和赤铁矿),焦炭,空气,石灰石原理:C+O2 CO2 CO2+C 2CO Fe2O3+3CO 2Fe+3CO2↑ 造渣:CaCO3 CaO+CO2↑
CaO+SiO2 CaSiO3。得到生铁和高炉炉渣,故选A、D。
点燃
====
高温
====
高温
====
高温
====
高温
====
3.在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④Fe2(SO4)3,铜粉可溶解的是( )
A.①② B.②④ C.②③ D.①④
【解析】选B。要使铜粉溶解,必须有强氧化性的物质存在。加入②后发生反应Fe2O3+3H2SO4 ==== Fe2(SO4)3+3H2O,生成Fe2(SO4)3和加入④后的Fe2(SO4)3都能将Cu氧化,发生2Fe3++Cu====2Fe2++Cu2+这一反应,使之溶解。
4.下列在炼铁高炉中所发生的反应及其作用与实际不相符的是( )
A.C+O2 ==== CO2 提供热量
B.CO2+C ==== 2CO 提供气体还原剂
C.CaO+SiO2 =====CaSiO3 向炼出的铁中加杂质
D.Fe2O3+3CO 2Fe+3CO2 还原铁矿石
【解析】选C。由教材内容可得,只有C中所说的作用是不正确的,因为C项反应的作用是除掉铁矿石中的脉石。
高温
====
【举一反三】为什么在炼铁时不直接将SiO2从铁矿石中分离出来?
提示:SiO2的熔点较高,很难能从铁矿石中分离出来,而将其转化成的硅酸钙的熔点较低,较容易地从矿石中分离出来,所以要向炼铁的高炉中加入一定量的CaCO3,将其转化为CaSiO3,便于分离。
5.用H2作还原剂和金属还原剂相比,制得的金属的纯度说法正确的是( )
A.用H2的高 B.用金属的高
C.二者相同 D.无法比较
【解析】选A。氢气和金属虽然都可作还原剂制得金属,但是金属作还原剂时的过量金属、氧化产物和还原产物多为固体,易使制得的金属中含有杂质,而H2的氧化产物为水,则不会引入杂质。
6.人体血红蛋白中含有Fe2+,如果误服亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力,服用维生素C可缓解亚硝酸盐中毒,这说明维生素C具有( )
A.酸性 B.碱性 C.氧化性 D.还原性
【解析】选D。Fe2+遇较强氧化剂可被氧化为Fe3+,而Fe3+遇较强还原剂则可被还原为Fe2+,故维生素C表现的是还原性,将Fe3+还原为Fe2+,即可缓解亚硝酸盐中毒。
二、非选择题(本题包括2小题,共26分)
7.(12分)(1)土壤中含铁。在烧制砖瓦时,用黏土做成的坯经过烘烧后,铁的化合物转化成_____而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的气体,化学方程式为:__________,它们把该红色物质还原成的黑色化合物是__________,同时还有未烧的碳颗粒,而制得青色砖瓦。
(2)用树枝火烧孔雀石[Cu2(OH)2CO3]冶炼金属铜,是古人冶炼铜的一种方法,该过程中,孔雀石受热先分解为黑色的__________,再与木炭反应得到铜,化学方程式为
________________________________________________。
【解析】(1)黏土烧制过程中,土壤中的铁转化成了Fe2O3,
因而得到红色砖瓦,在烘烧后期从窑顶慢慢浇水,会发生
C+H2O(g) CO+H2的反应,它们可以把红色的氧化铁还原
为黑色的FeO和Fe3O4而制得青色砖瓦。
高温
====
(2)孔雀石受热分解:Cu2(OH)2CO3 2CuO+CO2↑+H2O,黑色物质为CuO,再与木炭反应:CuO+C Cu+CO↑或2CuO+C
2Cu+CO2↑
答案:(1)Fe2O3 C+H2O(g) CO+H2 FeO和Fe3O4
(2)CuO
CuO+C Cu+CO↑或2CuO+C 2Cu+CO2↑
△
====
△
====
△
====
△
====
△
====
高温
====
8.(14分)在一定条件下可实现下图所示物质之间的变化
请填写以下空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。上图中的F是_____。
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式
_______________________________________________。
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式_________________________。
(4)每生成1 mol D同时生成___________________mol E。
【解析】由题意可知,上图中的A是偏铝酸盐溶液,F和G应为CuO和CO2,但能与A反应的应为CO2,所以F为CO2,与A反应得到的沉淀为Al(OH)3,受热分解得到B为Al2O3,电解得到的E和D应该为Al和O2,能与CuO反应的是Al,所以D为Al,E为O2。生成1 mol D转移3 mol电子,则生成O2 3/4 mol。
答案:(1)CO2 (2)Al3++4OH-====AlO2-+2H2O
(3) 2Al+3CuO Al2O3+3Cu (4)3/4
高温
====
【规律方法】框图推断题的解题方法
无机框图推断是对常见元素的单质及其重要化合物相互关系的考查,它融元素化合物、基本理论、计算于一体。侧重考查学生思维能力和综合应用的能力。
解决这类考题,首先要读懂题意和图意,找准突破口(题眼),从自己的记忆中搜寻典型的反应、事物或模型,然后大胆推测,只要符合框图关系的答案都是正确的。由于框图推断较好地考查了学生的直接思维品质,在很多考试中出现是理所当然的。
解推断题的基本思路如下:
1.正向思维,“顺藤摸瓜反应”
正向思维就是根据题设条件,结合有关的化学知识,依题意的层次结构,逐步推理,得出结论。
2.逆向思维,发挥联想
此种方法适用于物质间的相互转化为主要内容的推断题。解题时,以最终产物作为起点,层层逆推,形成思路,得出结论。
3.意向猜测,验证结论
“意向猜测,验证结论”的思维方法,就是先根据题意凭直觉初步作出结论,而后将结论代入到题述条件验证,若完全吻合,即为答案,这种方法常用于一些推理繁琐或一般方法不易解出的推断题。
