11-12版高中化学课时讲练通配套课件:3.3.1硅酸盐矿物与硅酸盐产品(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:3.3.1硅酸盐矿物与硅酸盐产品(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览








文档简介
(共45张PPT)
1.实验室怎样来保存Na2SiO3溶液?
提示:因为硅酸的酸性比碳酸还弱,所以空气中的CO2可以和Na2SiO3水溶液发生如下反应Na2SiO3+H2O+CO2 ===== H2SiO3↓+Na2CO3从而使硅酸钠变质,因此硅酸钠要密封保存。同时,又由于硅酸钠为矿物胶,有较强的粘性,因此也不能用磨口的玻璃瓶和玻璃塞,以免瓶口粘结。
2.晶体是具有规则几何外形,并具有固定熔、沸点的物质,结合生活常识,思考并讨论,玻璃是不是晶体?
提示:玻璃没有固定的熔、沸点,是在一定条件下,一定温度范围内先逐步软化,而后又熔化的物质,称为玻璃态物质。所以玻璃不是晶体。
3.结合制玻璃的原料及其性质,思考并探究,在玻璃熔炉中会发生哪些化学反应?
提示:制玻璃的原料包括:纯碱、石灰石和石英三种物质。将原料研碎加入玻璃熔炉后,在高温条件下会发生以下几个反应:
SiO2+Na2CO3 Na2SiO3+CO2↑,
SiO2+CaCO3 CaSiO3+CO2↑。
高温
====
高温
====
【例题】已知普通玻璃的主要成分是Na2SiO3、CaSiO3和SiO2,若已知m(CaSiO3)∶m(Na2SiO3)∶m(SiO2)=58∶61∶
120,则制取玻璃所需原料中m(CaCO3)∶m(Na2CO3)∶
m(SiO2)=_________,制造普通玻璃时发生的主要反应为______,________。盛装氢氧化钠溶液的试剂瓶不能用玻璃塞的原因是:______________________(用离子方程式表示) 。
【规范解答】由题意可知,玻璃中m(CaSiO3)∶m(Na2SiO3) ∶
m(SiO2)=58∶61∶120,则需要反应制得CaSiO3 58 g,Na2SiO3 61 g,还需要SiO2 120 g,也就得出三种物质的物
质的量之比为: =1∶1∶4则需要CaCO3 1 mol、
Na2CO3 1 mol、SiO2 6 mol,也就得出制取玻璃所需原料中
m(CaCO3)∶m(Na2CO3)∶m(SiO2)=100∶106∶360=50∶53∶
180。
答案:50∶53∶180
Na2CO3+SiO2 Na2SiO3+CO2↑
CaCO3+SiO2 CaSiO3+CO2↑
2OH-+SiO2====SiO32-+H2O
高温
====
高温
====
【互动探究】如果普通玻璃中含有质量分数为13%的Na2O、11.7%的CaO、75.3%的SiO2,则三种物质的物质的量之比为多少?
提示:由所给信息可知,三者的物质的量之比为:
n(Na2O)∶n(CaO)∶n(SiO2)=
=1∶1∶6。
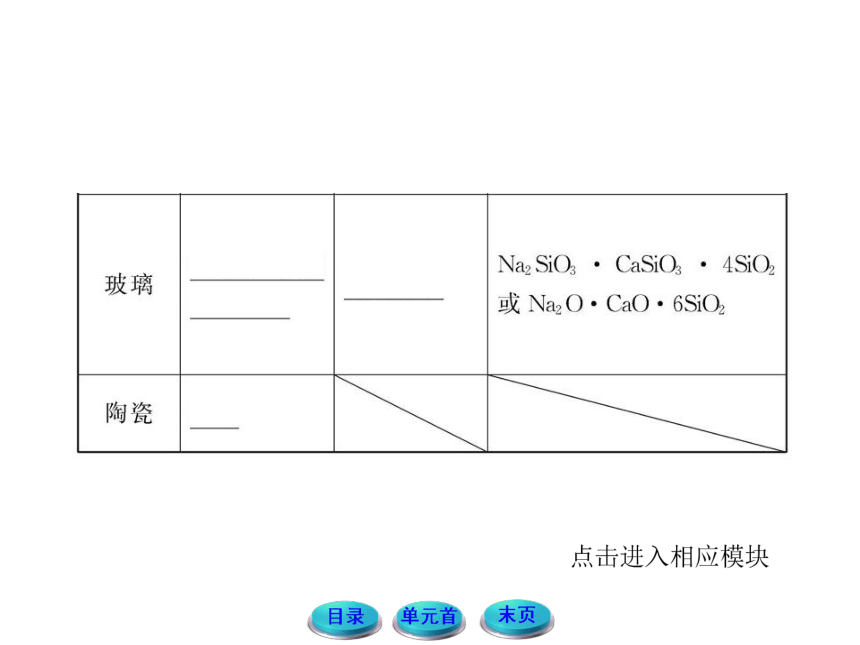
1.用氧化物的形式表示硅酸盐的顺序及注意事项:
硅酸盐的组成按氧化物的形式写时,它的顺序是:活泼金属氧化物→较活泼金属氧化物→SiO2→H2O,没水可以不写。要注意,
(1)氧化物之间用“·”隔开。
(2)各元素写成相应的氧化物,元素的价态保持不变。
(3)注意改写后应与原来化学式中的原子个数比保持不变。如:滑石Mg3(Si4O10)(OH)2可表示为3MgO·4SiO2·H2O。
(4)化学计量数配置出现分数时应化为整数。化为整数时,其他氧化物前的化学计量数相应改变。
(5)氧化物前的化学计量数代表氧化物本身,其比值仅指各氧化物化学计量数的最简比。
2.碳和硅的含氧酸盐与氧化物的反应原理比较:
(1)把CO2通入Na2SiO3溶液中,由于H2SiO3的酸性比H2CO3的酸性弱,且硅酸的溶解度小,发生Na2SiO3+CO2+H2O
====H2SiO3↓+Na2CO3,此反应是在水溶液中进行的复分解反应,符合“强酸制弱酸”的规律。
(2)SiO2+Na2CO3 Na2SiO3+CO2↑是在高温条件下发生的,CO2不断从体系中逸出,促使反应向生成Na2SiO3的方向进行。
高温
====
1.下列物质不属于硅酸盐的是( )
A.粘土 B.硅藻土
C.Al2(Si2O5)(OH)4 D.Mg2SiO4
【解析】选B。硅藻土是二氧化硅的一种形式,是硅的氧化物,而非硅酸盐。
2.生产水泥的主要设备是( )
A.熔炉 B.水泥回转窑
C.沸腾炉 D.合成塔
【解析】选B。生产水泥的主要设备是水泥回转窑。
3.关于水玻璃的叙述不正确的是( )
A.它是一种矿物胶,既不能燃烧也不易腐蚀
B.在建筑工业上可用作黏合剂和耐火材料
C.它在空气中易变质,因为SiO32-+CO2+H2O====H2SiO3↓+ CO32-
D.水玻璃的主要成分是二氧化硅
【解析】选D。水玻璃是Na2SiO3的水溶液,它是一种矿物胶,可以作黏合剂、防腐剂和耐火材料,在空气中容易吸收二氧化碳而变质。
4.石棉是一类具有压伸强度大、柔韧性强、耐热、耐高温、耐酸碱腐蚀等性质,且价格低廉的硅酸盐。其中一种叫矿青石棉,它的化学式为Na2Fe5Si8O22(OH)2。
(1)矿青石棉中与5个铁原子形成氧化物的氧原子数目是_____个。
(2)矿青石棉化学式中铁元素的“平均化合价”可视为_____;
(3)将该化合物的化学式改写为氧化物的形式为:______。
【解析】由于Na只能是+1价,Si只能是+4价,O只能是-2价,H只能是+1价,则可得2个钠结合1个O,8个Si结合16个O,2个H结合1个O,则可得出,这5个Fe结合的O为:24—1—16—1=6个,也就得出5个Fe共+12价,平均每个为+2.4价。
答案:(1)6 (2)+2.4
(3)Na2O·Fe2O3·3FeO·8SiO2·H2O
5.(2011·长春高一检测)有下列物品或设备:①陶瓷餐具②砖瓦③水泥路桥④门窗玻璃⑤水晶镜片⑥计算机芯片
⑦玛瑙手镯⑧硅太阳能电池⑨石英光导纤维。(用序号填写)
(1)用到硅单质的是_________。
(2)所用材料主要为SiO2的是__________。
(3)所用材料主要成分为硅酸盐的是___________。
【解析】由教材内容可知,陶瓷、砖瓦、水泥、玻璃的主要原料都是用硅酸盐;而水晶镜片、玛瑙手镯是用SiO2制成的;计算机芯片、硅太阳能电池是利用了硅能做半导体材料来做的。
答案:(1)⑥⑧ (2)⑤⑦⑨ (3)①②③④
一、选择题(本题包括6小题,每小题5分,共30分)
1.下列物质有固定熔点的是( )
A.玻璃 B.水泥
C.水玻璃 D.Na2O·SiO2
【解析】选D。有固定熔点的应该是晶体,而其他三种物质中,玻璃是玻璃态物质,而水泥和水玻璃是混合物,只有D中给的是纯净物。
2.在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是( )
A.纯碱 B.石灰石
C.石英 D.粘土
【解析】选B。比较这三种工业的原料即可得出。
【举一反三】石灰石在这三个工业中的作用是什么?
提示:炼铁时,石灰石是为了除掉SO2,而后两个都是制成产品的原料。
3.有关普通玻璃的叙述错误的是( )
A.玻璃是电的绝缘体,这种透明的物质是一种很复杂的混合物
B.制玻璃的原料是粘土
C.玻璃不是晶体
D.玻璃无一定的熔点
【解析】选B。由题意可知,玻璃的原料是纯碱、石灰石、石英这三种物质,没有粘土,其余对玻璃的叙述都是正确的。
【规律方法】石英玻璃、普通玻璃、钢化玻璃、有色玻璃的化学组成和性质的异同
石英玻璃是由二氧化硅组成的玻璃,其硬度较大,膨胀系数低,耐热性、化学稳定性和电绝缘性都好。把普通玻璃加热到接近软化温度后急速均匀冷却得到钢化玻璃。所以普通玻璃和钢化玻璃的化学组成相同,都是钠、钙的硅酸盐,但钢化玻璃的机械强度比普通玻璃大,热稳定性也较高。有色玻璃的化学组成与普通玻璃相比,增加了某些金属氧化物。
4.Na2SiO3与Na2CO3的共同性质是:①易溶于水;②水溶液能与CO2反应;③与稀硫酸发生复分解反应;④水溶液有黏合性能( )
A.④ B.①②③ C.除②外 D.①②③④
【解析】选B。Na2SiO3与Na2CO3的性质见表:
5.某硅酸盐样品中锌的质量分数为58.6%,其化学组成用氧化物形式可表示为nZnO·SiO2,则n值等于( )
A.0.5 B.1 C.2 D.3
【解析】选C。由题意可知,Zn的质量分数为:
w(Zn)= =58.6%,即可求出:n≈2。
6.高岭土的组成可表示为Al2Si2Ox(OH)y,其中x、y的数值分别是( )
A.7、2 B.5、4 C.6、3 D.3、6
【解析】选B。解答此题涉及两个未知数x、y,但由化合价规则只能列出一个方程,因而本题要用解不定方程的知识。根据化合价规则,Al为+3价,Si为+4价,O为-2价,OH为-1价,则有2×(+3)+2×(+4)+x×(-2)+y×(-1)=0,化简得2x+y=14,将A~D中x、y值代入,只有B项符合方程。
二、非选择题(本题包括2小题,共20分)
7.(10分)(2011·姜堰高一检测)我省物产资源丰富。东海有蛭石,蛭石为一种层状结构的含镁铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,因此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
(1)固体A的化学式是_______________;
(2)固体F的物质的量是_______________;
(3)通过计算,写出用氧化物的形式表示该种膨化蛭石组成的化学式______________。
【解析】由题意可知A为SiO2,n(SiO2)=
=0.04 mol,设固体G中Fe2O3的物质的量为x,MgO的物质的量为y。
依题意有:
解得:x=0.020 mol y=0.080 mol
n[Al(OH)3]=
n(Al2O3)=0.020 mol
于是n(H2O)=(11.20-40×0.08-60×0.040-160×0.020-102×0.020)÷18=0.020 (mol)
则: n(MgO )∶n(Fe2O3)∶n(Al2O3)∶n(SiO2)∶n(H2O)
=0.080 mol∶0.020 mol∶0.020 mol∶0.040 mol∶
0.020 mol=8∶2∶2∶4∶2=4∶1∶1∶2∶1
即该蛭石矿的组成为:4MgO·Al2O3·Fe2O3·2SiO2·H2O。
答案:(1)SiO2 (2)0.040 mol
(3)4 MgO·Al2O3·Fe2O3·2SiO2·H2O
8.(10分)往10 g Na2SiO3溶液中慢慢滴入一定浓度的稀盐酸,当反应完全时共用去稀盐酸20 mL,将生成的沉淀滤出,在空气中灼烧后,称得残留固体质量为1.5 g,求:
(1)稀盐酸的物质的量浓度为________________。
(2)该Na2SiO3溶液的质量分数为_______________。
【解析】由Na2SiO3+2HCl====2NaCl+H2SiO3↓,H2SiO3
SiO2+H2O有如下关系式:Na2SiO3~2HCl~SiO2。n(Na2SiO3)=n(SiO2)= =0.025 mol,n(HCl)=2n(SiO2)=2×0.025 mol=0.05 mol,m(Na2SiO3)=
0.025 mol×122 g/mol=3.05 g,该Na2SiO3溶液的质量分
数为:
w(Na2SiO3)= ×100%=30.5%。稀盐酸的物质的量浓度
为:c(HCl)= =2.5 mol/L。
答案:(1)2.5 mol/L (2)30.5%
△
====
1.实验室怎样来保存Na2SiO3溶液?
提示:因为硅酸的酸性比碳酸还弱,所以空气中的CO2可以和Na2SiO3水溶液发生如下反应Na2SiO3+H2O+CO2 ===== H2SiO3↓+Na2CO3从而使硅酸钠变质,因此硅酸钠要密封保存。同时,又由于硅酸钠为矿物胶,有较强的粘性,因此也不能用磨口的玻璃瓶和玻璃塞,以免瓶口粘结。
2.晶体是具有规则几何外形,并具有固定熔、沸点的物质,结合生活常识,思考并讨论,玻璃是不是晶体?
提示:玻璃没有固定的熔、沸点,是在一定条件下,一定温度范围内先逐步软化,而后又熔化的物质,称为玻璃态物质。所以玻璃不是晶体。
3.结合制玻璃的原料及其性质,思考并探究,在玻璃熔炉中会发生哪些化学反应?
提示:制玻璃的原料包括:纯碱、石灰石和石英三种物质。将原料研碎加入玻璃熔炉后,在高温条件下会发生以下几个反应:
SiO2+Na2CO3 Na2SiO3+CO2↑,
SiO2+CaCO3 CaSiO3+CO2↑。
高温
====
高温
====
【例题】已知普通玻璃的主要成分是Na2SiO3、CaSiO3和SiO2,若已知m(CaSiO3)∶m(Na2SiO3)∶m(SiO2)=58∶61∶
120,则制取玻璃所需原料中m(CaCO3)∶m(Na2CO3)∶
m(SiO2)=_________,制造普通玻璃时发生的主要反应为______,________。盛装氢氧化钠溶液的试剂瓶不能用玻璃塞的原因是:______________________(用离子方程式表示) 。
【规范解答】由题意可知,玻璃中m(CaSiO3)∶m(Na2SiO3) ∶
m(SiO2)=58∶61∶120,则需要反应制得CaSiO3 58 g,Na2SiO3 61 g,还需要SiO2 120 g,也就得出三种物质的物
质的量之比为: =1∶1∶4则需要CaCO3 1 mol、
Na2CO3 1 mol、SiO2 6 mol,也就得出制取玻璃所需原料中
m(CaCO3)∶m(Na2CO3)∶m(SiO2)=100∶106∶360=50∶53∶
180。
答案:50∶53∶180
Na2CO3+SiO2 Na2SiO3+CO2↑
CaCO3+SiO2 CaSiO3+CO2↑
2OH-+SiO2====SiO32-+H2O
高温
====
高温
====
【互动探究】如果普通玻璃中含有质量分数为13%的Na2O、11.7%的CaO、75.3%的SiO2,则三种物质的物质的量之比为多少?
提示:由所给信息可知,三者的物质的量之比为:
n(Na2O)∶n(CaO)∶n(SiO2)=
=1∶1∶6。
1.用氧化物的形式表示硅酸盐的顺序及注意事项:
硅酸盐的组成按氧化物的形式写时,它的顺序是:活泼金属氧化物→较活泼金属氧化物→SiO2→H2O,没水可以不写。要注意,
(1)氧化物之间用“·”隔开。
(2)各元素写成相应的氧化物,元素的价态保持不变。
(3)注意改写后应与原来化学式中的原子个数比保持不变。如:滑石Mg3(Si4O10)(OH)2可表示为3MgO·4SiO2·H2O。
(4)化学计量数配置出现分数时应化为整数。化为整数时,其他氧化物前的化学计量数相应改变。
(5)氧化物前的化学计量数代表氧化物本身,其比值仅指各氧化物化学计量数的最简比。
2.碳和硅的含氧酸盐与氧化物的反应原理比较:
(1)把CO2通入Na2SiO3溶液中,由于H2SiO3的酸性比H2CO3的酸性弱,且硅酸的溶解度小,发生Na2SiO3+CO2+H2O
====H2SiO3↓+Na2CO3,此反应是在水溶液中进行的复分解反应,符合“强酸制弱酸”的规律。
(2)SiO2+Na2CO3 Na2SiO3+CO2↑是在高温条件下发生的,CO2不断从体系中逸出,促使反应向生成Na2SiO3的方向进行。
高温
====
1.下列物质不属于硅酸盐的是( )
A.粘土 B.硅藻土
C.Al2(Si2O5)(OH)4 D.Mg2SiO4
【解析】选B。硅藻土是二氧化硅的一种形式,是硅的氧化物,而非硅酸盐。
2.生产水泥的主要设备是( )
A.熔炉 B.水泥回转窑
C.沸腾炉 D.合成塔
【解析】选B。生产水泥的主要设备是水泥回转窑。
3.关于水玻璃的叙述不正确的是( )
A.它是一种矿物胶,既不能燃烧也不易腐蚀
B.在建筑工业上可用作黏合剂和耐火材料
C.它在空气中易变质,因为SiO32-+CO2+H2O====H2SiO3↓+ CO32-
D.水玻璃的主要成分是二氧化硅
【解析】选D。水玻璃是Na2SiO3的水溶液,它是一种矿物胶,可以作黏合剂、防腐剂和耐火材料,在空气中容易吸收二氧化碳而变质。
4.石棉是一类具有压伸强度大、柔韧性强、耐热、耐高温、耐酸碱腐蚀等性质,且价格低廉的硅酸盐。其中一种叫矿青石棉,它的化学式为Na2Fe5Si8O22(OH)2。
(1)矿青石棉中与5个铁原子形成氧化物的氧原子数目是_____个。
(2)矿青石棉化学式中铁元素的“平均化合价”可视为_____;
(3)将该化合物的化学式改写为氧化物的形式为:______。
【解析】由于Na只能是+1价,Si只能是+4价,O只能是-2价,H只能是+1价,则可得2个钠结合1个O,8个Si结合16个O,2个H结合1个O,则可得出,这5个Fe结合的O为:24—1—16—1=6个,也就得出5个Fe共+12价,平均每个为+2.4价。
答案:(1)6 (2)+2.4
(3)Na2O·Fe2O3·3FeO·8SiO2·H2O
5.(2011·长春高一检测)有下列物品或设备:①陶瓷餐具②砖瓦③水泥路桥④门窗玻璃⑤水晶镜片⑥计算机芯片
⑦玛瑙手镯⑧硅太阳能电池⑨石英光导纤维。(用序号填写)
(1)用到硅单质的是_________。
(2)所用材料主要为SiO2的是__________。
(3)所用材料主要成分为硅酸盐的是___________。
【解析】由教材内容可知,陶瓷、砖瓦、水泥、玻璃的主要原料都是用硅酸盐;而水晶镜片、玛瑙手镯是用SiO2制成的;计算机芯片、硅太阳能电池是利用了硅能做半导体材料来做的。
答案:(1)⑥⑧ (2)⑤⑦⑨ (3)①②③④
一、选择题(本题包括6小题,每小题5分,共30分)
1.下列物质有固定熔点的是( )
A.玻璃 B.水泥
C.水玻璃 D.Na2O·SiO2
【解析】选D。有固定熔点的应该是晶体,而其他三种物质中,玻璃是玻璃态物质,而水泥和水玻璃是混合物,只有D中给的是纯净物。
2.在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是( )
A.纯碱 B.石灰石
C.石英 D.粘土
【解析】选B。比较这三种工业的原料即可得出。
【举一反三】石灰石在这三个工业中的作用是什么?
提示:炼铁时,石灰石是为了除掉SO2,而后两个都是制成产品的原料。
3.有关普通玻璃的叙述错误的是( )
A.玻璃是电的绝缘体,这种透明的物质是一种很复杂的混合物
B.制玻璃的原料是粘土
C.玻璃不是晶体
D.玻璃无一定的熔点
【解析】选B。由题意可知,玻璃的原料是纯碱、石灰石、石英这三种物质,没有粘土,其余对玻璃的叙述都是正确的。
【规律方法】石英玻璃、普通玻璃、钢化玻璃、有色玻璃的化学组成和性质的异同
石英玻璃是由二氧化硅组成的玻璃,其硬度较大,膨胀系数低,耐热性、化学稳定性和电绝缘性都好。把普通玻璃加热到接近软化温度后急速均匀冷却得到钢化玻璃。所以普通玻璃和钢化玻璃的化学组成相同,都是钠、钙的硅酸盐,但钢化玻璃的机械强度比普通玻璃大,热稳定性也较高。有色玻璃的化学组成与普通玻璃相比,增加了某些金属氧化物。
4.Na2SiO3与Na2CO3的共同性质是:①易溶于水;②水溶液能与CO2反应;③与稀硫酸发生复分解反应;④水溶液有黏合性能( )
A.④ B.①②③ C.除②外 D.①②③④
【解析】选B。Na2SiO3与Na2CO3的性质见表:
5.某硅酸盐样品中锌的质量分数为58.6%,其化学组成用氧化物形式可表示为nZnO·SiO2,则n值等于( )
A.0.5 B.1 C.2 D.3
【解析】选C。由题意可知,Zn的质量分数为:
w(Zn)= =58.6%,即可求出:n≈2。
6.高岭土的组成可表示为Al2Si2Ox(OH)y,其中x、y的数值分别是( )
A.7、2 B.5、4 C.6、3 D.3、6
【解析】选B。解答此题涉及两个未知数x、y,但由化合价规则只能列出一个方程,因而本题要用解不定方程的知识。根据化合价规则,Al为+3价,Si为+4价,O为-2价,OH为-1价,则有2×(+3)+2×(+4)+x×(-2)+y×(-1)=0,化简得2x+y=14,将A~D中x、y值代入,只有B项符合方程。
二、非选择题(本题包括2小题,共20分)
7.(10分)(2011·姜堰高一检测)我省物产资源丰富。东海有蛭石,蛭石为一种层状结构的含镁铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,因此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
(1)固体A的化学式是_______________;
(2)固体F的物质的量是_______________;
(3)通过计算,写出用氧化物的形式表示该种膨化蛭石组成的化学式______________。
【解析】由题意可知A为SiO2,n(SiO2)=
=0.04 mol,设固体G中Fe2O3的物质的量为x,MgO的物质的量为y。
依题意有:
解得:x=0.020 mol y=0.080 mol
n[Al(OH)3]=
n(Al2O3)=0.020 mol
于是n(H2O)=(11.20-40×0.08-60×0.040-160×0.020-102×0.020)÷18=0.020 (mol)
则: n(MgO )∶n(Fe2O3)∶n(Al2O3)∶n(SiO2)∶n(H2O)
=0.080 mol∶0.020 mol∶0.020 mol∶0.040 mol∶
0.020 mol=8∶2∶2∶4∶2=4∶1∶1∶2∶1
即该蛭石矿的组成为:4MgO·Al2O3·Fe2O3·2SiO2·H2O。
答案:(1)SiO2 (2)0.040 mol
(3)4 MgO·Al2O3·Fe2O3·2SiO2·H2O
8.(10分)往10 g Na2SiO3溶液中慢慢滴入一定浓度的稀盐酸,当反应完全时共用去稀盐酸20 mL,将生成的沉淀滤出,在空气中灼烧后,称得残留固体质量为1.5 g,求:
(1)稀盐酸的物质的量浓度为________________。
(2)该Na2SiO3溶液的质量分数为_______________。
【解析】由Na2SiO3+2HCl====2NaCl+H2SiO3↓,H2SiO3
SiO2+H2O有如下关系式:Na2SiO3~2HCl~SiO2。n(Na2SiO3)=n(SiO2)= =0.025 mol,n(HCl)=2n(SiO2)=2×0.025 mol=0.05 mol,m(Na2SiO3)=
0.025 mol×122 g/mol=3.05 g,该Na2SiO3溶液的质量分
数为:
w(Na2SiO3)= ×100%=30.5%。稀盐酸的物质的量浓度
为:c(HCl)= =2.5 mol/L。
答案:(1)2.5 mol/L (2)30.5%
△
====
