11-12版高中化学课时讲练通配套课件:4.1.1二氧化硫的性质和作用(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:4.1.1二氧化硫的性质和作用(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览






文档简介
(共65张PPT)
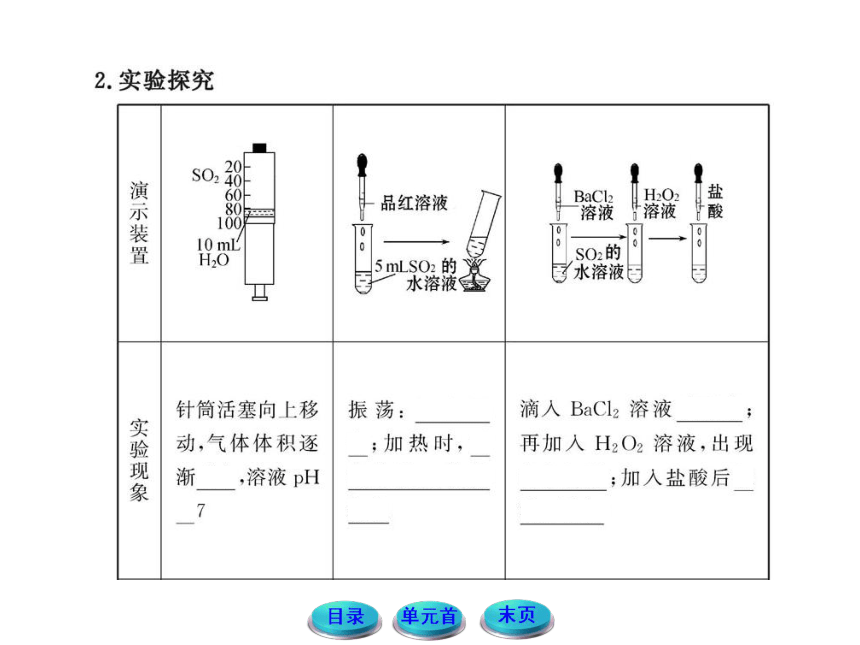
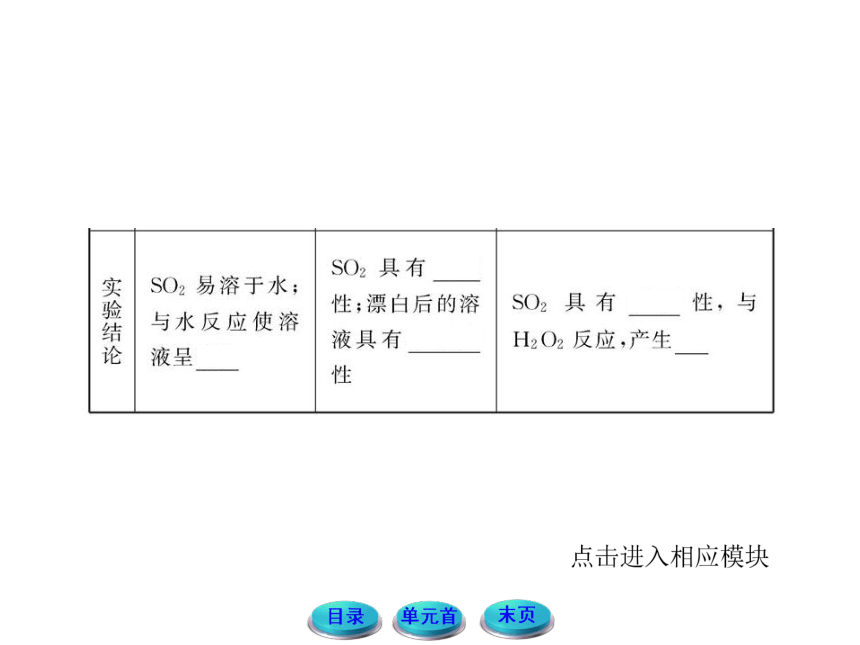
1.标出SO2中硫的化合价,请结合氧化还原的规律,思考并讨论,在SO2中硫的价态可以发生哪些变化?有哪些性质?
提示:SO2中硫元素的化合价为+4价,既可以升高至+6价,也可以降至0价或-2价。所以SO2既具有氧化性,也具有还原性。
2.有一同学想验证SO2的漂白性,他用了紫色石蕊试液,将SO2通入后发现紫色石蕊试液没褪色反而迅速变成了红色,思考并讨论,出现这种现象的原因。
提示:这是因为SO2虽然有漂白性,但SO2不能漂白酸碱指示剂,又因为SO2是酸性氧化物,遇到紫色石蕊试液会与水反应,生成亚硫酸,亚硫酸能使紫色石蕊试液变红,但不能使它褪色。
3.SO2和Cl2都是具有漂白性的物质,若同时将等物质的量的两种气体通入有色试液中,其漂白效果是不是更好?
提示:由于SO2和Cl2分别具有还原性和氧化性,通入水中二者易发生反应Cl2+SO2+2H2O===2HCl+H2SO4,导致漂白效果减弱甚至消失。
例1 如图所示装置是实验室制取SO2并验证SO2的某些性质的装置。试回答:
(1)在F中发生的化学反应方程式为___________________。
(2)A中的实验现象为________,此实验证明SO2是______。
(3)B中的品红试液__________,证明SO2有__________性。
(4)C中的实验现象是________,证明SO2有__________性。
(5)D中的实验现象是________,证明SO2有__________性。
(6)E的作用是________,反应的化学方程式是_________。
【规范解答】由于SO2易溶于水,且与水发生反应生成亚硫酸,能使紫色石蕊试液变红色,而不能使之褪色,SO2具有漂白性,能使品红试液褪色,SO2还具有弱氧化性,能与H2S反应生成硫单质沉淀,SO2还具有还原性,能使碘水褪色。
答案:(1)Na2SO3+H2SO4(浓) ====SO2↑+Na2SO4+H2O
(2)紫色石蕊试液变红 酸性氧化物
(3)褪色 漂白 (4)溶液变浑浊 氧化
(5)碘水颜色褪去 还原
(6)吸收多余的SO2,防止空气污染
2NaOH+SO2 ==== Na2SO3+H2O
【互动探究】SO2通入酸性KMnO4溶液中,溶液的颜色褪去,是不是SO2的漂白性所致?
提示:不是。酸性KMnO4溶液具有强氧化性,而SO2具有较强的还原性,二者发生了氧化还原反应,导致MnO4-被还原为Mn2+而使颜色褪去。
漂白剂的分类
(1)氧化性漂白,如HClO(漂白粉作漂白剂时也是转化为HClO)、H2O2、Na2O2等,由于这些物质具有强氧化性,与有色物质发生氧化还原反应而使之褪色,这种漂白比较稳定,长久放置也不会恢复原色。
(2)化合漂白,如SO2,是与有色物质发生化合反应而使之褪色,但这种漂白不稳定,受热或长期放置会恢复原色。
(3)吸附漂白,如活性炭,通过吸附色素漂白有色物质,是物理漂白,稳定。
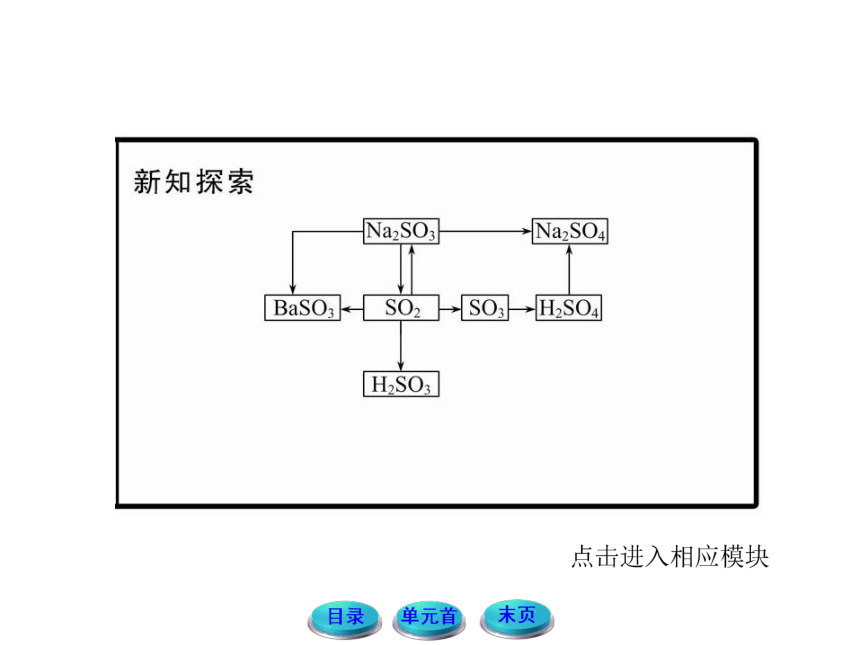
1.回顾氧化还原的知识,结合SO2、H2SO3的化合价,思考并分析SO2、H2SO3的性质有哪些?讨论并预测Na2SO3的性质,尝试写出有关的化学方程式。
提示:SO2、H2SO3中S元素的价态都是+4价,既可以升高被氧化,也可以降低被还原,所以既可以表现出还原性,也可以表现出氧化性。而Na2SO3中S的价态也是+4价,也可表现氧化性和还原性。如:2Na2SO3+O2====2Na2SO4,
Na2SO3+2Na2S+3H2SO4 ====3Na2SO4+3S↓+3H2O
2.结合前面所学知识思考并讨论,如果将收集的酸雨敞口放置一段时间,溶液的酸性将如何变化?变化的原因是什么?
提示:收集到的酸雨中主要含有H2SO3,是一种弱酸,由于H2SO3中S的价态是+4价,具有较强的还原性,在空气中露置一段时间,会与空气中的O2发生反应:
2H2SO3+O2 ==== 2H2SO4,生成强酸,导致溶液的酸性增强。
3.试结合电解质及电离的知识,讨论并分析,将SO2溶于水时会发生哪些反应?存在哪些过程?所得的溶液中,都有哪些微粒?
提示:SO2溶于水,会与水发生反应生成H2SO3,其方程式为:SO2+H2O H2SO3,而H2SO3是一种弱酸,会发生分步电离,H2SO3 H++HSO3-,HSO3- H++SO32-所得溶液中存在SO2、H2O、H2SO3等分子,也存在H+、HSO3-、SO32-等离子。
例2 (2011·扬州高一检测)已知X、Y、Z都是中学化学中常见的三种气体,X的颜色为黄绿色,向X的水溶液中滴入品红试液,品红褪色,将溶液加热后,溶液颜色无明显变化;向Y的水溶液中滴入品红试液,品红褪色,将溶液加热后,溶液又呈红色;向Z的水溶液中滴入红色石蕊试液,溶液呈蓝色。据此回答下列问题:
(1)试写出下列物质的化学式:Y_____、Z _____ 。
(2)将X通入Y的水溶液中发生反应的化学方程式是______。
(3)往Z的水溶液中通入少量Y,发生反应的化学方程式是____________________________。
【规范解答】由题意可知,X气体是氯气,而Y气体也具有漂白性,但漂白后的溶液受热后又恢复颜色,则说明Y是SO2,而使红色石蕊试液变蓝的气体只有NH3,故Z是NH3。
答案:(1)SO2 NH3
(2)Cl2+SO2+2H2O====2HCl+H2SO4
(3)2NH3+SO2+H2O====(NH4)2SO3
【互动探究】若将Y气体通入到BaCl2溶液中,能否生成沉淀?若再通入X气体,会有什么现象?
提示:SO2溶于水生成H2SO3,在酸性条件下不会生成BaSO3沉淀。若再通入Cl2,Cl2会将H2SO3氧化成H2SO4,H2SO4与BaCl2会生成BaSO4沉淀。
在工业上吸收废气中SO2气体的方法
(1)生石灰固硫法:
SO2+CaO====CaSO3
2CaSO3+O2====2CaSO4
(2)石灰水悬浊液洗涤法:
SO2+Ca(OH)2====CaSO3↓+H2O,
2CaSO3+O2====2CaSO4
(3)氨水脱硫法:
SO2+2NH3+H2O====(NH4)2SO3
SO2+NH3+H2O====NH4HSO3
(NH4)2SO3+H2SO4====(NH4)2SO4+SO2↑+H2O
2NH4HSO3+H2SO4====(NH4)2SO4+2SO2↑+2H2O
SO2和CO2性质的比较
探究:
1.根据CO2和SO2物理性质上的差异,如何鉴别CO2和SO2?
提示:闻气味,CO2为无味气体,SO2有刺激性气味。
2.根据CO2和SO2化学性质上的差异,如何鉴别CO2和SO2?
提示:(1)利用二氧化硫的还原性,根据通入酸性高锰酸钾溶液或溴水中是否褪色鉴别。
(2)利用二氧化硫的漂白性,根据通入品红溶液中是否褪色鉴别。
3.CO2和SO2均为酸性氧化物,在性质上具有一定的相似性,结合已有的知识探究能否用澄清石灰水鉴别CO2和SO2,为什么?
提示:不能,少量的CO2和SO2通入到澄清石灰水中,均产生白色沉淀;足量的CO2和SO2通入到澄清石灰水中现象均是先变浑浊后变澄清。
4.若要证明某气体是CO2和SO2的混合气体,应进行怎样的操作?
提示:证明SO2存在可使用品红溶液,证明CO2存在可使用澄清石灰水,但由于SO2也可使澄清石灰水变浑浊,因此应先使气体通入品红溶液中,验证SO2存在后将气体通入足量酸性KMnO4溶液中以除去SO2,然后再通入品红溶液中验证SO2是否被除尽,最后再通入澄清石灰水中以验证CO2的存在。
5.已知:酸性H2SO3>H2CO3,除去CO2中的SO2有几种方法?
提示:(1)用饱和NaHCO3溶液,2NaHCO3+SO2====Na2SO3+2CO2
+H2O。
(2)用酸性KMnO4溶液或溴水,2KMnO4+5SO2+2H2O====
2MnSO4+K2SO4+2H2SO4;
SO2+Br2+2H2O====H2SO4+2HBr。
1.区别SO2与CO2可用的试剂是( )
A.品红溶液
B.澄清石灰水
C.紫色石蕊试液
D.BaCl2溶液
【解析】选A。由题意可知,SO2、CO2通入澄清石灰水中都是先有白色沉淀生成,通入的气体过量后,白色沉淀又会消失;而通入紫色石蕊试液中又都会变红;通入BaCl2溶液中都无现象;通入品红溶液中,SO2会使之褪色,而CO2不会。
2.将SO2通入显红色的酚酞试液中,发现红色消失,主要是因为SO2( )
A.有漂白性
B.有还原性
C.溶于水后显酸性
D.有氧化性
【解析】选C。由题意可得,使酚酞试液显红色的物质是碱性物质,通入SO2后,形成的H2SO3与碱性物质发生反应,导致颜色褪去。
3.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg/L,下列措施中不能够减少SO2排放量的是( )
A.使用水煤气或干馏煤气作燃料
B.将烟囱加高
C.在煤中加入石灰后燃用
D.循环处理吸收塔放出的尾气
【解析】选B。将烟囱加高不能减少向大气中排放SO2的量,对SO2的排放量没影响。
4.已知A是一种固体单质,根据如图所示,判断:
A._________,B._________,C._________。
反应的化学方程式是:
①________________________________________,
②________________________________________,
③________________________________________。
【解析】由题意可知,A是固体单质,与O2反应生成的氧化物与其氢化物反应能生成这种单质,所以这种单质是硫单质,也就得出其答案。
答案:S SO2 H2S
S+O2 SO2
SO2+2H2S====3S↓+2H2O
H2+S H2S
△
====
点燃
====
5.实验室常采用下列方法制取气体A、B,①Na2SO3与浓硫酸反应产生气体A;气体A具有刺激性气味且可以使品红溶液褪色,经加热后又变红;②MnO2与浓盐酸在加热条件下产生气体B;试回答下列问题:
(1)分别写出两种气体的化学式:A__________________、
B______________。
(2)写出制取以上两种气体的化学方程式:
①______________________________________________;
②______________________________________________。
(3)把气体A和B按物质的量之比1∶1通入水中,生成两种强酸,试写出该反应的化学方程式:___________________,
其中____________是还原剂,____________是氧化剂。
(4)气体A和潮湿的气体B皆可作漂白剂,若用两者(体积比1∶1)同时漂白一种物质时,漂白效果会______。
A.增强 B.不变
C.减弱 D.以上都有可能
【解析】由题意可得,这是一个由气体性质和气体制备结合在一起的试题,在处理时要仔细阅读,认真分析,Na2SO3与浓硫酸反应产生气体A,可得A是SO2,MnO2与浓盐酸在加热条件下产生气体B,可得B为Cl2。
答案:(1)SO2 Cl2
(2)①Na2SO3+H2SO4(浓)====Na2SO4+H2O+SO2↑
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(3)Cl2+SO2+2H2O====H2SO4+2HCl SO2 Cl2
(4)C
△
====
一、选择题(本题包括6小题,每小题4分,共24分)
1.既能使潮湿的蓝色石蕊试纸变红,又能使品红溶液褪色,还能使溴水褪色的是( )
A.CO2 B.H2S
C.Cl2 D.SO2
【解析】选D。目标气体必须是酸性气体,且有漂白性,可选择的选项为SO2。
2.(2011·乌鲁木齐高一检测)银耳本身为淡黄色,某地出产一种雪耳,颜色洁白如雪。其制作过程如下:将银耳堆放在密封状态良好的塑料棚内,在棚的一端支一口锅,锅内放入硫磺,加热使硫磺熔化并燃烧,两天左右雪耳就制成了,这种雪耳炖不烂,且对人有害。制作雪耳利用的是
( )
A.硫的还原性 B.SO2的漂白性
C.硫的漂白性 D.SO2的还原性
【解析】选B。由题意可知,将硫加热并燃烧后,产生SO2,使银耳由淡黄色变为雪白色,则说明这是由SO2具有的漂白性所致。
3.香烟烟雾中往往含有CO和SO2气体,下列关于这两种气体的说法中正确的是( )
A.两者都易溶于水
B.两者都是形成酸雨的主要原因
C.两者都能使品红溶液褪色
D.两者都污染环境,危害健康
【解析】选D。由题意可得,对于CO和SO2这两种气体来说,CO是难溶于水的气体,而CO不会形成酸雨,也不能使品红溶液褪色,但两种气体都有毒,污染环境,危害人体健康。
【举一反三】如果将CO换成CO2,两种气体会有什么共同之处呢?
提示:两种都是酸性气体,都能使澄清石灰水变浑浊,过量又变澄清等。
4.检验SO2中是否混有CO2气体,可采用的方法是( )
A.通过品红溶液
B.先通过NaOH溶液,再通入澄清石灰水
C.通过澄清石灰水
D.先通过酸性KMnO4溶液,再通过澄清石灰水
【解析】选D。A选项检验的是SO2;B选项不管是否混有CO2都不会产生白色沉淀;C选项不管有没有CO2都会产生白色沉淀,不能验证有无CO2;只有D选项,酸性KMnO4溶液将SO2完全吸收,通过澄清石灰水,若有白色沉淀则一定有CO2,若无沉淀则无CO2,故正确答案为D。
5.下列有关酸雨的说法正确的是( )
A.酸雨就是指pH<7的雨水
B.酸雨是因为雨水中含有CO2
C.工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因
D.酸雨没有危害,所以不必担心,也不必想办法治理
【解析】选C。酸雨就是由于空气污染造成雨水的酸性比较强,pH一般在5左右,是由于SO2、NO2等造成的,而不是CO2造成的;SO2是形成酸雨的主要原因之一,主要来源于工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属,酸雨的危害很大。
6.2010年4月22日是第41个世界地球日,国土资源部确定我国今年的地球日的主题为“珍惜地球资源,转变发展方式,倡导低碳生活”。开发新能源可以降低酸雨所造成的危害,下列与这一主题不相符的是( )
①用天然气代替煤作民用燃料
②提高热能利用率
③使用CS2萃取煤炭中的硫
④加大石油、煤炭的开采速度,增加化石燃料的供应量
⑤推广燃煤脱硫技术,防治SO2的污染
⑥尽量开发太阳能、核能、氢能等新型能源
⑦将块状煤粉碎,提高其燃烧效率
A.①③④⑥⑦ B.②③⑤⑥
C.③④⑦ D.①②③⑤⑦
【解析】选C。由题中信息可知,其中③中的CS2也是一种有毒物质,而且在煤中的硫也不是硫单质;④与现在的要求差别很大,违背题干要求;⑦将块状煤粉碎,提高其燃烧效率对空气的污染没有减少。所以以上几条都与题干中的主题不相符。
二、非选择题(本题包括2小题,共26分)
7.(15分)(2011·东莞高一检测)甲、乙两同学进行化学研究性学习:测定某雨水的pH并判断该雨水是否为酸雨。
甲同学取pH试纸用蒸馏水湿润后置于表面皿中,取雨水少量并滴几滴雨水到pH试纸上,与标准比色卡对照,测得pH为6。由此,甲同学得出这次雨水不是酸雨的结论。
乙同学用烧杯取雨水少许,用pH试纸正确测定该雨水的pH,测得pH为5。露置于教室中一段时间后,再测得pH为4。
请回答下列问题:
(1)上述甲、乙两同学化学研究性学习思路的可取之处是
_______________________________________________。
(2)你认为甲同学的结论是否合理并说明你的理由
______________________________________________。
(3)请你解释乙同学的实验中先测得pH为5,露置于教室中一段时间后,再测得pH为4的原因(用化学方程式并结合文字说明)_________________________________。
(4)酸雨形成的原因与下列哪些气体有关(填代号)___。
A.CO2 B.SO2 C.CO
(5)用Na2SO3溶液吸收工业中SO2尾气是一种治理工业SO2尾气污染比较新颖的方法。试用化学方程式表示其原理________________________。
【解析】(1) 通过实验的方法来解决化学问题。(2)用pH试纸测定溶液的pH时应保持试纸干燥。(3)这是因为雨水中含有H2SO3,H2SO3具有较强的还原性,可逐渐的被空气中的O2氧化成H2SO4,而H2SO4的酸性强于H2SO3。
答案:(1)通过实验的方法来解决化学问题
(2)不合理。甲同学测定雨水的pH前将pH试纸用蒸馏水润湿,相当于将雨水进行稀释
(3)2H2SO3+O2====2H2SO4,生成的H2SO4是强酸使酸性增强
(4)B
(5)Na2SO3+SO2+H2O====2NaHSO3
8.(11分)某化学兴趣小组模拟测定硫酸工业生产中的SO2、N2、O2的混合气体中SO2的体积分数,选用了下列简易装置:
(1)若混合气体的流向按从左到右时,上述实验装置的连接顺序是:混合气体→_____(填“a”、“b”、“c”、“d”、“e”)。
(2)装置③中发生反应的离子方程式为:_____。当装置③中恰好出现蓝色褪去现象时,应立即停止通气。若此时没有及时停止通气,则测定的SO2的体积分数_____(填“偏高”、“偏低”或“不受影响”)。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,与SO2气体恰好完全反应,收集到的N2和O2的体积为297.6 mL(已折算成标准状况下的体积)。则SO2的体积分数为_____。
【解析】由题意可知,测定气体的体积实际上是用气体将①瓶中的水排出来,然后测定排出的水的体积即可,但在排水之前,应先将混合气体中的SO2用碘反应掉,所以顺序为:c→d→b→a→e,若③中出现现象后没有及时停止通气,那么将有一部分SO2没有与I2反应进入到后面的集气瓶中,造成碘吸收的SO2比实际的小,结果偏低;由碘和SO2反应的离子方程式I2+SO2+2H2O====2I-+ SO42-+4H+可以得出,I2和SO2在反应中是1∶1的关系,则由于I2的量为:
0.02 L×0.05 mol/L=0.001 mol,即SO2的物质的量也是0.001 mol,其标准状况下的体积为22.4 mL,所以其体积分数为:
答案:(1)c→d→b→a→e
(2)I2+SO2+2H2O====2I-+ SO42- +4H+ 偏低
(3)7%
【规律方法】检验SO2和吸收SO2的常用试剂
(1)可用于吸收SO2的试剂还有:NaOH溶液、酸性KMnO4溶液、溴水、氨水。
(2)可用于检验SO2的试剂有:品红溶液、酸性KMnO4溶液、溴水、碘的淀粉溶液。在没有CO2干扰时,也可以用澄清石灰水。
1.标出SO2中硫的化合价,请结合氧化还原的规律,思考并讨论,在SO2中硫的价态可以发生哪些变化?有哪些性质?
提示:SO2中硫元素的化合价为+4价,既可以升高至+6价,也可以降至0价或-2价。所以SO2既具有氧化性,也具有还原性。
2.有一同学想验证SO2的漂白性,他用了紫色石蕊试液,将SO2通入后发现紫色石蕊试液没褪色反而迅速变成了红色,思考并讨论,出现这种现象的原因。
提示:这是因为SO2虽然有漂白性,但SO2不能漂白酸碱指示剂,又因为SO2是酸性氧化物,遇到紫色石蕊试液会与水反应,生成亚硫酸,亚硫酸能使紫色石蕊试液变红,但不能使它褪色。
3.SO2和Cl2都是具有漂白性的物质,若同时将等物质的量的两种气体通入有色试液中,其漂白效果是不是更好?
提示:由于SO2和Cl2分别具有还原性和氧化性,通入水中二者易发生反应Cl2+SO2+2H2O===2HCl+H2SO4,导致漂白效果减弱甚至消失。
例1 如图所示装置是实验室制取SO2并验证SO2的某些性质的装置。试回答:
(1)在F中发生的化学反应方程式为___________________。
(2)A中的实验现象为________,此实验证明SO2是______。
(3)B中的品红试液__________,证明SO2有__________性。
(4)C中的实验现象是________,证明SO2有__________性。
(5)D中的实验现象是________,证明SO2有__________性。
(6)E的作用是________,反应的化学方程式是_________。
【规范解答】由于SO2易溶于水,且与水发生反应生成亚硫酸,能使紫色石蕊试液变红色,而不能使之褪色,SO2具有漂白性,能使品红试液褪色,SO2还具有弱氧化性,能与H2S反应生成硫单质沉淀,SO2还具有还原性,能使碘水褪色。
答案:(1)Na2SO3+H2SO4(浓) ====SO2↑+Na2SO4+H2O
(2)紫色石蕊试液变红 酸性氧化物
(3)褪色 漂白 (4)溶液变浑浊 氧化
(5)碘水颜色褪去 还原
(6)吸收多余的SO2,防止空气污染
2NaOH+SO2 ==== Na2SO3+H2O
【互动探究】SO2通入酸性KMnO4溶液中,溶液的颜色褪去,是不是SO2的漂白性所致?
提示:不是。酸性KMnO4溶液具有强氧化性,而SO2具有较强的还原性,二者发生了氧化还原反应,导致MnO4-被还原为Mn2+而使颜色褪去。
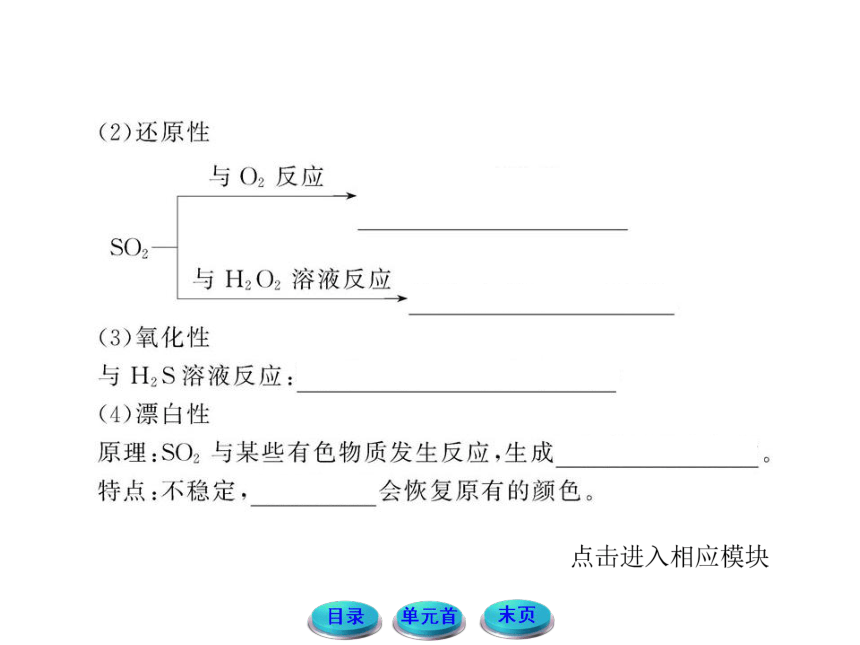
漂白剂的分类
(1)氧化性漂白,如HClO(漂白粉作漂白剂时也是转化为HClO)、H2O2、Na2O2等,由于这些物质具有强氧化性,与有色物质发生氧化还原反应而使之褪色,这种漂白比较稳定,长久放置也不会恢复原色。
(2)化合漂白,如SO2,是与有色物质发生化合反应而使之褪色,但这种漂白不稳定,受热或长期放置会恢复原色。
(3)吸附漂白,如活性炭,通过吸附色素漂白有色物质,是物理漂白,稳定。
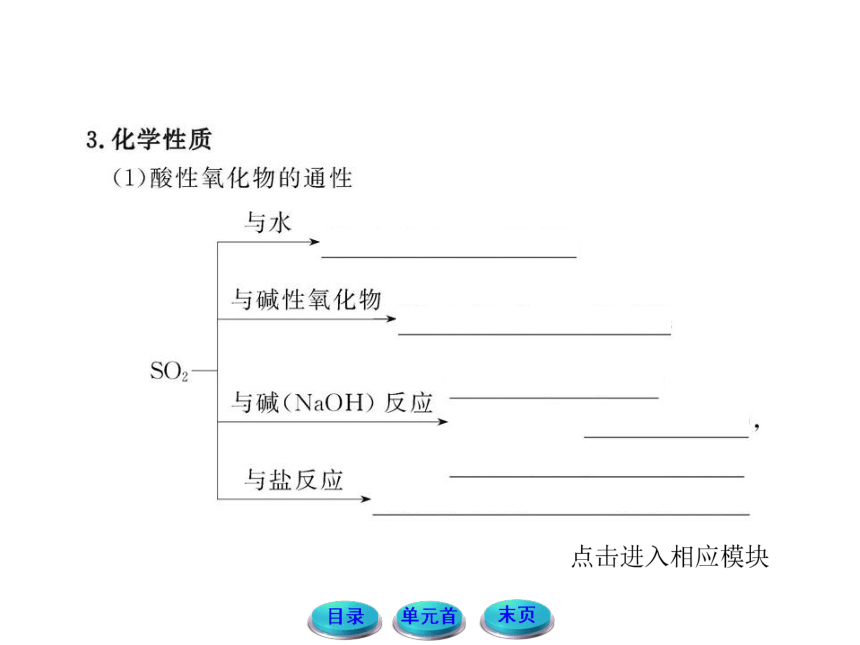
1.回顾氧化还原的知识,结合SO2、H2SO3的化合价,思考并分析SO2、H2SO3的性质有哪些?讨论并预测Na2SO3的性质,尝试写出有关的化学方程式。
提示:SO2、H2SO3中S元素的价态都是+4价,既可以升高被氧化,也可以降低被还原,所以既可以表现出还原性,也可以表现出氧化性。而Na2SO3中S的价态也是+4价,也可表现氧化性和还原性。如:2Na2SO3+O2====2Na2SO4,
Na2SO3+2Na2S+3H2SO4 ====3Na2SO4+3S↓+3H2O
2.结合前面所学知识思考并讨论,如果将收集的酸雨敞口放置一段时间,溶液的酸性将如何变化?变化的原因是什么?
提示:收集到的酸雨中主要含有H2SO3,是一种弱酸,由于H2SO3中S的价态是+4价,具有较强的还原性,在空气中露置一段时间,会与空气中的O2发生反应:
2H2SO3+O2 ==== 2H2SO4,生成强酸,导致溶液的酸性增强。
3.试结合电解质及电离的知识,讨论并分析,将SO2溶于水时会发生哪些反应?存在哪些过程?所得的溶液中,都有哪些微粒?
提示:SO2溶于水,会与水发生反应生成H2SO3,其方程式为:SO2+H2O H2SO3,而H2SO3是一种弱酸,会发生分步电离,H2SO3 H++HSO3-,HSO3- H++SO32-所得溶液中存在SO2、H2O、H2SO3等分子,也存在H+、HSO3-、SO32-等离子。
例2 (2011·扬州高一检测)已知X、Y、Z都是中学化学中常见的三种气体,X的颜色为黄绿色,向X的水溶液中滴入品红试液,品红褪色,将溶液加热后,溶液颜色无明显变化;向Y的水溶液中滴入品红试液,品红褪色,将溶液加热后,溶液又呈红色;向Z的水溶液中滴入红色石蕊试液,溶液呈蓝色。据此回答下列问题:
(1)试写出下列物质的化学式:Y_____、Z _____ 。
(2)将X通入Y的水溶液中发生反应的化学方程式是______。
(3)往Z的水溶液中通入少量Y,发生反应的化学方程式是____________________________。
【规范解答】由题意可知,X气体是氯气,而Y气体也具有漂白性,但漂白后的溶液受热后又恢复颜色,则说明Y是SO2,而使红色石蕊试液变蓝的气体只有NH3,故Z是NH3。
答案:(1)SO2 NH3
(2)Cl2+SO2+2H2O====2HCl+H2SO4
(3)2NH3+SO2+H2O====(NH4)2SO3
【互动探究】若将Y气体通入到BaCl2溶液中,能否生成沉淀?若再通入X气体,会有什么现象?
提示:SO2溶于水生成H2SO3,在酸性条件下不会生成BaSO3沉淀。若再通入Cl2,Cl2会将H2SO3氧化成H2SO4,H2SO4与BaCl2会生成BaSO4沉淀。
在工业上吸收废气中SO2气体的方法
(1)生石灰固硫法:
SO2+CaO====CaSO3
2CaSO3+O2====2CaSO4
(2)石灰水悬浊液洗涤法:
SO2+Ca(OH)2====CaSO3↓+H2O,
2CaSO3+O2====2CaSO4
(3)氨水脱硫法:
SO2+2NH3+H2O====(NH4)2SO3
SO2+NH3+H2O====NH4HSO3
(NH4)2SO3+H2SO4====(NH4)2SO4+SO2↑+H2O
2NH4HSO3+H2SO4====(NH4)2SO4+2SO2↑+2H2O
SO2和CO2性质的比较
探究:
1.根据CO2和SO2物理性质上的差异,如何鉴别CO2和SO2?
提示:闻气味,CO2为无味气体,SO2有刺激性气味。
2.根据CO2和SO2化学性质上的差异,如何鉴别CO2和SO2?
提示:(1)利用二氧化硫的还原性,根据通入酸性高锰酸钾溶液或溴水中是否褪色鉴别。
(2)利用二氧化硫的漂白性,根据通入品红溶液中是否褪色鉴别。
3.CO2和SO2均为酸性氧化物,在性质上具有一定的相似性,结合已有的知识探究能否用澄清石灰水鉴别CO2和SO2,为什么?
提示:不能,少量的CO2和SO2通入到澄清石灰水中,均产生白色沉淀;足量的CO2和SO2通入到澄清石灰水中现象均是先变浑浊后变澄清。
4.若要证明某气体是CO2和SO2的混合气体,应进行怎样的操作?
提示:证明SO2存在可使用品红溶液,证明CO2存在可使用澄清石灰水,但由于SO2也可使澄清石灰水变浑浊,因此应先使气体通入品红溶液中,验证SO2存在后将气体通入足量酸性KMnO4溶液中以除去SO2,然后再通入品红溶液中验证SO2是否被除尽,最后再通入澄清石灰水中以验证CO2的存在。
5.已知:酸性H2SO3>H2CO3,除去CO2中的SO2有几种方法?
提示:(1)用饱和NaHCO3溶液,2NaHCO3+SO2====Na2SO3+2CO2
+H2O。
(2)用酸性KMnO4溶液或溴水,2KMnO4+5SO2+2H2O====
2MnSO4+K2SO4+2H2SO4;
SO2+Br2+2H2O====H2SO4+2HBr。
1.区别SO2与CO2可用的试剂是( )
A.品红溶液
B.澄清石灰水
C.紫色石蕊试液
D.BaCl2溶液
【解析】选A。由题意可知,SO2、CO2通入澄清石灰水中都是先有白色沉淀生成,通入的气体过量后,白色沉淀又会消失;而通入紫色石蕊试液中又都会变红;通入BaCl2溶液中都无现象;通入品红溶液中,SO2会使之褪色,而CO2不会。
2.将SO2通入显红色的酚酞试液中,发现红色消失,主要是因为SO2( )
A.有漂白性
B.有还原性
C.溶于水后显酸性
D.有氧化性
【解析】选C。由题意可得,使酚酞试液显红色的物质是碱性物质,通入SO2后,形成的H2SO3与碱性物质发生反应,导致颜色褪去。
3.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg/L,下列措施中不能够减少SO2排放量的是( )
A.使用水煤气或干馏煤气作燃料
B.将烟囱加高
C.在煤中加入石灰后燃用
D.循环处理吸收塔放出的尾气
【解析】选B。将烟囱加高不能减少向大气中排放SO2的量,对SO2的排放量没影响。
4.已知A是一种固体单质,根据如图所示,判断:
A._________,B._________,C._________。
反应的化学方程式是:
①________________________________________,
②________________________________________,
③________________________________________。
【解析】由题意可知,A是固体单质,与O2反应生成的氧化物与其氢化物反应能生成这种单质,所以这种单质是硫单质,也就得出其答案。
答案:S SO2 H2S
S+O2 SO2
SO2+2H2S====3S↓+2H2O
H2+S H2S
△
====
点燃
====
5.实验室常采用下列方法制取气体A、B,①Na2SO3与浓硫酸反应产生气体A;气体A具有刺激性气味且可以使品红溶液褪色,经加热后又变红;②MnO2与浓盐酸在加热条件下产生气体B;试回答下列问题:
(1)分别写出两种气体的化学式:A__________________、
B______________。
(2)写出制取以上两种气体的化学方程式:
①______________________________________________;
②______________________________________________。
(3)把气体A和B按物质的量之比1∶1通入水中,生成两种强酸,试写出该反应的化学方程式:___________________,
其中____________是还原剂,____________是氧化剂。
(4)气体A和潮湿的气体B皆可作漂白剂,若用两者(体积比1∶1)同时漂白一种物质时,漂白效果会______。
A.增强 B.不变
C.减弱 D.以上都有可能
【解析】由题意可得,这是一个由气体性质和气体制备结合在一起的试题,在处理时要仔细阅读,认真分析,Na2SO3与浓硫酸反应产生气体A,可得A是SO2,MnO2与浓盐酸在加热条件下产生气体B,可得B为Cl2。
答案:(1)SO2 Cl2
(2)①Na2SO3+H2SO4(浓)====Na2SO4+H2O+SO2↑
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(3)Cl2+SO2+2H2O====H2SO4+2HCl SO2 Cl2
(4)C
△
====
一、选择题(本题包括6小题,每小题4分,共24分)
1.既能使潮湿的蓝色石蕊试纸变红,又能使品红溶液褪色,还能使溴水褪色的是( )
A.CO2 B.H2S
C.Cl2 D.SO2
【解析】选D。目标气体必须是酸性气体,且有漂白性,可选择的选项为SO2。
2.(2011·乌鲁木齐高一检测)银耳本身为淡黄色,某地出产一种雪耳,颜色洁白如雪。其制作过程如下:将银耳堆放在密封状态良好的塑料棚内,在棚的一端支一口锅,锅内放入硫磺,加热使硫磺熔化并燃烧,两天左右雪耳就制成了,这种雪耳炖不烂,且对人有害。制作雪耳利用的是
( )
A.硫的还原性 B.SO2的漂白性
C.硫的漂白性 D.SO2的还原性
【解析】选B。由题意可知,将硫加热并燃烧后,产生SO2,使银耳由淡黄色变为雪白色,则说明这是由SO2具有的漂白性所致。
3.香烟烟雾中往往含有CO和SO2气体,下列关于这两种气体的说法中正确的是( )
A.两者都易溶于水
B.两者都是形成酸雨的主要原因
C.两者都能使品红溶液褪色
D.两者都污染环境,危害健康
【解析】选D。由题意可得,对于CO和SO2这两种气体来说,CO是难溶于水的气体,而CO不会形成酸雨,也不能使品红溶液褪色,但两种气体都有毒,污染环境,危害人体健康。
【举一反三】如果将CO换成CO2,两种气体会有什么共同之处呢?
提示:两种都是酸性气体,都能使澄清石灰水变浑浊,过量又变澄清等。
4.检验SO2中是否混有CO2气体,可采用的方法是( )
A.通过品红溶液
B.先通过NaOH溶液,再通入澄清石灰水
C.通过澄清石灰水
D.先通过酸性KMnO4溶液,再通过澄清石灰水
【解析】选D。A选项检验的是SO2;B选项不管是否混有CO2都不会产生白色沉淀;C选项不管有没有CO2都会产生白色沉淀,不能验证有无CO2;只有D选项,酸性KMnO4溶液将SO2完全吸收,通过澄清石灰水,若有白色沉淀则一定有CO2,若无沉淀则无CO2,故正确答案为D。
5.下列有关酸雨的说法正确的是( )
A.酸雨就是指pH<7的雨水
B.酸雨是因为雨水中含有CO2
C.工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因
D.酸雨没有危害,所以不必担心,也不必想办法治理
【解析】选C。酸雨就是由于空气污染造成雨水的酸性比较强,pH一般在5左右,是由于SO2、NO2等造成的,而不是CO2造成的;SO2是形成酸雨的主要原因之一,主要来源于工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属,酸雨的危害很大。
6.2010年4月22日是第41个世界地球日,国土资源部确定我国今年的地球日的主题为“珍惜地球资源,转变发展方式,倡导低碳生活”。开发新能源可以降低酸雨所造成的危害,下列与这一主题不相符的是( )
①用天然气代替煤作民用燃料
②提高热能利用率
③使用CS2萃取煤炭中的硫
④加大石油、煤炭的开采速度,增加化石燃料的供应量
⑤推广燃煤脱硫技术,防治SO2的污染
⑥尽量开发太阳能、核能、氢能等新型能源
⑦将块状煤粉碎,提高其燃烧效率
A.①③④⑥⑦ B.②③⑤⑥
C.③④⑦ D.①②③⑤⑦
【解析】选C。由题中信息可知,其中③中的CS2也是一种有毒物质,而且在煤中的硫也不是硫单质;④与现在的要求差别很大,违背题干要求;⑦将块状煤粉碎,提高其燃烧效率对空气的污染没有减少。所以以上几条都与题干中的主题不相符。
二、非选择题(本题包括2小题,共26分)
7.(15分)(2011·东莞高一检测)甲、乙两同学进行化学研究性学习:测定某雨水的pH并判断该雨水是否为酸雨。
甲同学取pH试纸用蒸馏水湿润后置于表面皿中,取雨水少量并滴几滴雨水到pH试纸上,与标准比色卡对照,测得pH为6。由此,甲同学得出这次雨水不是酸雨的结论。
乙同学用烧杯取雨水少许,用pH试纸正确测定该雨水的pH,测得pH为5。露置于教室中一段时间后,再测得pH为4。
请回答下列问题:
(1)上述甲、乙两同学化学研究性学习思路的可取之处是
_______________________________________________。
(2)你认为甲同学的结论是否合理并说明你的理由
______________________________________________。
(3)请你解释乙同学的实验中先测得pH为5,露置于教室中一段时间后,再测得pH为4的原因(用化学方程式并结合文字说明)_________________________________。
(4)酸雨形成的原因与下列哪些气体有关(填代号)___。
A.CO2 B.SO2 C.CO
(5)用Na2SO3溶液吸收工业中SO2尾气是一种治理工业SO2尾气污染比较新颖的方法。试用化学方程式表示其原理________________________。
【解析】(1) 通过实验的方法来解决化学问题。(2)用pH试纸测定溶液的pH时应保持试纸干燥。(3)这是因为雨水中含有H2SO3,H2SO3具有较强的还原性,可逐渐的被空气中的O2氧化成H2SO4,而H2SO4的酸性强于H2SO3。
答案:(1)通过实验的方法来解决化学问题
(2)不合理。甲同学测定雨水的pH前将pH试纸用蒸馏水润湿,相当于将雨水进行稀释
(3)2H2SO3+O2====2H2SO4,生成的H2SO4是强酸使酸性增强
(4)B
(5)Na2SO3+SO2+H2O====2NaHSO3
8.(11分)某化学兴趣小组模拟测定硫酸工业生产中的SO2、N2、O2的混合气体中SO2的体积分数,选用了下列简易装置:
(1)若混合气体的流向按从左到右时,上述实验装置的连接顺序是:混合气体→_____(填“a”、“b”、“c”、“d”、“e”)。
(2)装置③中发生反应的离子方程式为:_____。当装置③中恰好出现蓝色褪去现象时,应立即停止通气。若此时没有及时停止通气,则测定的SO2的体积分数_____(填“偏高”、“偏低”或“不受影响”)。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,与SO2气体恰好完全反应,收集到的N2和O2的体积为297.6 mL(已折算成标准状况下的体积)。则SO2的体积分数为_____。
【解析】由题意可知,测定气体的体积实际上是用气体将①瓶中的水排出来,然后测定排出的水的体积即可,但在排水之前,应先将混合气体中的SO2用碘反应掉,所以顺序为:c→d→b→a→e,若③中出现现象后没有及时停止通气,那么将有一部分SO2没有与I2反应进入到后面的集气瓶中,造成碘吸收的SO2比实际的小,结果偏低;由碘和SO2反应的离子方程式I2+SO2+2H2O====2I-+ SO42-+4H+可以得出,I2和SO2在反应中是1∶1的关系,则由于I2的量为:
0.02 L×0.05 mol/L=0.001 mol,即SO2的物质的量也是0.001 mol,其标准状况下的体积为22.4 mL,所以其体积分数为:
答案:(1)c→d→b→a→e
(2)I2+SO2+2H2O====2I-+ SO42- +4H+ 偏低
(3)7%
【规律方法】检验SO2和吸收SO2的常用试剂
(1)可用于吸收SO2的试剂还有:NaOH溶液、酸性KMnO4溶液、溴水、氨水。
(2)可用于检验SO2的试剂有:品红溶液、酸性KMnO4溶液、溴水、碘的淀粉溶液。在没有CO2干扰时,也可以用澄清石灰水。
