11-12版高中化学课时讲练通配套课件:4.2.1氮氧化物的产生及转化(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:4.2.1氮氧化物的产生及转化(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览








文档简介
(共53张PPT)
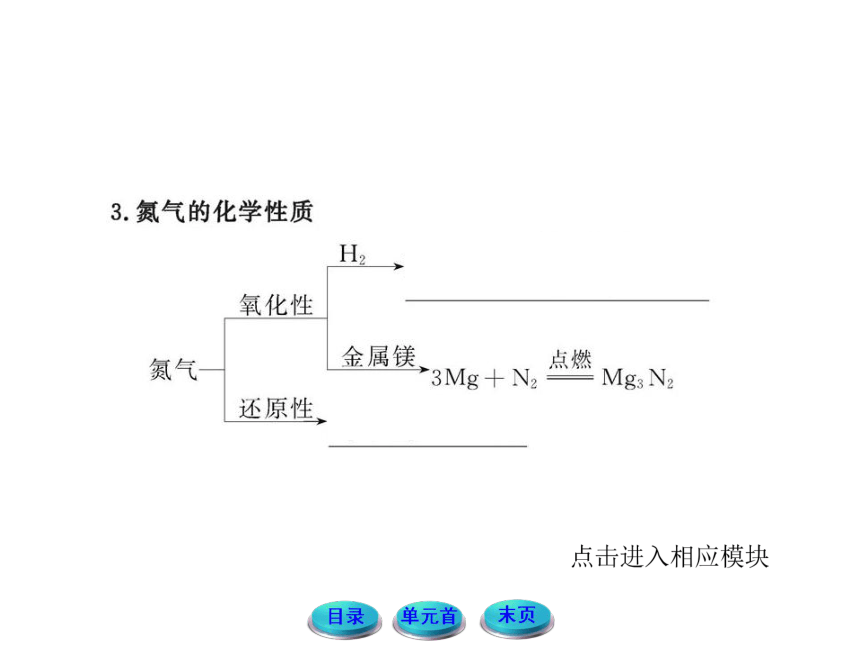
1.在空气中含有大量的N2,但在自然界中只有少部分氮元素以化合态存在。请根据N2的性质分析其原因。
提示:N2是双原子分子,在分子内的两个氮原子之间,存在着一种作用力,将两个氮原子结合在一起,在N2分子中,这种作用力非常强,一般的外部条件很难将其破坏,所以常温下N2的性质很稳定,只有在高温、高压、放电的条件下发生反应,而在自然的条件下很难达到这些条件,因此只有少部分氮元素以化合态存在。
2.袋装食品通常采用真空包装或在食品袋中充入N2,思考并讨论,充入N2的作用是什么?利用了N2的什么性质?
提示:充入N2,是用来作保护气的;利用了N2很稳定,在一般条件下很难与其他物质发生反应的性质。
例1 下列关于氮气的叙述中错误的是
A.N2是一种无色、无味的气体,易液化
B.N2可用制作氮肥和硝酸的原料
C.N2可利用浓硫酸和碱石灰干燥
D.N2不能用排空气法收集
【规范解答】选A。本题考查了N2的物理性质——密度、颜色、状态、气味及沸点。N2是一种沸点较低的气体,其沸点为-195.8 ℃,将其变为液体比较困难,故不易液化,性质又很不活泼,不与浓硫酸、碱石灰发生反应,所以可以用浓硫酸、碱石灰来干燥,其密度与空气非常接近,所以不能用排空气法来收集。
【互动探究】空气中含大量N2,是工业生产中N2的主要来源。工业上如何从空气中分离得到纯净的N2?
提示:工业制取N2有两种方法:一种是将空气液化,然后蒸发,首先挥发出N2;另一种方法是将木炭在空气中燃烧,将所得气体通过碱洗后得到N2。
1.结合NO、NO2的性质,思考并讨论:
(1)在雷雨天气下,空气中的氮气会发生哪些变化?(用方程式表示)
提示:雷雨天气下,会有闪电,则会发生:N2+O2 2NO的反应。生成的NO会迅速与空气中的O2反应:2NO+O2====
2NO2,NO2会与水发生反应:3NO2+H2O====2HNO3+NO。
(2)硝酸能与土壤中的矿物质发生反应生成硝酸盐,请讨论并分析,雷雨会对庄稼产生什么影响?
放电
====
提示:雷雨天气时,空气中的N2与O2在放电的条件下生成NO进而转化成NO2,NO2后又与水反应生成硝酸,随雨水落入地下,与土壤中的矿物质发生反应生成硝酸盐,随水进入土壤,可作为氮肥被植物的根吸收,对庄稼的生长有好处,所以有“雷雨发庄稼”的说法。
2.溴蒸气和NO2都是红棕色的气体,请思考,如何鉴别这两种气体?
提示:由于NO2气体和溴蒸气(Br2)都是红棕色气体,又均能使湿润的淀粉碘化钾试纸变蓝,所以不能用淀粉碘化钾试纸来鉴别,二者也都能与NaOH溶液反应而褪色,所以也不能用NaOH溶液来鉴别。可以用AgNO3溶液,能与AgNO3溶液反应生成淡黄色沉淀的为溴蒸气;也可以用CCl4,溴蒸气溶于CCl4后会显橙红色而NO2不溶于CCl4;还可用水来鉴别,通入水中,得到的溶液是橙色的是溴蒸气,得到的溶液为无色的是NO2。
例2 为了治理污染,工业上通常通入NH3与废气发生下列反应:NOx+NH3 N2+H2O,现有3 L NO、NO2的混合气体,可用同温同压下3.5 L NH3恰好使其完全转化为N2,则原混合物中NO、NO2的体积比为_____。
【规范解答】设NO、NO2的混合气体中,NO的体积为x,NO2
则为3 L-x,两种气体与NH3反应的方程式为:4NH3+6NO====
5N2+6H2O和8NH3+6NO2====7N2+12H2O可得,NO反应所消耗的
NH3为 x,而NO2所消耗的NH3为 (3 L-x),则可得, x+
(3 L-x)=3.5 L,也就得出x=0.75 L,则得:
答案:1∶3
【互动探究】工业上为了消除氮的氧化物的污染还可用什么办法?
提示:如果在混合物中,NO2的量多于NO的,还可用氢氧化钠来除掉。其反应的方程式为:
NO2+NO+2NaOH====2NaNO2+H2O
2NaOH+2NO2====NaNO2+NaNO3+H2O
NO和NO2的收集方法
由于NO极易与O2反应,故不能用排空气法收集,只能用排水法收集;而NO2极易与水反应,所以NO2只能用排空气法收集。
氮的氧化物与O2的混合物溶于水的相关计算
NO和NO2是两种重要的氮的氧化物,是工业制取硝酸的中间产物。最大程度地吸收氮的氧化物可以充分利用原料,并减少污染物的排放。结合NO和NO2的性质探究以下问题。
探究:
1.把一支充满NO2气体的试管倒置在水槽中充分反应后,水能否充满试管?
提示:NO2与水反应的化学方程式为3NO2+H2O====2HNO3+NO,由此可知最后水只能充满整个试管的2/3。
2.把一支充满NO2和O2的试管倒置在水槽中充分反应后,若水充满试管,NO2和O2的量应满足什么关系?
提示:根据反应:3NO2+H2O====2HNO3+NO,2NO+O2====2NO2可得4NO2+2H2O+O2=====4HNO3;即当NO2与O2体积比为4∶1时水可充满试管。
3.如果向一支充满NO的试管中充入O2,应满足什么条件水才能充满试管?
提示:结合反应2NO+O2====2NO2,3NO2+H2O====2HNO3+NO知4NO+3O2+2H2O====4HNO3。所以当NO和O2体积比为4∶3时水可充满试管。
1.(2011·舟山高一检测)把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
【解析】选C。由题意可知,少量NO2气体通入过量的小苏打溶液中,NO2会与水先反应生成HNO3,同时会有少量NO生成,生成的HNO3与NaHCO3反应生成CO2,CO2与Na2O2反应生成O2,O2接着与NO反应生成NO2,同时还会有氧气剩余。
2.发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后产生的高温气体主要是CO2、H2O、N2、NO,这些气体均无色,但在卫星发射现场看到火箭喷出大量红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO和H2O反应生成H2和NO2
【解析】选B。由所生成的气体成分可以得出,由于NO的性质非常不稳定,易与空气中的O2发生反应生成红棕色的NO2,使气体的颜色成为红色。
3.同温同压下,在三支相同体积的试管里分别充有两种等体积混合的气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系中正确的是( )
A.V1>V2>V3
B.V1>V3>V2
C.V2>V3>V1
D.V3>V1>V2
【解析】选B。设每支试管的总体积为V,由三支试管中所盛的气体可知,①中为NO和NO2,只有NO2能与水发生反应:3NO2+H2O====2HNO3+NO,由两种气体的量相等和方程式
可得,剩余气体的体积为 ②中所盛的气
体为NO2和O2,发生4NO2+O2+2H2O====4HNO3这一反应,由
于二者体积相等,所以剩余的气体为O2,由于反应中NO2的
体积为 V,则消耗的O2为其体积的 ,即为 V,则剩余
O2为 V,③中所盛气体为NH3和N2,只有NH3极易溶于水,
而N2全部剩余,为 V,则可得三支试管中所剩余的气体的
体积大小关系为 V> V> V,即为B项。
4.某同学收集了一集气瓶红棕色气体,用玻璃片盖好,然后向其中加入少量水,振荡后变为无色,然后轻轻移开玻璃片使少量空气进入瓶内,气体又变为红棕色。
(1)集气瓶内红棕色气体是:________________________。
(2)气体颜色变化的原因是:________________________;
有关的化学方程式是:_____________________________。
(3)在收集该红棕色气体时用什么方法?做该实验时应注意什么问题?为什么?
【解析】在中学阶段常见的红棕色气体有NO2和溴(Br2)蒸气,能产生题干现象的是NO2,由于NO2的密度比空气大,应用向上排空气法收集;又因NO2是毒性气体,应收集尾气,同时应在通风条件下进行,防止意外发生。
答案:(1)NO2
(2)NO2与H2O反应生成无色NO,NO遇空气中的O2反应生成红棕色的NO2
3NO2+H2O====2HNO3+NO、
2NO+O2====2NO2
(3)收集NO2应用向上排空气法。做该实验时要注意通风及尾气吸收,因为NO和NO2都有毒。
5.NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、提高免疫力、增强记忆力的功能,因而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题:
(1)NO对环境的危害在于_________(填以下项目的编号)。
A.破坏臭氧层
B.高温下能使一些金属被氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含有Cu+的酶活化中心,亚硝酸根离子(NO2-)转化为NO,写出Cu+和亚硝酸根离子(NO2-)在酸性水溶液中反应的化学方程式:_________________。
(3)在常温下,把NO气体压缩到100个大气压,在一个固定的容器里加热到50 ℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式:_________________。
(4)解释变化(3)中为什么最后的气体总压力小于2/3。
【解析】该题属于信息题,一般认为NO是有害气体,此题告诉人们它对人类也有有用的一面。考查根据客观事实写方程式的能力。
答案:(1)C、D
(2)Cu++ NO2- +2H+====Cu2++NO↑+H2O
(3)3NO N2O+NO2
(4)有少量NO2继续反应生成N2O4,而使气体的物质的量小于原气体的物质的量的2/3
高压
====
一、选择题(本题包括6小题,每小题4分,共24分)
1.(双选)下列用途应用了氮气的不活泼性的是( )
A.用于金属焊接的保护气及其与Ar混合填充灯泡
B.用于合成氨气
C.工业上以氮气为原料制硝酸
D.保护粮食和水果等农副产品
【解析】选A、D。N2的化学性质不活泼,一般不跟其他物质发生反应,用N2填充灯泡,用来保护粮食和水果,可防止变质,都是利用了N2的不活泼性。
2.下列过程属于人工固氮的是( )
A.分离液态空气制氮气
B.闪电时N2转化为NO
C.合成氨
D.豆科作物根瘤菌将N2转化为NH3
【解析】选C。固氮是指将游离态的氮转化为化合态的氮的过程,人工固氮是指人为地将N2转化为氮的化合物。
3.氮气是空气的主要成分,且含量很大,现已有科学家设计出了液氮蒸汽机,即利用液氮的蒸发来驱动机车,从而达到保护环境的目的。其主要依据是( )
A.液氮的沸点为-195.8 ℃,远低于常温
B.氮气与氧气反应放热
C.氮气在空气中燃烧放热
D.氮气性质稳定,不与氧气发生反应
【解析】选A。由题意可知,设计出了液氮蒸汽机,即利用液氮的蒸发来驱动机车,一方面氮气是空气中的主要成分,且含量很大,另一方面就是它无毒和沸点较低。
4.下列推断正确的是( )
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
【解析】选A。酸性氧化物是能够跟碱反应,生成盐和水的氧化物,故A正确,因为2NaOH+SiO2====Na2SiO3+H2O;Na2O与CO2反应生成Na2CO3,Na2O2与CO2反应除生成Na2CO3外,还生成O2,故B错;NO在空气中会发生反应2NO+O2====2NO2,故C错;因为新制氯水中含有HClO,故滴入少量的紫色石蕊试液的现象是先变红,后褪色,故D错。
【举一反三】Na2O、Na2O2组成元素相同,与 SO2反应产物相同吗?
提示:不相同,由于Na2O与SO2反应生成的是Na2SO3,而Na2O2与SO2反应时,Na2O2具有强氧化性,反应后生成的是Na2SO4。
5.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A.H2S B.Cl2
C.NH3 D.NO
【解析】选D。浓硫酸是一种既具有酸性,又具有强氧化性的干燥剂,而碱石灰是一种碱性干燥剂,则符合题意的只有D。
【规律方法】常见的干燥剂及选择方法
中学化学中常见的干燥剂有:①浓硫酸:不可干燥碱性气体(NH3)和强还原性气体(H2S、HBr、HI等);
②P2O5:不可干燥碱性气体(NH3);
③碱石灰、生石灰等:不可干燥酸性气体如:CO2、SO2、H2S、Cl2、HCl、HBr、HI等;
④无水氯化钙:不可干燥NH3(特殊原因);
⑤CuSO4:常用来检验水的存在,一般不用来干燥气体。
6.在一定温度和压强下,将一容积15 mL的试管充满NO2后,倒置于一个盛水的水槽中。当试管内液面上升至一定高度不再变化时,在相同条件下再通入O2,若要使试管内液面仍保持在原高度,则应通入O2体积为( )
A.3.75 mL B.7.5 mL
C.8.75 mL D.10.5 mL
【解析】选C。由题意可得,一容积15 mL的试管充满NO2后,倒置于一个盛水的水槽中,则由3NO2+H2O====2HNO3+NO可得,水上升至试管的 处,还有5 mL NO,这时通入O2,让二者发生4NO+3O2+2H2O====4HNO3这一反应,则需要O2 3.75 mL,还要让O2再余下5 mL,则共需O28.75 mL。
二、非选择题(本题包括2小题,共26分)
7.(10分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式:______;氧化剂是_____,还原剂是_______。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是_____________。
(3)控制城市空气污染源的方法可以有_______。
a.开发氢能源 b.使用电动车
c.植树造林 d.戴上呼吸面具
【解析】解此题,一方面应从反应物自身的性质入手,汽车尾气中,CO具有较强的还原性,NO具有较强的氧化性,一定条件下,可能发生氧化还原反应;另一方面,应紧扣题意,寻找突破口,由“生成可参与大气生态循环的无毒气体”,推出产物为CO2和N2。
答案:(1)2CO+2NO 2CO2+N2 NO CO
(2)“催化转换器”促进SO2转化成SO3,产生硫酸酸雾
(3)a、b
催化剂
====
8.(16分)某非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气
体。
①A的化学式:___________________________________。
②工业生产中大量排放的B气体被雨水吸收后形成
__________而污染环境。
③写出B→C反应的化学方程式:_____________________。
④D的浓溶液可与木炭反应并生成C气体,该反应的化学方程式为:_____________________。
(2)若A在常温下为气体,C是红棕色气体。
①A、C的化学式分别是:A_________,__________。
②写出B→C反应的化学方程式:________________。
【解析】由题意可得,A是淡黄色固体单质,则A就是硫,B为SO2,C为SO3,D为H2SO4。若A是气体,C是红棕色气体,则A为N2,B为NO,C为NO2,D为HNO3。
答案:(1)①S ②H2SO4 (H2SO3) 或酸雨
③2SO2+O2 2SO3
④C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
(2)①N2 NO2
②2NO+O2====2NO2
△
====
催化剂
△
1.在空气中含有大量的N2,但在自然界中只有少部分氮元素以化合态存在。请根据N2的性质分析其原因。
提示:N2是双原子分子,在分子内的两个氮原子之间,存在着一种作用力,将两个氮原子结合在一起,在N2分子中,这种作用力非常强,一般的外部条件很难将其破坏,所以常温下N2的性质很稳定,只有在高温、高压、放电的条件下发生反应,而在自然的条件下很难达到这些条件,因此只有少部分氮元素以化合态存在。
2.袋装食品通常采用真空包装或在食品袋中充入N2,思考并讨论,充入N2的作用是什么?利用了N2的什么性质?
提示:充入N2,是用来作保护气的;利用了N2很稳定,在一般条件下很难与其他物质发生反应的性质。
例1 下列关于氮气的叙述中错误的是
A.N2是一种无色、无味的气体,易液化
B.N2可用制作氮肥和硝酸的原料
C.N2可利用浓硫酸和碱石灰干燥
D.N2不能用排空气法收集
【规范解答】选A。本题考查了N2的物理性质——密度、颜色、状态、气味及沸点。N2是一种沸点较低的气体,其沸点为-195.8 ℃,将其变为液体比较困难,故不易液化,性质又很不活泼,不与浓硫酸、碱石灰发生反应,所以可以用浓硫酸、碱石灰来干燥,其密度与空气非常接近,所以不能用排空气法来收集。
【互动探究】空气中含大量N2,是工业生产中N2的主要来源。工业上如何从空气中分离得到纯净的N2?
提示:工业制取N2有两种方法:一种是将空气液化,然后蒸发,首先挥发出N2;另一种方法是将木炭在空气中燃烧,将所得气体通过碱洗后得到N2。
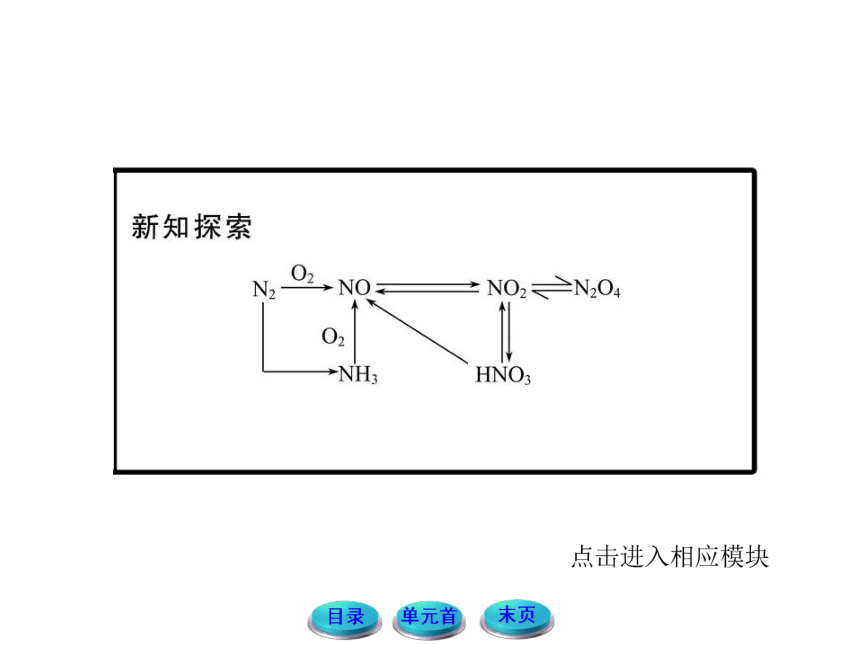
1.结合NO、NO2的性质,思考并讨论:
(1)在雷雨天气下,空气中的氮气会发生哪些变化?(用方程式表示)
提示:雷雨天气下,会有闪电,则会发生:N2+O2 2NO的反应。生成的NO会迅速与空气中的O2反应:2NO+O2====
2NO2,NO2会与水发生反应:3NO2+H2O====2HNO3+NO。
(2)硝酸能与土壤中的矿物质发生反应生成硝酸盐,请讨论并分析,雷雨会对庄稼产生什么影响?
放电
====
提示:雷雨天气时,空气中的N2与O2在放电的条件下生成NO进而转化成NO2,NO2后又与水反应生成硝酸,随雨水落入地下,与土壤中的矿物质发生反应生成硝酸盐,随水进入土壤,可作为氮肥被植物的根吸收,对庄稼的生长有好处,所以有“雷雨发庄稼”的说法。
2.溴蒸气和NO2都是红棕色的气体,请思考,如何鉴别这两种气体?
提示:由于NO2气体和溴蒸气(Br2)都是红棕色气体,又均能使湿润的淀粉碘化钾试纸变蓝,所以不能用淀粉碘化钾试纸来鉴别,二者也都能与NaOH溶液反应而褪色,所以也不能用NaOH溶液来鉴别。可以用AgNO3溶液,能与AgNO3溶液反应生成淡黄色沉淀的为溴蒸气;也可以用CCl4,溴蒸气溶于CCl4后会显橙红色而NO2不溶于CCl4;还可用水来鉴别,通入水中,得到的溶液是橙色的是溴蒸气,得到的溶液为无色的是NO2。
例2 为了治理污染,工业上通常通入NH3与废气发生下列反应:NOx+NH3 N2+H2O,现有3 L NO、NO2的混合气体,可用同温同压下3.5 L NH3恰好使其完全转化为N2,则原混合物中NO、NO2的体积比为_____。
【规范解答】设NO、NO2的混合气体中,NO的体积为x,NO2
则为3 L-x,两种气体与NH3反应的方程式为:4NH3+6NO====
5N2+6H2O和8NH3+6NO2====7N2+12H2O可得,NO反应所消耗的
NH3为 x,而NO2所消耗的NH3为 (3 L-x),则可得, x+
(3 L-x)=3.5 L,也就得出x=0.75 L,则得:
答案:1∶3
【互动探究】工业上为了消除氮的氧化物的污染还可用什么办法?
提示:如果在混合物中,NO2的量多于NO的,还可用氢氧化钠来除掉。其反应的方程式为:
NO2+NO+2NaOH====2NaNO2+H2O
2NaOH+2NO2====NaNO2+NaNO3+H2O
NO和NO2的收集方法
由于NO极易与O2反应,故不能用排空气法收集,只能用排水法收集;而NO2极易与水反应,所以NO2只能用排空气法收集。
氮的氧化物与O2的混合物溶于水的相关计算
NO和NO2是两种重要的氮的氧化物,是工业制取硝酸的中间产物。最大程度地吸收氮的氧化物可以充分利用原料,并减少污染物的排放。结合NO和NO2的性质探究以下问题。
探究:
1.把一支充满NO2气体的试管倒置在水槽中充分反应后,水能否充满试管?
提示:NO2与水反应的化学方程式为3NO2+H2O====2HNO3+NO,由此可知最后水只能充满整个试管的2/3。
2.把一支充满NO2和O2的试管倒置在水槽中充分反应后,若水充满试管,NO2和O2的量应满足什么关系?
提示:根据反应:3NO2+H2O====2HNO3+NO,2NO+O2====2NO2可得4NO2+2H2O+O2=====4HNO3;即当NO2与O2体积比为4∶1时水可充满试管。
3.如果向一支充满NO的试管中充入O2,应满足什么条件水才能充满试管?
提示:结合反应2NO+O2====2NO2,3NO2+H2O====2HNO3+NO知4NO+3O2+2H2O====4HNO3。所以当NO和O2体积比为4∶3时水可充满试管。
1.(2011·舟山高一检测)把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
【解析】选C。由题意可知,少量NO2气体通入过量的小苏打溶液中,NO2会与水先反应生成HNO3,同时会有少量NO生成,生成的HNO3与NaHCO3反应生成CO2,CO2与Na2O2反应生成O2,O2接着与NO反应生成NO2,同时还会有氧气剩余。
2.发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后产生的高温气体主要是CO2、H2O、N2、NO,这些气体均无色,但在卫星发射现场看到火箭喷出大量红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO和H2O反应生成H2和NO2
【解析】选B。由所生成的气体成分可以得出,由于NO的性质非常不稳定,易与空气中的O2发生反应生成红棕色的NO2,使气体的颜色成为红色。
3.同温同压下,在三支相同体积的试管里分别充有两种等体积混合的气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系中正确的是( )
A.V1>V2>V3
B.V1>V3>V2
C.V2>V3>V1
D.V3>V1>V2
【解析】选B。设每支试管的总体积为V,由三支试管中所盛的气体可知,①中为NO和NO2,只有NO2能与水发生反应:3NO2+H2O====2HNO3+NO,由两种气体的量相等和方程式
可得,剩余气体的体积为 ②中所盛的气
体为NO2和O2,发生4NO2+O2+2H2O====4HNO3这一反应,由
于二者体积相等,所以剩余的气体为O2,由于反应中NO2的
体积为 V,则消耗的O2为其体积的 ,即为 V,则剩余
O2为 V,③中所盛气体为NH3和N2,只有NH3极易溶于水,
而N2全部剩余,为 V,则可得三支试管中所剩余的气体的
体积大小关系为 V> V> V,即为B项。
4.某同学收集了一集气瓶红棕色气体,用玻璃片盖好,然后向其中加入少量水,振荡后变为无色,然后轻轻移开玻璃片使少量空气进入瓶内,气体又变为红棕色。
(1)集气瓶内红棕色气体是:________________________。
(2)气体颜色变化的原因是:________________________;
有关的化学方程式是:_____________________________。
(3)在收集该红棕色气体时用什么方法?做该实验时应注意什么问题?为什么?
【解析】在中学阶段常见的红棕色气体有NO2和溴(Br2)蒸气,能产生题干现象的是NO2,由于NO2的密度比空气大,应用向上排空气法收集;又因NO2是毒性气体,应收集尾气,同时应在通风条件下进行,防止意外发生。
答案:(1)NO2
(2)NO2与H2O反应生成无色NO,NO遇空气中的O2反应生成红棕色的NO2
3NO2+H2O====2HNO3+NO、
2NO+O2====2NO2
(3)收集NO2应用向上排空气法。做该实验时要注意通风及尾气吸收,因为NO和NO2都有毒。
5.NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、提高免疫力、增强记忆力的功能,因而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题:
(1)NO对环境的危害在于_________(填以下项目的编号)。
A.破坏臭氧层
B.高温下能使一些金属被氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含有Cu+的酶活化中心,亚硝酸根离子(NO2-)转化为NO,写出Cu+和亚硝酸根离子(NO2-)在酸性水溶液中反应的化学方程式:_________________。
(3)在常温下,把NO气体压缩到100个大气压,在一个固定的容器里加热到50 ℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式:_________________。
(4)解释变化(3)中为什么最后的气体总压力小于2/3。
【解析】该题属于信息题,一般认为NO是有害气体,此题告诉人们它对人类也有有用的一面。考查根据客观事实写方程式的能力。
答案:(1)C、D
(2)Cu++ NO2- +2H+====Cu2++NO↑+H2O
(3)3NO N2O+NO2
(4)有少量NO2继续反应生成N2O4,而使气体的物质的量小于原气体的物质的量的2/3
高压
====
一、选择题(本题包括6小题,每小题4分,共24分)
1.(双选)下列用途应用了氮气的不活泼性的是( )
A.用于金属焊接的保护气及其与Ar混合填充灯泡
B.用于合成氨气
C.工业上以氮气为原料制硝酸
D.保护粮食和水果等农副产品
【解析】选A、D。N2的化学性质不活泼,一般不跟其他物质发生反应,用N2填充灯泡,用来保护粮食和水果,可防止变质,都是利用了N2的不活泼性。
2.下列过程属于人工固氮的是( )
A.分离液态空气制氮气
B.闪电时N2转化为NO
C.合成氨
D.豆科作物根瘤菌将N2转化为NH3
【解析】选C。固氮是指将游离态的氮转化为化合态的氮的过程,人工固氮是指人为地将N2转化为氮的化合物。
3.氮气是空气的主要成分,且含量很大,现已有科学家设计出了液氮蒸汽机,即利用液氮的蒸发来驱动机车,从而达到保护环境的目的。其主要依据是( )
A.液氮的沸点为-195.8 ℃,远低于常温
B.氮气与氧气反应放热
C.氮气在空气中燃烧放热
D.氮气性质稳定,不与氧气发生反应
【解析】选A。由题意可知,设计出了液氮蒸汽机,即利用液氮的蒸发来驱动机车,一方面氮气是空气中的主要成分,且含量很大,另一方面就是它无毒和沸点较低。
4.下列推断正确的是( )
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
【解析】选A。酸性氧化物是能够跟碱反应,生成盐和水的氧化物,故A正确,因为2NaOH+SiO2====Na2SiO3+H2O;Na2O与CO2反应生成Na2CO3,Na2O2与CO2反应除生成Na2CO3外,还生成O2,故B错;NO在空气中会发生反应2NO+O2====2NO2,故C错;因为新制氯水中含有HClO,故滴入少量的紫色石蕊试液的现象是先变红,后褪色,故D错。
【举一反三】Na2O、Na2O2组成元素相同,与 SO2反应产物相同吗?
提示:不相同,由于Na2O与SO2反应生成的是Na2SO3,而Na2O2与SO2反应时,Na2O2具有强氧化性,反应后生成的是Na2SO4。
5.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A.H2S B.Cl2
C.NH3 D.NO
【解析】选D。浓硫酸是一种既具有酸性,又具有强氧化性的干燥剂,而碱石灰是一种碱性干燥剂,则符合题意的只有D。
【规律方法】常见的干燥剂及选择方法
中学化学中常见的干燥剂有:①浓硫酸:不可干燥碱性气体(NH3)和强还原性气体(H2S、HBr、HI等);
②P2O5:不可干燥碱性气体(NH3);
③碱石灰、生石灰等:不可干燥酸性气体如:CO2、SO2、H2S、Cl2、HCl、HBr、HI等;
④无水氯化钙:不可干燥NH3(特殊原因);
⑤CuSO4:常用来检验水的存在,一般不用来干燥气体。
6.在一定温度和压强下,将一容积15 mL的试管充满NO2后,倒置于一个盛水的水槽中。当试管内液面上升至一定高度不再变化时,在相同条件下再通入O2,若要使试管内液面仍保持在原高度,则应通入O2体积为( )
A.3.75 mL B.7.5 mL
C.8.75 mL D.10.5 mL
【解析】选C。由题意可得,一容积15 mL的试管充满NO2后,倒置于一个盛水的水槽中,则由3NO2+H2O====2HNO3+NO可得,水上升至试管的 处,还有5 mL NO,这时通入O2,让二者发生4NO+3O2+2H2O====4HNO3这一反应,则需要O2 3.75 mL,还要让O2再余下5 mL,则共需O28.75 mL。
二、非选择题(本题包括2小题,共26分)
7.(10分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式:______;氧化剂是_____,还原剂是_______。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是_____________。
(3)控制城市空气污染源的方法可以有_______。
a.开发氢能源 b.使用电动车
c.植树造林 d.戴上呼吸面具
【解析】解此题,一方面应从反应物自身的性质入手,汽车尾气中,CO具有较强的还原性,NO具有较强的氧化性,一定条件下,可能发生氧化还原反应;另一方面,应紧扣题意,寻找突破口,由“生成可参与大气生态循环的无毒气体”,推出产物为CO2和N2。
答案:(1)2CO+2NO 2CO2+N2 NO CO
(2)“催化转换器”促进SO2转化成SO3,产生硫酸酸雾
(3)a、b
催化剂
====
8.(16分)某非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气
体。
①A的化学式:___________________________________。
②工业生产中大量排放的B气体被雨水吸收后形成
__________而污染环境。
③写出B→C反应的化学方程式:_____________________。
④D的浓溶液可与木炭反应并生成C气体,该反应的化学方程式为:_____________________。
(2)若A在常温下为气体,C是红棕色气体。
①A、C的化学式分别是:A_________,__________。
②写出B→C反应的化学方程式:________________。
【解析】由题意可得,A是淡黄色固体单质,则A就是硫,B为SO2,C为SO3,D为H2SO4。若A是气体,C是红棕色气体,则A为N2,B为NO,C为NO2,D为HNO3。
答案:(1)①S ②H2SO4 (H2SO3) 或酸雨
③2SO2+O2 2SO3
④C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
(2)①N2 NO2
②2NO+O2====2NO2
△
====
催化剂
△
