11-12版高中化学课时讲练通配套课件:专题质量评估(二) (苏教版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:专题质量评估(二) (苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 613.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-12 19:18:56 | ||
图片预览











文档简介
(共51张PPT)
(二)
专题2 从海水中获得的化学物质
(90分钟 100分)
一、选择题(本题包括15小题,每小题3分,
共45分)
1.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
【解析】选C。海水中钾元素以K+形式存在,生成钾单质必然发生化学反应,A错。蒸发制海盐的过程中发生的主要是物理变化,B错。潮汐发电是将动能转化为电能,D错。
2.(2011·福州高一检测)在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一定正确的是( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2存在
C.加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明氯水中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
【解析】选B。氯水中使有色布条褪色的物质为HClO,A项错误。Cl2为黄绿色,有刺激性气味,B项正确。因为加入了盐酸则无法证明原来的氯水中是否含有Cl-,C项错误。因Cl2也与NaOH反应,故D项错误。
3.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是
( )
①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液
⑤盐酸 ⑥盐酸酸化的漂白粉溶液
A.①②③ B.①②③⑥ C.③⑥ D.③④⑥
【解析】选C。根据题目,能使干燥的蓝色石蕊试纸显红色,体现H+的性质,溶液呈酸性;使红色褪去,体现HClO的性质,使蓝色石蕊试纸先变红后褪色的应该是既含有盐酸,又含有HClO的物质。氯气、液氯中只有氯气分子,在氯气的酒精溶液中存在的是氯气分子和酒精分子(氯气的酒精溶液就是将氯气溶于酒精,两者之间并没有发生反应),氯气分子不能使干燥的蓝色石蕊试纸变红。盐酸只能使干燥的蓝色石蕊试纸变红色,不能使其褪色。盐酸酸化的漂白粉溶液中,盐酸与漂白粉中的Ca(ClO)2发生反应Ca(ClO)2+2HCl====CaCl2+2HClO,反应剩余的盐酸使干燥的蓝色石蕊试纸变红色,生成的HClO使红色褪去。
4.将适量的氯气通入溴化钠溶液中恰好完全反应,再向溶液中加入一定量的CCl4,充分振荡,观察到的现象是( )
A.溶液由无色变橙色
B.上层几乎无色,下层显橙色
C.溶液由橙色变无色
D.上层无色,下层为紫色
【解析】选B。通入Cl2后发生反应:Cl2+2Br-====2Cl-+Br2,加入CCl4振荡,静置后,溶液分为上、下两层,上层为NaCl溶液层,下层为Br2的CCl4溶液层。
5.把各组中的气体通入溶液中,溶液导电能力显著增强的是( )
A.CO2通入NaOH溶液
B.CO2通入石灰水
C.NH3通入CH3COOH溶液
D.NH3通入盐酸溶液中
【解析】选C。NH3通入弱电解质CH3COOH溶液,会生成易电离的强电解质醋酸铵,增加溶液中的离子浓度,使溶液的导电能力显著增强。
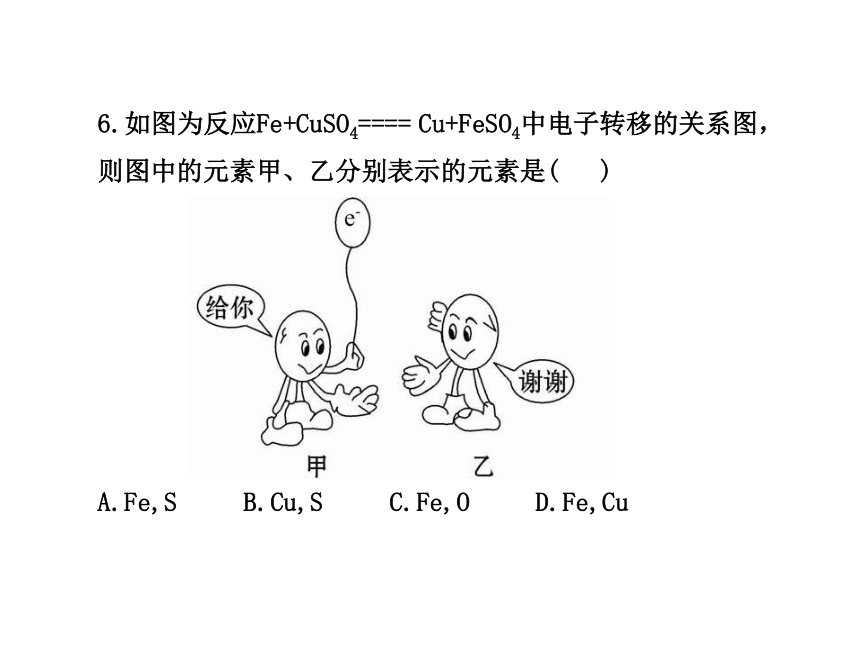
6.如图为反应Fe+CuSO4==== Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示的元素是( )
A.Fe,S B.Cu,S C.Fe,O D.Fe,Cu
【解析】选D。本题考查了氧化还原反应的实质,在所给反应中Fe失电子,作还原剂;Cu2+得电子,生成Cu;所以甲表示元素Fe,乙表示元素Cu。
7.下列叙述中正确的是( )
A.碘易升华,所以要保存在铁盖旋紧的试剂瓶中
B.液溴应保存在磨口玻璃塞棕色细口试剂瓶中,并加少量水进行水封
C.碘易溶于酒精,所以可用酒精从碘水中将碘萃取出来
D.用加热的方法可将碳酸氢钠中混有的少量碘除去
【解析】选B。碘易升华,生成的碘蒸气可将铁氧化成FeI2,所以A项错误;溴易挥发,水封可减缓挥发,放在玻璃塞的棕色瓶中,防止HBrO见光分解。一般液体药品盛在细口瓶中,固体药品盛在广口瓶中,故B项正确;酒精不能用作碘水中碘的萃取剂,萃取碘水中的碘用的试剂必须和水互不相溶;碳酸氢钠在受热时易分解:2NaHCO3
Na2CO3+H2O+CO2↑。
△
====
8.(2011·琼海高一检测)下列离子方程式正确的是( )
A.钠跟水反应:Na+2H2O====Na++2OH-+H2↑
B.碳酸钙与盐酸反应:CO32-+2H+====CO2↑+H2O
C.稀硫酸与锌反应:
H2SO4+Zn====Zn2++SO42-+H2↑
D.硫酸溶液与氢氧化钠溶液反应:H++OH- ==== H2O
【解析】选D。钠跟水反应:2Na+2H2O====2Na++2OH-+H2↑,A错;碳酸钙与盐酸反应:CaCO3+2H+====CO2↑
+H2O+Ca2+,B错;稀硫酸与锌反应:2H++Zn====Zn2++H2↑,C错。
9.(双选)下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.①Cu(OH)2与盐酸 ②Cu(OH)2与醋酸
B.①BaCl2溶液与Na2SO4溶液
②Ba(OH)2溶液与Na2SO4溶液
C.①NaHCO3溶液与NaHSO4溶液
②Na2CO3溶液与NaHSO4溶液
D.①石灰石与硝酸 ②石灰石与盐酸
【解析】选B、D。A项中盐酸拆开,醋酸不能拆;B项都可以用Ba2++ SO42-====BaSO4↓表示;C项碳酸氢根离子与碳酸根离子不同;D项都可以用CaCO3+2H+====Ca2++CO2↑+H2O表示。
10.某同学用下列装置制备并检验Cl2的性质。
下列说法正确的是( )
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
【解析】选D。A项:MnO2与浓盐酸反应生成Cl2,与稀盐酸不反应,该项说法错误;B项:应发生取代反应;C项:应生成棕黄色的烟。
11.如图所示,纵坐标表示导电能力,
横坐标表示所加溶液的量,以下各组
反应,符合该图的是( )
A.Ba(OH)2溶液中滴加稀硫酸
B.NaOH溶液中滴加稀盐酸
C.CH3COOH溶液中滴加KOH溶液
D.Cu(OH)2悬浊液中滴加HNO3溶液
【解析】选A。A项,Ba(OH)2+H2SO4 ==== BaSO4↓+2H2O,当向Ba(OH)2溶液中滴加稀硫酸时,最初Ba(OH)2导电,恰好完全反应时生成BaSO4沉淀和水,导电能力减弱,此时液体几乎不导电,继续滴加H2SO4,H2SO4会导电;B项,反应生成NaCl,导电能力变化不大;C、D两项中开始溶液中因由弱电解质生成强电解质而使导电能力增强,只有A正确。
12.下列物质中含有的杂质(括号内为杂质),可以用加热的方法除去的是( )
A.CaCO3(CaO) B.Cu(CuO)
C.Na2CO3(NaHCO3) D.NaHCO3(Na2CO3)
【解析】选C。A、B、D三项,加热时,杂质不反应,主要成分却能反应,故不能用来除去杂质;C项加热时,NaHCO3分解生成Na2CO3。故选C。
13.在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-6种离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
A.Cu2+、H+、Cl- B.CO32-、OH-、Cl-
C.K+、H+、Cl- D.K+、OH-、CO32-
【解析】选D。甲烧杯中含有Cu2+,则CO32-、OH-在乙烧杯中,Cl-在甲烧杯中。
14.(2011·泰安高一检测)氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl2相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H2O====HBrO
+HCl。下列有关BrCl的性质的叙述中不正确的是( )
A.是较强的氧化剂
B.是一种化合物
C.能使湿润的淀粉碘化钾试纸变蓝
D.BrCl与水反应中,BrCl既是氧化剂又是还原剂
【解析】选D。BrCl的化学性质与Cl2相似,应是较强的氧化剂,可氧化KI生成I2,I2遇淀粉变蓝。BrCl由两种元素组成,显然属于化合物。BrCl分子中,Cl原子吸引电子的能力强,故电子对偏向Cl,使Cl显-1价,Br显+1价,根据反应BrCl+H2O====HBrO+HCl,BrCl中各元素化合价未变,故此反应不是氧化还原反应。
15.下列叙述中正确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
【解析】选D。CaCO3与CO2和水反应生成Ca(HCO3)2,再加入NaHCO3是没有现象的,A项错;向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,仅生成NaHCO3,无CO2气体放出,B项错;等质量的NaHCO3和Na2CO3,其中NaHCO3的物质的量多,与足量盐酸反应时,放出的CO2多,C项错;D项,发生的反应为:Na2CO3+CO2+H2O====2NaHCO3↓,由于NaHCO3的溶解度比Na2CO3小,故有结晶析出,正确。
二、非选择题(本题包括6小题,共55分)
16.(7分)下列物质:①氨气 ②氨水 ③盐酸 ④醋酸
⑤硫酸钡 ⑥氯化银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气 水
(1)属于电解质的是______;(填代码,下同)
(2)属于非电解质的是_______;
(3)属于强电解质的是_________;
(4)属于弱电解质的是________;
(5)通常状况下,能明显导电的是________。
【解析】氨气(NH3)、二氧化碳(CO2)本身不电离,又是化合物,所以是非电解质;氢气为单质,不是化合物,既不是电解质又不是非电解质;氨水(NH3的水溶液)、盐酸(HCl的水溶液)为混合物,是电解质溶液,其中NH3·H2O和氯化氢是电解质;硫酸钡(BaSO4)、氯化银(AgCl)由于溶解度小,离子浓度小,所以导电性弱,但溶解的部分完全电离,所以不仅是电解质,而且是强电解质;CH3COOH、NH3·H2O虽都是弱电解质,但两者反应的产物醋酸铵(CH3COONH4)由于在水溶液中完全电离,所以是强电解质:CH3COOH+NH3·H2O====CH3COONH4+H2O(中和反应)CH3COONH4
====CH3COO-+NH4+。
答案:(1)④⑤⑥⑦⑨ (2)①⑧ (3)⑤⑥⑦⑨
(4)④ (5)②③
17.(8分)(2011·福州高一检测)过量铁粉与稀硝酸反应的方程式为:
3Fe+8HNO3(稀)====3Fe(NO3)2+2NO↑+4H2O,
(1)标出电子转移的方向和数目;
(2)该反应的氧化剂是_____,还原产物是_____;
(3)标准状况下,当生成2.24 L NO气体时,有_____g Fe参加反应,转移电子的物质的量为_____mol,有_____mol氧化剂被还原。
【解析】
3Fe+8HNO3(稀)====3Fe(NO3)2+2NO↑+4H2O
3×56 g 2 mol
x 0.1 mol
x=8.4 g
被还原的硝酸的物质的量等于生成的一氧化氮的物质的量。
答案:(1)
18.(12分)物质A有以下转化关系:
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是_____,B是_____,C是_____,X粉末是_____。
(2)确认A中阳离子的实验方法是_____。
(3)写出反应Ⅰ的化学方程式____________________。
(4)写出反应Ⅱ的离子方程式____________________。
(5)若参加反应的A的质量为39 g,则消耗CO2的体积(标准状况下)为_____L,反应过程中转移电子的物质的量为_____mol。
【解析】能够和CO2反应的淡黄色粉末一定是Na2O2,由此可以确定A是Na2O2,B是O2,C是Na2CO3;中学阶段所学过的蓝色沉淀只有Cu(OH)2,所以黑色固体和浓硫酸反应生成蓝色溶液应为CuSO4,黑色固体应为CuO,X粉末是Cu,无色溶液为NaOH。
答案:(1)Na2O2 O2 Na2CO3 Cu
(2)焰色反应
(3)2Na2O2+2CO2 ==== 2Na2CO3+O2
(4)Cu2++2OH- ==== Cu(OH)2↓
(5)11.2 0.5
19.(7分)某无色透明的溶液可能含有K+、Cu2+、Ca2+、Br-、
SO42-、CO32-、Cl-中的几种,进行如下实验:
(1)滴加氯化钡溶液,有白色沉淀产生。将沉淀滤出,产生的沉淀可部分溶于稀硝酸,将滤液分为两份。
(2)取一份滤液,向其中加入氯水,振荡后静置,氯水颜色不变。
(3)向另一份滤液中加入硝酸银溶液,有白色沉淀生成。试判断:
该溶液中一定有________________________________,
肯定没有_____________________________________,
可能有_______________________________________。
【解析】根据题干中“无色透明的溶液”首先排除Cu2+,并
且Ca2+与SO42-、CO32-、不共存;在(1)步可知原溶液中有
SO42-、CO32-,因此没有Ca2+,Cu2+与Ca2+都被排除,则溶液中一定含有K+;在(2)步可知原溶液中没有Br-;在(3)步不能确定原溶液中是否有氯离子,因为溶液中SO42-、CO32-、也可以与Ag+生成白色沉淀,且溶液之前已加入过氯离子。
答案:K+、SO42-、CO32- Br-、Cu2+、Ca2+ Cl-
20.(10分)有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示。已知:常温常压下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体。请回答下列问题:
(1)B的名称_____。
(2)在一定条件下,D+C E,该反应属于____(填序号)。
①氧化还原反应 ②非氧化还原反应 ③化合反应
④分解反应 ⑤复分解反应 ⑥置换反应 ⑦放热反应
⑧吸热反应 ⑨离子反应
(3)写出下列反应的化学方程式:
①A与C作用生成B:___________________;
②B与CO2反应:___________________。
(4)将A与E反应的另一种产物溶于水配成溶液,再向该溶液中通入过量的CO2,反应的离子方程式为________________
_________________________________________________。
(5)化学反应都有新物质产生,同时还伴随着能量变化。我们曾观察过一个演示实验:用脱脂棉包住约0.2 g B的粉末,放在石棉网上。在脱脂棉上滴加几滴E。请回答下列问题:
①B与E发生反应的离子方程式为_____________________。
②观察到的现象是____________,请解释这个现象发生的原因:____________________________________。
【解析】B为淡黄色固体是该题的突破口,结合题中A、C、D、E的信息可推测出A为Na、B为Na2O2、C为O2、D为H2、E为H2O,推测出各物质,分析各项答案就容易了。
(2)D与C的反应是H2和O2反应生成水的反应,属于氧化还原反应,又属于化合反应,该反应是放热反应。(4)A与E反应除生成H2外还生成NaOH,NaOH溶液与过量的CO2反应生成NaHCO3。
(5)Na2O2与H2O反应放出O2,该反应放热,又有氧气助燃,能够使脱脂棉剧烈燃烧。
答案:(1)过氧化钠 (2)①③⑦
(3)①2Na+O2 Na2O2
②2Na2O2+2CO2====2Na2CO3+O2
(4)CO2+OH- ==== HCO3-
(5)①2Na2O2+2H2O====4OH-+4Na++O2↑
②脱脂棉剧烈燃烧 反应放热能使脱脂棉燃烧,反应中生成的氧气又使燃烧加剧
点燃
====
21.(11分)(2011·杭州高一检测)从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
(1)上述流程图①~⑨步骤中,属于氧化还原反应的是_____(填序号);
(2)若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:
A.盐酸、B.Na2CO3溶液、C.NaOH溶液。
请你正确排列加入的顺序:
__________、_________、__________(填编号);
(3)用如图装置电解饱和食盐水,石墨棒上产生的气体为Cl2;在铁棒周围的溶液里滴加紫色石蕊试液,溶液变成____色;
(4)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作为______(填编号)。
A.蒸馏 B.蒸发
C.冷却结晶 D.晶体灼烧
【解析】①~⑨各步骤的原理及发生的反应如下表:
(3)铁棒作阴极,其电极反应为:2H2O+2e- ==== H2↑+2OH-,溶液产生OH-,加入紫色石蕊试液,溶液变蓝。
(4)因为MgCl2的溶解度随温度的升高而增大,所以从MgCl2溶液中获取MgCl2·6H2O晶体,可以先将溶液加热浓缩,制成热的MgCl2饱和溶液,然后冷却结晶,过滤即得MgCl2·6H2O晶体。
答案:(1)③⑨ (2)B C A(或C B A) (3)蓝
(4)B、C
(二)
专题2 从海水中获得的化学物质
(90分钟 100分)
一、选择题(本题包括15小题,每小题3分,
共45分)
1.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
【解析】选C。海水中钾元素以K+形式存在,生成钾单质必然发生化学反应,A错。蒸发制海盐的过程中发生的主要是物理变化,B错。潮汐发电是将动能转化为电能,D错。
2.(2011·福州高一检测)在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一定正确的是( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2存在
C.加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明氯水中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
【解析】选B。氯水中使有色布条褪色的物质为HClO,A项错误。Cl2为黄绿色,有刺激性气味,B项正确。因为加入了盐酸则无法证明原来的氯水中是否含有Cl-,C项错误。因Cl2也与NaOH反应,故D项错误。
3.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是
( )
①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液
⑤盐酸 ⑥盐酸酸化的漂白粉溶液
A.①②③ B.①②③⑥ C.③⑥ D.③④⑥
【解析】选C。根据题目,能使干燥的蓝色石蕊试纸显红色,体现H+的性质,溶液呈酸性;使红色褪去,体现HClO的性质,使蓝色石蕊试纸先变红后褪色的应该是既含有盐酸,又含有HClO的物质。氯气、液氯中只有氯气分子,在氯气的酒精溶液中存在的是氯气分子和酒精分子(氯气的酒精溶液就是将氯气溶于酒精,两者之间并没有发生反应),氯气分子不能使干燥的蓝色石蕊试纸变红。盐酸只能使干燥的蓝色石蕊试纸变红色,不能使其褪色。盐酸酸化的漂白粉溶液中,盐酸与漂白粉中的Ca(ClO)2发生反应Ca(ClO)2+2HCl====CaCl2+2HClO,反应剩余的盐酸使干燥的蓝色石蕊试纸变红色,生成的HClO使红色褪去。
4.将适量的氯气通入溴化钠溶液中恰好完全反应,再向溶液中加入一定量的CCl4,充分振荡,观察到的现象是( )
A.溶液由无色变橙色
B.上层几乎无色,下层显橙色
C.溶液由橙色变无色
D.上层无色,下层为紫色
【解析】选B。通入Cl2后发生反应:Cl2+2Br-====2Cl-+Br2,加入CCl4振荡,静置后,溶液分为上、下两层,上层为NaCl溶液层,下层为Br2的CCl4溶液层。
5.把各组中的气体通入溶液中,溶液导电能力显著增强的是( )
A.CO2通入NaOH溶液
B.CO2通入石灰水
C.NH3通入CH3COOH溶液
D.NH3通入盐酸溶液中
【解析】选C。NH3通入弱电解质CH3COOH溶液,会生成易电离的强电解质醋酸铵,增加溶液中的离子浓度,使溶液的导电能力显著增强。
6.如图为反应Fe+CuSO4==== Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示的元素是( )
A.Fe,S B.Cu,S C.Fe,O D.Fe,Cu
【解析】选D。本题考查了氧化还原反应的实质,在所给反应中Fe失电子,作还原剂;Cu2+得电子,生成Cu;所以甲表示元素Fe,乙表示元素Cu。
7.下列叙述中正确的是( )
A.碘易升华,所以要保存在铁盖旋紧的试剂瓶中
B.液溴应保存在磨口玻璃塞棕色细口试剂瓶中,并加少量水进行水封
C.碘易溶于酒精,所以可用酒精从碘水中将碘萃取出来
D.用加热的方法可将碳酸氢钠中混有的少量碘除去
【解析】选B。碘易升华,生成的碘蒸气可将铁氧化成FeI2,所以A项错误;溴易挥发,水封可减缓挥发,放在玻璃塞的棕色瓶中,防止HBrO见光分解。一般液体药品盛在细口瓶中,固体药品盛在广口瓶中,故B项正确;酒精不能用作碘水中碘的萃取剂,萃取碘水中的碘用的试剂必须和水互不相溶;碳酸氢钠在受热时易分解:2NaHCO3
Na2CO3+H2O+CO2↑。
△
====
8.(2011·琼海高一检测)下列离子方程式正确的是( )
A.钠跟水反应:Na+2H2O====Na++2OH-+H2↑
B.碳酸钙与盐酸反应:CO32-+2H+====CO2↑+H2O
C.稀硫酸与锌反应:
H2SO4+Zn====Zn2++SO42-+H2↑
D.硫酸溶液与氢氧化钠溶液反应:H++OH- ==== H2O
【解析】选D。钠跟水反应:2Na+2H2O====2Na++2OH-+H2↑,A错;碳酸钙与盐酸反应:CaCO3+2H+====CO2↑
+H2O+Ca2+,B错;稀硫酸与锌反应:2H++Zn====Zn2++H2↑,C错。
9.(双选)下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.①Cu(OH)2与盐酸 ②Cu(OH)2与醋酸
B.①BaCl2溶液与Na2SO4溶液
②Ba(OH)2溶液与Na2SO4溶液
C.①NaHCO3溶液与NaHSO4溶液
②Na2CO3溶液与NaHSO4溶液
D.①石灰石与硝酸 ②石灰石与盐酸
【解析】选B、D。A项中盐酸拆开,醋酸不能拆;B项都可以用Ba2++ SO42-====BaSO4↓表示;C项碳酸氢根离子与碳酸根离子不同;D项都可以用CaCO3+2H+====Ca2++CO2↑+H2O表示。
10.某同学用下列装置制备并检验Cl2的性质。
下列说法正确的是( )
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
【解析】选D。A项:MnO2与浓盐酸反应生成Cl2,与稀盐酸不反应,该项说法错误;B项:应发生取代反应;C项:应生成棕黄色的烟。
11.如图所示,纵坐标表示导电能力,
横坐标表示所加溶液的量,以下各组
反应,符合该图的是( )
A.Ba(OH)2溶液中滴加稀硫酸
B.NaOH溶液中滴加稀盐酸
C.CH3COOH溶液中滴加KOH溶液
D.Cu(OH)2悬浊液中滴加HNO3溶液
【解析】选A。A项,Ba(OH)2+H2SO4 ==== BaSO4↓+2H2O,当向Ba(OH)2溶液中滴加稀硫酸时,最初Ba(OH)2导电,恰好完全反应时生成BaSO4沉淀和水,导电能力减弱,此时液体几乎不导电,继续滴加H2SO4,H2SO4会导电;B项,反应生成NaCl,导电能力变化不大;C、D两项中开始溶液中因由弱电解质生成强电解质而使导电能力增强,只有A正确。
12.下列物质中含有的杂质(括号内为杂质),可以用加热的方法除去的是( )
A.CaCO3(CaO) B.Cu(CuO)
C.Na2CO3(NaHCO3) D.NaHCO3(Na2CO3)
【解析】选C。A、B、D三项,加热时,杂质不反应,主要成分却能反应,故不能用来除去杂质;C项加热时,NaHCO3分解生成Na2CO3。故选C。
13.在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-6种离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
A.Cu2+、H+、Cl- B.CO32-、OH-、Cl-
C.K+、H+、Cl- D.K+、OH-、CO32-
【解析】选D。甲烧杯中含有Cu2+,则CO32-、OH-在乙烧杯中,Cl-在甲烧杯中。
14.(2011·泰安高一检测)氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl2相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H2O====HBrO
+HCl。下列有关BrCl的性质的叙述中不正确的是( )
A.是较强的氧化剂
B.是一种化合物
C.能使湿润的淀粉碘化钾试纸变蓝
D.BrCl与水反应中,BrCl既是氧化剂又是还原剂
【解析】选D。BrCl的化学性质与Cl2相似,应是较强的氧化剂,可氧化KI生成I2,I2遇淀粉变蓝。BrCl由两种元素组成,显然属于化合物。BrCl分子中,Cl原子吸引电子的能力强,故电子对偏向Cl,使Cl显-1价,Br显+1价,根据反应BrCl+H2O====HBrO+HCl,BrCl中各元素化合价未变,故此反应不是氧化还原反应。
15.下列叙述中正确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
【解析】选D。CaCO3与CO2和水反应生成Ca(HCO3)2,再加入NaHCO3是没有现象的,A项错;向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,仅生成NaHCO3,无CO2气体放出,B项错;等质量的NaHCO3和Na2CO3,其中NaHCO3的物质的量多,与足量盐酸反应时,放出的CO2多,C项错;D项,发生的反应为:Na2CO3+CO2+H2O====2NaHCO3↓,由于NaHCO3的溶解度比Na2CO3小,故有结晶析出,正确。
二、非选择题(本题包括6小题,共55分)
16.(7分)下列物质:①氨气 ②氨水 ③盐酸 ④醋酸
⑤硫酸钡 ⑥氯化银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气 水
(1)属于电解质的是______;(填代码,下同)
(2)属于非电解质的是_______;
(3)属于强电解质的是_________;
(4)属于弱电解质的是________;
(5)通常状况下,能明显导电的是________。
【解析】氨气(NH3)、二氧化碳(CO2)本身不电离,又是化合物,所以是非电解质;氢气为单质,不是化合物,既不是电解质又不是非电解质;氨水(NH3的水溶液)、盐酸(HCl的水溶液)为混合物,是电解质溶液,其中NH3·H2O和氯化氢是电解质;硫酸钡(BaSO4)、氯化银(AgCl)由于溶解度小,离子浓度小,所以导电性弱,但溶解的部分完全电离,所以不仅是电解质,而且是强电解质;CH3COOH、NH3·H2O虽都是弱电解质,但两者反应的产物醋酸铵(CH3COONH4)由于在水溶液中完全电离,所以是强电解质:CH3COOH+NH3·H2O====CH3COONH4+H2O(中和反应)CH3COONH4
====CH3COO-+NH4+。
答案:(1)④⑤⑥⑦⑨ (2)①⑧ (3)⑤⑥⑦⑨
(4)④ (5)②③
17.(8分)(2011·福州高一检测)过量铁粉与稀硝酸反应的方程式为:
3Fe+8HNO3(稀)====3Fe(NO3)2+2NO↑+4H2O,
(1)标出电子转移的方向和数目;
(2)该反应的氧化剂是_____,还原产物是_____;
(3)标准状况下,当生成2.24 L NO气体时,有_____g Fe参加反应,转移电子的物质的量为_____mol,有_____mol氧化剂被还原。
【解析】
3Fe+8HNO3(稀)====3Fe(NO3)2+2NO↑+4H2O
3×56 g 2 mol
x 0.1 mol
x=8.4 g
被还原的硝酸的物质的量等于生成的一氧化氮的物质的量。
答案:(1)
18.(12分)物质A有以下转化关系:
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是_____,B是_____,C是_____,X粉末是_____。
(2)确认A中阳离子的实验方法是_____。
(3)写出反应Ⅰ的化学方程式____________________。
(4)写出反应Ⅱ的离子方程式____________________。
(5)若参加反应的A的质量为39 g,则消耗CO2的体积(标准状况下)为_____L,反应过程中转移电子的物质的量为_____mol。
【解析】能够和CO2反应的淡黄色粉末一定是Na2O2,由此可以确定A是Na2O2,B是O2,C是Na2CO3;中学阶段所学过的蓝色沉淀只有Cu(OH)2,所以黑色固体和浓硫酸反应生成蓝色溶液应为CuSO4,黑色固体应为CuO,X粉末是Cu,无色溶液为NaOH。
答案:(1)Na2O2 O2 Na2CO3 Cu
(2)焰色反应
(3)2Na2O2+2CO2 ==== 2Na2CO3+O2
(4)Cu2++2OH- ==== Cu(OH)2↓
(5)11.2 0.5
19.(7分)某无色透明的溶液可能含有K+、Cu2+、Ca2+、Br-、
SO42-、CO32-、Cl-中的几种,进行如下实验:
(1)滴加氯化钡溶液,有白色沉淀产生。将沉淀滤出,产生的沉淀可部分溶于稀硝酸,将滤液分为两份。
(2)取一份滤液,向其中加入氯水,振荡后静置,氯水颜色不变。
(3)向另一份滤液中加入硝酸银溶液,有白色沉淀生成。试判断:
该溶液中一定有________________________________,
肯定没有_____________________________________,
可能有_______________________________________。
【解析】根据题干中“无色透明的溶液”首先排除Cu2+,并
且Ca2+与SO42-、CO32-、不共存;在(1)步可知原溶液中有
SO42-、CO32-,因此没有Ca2+,Cu2+与Ca2+都被排除,则溶液中一定含有K+;在(2)步可知原溶液中没有Br-;在(3)步不能确定原溶液中是否有氯离子,因为溶液中SO42-、CO32-、也可以与Ag+生成白色沉淀,且溶液之前已加入过氯离子。
答案:K+、SO42-、CO32- Br-、Cu2+、Ca2+ Cl-
20.(10分)有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示。已知:常温常压下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体。请回答下列问题:
(1)B的名称_____。
(2)在一定条件下,D+C E,该反应属于____(填序号)。
①氧化还原反应 ②非氧化还原反应 ③化合反应
④分解反应 ⑤复分解反应 ⑥置换反应 ⑦放热反应
⑧吸热反应 ⑨离子反应
(3)写出下列反应的化学方程式:
①A与C作用生成B:___________________;
②B与CO2反应:___________________。
(4)将A与E反应的另一种产物溶于水配成溶液,再向该溶液中通入过量的CO2,反应的离子方程式为________________
_________________________________________________。
(5)化学反应都有新物质产生,同时还伴随着能量变化。我们曾观察过一个演示实验:用脱脂棉包住约0.2 g B的粉末,放在石棉网上。在脱脂棉上滴加几滴E。请回答下列问题:
①B与E发生反应的离子方程式为_____________________。
②观察到的现象是____________,请解释这个现象发生的原因:____________________________________。
【解析】B为淡黄色固体是该题的突破口,结合题中A、C、D、E的信息可推测出A为Na、B为Na2O2、C为O2、D为H2、E为H2O,推测出各物质,分析各项答案就容易了。
(2)D与C的反应是H2和O2反应生成水的反应,属于氧化还原反应,又属于化合反应,该反应是放热反应。(4)A与E反应除生成H2外还生成NaOH,NaOH溶液与过量的CO2反应生成NaHCO3。
(5)Na2O2与H2O反应放出O2,该反应放热,又有氧气助燃,能够使脱脂棉剧烈燃烧。
答案:(1)过氧化钠 (2)①③⑦
(3)①2Na+O2 Na2O2
②2Na2O2+2CO2====2Na2CO3+O2
(4)CO2+OH- ==== HCO3-
(5)①2Na2O2+2H2O====4OH-+4Na++O2↑
②脱脂棉剧烈燃烧 反应放热能使脱脂棉燃烧,反应中生成的氧气又使燃烧加剧
点燃
====
21.(11分)(2011·杭州高一检测)从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
(1)上述流程图①~⑨步骤中,属于氧化还原反应的是_____(填序号);
(2)若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:
A.盐酸、B.Na2CO3溶液、C.NaOH溶液。
请你正确排列加入的顺序:
__________、_________、__________(填编号);
(3)用如图装置电解饱和食盐水,石墨棒上产生的气体为Cl2;在铁棒周围的溶液里滴加紫色石蕊试液,溶液变成____色;
(4)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作为______(填编号)。
A.蒸馏 B.蒸发
C.冷却结晶 D.晶体灼烧
【解析】①~⑨各步骤的原理及发生的反应如下表:
(3)铁棒作阴极,其电极反应为:2H2O+2e- ==== H2↑+2OH-,溶液产生OH-,加入紫色石蕊试液,溶液变蓝。
(4)因为MgCl2的溶解度随温度的升高而增大,所以从MgCl2溶液中获取MgCl2·6H2O晶体,可以先将溶液加热浓缩,制成热的MgCl2饱和溶液,然后冷却结晶,过滤即得MgCl2·6H2O晶体。
答案:(1)③⑨ (2)B C A(或C B A) (3)蓝
(4)B、C
