5.1质量守恒定律课件--2021-2022学年九年级化学人教版上册(共46张PPT)
文档属性
| 名称 | 5.1质量守恒定律课件--2021-2022学年九年级化学人教版上册(共46张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 8.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-05 23:10:51 | ||
图片预览











文档简介
(共46张PPT)
课题1 质量守恒定律
第五单元 化学方程式
1.通过实验探究,发现、认识、理解质量守恒定律, 了解常见化学方应中的质量关系。
2.能从分子、原子角度揭示化学反应实质,认识质量 守恒的原因。
3.能运用质量守恒定律解释、解决化学反应中的现象及存在的问题。
生日宴会中我们发现生日蜡烛会越烧越短。化学反应发生后物质的质量是不是变少了?
为什么变短了?
通过准确测量,发现铁生锈后质量变大了。化学反应发生后物质的质量是不是增加了?
为什么变重了?
【提出问题】化学反应前后物质的质量有没有变化呢?
【猜想】你的猜想是 (变大、变小或不变)
活动与探究一
红磷燃烧前后总质量的测定
探究步骤 探究内容
1.提出问题 红磷燃烧前后物质的质量之间有什么关系呢?
2.提出假设 ①减小;②增大;③不变。
3.设计实验
4.观察现象
5.得出结论
①称量反应前装置及药品的质量总和
②引燃红磷
③反应完毕,称量反应后装置的质量总和
红磷燃烧,产生大量白烟,放热,生成白色固体;气球先变大后缩小;天平保持平衡。
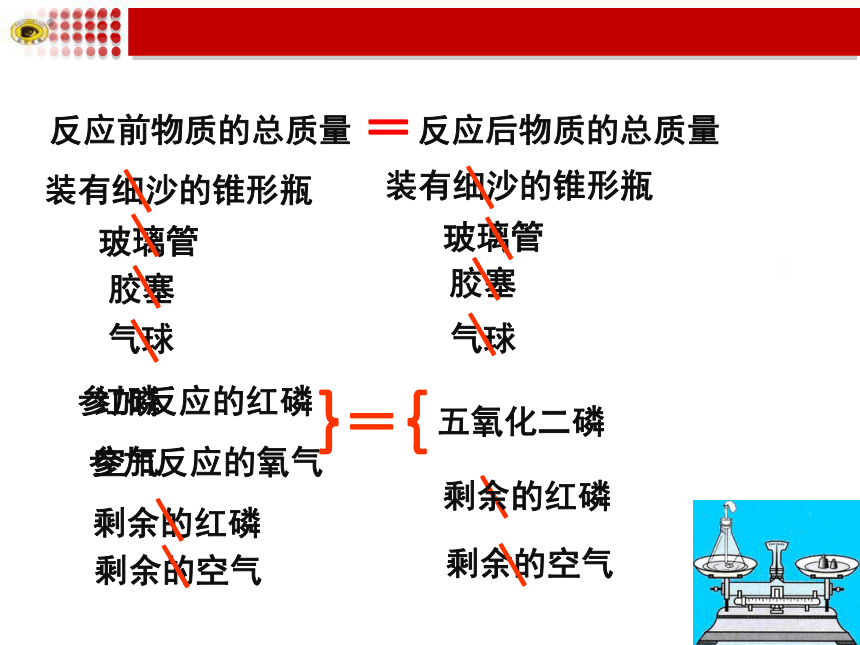
红磷燃烧前后物质的总质量相等。
实验前
实验中
实验后
气球的作用:防止由于气体膨胀而冲开瓶塞。
装有细沙的锥形瓶
玻璃管
红磷
空气
装有细沙的锥形瓶
玻璃管
胶塞
胶塞
五氧化二磷
剩余的空气
剩余的红磷
参加反应的红磷
参加反应的氧气
\
\
\
\
\
\
\
\
反应后物质的总质量
反应前物质的总质量
=
}
=
{
气球
气球
\
\
剩余的红磷
剩余的空气
\
\
探究实验
铁和硫酸铜溶液反应前后质量的测定
取一根铁钉
①首先 ;
②然后,不动砝码和游码,取下烧杯,镊子夹取铁钉
放入到硫酸铜溶液中,过一会取出,观察现象;
③反应后;___________________________________;
④实验完毕,整理实验仪器 (砝码回盒,游码归零)
称量烧杯、硫酸铜溶液、铁钉的质量
再次放到天平上称量,看天平是否平衡
实验的步骤:
实验现象:
铁钉表面覆盖一层红色固体物质,(溶液由蓝色变为浅绿色),天平平衡。
Fe + CuSO4 =
Cu + FeSO4
银白色
蓝色
红色
浅绿色
铁 + 硫酸铜 == 铜 +硫酸亚铁
M1 = M2
Fe CuSO4 Cu FeSO4
反应原理:
结论:反应物质量总和=生成物质量总和
m(Fe)+ m(CuSO4) = m(Cu) + m(FeSO4)
参加化学反应的各物质的质量总和
反应后生成的各物质的质量总和
质量守恒定律:
【典例1】下列变化能用质量守恒定律解释的是( )
A.5g水受热变成5g水蒸气
B.5g食盐溶解在95g水中,成为100g食盐溶液
C.铁与硫酸铜溶液反应后质量不变
D.100mL水中加入100mL酒精,成为体积小于200mL的
溶液
C
1.蜡烛在空气中燃烧,蜡烛的质量为什么会变小?
2.铁生锈后,质量为什么会
变大?
【典例2】
12g碳在充足的氧气中燃烧,生成二氧化碳44g,
则有____g 氧气参加反应。
【典例3】
序号 碳的质量(g) 氧气的质量(g) 二氧化碳的质量(g)
1 12 40
2 20 32
3 20 16
32
44
44
22
把握质量守恒定律应注意几点
1.只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!
2.“总和”意味着把各种状态的反应物和生成物都计算在内。如肉眼看不见的气体等。
3. “参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
化学反应
将稀盐酸倒入烧杯中
实验现象:
固体粉末消失,产生大量气泡;
碳酸钠 + 盐酸 氯化钠 + 二氧化碳 + 水
反应原理:
探究实验
天平不平衡,指针向右倾斜,
右盘下沉
天平平衡情况:
Na2CO3+HCl NaCl + CO2
H2O
+
怎么反应后天平不平衡了呢?
这个反应遵守质量守恒定律吗?
在有气体生成的化学变化中,验证质量守恒定律时候,必须在密闭容器中进行
敞口装置体系
1
2
碳酸钠粉末
稀盐酸
装置特点:利用气球形成密闭且容积可变体系。
容积不可变的密闭体系
镁 + 氧气
氧化镁
点燃
思考:1.该实验的现象是什么?
发出耀眼的白光,放出大量的热,生成白色固体,同时还有白烟产生。
思考:2.该反应的原理是什么?
Mg + O2
MgO
点燃
Mg + O2
MgO
点燃
变重
变轻
m(Mg ) +m(O2 ) = m( MgO )
m(Mg ) +m(O2 ) = m(白色粉末)+ m(白烟)
思考:
如果在燃着的镁条上方罩上罩,使生成物全部收集起来称量,会出现什么结果?
在有气体参加化学变化中,验证质量守恒定律时候,必须在密闭容器中进行
为什么化学反应前后的物质的质量总和相等?
试用宏观(元素)、微观(分子、原子)的观点解释质量守恒的原因。
化学变化的实质是:
分子
原子
分解为
新分子
重组
水 氢气 + 氧气
通电
分析讨论:
①化学反应前后,元素种类变了吗?
②化学反应前后,原子种类变了吗?
H2O H2 O2
化学反应前后
一定不变:
原子的种类
原子的数目
原子的质量
微观
元素的种类
元素的质量
宏观
结果:
物质总质量不变
(六不变)
化学反应前后
一定改变:
(宏观)物质的种类
(微观)粒子的种类
可能改变:
粒子的个数
“水变成含碳元素的高价的汽油、柴油,经济收入惊人,技术转让,请有识之士加盟。”
同学们,假如你是老板,你是否会加盟呢?请谈一谈你的想法?
化学反应前后,元素种类不变
化学反应前后质量守恒的原因是:
原子的种类不变
原子的质量不变
原子的数目不变
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不 变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
物质的状态或颜色
1.化学反应前后,肯定没有发生变化的是( )
①原子数目 ②分子数目 ③元素种类
④物质种类 ⑤原子种类 ⑥物质的总质量
A ①④⑥ B ①③⑤⑥
C ①②⑥ D ②③⑤
B
目标检测
3.现将10g A和足量B混合加热,A与B发生化学反应,10g A完全反应后生成8g C和4g D,则参加反应的A与B的质量比是( )
A. 1 : 1 B. 2 : 1 C. 4 : 1 D. 5 : 1
D
2.现有31g红磷与40g氧气恰好完全反应,则生成五氧化二磷的质量为____g。
71
9
目标检测
4.判断下列说法是否正确,并改正错误的说法.
(1)物质在空气中加热发生反应后,生成物的总质量必定等于反应物的总质量。
(2)高锰酸钾受热分解后,剩余固体的质量减少,因此这个反应不遵守质量守恒定律。
(3)细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大,因此这个反应不遵守质量守恒定律。
×
×
×
目标检测
5.将25g氯酸钾和6g二氧化锰的混合物加热一段时间后,得到残余固体的质量为22 g,则产生氧气____g。
9
碳
点燃
二氧化碳
+
氧气
“和”、“与”、“跟”
“反应条件”
“生成”
反应物
生成物
写起来很麻烦,
怎么办
二.化学方程式
这是什么式子 它可以提供
哪些信息 它怎么读呢
C
O2
点燃
CO2
+
C
O
O
C
O
O
12
16×2
32
44
:
:
:
:
12+16×2
12
这种用化学式表示化学反应的式子,叫做化学方程式
C +
O2
点燃
CO2
2.表明反应条件
4.表示各物质的质量关系
1.表明反应物
3.表明生成物
讨论:
化学方程式提供的信息:
32
44
:
:
12
5.表示各物质之间粒子个数比
化学方程式的意义(读法)
(1) 表示反应物,生成物和反应条件(宏观意义)
读物质:表示碳和氧气在点燃条件下反应,生成二氧化碳
(2)表示反应物和生成物之间各物质的质量比(宏观意义)
读质量:表示每12份质量的碳与32份质量的氧气在点燃条件下反应完全反应,生成44份质量的二氧化碳。
(3)表示反应物和生成物的各粒子个数比(微观意义)
(粒子个数比即化学式前面的化学计量数之比)
读微粒:表示每1个碳原子与1个氧分子在点燃条件下反应,生成1个二氧化碳分子。
4P + 5O2 2P2O5
4×31 5×32 2×142
点燃
1.读物质:磷和氧气在点燃条件下反应,生成五氧化二磷。
3.读微粒:每4个磷原子和5个氧分子在点燃的条件下反应,生成2个五氧化二磷分子。
2.读质量:每124份质量的磷与160份质量的氧气在点燃的条件下完全反应, 生成284份质量的五氧化二磷。
你能说!
如 :3H2 + N2 2NH3
高温、高压
催化剂
(1)读物质:氢气和氮气在高温、高压和催化 剂的条件下反应生成氨气;
(3)读微粒:3个氢分子和1个氮分子在高温、
高压和催化剂的条件下反应生成 2个氨分子;
(2)读质量:每6份质量的氢气和28份质量的 氮气在高温、高压和催化剂的条件下反
应后可生成34份质量的氨气;
2×3 28 17×2
课题1 质量守恒定律
第五单元 化学方程式
1.通过实验探究,发现、认识、理解质量守恒定律, 了解常见化学方应中的质量关系。
2.能从分子、原子角度揭示化学反应实质,认识质量 守恒的原因。
3.能运用质量守恒定律解释、解决化学反应中的现象及存在的问题。
生日宴会中我们发现生日蜡烛会越烧越短。化学反应发生后物质的质量是不是变少了?
为什么变短了?
通过准确测量,发现铁生锈后质量变大了。化学反应发生后物质的质量是不是增加了?
为什么变重了?
【提出问题】化学反应前后物质的质量有没有变化呢?
【猜想】你的猜想是 (变大、变小或不变)
活动与探究一
红磷燃烧前后总质量的测定
探究步骤 探究内容
1.提出问题 红磷燃烧前后物质的质量之间有什么关系呢?
2.提出假设 ①减小;②增大;③不变。
3.设计实验
4.观察现象
5.得出结论
①称量反应前装置及药品的质量总和
②引燃红磷
③反应完毕,称量反应后装置的质量总和
红磷燃烧,产生大量白烟,放热,生成白色固体;气球先变大后缩小;天平保持平衡。
红磷燃烧前后物质的总质量相等。
实验前
实验中
实验后
气球的作用:防止由于气体膨胀而冲开瓶塞。
装有细沙的锥形瓶
玻璃管
红磷
空气
装有细沙的锥形瓶
玻璃管
胶塞
胶塞
五氧化二磷
剩余的空气
剩余的红磷
参加反应的红磷
参加反应的氧气
\
\
\
\
\
\
\
\
反应后物质的总质量
反应前物质的总质量
=
}
=
{
气球
气球
\
\
剩余的红磷
剩余的空气
\
\
探究实验
铁和硫酸铜溶液反应前后质量的测定
取一根铁钉
①首先 ;
②然后,不动砝码和游码,取下烧杯,镊子夹取铁钉
放入到硫酸铜溶液中,过一会取出,观察现象;
③反应后;___________________________________;
④实验完毕,整理实验仪器 (砝码回盒,游码归零)
称量烧杯、硫酸铜溶液、铁钉的质量
再次放到天平上称量,看天平是否平衡
实验的步骤:
实验现象:
铁钉表面覆盖一层红色固体物质,(溶液由蓝色变为浅绿色),天平平衡。
Fe + CuSO4 =
Cu + FeSO4
银白色
蓝色
红色
浅绿色
铁 + 硫酸铜 == 铜 +硫酸亚铁
M1 = M2
Fe CuSO4 Cu FeSO4
反应原理:
结论:反应物质量总和=生成物质量总和
m(Fe)+ m(CuSO4) = m(Cu) + m(FeSO4)
参加化学反应的各物质的质量总和
反应后生成的各物质的质量总和
质量守恒定律:
【典例1】下列变化能用质量守恒定律解释的是( )
A.5g水受热变成5g水蒸气
B.5g食盐溶解在95g水中,成为100g食盐溶液
C.铁与硫酸铜溶液反应后质量不变
D.100mL水中加入100mL酒精,成为体积小于200mL的
溶液
C
1.蜡烛在空气中燃烧,蜡烛的质量为什么会变小?
2.铁生锈后,质量为什么会
变大?
【典例2】
12g碳在充足的氧气中燃烧,生成二氧化碳44g,
则有____g 氧气参加反应。
【典例3】
序号 碳的质量(g) 氧气的质量(g) 二氧化碳的质量(g)
1 12 40
2 20 32
3 20 16
32
44
44
22
把握质量守恒定律应注意几点
1.只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!
2.“总和”意味着把各种状态的反应物和生成物都计算在内。如肉眼看不见的气体等。
3. “参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
化学反应
将稀盐酸倒入烧杯中
实验现象:
固体粉末消失,产生大量气泡;
碳酸钠 + 盐酸 氯化钠 + 二氧化碳 + 水
反应原理:
探究实验
天平不平衡,指针向右倾斜,
右盘下沉
天平平衡情况:
Na2CO3+HCl NaCl + CO2
H2O
+
怎么反应后天平不平衡了呢?
这个反应遵守质量守恒定律吗?
在有气体生成的化学变化中,验证质量守恒定律时候,必须在密闭容器中进行
敞口装置体系
1
2
碳酸钠粉末
稀盐酸
装置特点:利用气球形成密闭且容积可变体系。
容积不可变的密闭体系
镁 + 氧气
氧化镁
点燃
思考:1.该实验的现象是什么?
发出耀眼的白光,放出大量的热,生成白色固体,同时还有白烟产生。
思考:2.该反应的原理是什么?
Mg + O2
MgO
点燃
Mg + O2
MgO
点燃
变重
变轻
m(Mg ) +m(O2 ) = m( MgO )
m(Mg ) +m(O2 ) = m(白色粉末)+ m(白烟)
思考:
如果在燃着的镁条上方罩上罩,使生成物全部收集起来称量,会出现什么结果?
在有气体参加化学变化中,验证质量守恒定律时候,必须在密闭容器中进行
为什么化学反应前后的物质的质量总和相等?
试用宏观(元素)、微观(分子、原子)的观点解释质量守恒的原因。
化学变化的实质是:
分子
原子
分解为
新分子
重组
水 氢气 + 氧气
通电
分析讨论:
①化学反应前后,元素种类变了吗?
②化学反应前后,原子种类变了吗?
H2O H2 O2
化学反应前后
一定不变:
原子的种类
原子的数目
原子的质量
微观
元素的种类
元素的质量
宏观
结果:
物质总质量不变
(六不变)
化学反应前后
一定改变:
(宏观)物质的种类
(微观)粒子的种类
可能改变:
粒子的个数
“水变成含碳元素的高价的汽油、柴油,经济收入惊人,技术转让,请有识之士加盟。”
同学们,假如你是老板,你是否会加盟呢?请谈一谈你的想法?
化学反应前后,元素种类不变
化学反应前后质量守恒的原因是:
原子的种类不变
原子的质量不变
原子的数目不变
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不 变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
物质的状态或颜色
1.化学反应前后,肯定没有发生变化的是( )
①原子数目 ②分子数目 ③元素种类
④物质种类 ⑤原子种类 ⑥物质的总质量
A ①④⑥ B ①③⑤⑥
C ①②⑥ D ②③⑤
B
目标检测
3.现将10g A和足量B混合加热,A与B发生化学反应,10g A完全反应后生成8g C和4g D,则参加反应的A与B的质量比是( )
A. 1 : 1 B. 2 : 1 C. 4 : 1 D. 5 : 1
D
2.现有31g红磷与40g氧气恰好完全反应,则生成五氧化二磷的质量为____g。
71
9
目标检测
4.判断下列说法是否正确,并改正错误的说法.
(1)物质在空气中加热发生反应后,生成物的总质量必定等于反应物的总质量。
(2)高锰酸钾受热分解后,剩余固体的质量减少,因此这个反应不遵守质量守恒定律。
(3)细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大,因此这个反应不遵守质量守恒定律。
×
×
×
目标检测
5.将25g氯酸钾和6g二氧化锰的混合物加热一段时间后,得到残余固体的质量为22 g,则产生氧气____g。
9
碳
点燃
二氧化碳
+
氧气
“和”、“与”、“跟”
“反应条件”
“生成”
反应物
生成物
写起来很麻烦,
怎么办
二.化学方程式
这是什么式子 它可以提供
哪些信息 它怎么读呢
C
O2
点燃
CO2
+
C
O
O
C
O
O
12
16×2
32
44
:
:
:
:
12+16×2
12
这种用化学式表示化学反应的式子,叫做化学方程式
C +
O2
点燃
CO2
2.表明反应条件
4.表示各物质的质量关系
1.表明反应物
3.表明生成物
讨论:
化学方程式提供的信息:
32
44
:
:
12
5.表示各物质之间粒子个数比
化学方程式的意义(读法)
(1) 表示反应物,生成物和反应条件(宏观意义)
读物质:表示碳和氧气在点燃条件下反应,生成二氧化碳
(2)表示反应物和生成物之间各物质的质量比(宏观意义)
读质量:表示每12份质量的碳与32份质量的氧气在点燃条件下反应完全反应,生成44份质量的二氧化碳。
(3)表示反应物和生成物的各粒子个数比(微观意义)
(粒子个数比即化学式前面的化学计量数之比)
读微粒:表示每1个碳原子与1个氧分子在点燃条件下反应,生成1个二氧化碳分子。
4P + 5O2 2P2O5
4×31 5×32 2×142
点燃
1.读物质:磷和氧气在点燃条件下反应,生成五氧化二磷。
3.读微粒:每4个磷原子和5个氧分子在点燃的条件下反应,生成2个五氧化二磷分子。
2.读质量:每124份质量的磷与160份质量的氧气在点燃的条件下完全反应, 生成284份质量的五氧化二磷。
你能说!
如 :3H2 + N2 2NH3
高温、高压
催化剂
(1)读物质:氢气和氮气在高温、高压和催化 剂的条件下反应生成氨气;
(3)读微粒:3个氢分子和1个氮分子在高温、
高压和催化剂的条件下反应生成 2个氨分子;
(2)读质量:每6份质量的氢气和28份质量的 氮气在高温、高压和催化剂的条件下反
应后可生成34份质量的氨气;
2×3 28 17×2
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
