探索酸的性质4(第四课时)
图片预览



文档简介
(共10张PPT)
1、 盐酸能使指示剂变色
2、 酸 + 碱 =盐 + 水
3、 酸 + 盐 = 新盐 + 新酸
4、 酸 +金属氧化物= 盐 + 水
5、 酸+金属 = 盐 + 氢气
回顾:酸的有哪些性质 (化学性质)
如:HCl + NaOH =
如:CaCO3+2HCl =
如:Fe2O3+6HCl =
如:Fe+2HCl =
NaCl + H2O
CaCl2+H2O + CO2↑
2FeCl3+3H2O
FeCl2+H2 ↑
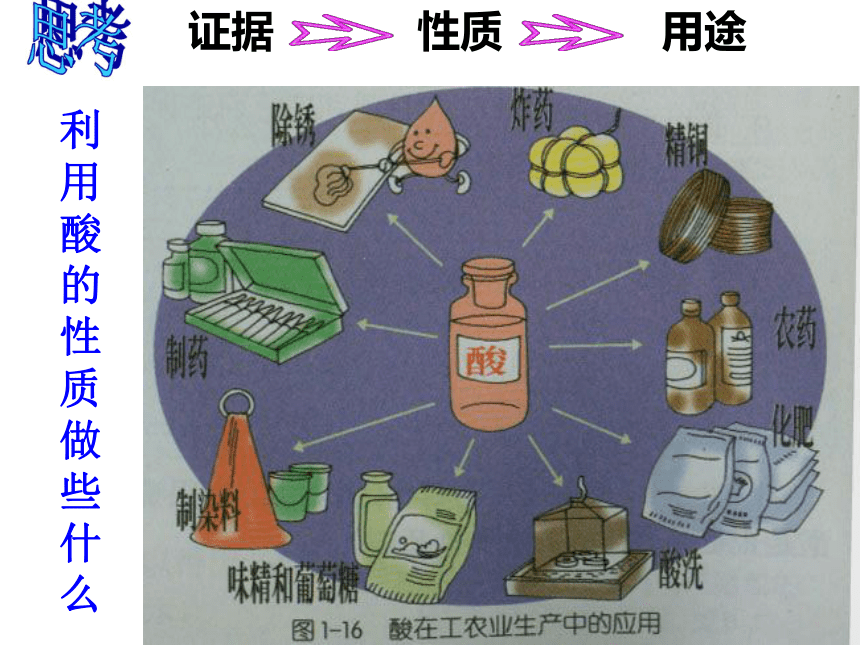
利用酸的性质做些什么
证据
性质
用途
1、除锈:在用稀盐酸除铁锈时,酸不能太多,且放置时间也不能太长,不然稀盐酸会继续跟铁反应。
2、制取氢气:实验室中可用稀盐酸或稀硫酸 来制取氢气。
三种离子(Cl- SO42- CO3 2-)的检验:
SO42—的检验方法:
Cl—的检验方法:
CO32—的检验方法:
滴加硝酸钡溶液,再滴入稀硝酸。
滴加硝酸银溶液,再滴入稀硝酸。
滴加稀盐酸溶液,将产生的气体通入澄清石灰水,变浑浊的气体
1、下列物质久置于空气中,它的pH会增大的是 -----------( )
A、 浓盐酸 B、石灰水
C、浓硫酸 D、浓食盐水
2、稀硝酸中混有小量的盐酸,为了除去盐酸,可以加入适量的----( )
A、Fe B、AgNO3
C、BaCl2 D、KOH
3.铝、镁能与稀盐酸、稀硫酸反应产生氢气,分别写出铝、镁与稀盐酸、稀硫酸反应的化学方程式。
4·下列物质中不能跟稀硫酸反应的是( )
A· 铁 B· 氧化镁 C·二氧化碳 D·碳酸钠。
C
5·下列物质不属于稀盐酸的用途的是( )
A·实验室制取氢气, B·实验室制取二氧化碳
C·工业除锈 D·制食盐(氯化钠)
D
6、写出下列方程式
(1)Fe+H2SO4 == ________
(2)CuO+H2SO4== ________
(3)NaOH+H2SO4== _______
(4)H2SO4+BaCl2== _______
(5)HCl+AgNO3== ________
7、 13克锌与100克稀硫酸恰好反应,求:
(1)产生氢气的质量。
(2)稀硫酸的质量分数。
(3)反应后所得溶液的质量分数。
8、下列物质中,能除去铁制品表面铁锈的是( )
A、稀硫酸 B、水
C、氢氧化钠溶液 D、硫酸铜溶液
1、 盐酸能使指示剂变色
2、 酸 + 碱 =盐 + 水
3、 酸 + 盐 = 新盐 + 新酸
4、 酸 +金属氧化物= 盐 + 水
5、 酸+金属 = 盐 + 氢气
回顾:酸的有哪些性质 (化学性质)
如:HCl + NaOH =
如:CaCO3+2HCl =
如:Fe2O3+6HCl =
如:Fe+2HCl =
NaCl + H2O
CaCl2+H2O + CO2↑
2FeCl3+3H2O
FeCl2+H2 ↑
利用酸的性质做些什么
证据
性质
用途
1、除锈:在用稀盐酸除铁锈时,酸不能太多,且放置时间也不能太长,不然稀盐酸会继续跟铁反应。
2、制取氢气:实验室中可用稀盐酸或稀硫酸 来制取氢气。
三种离子(Cl- SO42- CO3 2-)的检验:
SO42—的检验方法:
Cl—的检验方法:
CO32—的检验方法:
滴加硝酸钡溶液,再滴入稀硝酸。
滴加硝酸银溶液,再滴入稀硝酸。
滴加稀盐酸溶液,将产生的气体通入澄清石灰水,变浑浊的气体
1、下列物质久置于空气中,它的pH会增大的是 -----------( )
A、 浓盐酸 B、石灰水
C、浓硫酸 D、浓食盐水
2、稀硝酸中混有小量的盐酸,为了除去盐酸,可以加入适量的----( )
A、Fe B、AgNO3
C、BaCl2 D、KOH
3.铝、镁能与稀盐酸、稀硫酸反应产生氢气,分别写出铝、镁与稀盐酸、稀硫酸反应的化学方程式。
4·下列物质中不能跟稀硫酸反应的是( )
A· 铁 B· 氧化镁 C·二氧化碳 D·碳酸钠。
C
5·下列物质不属于稀盐酸的用途的是( )
A·实验室制取氢气, B·实验室制取二氧化碳
C·工业除锈 D·制食盐(氯化钠)
D
6、写出下列方程式
(1)Fe+H2SO4 == ________
(2)CuO+H2SO4== ________
(3)NaOH+H2SO4== _______
(4)H2SO4+BaCl2== _______
(5)HCl+AgNO3== ________
7、 13克锌与100克稀硫酸恰好反应,求:
(1)产生氢气的质量。
(2)稀硫酸的质量分数。
(3)反应后所得溶液的质量分数。
8、下列物质中,能除去铁制品表面铁锈的是( )
A、稀硫酸 B、水
C、氢氧化钠溶液 D、硫酸铜溶液
