常见的盐(1)
图片预览











文档简介
(共32张PPT)
第一课时
1.指出下列化学方程式的错误所在:
1). SO2 + 2NaOH = Na2SO4 + H2O
2). CuO + 2KOH = Cu(OH)2↓ +K2O
3). NaOH + FeCl3 = Fe(OH)2↓ + 3NaCl
SO2 + 2NaOH = Na2SO3 + H2O
KOH是碱,只能跟某些非金属氧化物反应,而不能跟金属氧化物反应,所以这个反应不能进行.
3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl
活动一:思考讨论下列问题:
2.用化学方程式表示:
1)检验二氧化碳的存在
2)除去较多的二氧化碳
3)检验某酸溶液是盐酸
CO2 + Ca(OH)2 = CaCO3 ↓ + H2O
CO2 + 2NaOH = Na2CO3 + H2O
HCl + AgNO3 = AgCl ↓+ HNO3
列举酸与碱、酸与盐、碱与盐的反应
思考与讨论:
碳酸钠与氢氧化钙反应及列举的3个反应有
什么特点?你又有哪些新发现?
复分解反应:
两种化合物互相交换成分,生成另外两种化合物的反应。
一般形式:AB + CD→AD + CB
复分解反应的swf
盐是什么
有人说:盐就是我们平时吃的食盐.
你认为对吗?
你还知道哪些盐
江苏淮安盱眙实验中学发生亚硝酸盐中毒事件
2010年9月6日,江苏淮安市盱眙实验中学部分学生在校园内一小吃部吃完晚饭后,很多学生出现腹痛、呕吐等症状,随后这些学生被紧急送往盱眙各医院进行救治,经医院确诊,此次中毒事件的罪魁祸首为亚硝酸盐。有关部门目前已在小吃部的盐罐里查出亚硝酸盐的成分。
亚硝酸盐,一类盐的总称,主要指亚硝酸钠(NaNO2) 。亚硝酸钠是工业用盐,它是一种白色不透明晶体,外形及滋味都很像食盐。亚硝酸钠不仅是致癌物质,而且摄入0.3~0.5 g即可引起食物中毒,3 g可致死。
亚硝酸钠(NaNO2)不可误食
盐是一类物质,它包括的种类很多,食盐只是其中一种,自然界中有各种各样的盐。
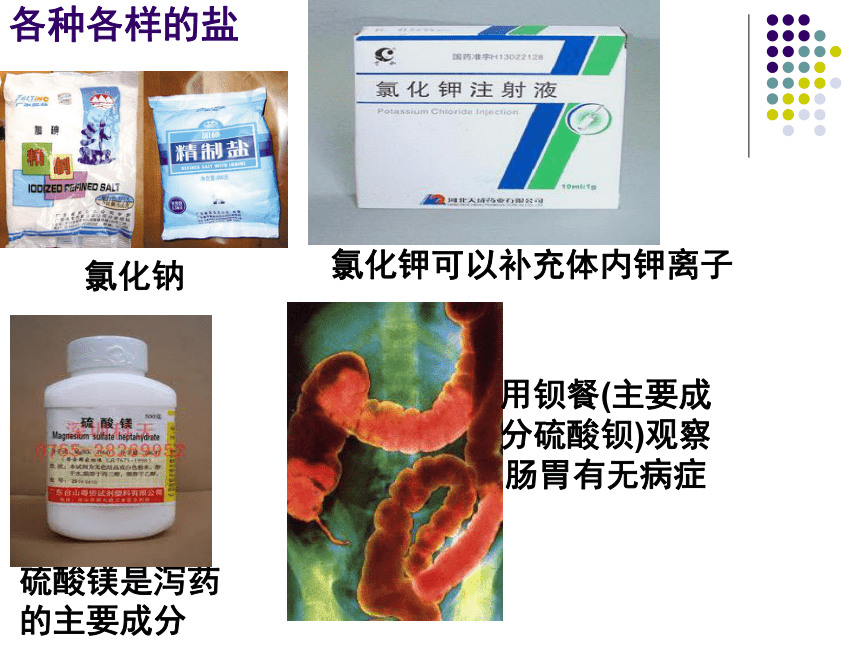
各种各样的盐
用钡餐(主要成分硫酸钡)观察肠胃有无病症
氯化钠
硫酸镁是泻药的主要成分
氯化钾可以补充体内钾离子
硝酸银是制造胶卷的原料之一
石膏(硫酸钙)可以固定骨折的部位
硝酸银是制造胶卷的原料之一
硝酸银是制造胶卷的原料之一
硝酸铵是氮肥
碳酸钾是钾肥
盐是电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物。
一、 什么是盐?
盐是酸和碱中和反应的产物。
知识回顾:
盐酸和氢氧化钠反应生成什么?
HCl + NaOH === NaCl+ H2O
1
2
3
4
盐+酸→另一种盐+另一种酸
盐+碱→另一种盐+另一种碱
盐+盐 →两种新盐
盐+金属→另一种盐+金属
利用下列物质完成你所设计的实验
NaCl溶液 Na2SO4 溶液
CuSO4溶液 AgNO3 溶液 FeCL3 溶液 BaCl2 溶液
HCl溶液 H2SO4溶液 Ca(OH)2溶液 NaOH溶液 Fe Cu
探究一:盐与酸
思考:
(1)盐与酸反应的条件是什么?
(2)实验结论是什么?
盐+酸→另一种盐+另一种酸
这也是一种制酸的方法
此类反应的发生必须符合复分解反应的条件
实验: AgNO3 溶液中加HCl溶液
现象:_____________
化学方程式:____________
1
产生白色沉淀
AgNO3+HCl=AgCl↓+HNO3
探究二:盐与碱
(1)选择哪些盐与碱溶液反应?
(2)反应条件是什么?
(3)实验结论是什么?
思考:
实验: FeCl3溶液中加NaOH溶液, 现象:_____________
化学方程式:____________
2
产生红褐色沉淀
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
可溶性盐+可溶性碱→新盐+新碱
注意:
1、这也是一种制碱的方法
2、这种反应类型中,盐和碱若要反应,必须都可溶,反应后的碱和盐中至少有一种是沉淀
探究三:盐与盐
( 1 )哪些盐之间能发生反应?
( 2 )盐与盐反应的条件是什么?
( 3 ) 实验结论是什么?
思考:
讨论:
往BaCl2溶液中加入另一种无色溶液,生成了白色沉淀,则此无色溶液可能是_____
盐+盐→两种新盐
实验: BaCl2 溶液溶液中加CuSO4 溶液,现象:_____________
化学方程式:____________
3
溶液由蓝色变成绿色,并产生白色沉淀
BaCl2+CuSO4=BaSO4↓+CuCl2
注意:
参加反应的两种盐都必须可溶
反应生成的盐中至少一种难溶或易分解
探究四:金属与盐
思考:
(1)金属跟盐反应的条件是什么?
(2)实验结论是什么?
实验: CuSO4溶液中加入铁钉, 现象:_____________
化学方程式:____________
CuSO4+Fe=FeSO4+Cu
盐+金属→另一种盐+金属
4
铁钉表面逐渐出现红色的固体
注意:
盐和金属的反应,是按金属活动性顺序的规律进行的,在金属活动性顺序里,排在前面的金属才能把排在后面的金属从它们的盐溶液里置换出来
参加反应的盐和反应生成的盐均必须可溶
参加反应的金属若为钾、钙、钠,则反应的规律不是如此,而是如:
2Na + 2H2O + CuSO4 = Na2SO4 + Cu(OH)2 + H2
盐的化学性质:
1。盐+酸 另一种盐+另一种酸
2。盐+碱 另一种盐+另一种碱
3。盐+金属 另一种盐+金属
4。盐+盐 盐+盐
这是一种制酸的方法
(盐和碱均可溶)
(至少有一种是沉淀)
(两种盐均可溶)
(至少有一种是沉淀)
说说本节课你知道了什么?
1、完成下列反应的化学方程式
(1)利用纯碱制烧碱
(2)利用硫酸制盐酸
(3)利用稀盐酸除去水壶中的水垢
(4)硝酸铜溶液中滴入碳酸钾溶液
(5)锌片投入氯化铜溶液中
轻松十分钟:基础训练题
2、下列各组在溶液中能大量共存的是
A、KOH CuSO4 NaCl
B、NaCl Na2CO3 Ba(OH)2
C、Ca(0H)2 KCl H2SO4
D、Na2CO3 KOH NH4Cl
金属与盐反应
3、甲、乙、丙三种金属,乙和丙能溶于盐酸而甲不能,将乙浸入丙的盐溶液中有丙析出,则这三种金属的活动性从弱到强的顺序是)____________
4、 用实验方法验证铁、铜、银的金属活动性顺序,实验用品中除了上述三种金属外,若还需选用一种试剂,这种试剂是( )
A、CuSO4 B、AgNO3
C、稀HCl D、FeSO4
金属要比盐中的金属活泼(但不能用K、Ca、Na),盐是可溶性的盐
5、某工厂排出的废液中主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,他们设计以下步骤,试回答问题 (步骤在下图) 1)写出加入的X、Y物质的化学式 X Y . 2)写出固体A及滤液B、C中主要成分的化学式A B C 。 3)Z处进行的操作是 。
废液
加入过量的X过滤
固体混合物A
加入适量的Y过滤
金属银
滤液C
滤液B
蒸发结晶
硝酸锌固体
固体D
Z
加入适量E
6、在Cu(NO3)2、AgNO3的混合溶液中,加入一定量的锌粉,充分反应后可能有下列情况:1)若反应后锌有剩余,则溶液中所含的溶质是________
2)若将反应后的物质过滤,向所得固体物质中滴加稀盐酸,没有气体产生,则固体物质一定有______,可能有________
3)若将反应后的物质过滤,向滤液中滴加NaCl溶液,有不溶于稀硝酸的白色沉淀生成,则滤液中含有的溶质是_________
第一课时
1.指出下列化学方程式的错误所在:
1). SO2 + 2NaOH = Na2SO4 + H2O
2). CuO + 2KOH = Cu(OH)2↓ +K2O
3). NaOH + FeCl3 = Fe(OH)2↓ + 3NaCl
SO2 + 2NaOH = Na2SO3 + H2O
KOH是碱,只能跟某些非金属氧化物反应,而不能跟金属氧化物反应,所以这个反应不能进行.
3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl
活动一:思考讨论下列问题:
2.用化学方程式表示:
1)检验二氧化碳的存在
2)除去较多的二氧化碳
3)检验某酸溶液是盐酸
CO2 + Ca(OH)2 = CaCO3 ↓ + H2O
CO2 + 2NaOH = Na2CO3 + H2O
HCl + AgNO3 = AgCl ↓+ HNO3
列举酸与碱、酸与盐、碱与盐的反应
思考与讨论:
碳酸钠与氢氧化钙反应及列举的3个反应有
什么特点?你又有哪些新发现?
复分解反应:
两种化合物互相交换成分,生成另外两种化合物的反应。
一般形式:AB + CD→AD + CB
复分解反应的swf
盐是什么
有人说:盐就是我们平时吃的食盐.
你认为对吗?
你还知道哪些盐
江苏淮安盱眙实验中学发生亚硝酸盐中毒事件
2010年9月6日,江苏淮安市盱眙实验中学部分学生在校园内一小吃部吃完晚饭后,很多学生出现腹痛、呕吐等症状,随后这些学生被紧急送往盱眙各医院进行救治,经医院确诊,此次中毒事件的罪魁祸首为亚硝酸盐。有关部门目前已在小吃部的盐罐里查出亚硝酸盐的成分。
亚硝酸盐,一类盐的总称,主要指亚硝酸钠(NaNO2) 。亚硝酸钠是工业用盐,它是一种白色不透明晶体,外形及滋味都很像食盐。亚硝酸钠不仅是致癌物质,而且摄入0.3~0.5 g即可引起食物中毒,3 g可致死。
亚硝酸钠(NaNO2)不可误食
盐是一类物质,它包括的种类很多,食盐只是其中一种,自然界中有各种各样的盐。
各种各样的盐
用钡餐(主要成分硫酸钡)观察肠胃有无病症
氯化钠
硫酸镁是泻药的主要成分
氯化钾可以补充体内钾离子
硝酸银是制造胶卷的原料之一
石膏(硫酸钙)可以固定骨折的部位
硝酸银是制造胶卷的原料之一
硝酸银是制造胶卷的原料之一
硝酸铵是氮肥
碳酸钾是钾肥
盐是电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物。
一、 什么是盐?
盐是酸和碱中和反应的产物。
知识回顾:
盐酸和氢氧化钠反应生成什么?
HCl + NaOH === NaCl+ H2O
1
2
3
4
盐+酸→另一种盐+另一种酸
盐+碱→另一种盐+另一种碱
盐+盐 →两种新盐
盐+金属→另一种盐+金属
利用下列物质完成你所设计的实验
NaCl溶液 Na2SO4 溶液
CuSO4溶液 AgNO3 溶液 FeCL3 溶液 BaCl2 溶液
HCl溶液 H2SO4溶液 Ca(OH)2溶液 NaOH溶液 Fe Cu
探究一:盐与酸
思考:
(1)盐与酸反应的条件是什么?
(2)实验结论是什么?
盐+酸→另一种盐+另一种酸
这也是一种制酸的方法
此类反应的发生必须符合复分解反应的条件
实验: AgNO3 溶液中加HCl溶液
现象:_____________
化学方程式:____________
1
产生白色沉淀
AgNO3+HCl=AgCl↓+HNO3
探究二:盐与碱
(1)选择哪些盐与碱溶液反应?
(2)反应条件是什么?
(3)实验结论是什么?
思考:
实验: FeCl3溶液中加NaOH溶液, 现象:_____________
化学方程式:____________
2
产生红褐色沉淀
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
可溶性盐+可溶性碱→新盐+新碱
注意:
1、这也是一种制碱的方法
2、这种反应类型中,盐和碱若要反应,必须都可溶,反应后的碱和盐中至少有一种是沉淀
探究三:盐与盐
( 1 )哪些盐之间能发生反应?
( 2 )盐与盐反应的条件是什么?
( 3 ) 实验结论是什么?
思考:
讨论:
往BaCl2溶液中加入另一种无色溶液,生成了白色沉淀,则此无色溶液可能是_____
盐+盐→两种新盐
实验: BaCl2 溶液溶液中加CuSO4 溶液,现象:_____________
化学方程式:____________
3
溶液由蓝色变成绿色,并产生白色沉淀
BaCl2+CuSO4=BaSO4↓+CuCl2
注意:
参加反应的两种盐都必须可溶
反应生成的盐中至少一种难溶或易分解
探究四:金属与盐
思考:
(1)金属跟盐反应的条件是什么?
(2)实验结论是什么?
实验: CuSO4溶液中加入铁钉, 现象:_____________
化学方程式:____________
CuSO4+Fe=FeSO4+Cu
盐+金属→另一种盐+金属
4
铁钉表面逐渐出现红色的固体
注意:
盐和金属的反应,是按金属活动性顺序的规律进行的,在金属活动性顺序里,排在前面的金属才能把排在后面的金属从它们的盐溶液里置换出来
参加反应的盐和反应生成的盐均必须可溶
参加反应的金属若为钾、钙、钠,则反应的规律不是如此,而是如:
2Na + 2H2O + CuSO4 = Na2SO4 + Cu(OH)2 + H2
盐的化学性质:
1。盐+酸 另一种盐+另一种酸
2。盐+碱 另一种盐+另一种碱
3。盐+金属 另一种盐+金属
4。盐+盐 盐+盐
这是一种制酸的方法
(盐和碱均可溶)
(至少有一种是沉淀)
(两种盐均可溶)
(至少有一种是沉淀)
说说本节课你知道了什么?
1、完成下列反应的化学方程式
(1)利用纯碱制烧碱
(2)利用硫酸制盐酸
(3)利用稀盐酸除去水壶中的水垢
(4)硝酸铜溶液中滴入碳酸钾溶液
(5)锌片投入氯化铜溶液中
轻松十分钟:基础训练题
2、下列各组在溶液中能大量共存的是
A、KOH CuSO4 NaCl
B、NaCl Na2CO3 Ba(OH)2
C、Ca(0H)2 KCl H2SO4
D、Na2CO3 KOH NH4Cl
金属与盐反应
3、甲、乙、丙三种金属,乙和丙能溶于盐酸而甲不能,将乙浸入丙的盐溶液中有丙析出,则这三种金属的活动性从弱到强的顺序是)____________
4、 用实验方法验证铁、铜、银的金属活动性顺序,实验用品中除了上述三种金属外,若还需选用一种试剂,这种试剂是( )
A、CuSO4 B、AgNO3
C、稀HCl D、FeSO4
金属要比盐中的金属活泼(但不能用K、Ca、Na),盐是可溶性的盐
5、某工厂排出的废液中主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,他们设计以下步骤,试回答问题 (步骤在下图) 1)写出加入的X、Y物质的化学式 X Y . 2)写出固体A及滤液B、C中主要成分的化学式A B C 。 3)Z处进行的操作是 。
废液
加入过量的X过滤
固体混合物A
加入适量的Y过滤
金属银
滤液C
滤液B
蒸发结晶
硝酸锌固体
固体D
Z
加入适量E
6、在Cu(NO3)2、AgNO3的混合溶液中,加入一定量的锌粉,充分反应后可能有下列情况:1)若反应后锌有剩余,则溶液中所含的溶质是________
2)若将反应后的物质过滤,向所得固体物质中滴加稀盐酸,没有气体产生,则固体物质一定有______,可能有________
3)若将反应后的物质过滤,向滤液中滴加NaCl溶液,有不溶于稀硝酸的白色沉淀生成,则滤液中含有的溶质是_________
