【2021-2022学年】化学选修4 新人教版 第一章化学反应与能量章末 课后培优练(含解析)
文档属性
| 名称 | 【2021-2022学年】化学选修4 新人教版 第一章化学反应与能量章末 课后培优练(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-08 14:29:57 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
选修4第一章化学反应与能量章末同步练习
第I卷(选择题)
一、单选题
1.下列关于燃料充分燃烧的说法中,不正确的是( )
A.热能要充分利用 B.固体燃料要粉碎
C.空气的量越多越好 D.液体燃料喷成雾状
2.下列反应属于吸热反应的是( )
A.木炭燃烧 B.CaCO3受热分解 C.Na与水反应 D.盐酸与NaOH溶液反应
3.属于氧化还原反应且反应过程中能量变化符合如图所示的是( )
A. B.
C. D.
4.分析下表中的四个热化学方程式,可判断出氢气和丙烷的标准燃烧热分别是( )
“嫦娥一号”发射火箭的主要燃料 液氢() ① ②
北京奥运会“祥云”火炬的燃料 丙烷() ③ ④
A.、 B.、
C.、 D.、
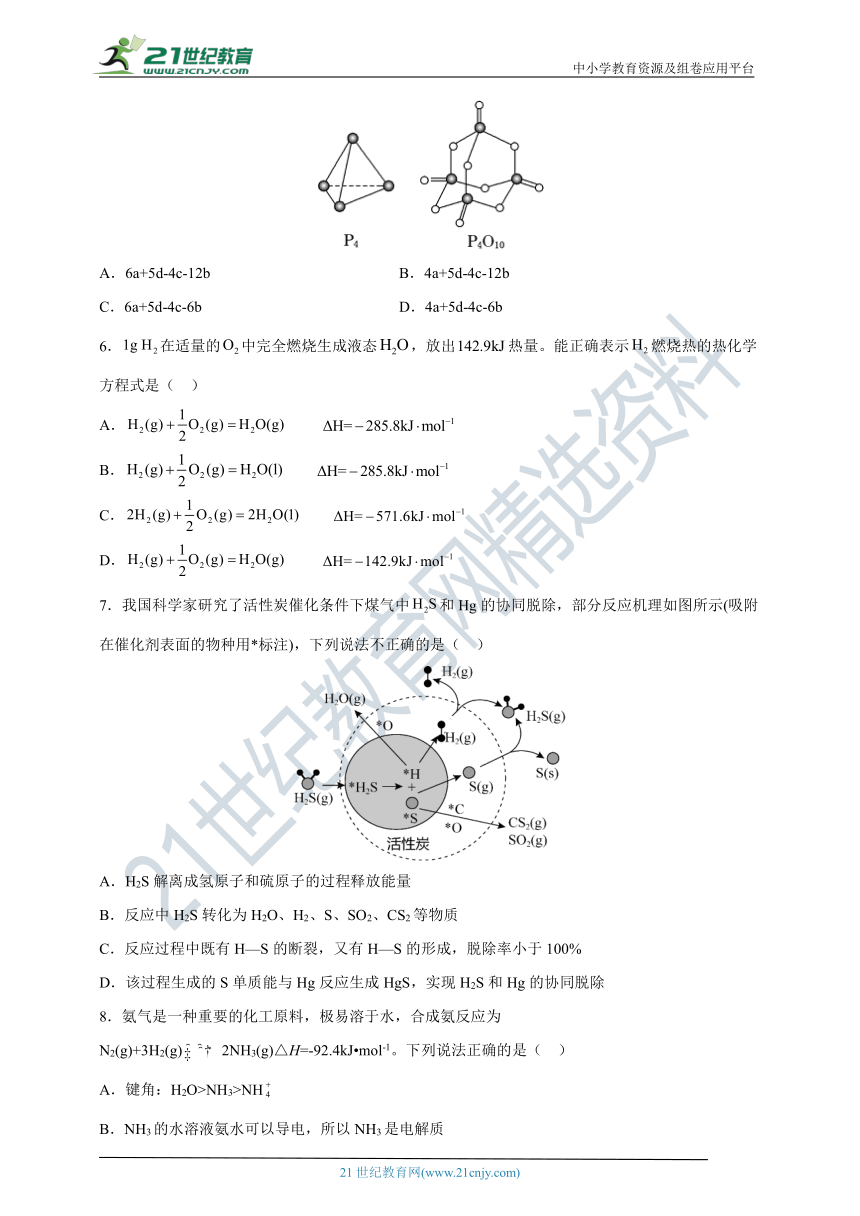
5.白磷与氧可发生如下反应:P4+5O2=P4O10,已知断裂下列化学键需要吸收的能量分别为:P—PakJ·、P—ObkJ·、P=OckJ·、O=OdkJ·根据图示的分子结构和有关数据计算该反应的反应热( )
A.6a+5d-4c-12b B.4a+5d-4c-12b
C.6a+5d-4c-6b D.4a+5d-4c-6b
6.在适量的中完全燃烧生成液态,放出热量。能正确表示燃烧热的热化学方程式是( )
A.
B.
C.
D.
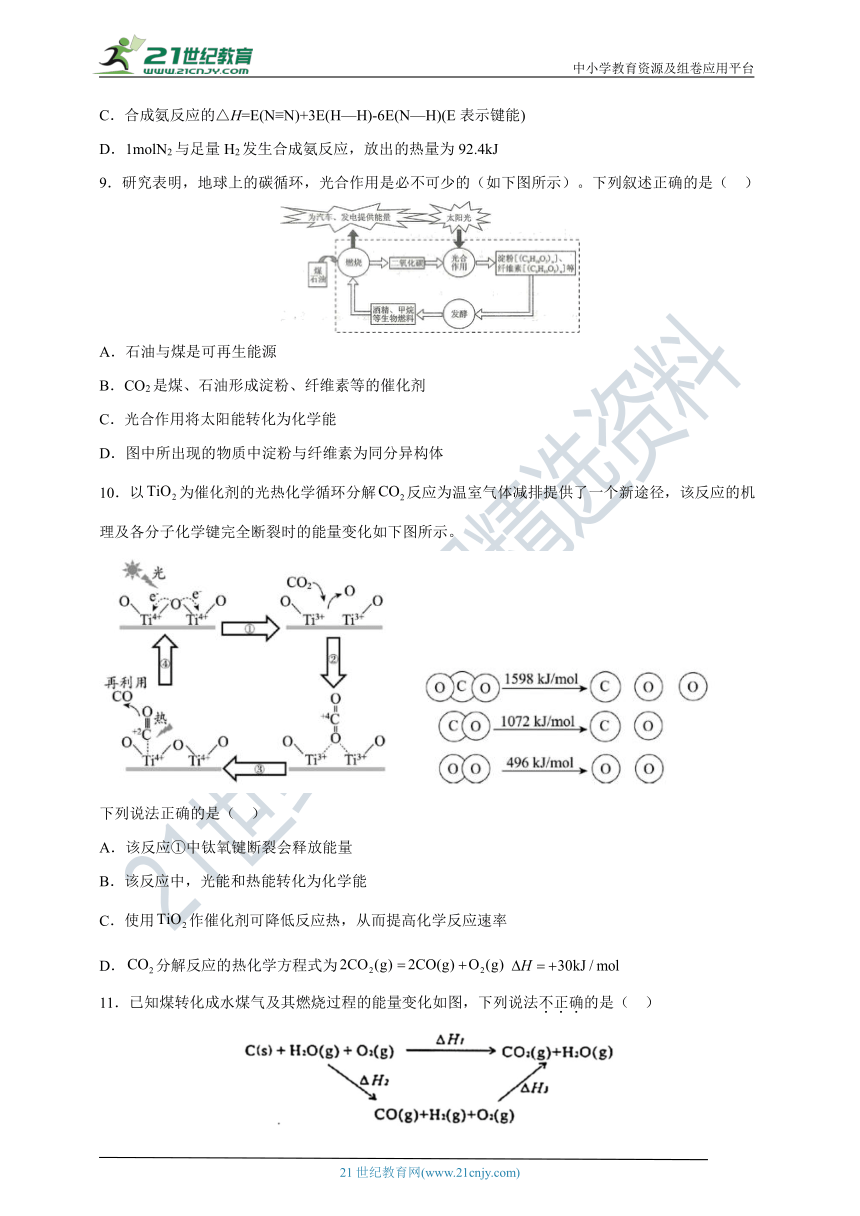
7.我国科学家研究了活性炭催化条件下煤气中和Hg的协同脱除,部分反应机理如图所示(吸附在催化剂表面的物种用*标注),下列说法不正确的是( )
A.H2S解离成氢原子和硫原子的过程释放能量
B.反应中H2S转化为H2O、H2、S、SO2、CS2等物质
C.反应过程中既有H—S的断裂,又有H—S的形成,脱除率小于100%
D.该过程生成的S单质能与Hg反应生成HgS,实现H2S和Hg的协同脱除
8.氨气是一种重要的化工原料,极易溶于水,合成氨反应为N2(g)+3H2(g)2NH3(g)△H=-92.4kJ mol-1。下列说法正确的是( )
A.键角:H2O>NH3>NH
B.NH3的水溶液氨水可以导电,所以NH3是电解质
C.合成氨反应的△H=E(N≡N)+3E(H—H)-6E(N—H)(E表示键能)
D.1molN2与足量H2发生合成氨反应,放出的热量为92.4kJ
9.研究表明,地球上的碳循环,光合作用是必不可少的(如下图所示)。下列叙述正确的是( )
A.石油与煤是可再生能源
B.CO2是煤、石油形成淀粉、纤维素等的催化剂
C.光合作用将太阳能转化为化学能
D.图中所出现的物质中淀粉与纤维素为同分异构体
10.以为催化剂的光热化学循环分解反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
下列说法正确的是( )
A.该反应①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用作催化剂可降低反应热,从而提高化学反应速率
D.分解反应的热化学方程式为
11.已知煤转化成水煤气及其燃烧过程的能量变化如图,下列说法不正确的是( )
A.由△H3可知,该步反应的反应物键能总和小于生成物的键能总和
B.△H1-△H2+△H3=0
C.△H1<△H2
D.若用C(s)和H2O(l)转化为H2(g)和CO(g),则△H2变大
12.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的分子。分子结构与相似,已知断裂吸收热量,生成放出热量。根据以上信息和数据,下列说法正确的是( )
A.属于一种新型的化合物 B.沸点比(白磷)高
C.与是氮元素的同位素 D.气体转变为将放出热量
13.下列说法正确的是( )
A.测定中和热时将氢氧化钠溶液和盐酸混合后,立即读数并记录溶液的起始温度
B.将火柴头直接浸入水中,加入硝酸银溶液和稀硝酸,通过观察是否产生白色沉淀来检验其中是否含有氯元素
C.溴腐浊致伤,先用甘油洗伤口,再用水洗
D.用纸层析法分离和,将滤纸上的试样点完全浸入展开剂可提高分离效果
14.已知 。已知的标准燃烧热,的标准燃烧热,1 mol液态水蒸发为气态水的焓变。则2 mol氢气完全燃烧生成气态水的为( )
A.-658 B.-48 C.-329 D.-285
15.已知:(I)C(s)+O2(g)=CO2(g) H1
(II) H2(g)+O2(g)=H2O (g) H2
(III)CO(g)+O2(g)=CO2(g) H3
(IV)C(s)+H2O(g)=CO(g)+H2(g) H4
下列说法正确的是( )
A. H1<0、 H3>0
B. H4= H2+ H3+ H1
C. H2+ H3< H1
D. H1 、 H2 、 H3分别对应为C、、CO的标准燃烧热
16.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,则该反应的反应热为( )
A.-180 kJ·mol-1 B.+180 kJ·mol-1
C.+812 kJ·mol-1 D.-812 kJ·mol-1
17.近年来,利用电化学催化方法进行转化的研究引起了世界范围内的高度关注。下图是以作为催化剂催化转化为甲酸的反应过程。下列有关说法正确的是( )
A.和中均含有极性共价键和非极性共价键
B.过程②和③分别在形成键和键时吸收能量
C.过程①说明在催化剂的表面形成了一种特殊的化学键
D.若该催化转化过程的催化效率为80%,则生成甲酸时,加入的为
18.已知:①
②
③
则下列说法正确的是( )
A.的燃烧热
B.
C.等质量的和完全燃烧生成和液态水,放出的热量多
D.在足量氧气中完全燃烧生成气态水放出的热量大于571.6kJ
19.我国利用合成气直接制取烯烃获重大突破,其原理是( )
反应①:
反应②:
反应③:
反应④:
能量变化如图所示
反应⑤:
下列说法正确的是( )
A.反应③使用催化剂,减小
B.
C.反应④中正反应的活化能(反应物转化为活化分子所吸收的能量)大于逆反应的活化能
D.
20.资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为:CO2+4H2CH4+2H2O。CO2与氢气反应制CH4的一种催化机理如图所示,下列说法正确的是( )
A.反应中La2O3是中间产物
B.H2在Ni催化作用下产生 H过程的△S>0
C.反应中La2O2CO3释放出CO2
D.使用催化剂可以降低反应的焓变,从而提高化学反应速率
第II卷(非选择题)
二、填空题
21.氢元素单质及其化合物是人类赖以生活的重要能源。回答下列问题
(1)肼(N2H4)是一种液态火箭推进剂。N2H4分解的能量变化如图所示:
①正反应的活化能为__________kJ·mol-1,气态肼分解的热化学方程式为_______________。
②该反应的△S_________(填“>”“<”或“=”)0,该反应自发进行的条件为__________(填“高温”“低温”或“任意温度”)。
(2)盖斯定律认为:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①反应A+B→C(△H<0)分两步进行:
(i)A+B→X(△H>0)
(ii)X→C(△H<0)
下列示意图中,能正确表示总反应过程中能量变化的是__________(填字母)。
②已知:H2O(g)=H2O(l) △H1=-Q1 kJ·mol-1
C2H5OH(g)=C2H5OH(1) △H2=-Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ·mol-1
则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的△H=_________kJ·mol-1,若将23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为__________。
22.请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1_______ΔH2(填“>”“<”或“=”,下同)。
(2)相同条件下,2 mol氢原子所具有的能量_______1 mol 氢分子所具有的能量。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_______ΔH2。
①4P(白磷,s)+5O2(g)=2P2O5(s) ΔH1 ②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(4)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_______57.3 kJ。
(5)已知:1 mol 甲烷与氧气在t ℃、p kPa 时,完全反应生成二氧化碳气体和液态水,放出了a kJ 热量,该反应的热化学方程式是_______。
23.Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______(填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为_______。
(3)C(s)的燃烧热的热化学方程式为__________________________________________
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),计算该反应的ΔH=_______。
24.根据要求,回答下列问题:
(1)有机物 M 经过太阳光光照可转化成有机物 N,转化过程如下:
两者稳定性大小是:N ______M(填“>”“<”或“=”)。
(2)已知:CH3OH(l)的燃烧热△H1=-726.5 k·mol-1; △H2。则△H1______△H2(填“>”“<”或“=”)。
(3)使 Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和 CO2(g)。每消耗1mol Cl2(g)放出 145 kJ 热量,则该反应的热化学方程式为__________________________。
(4)火箭和导弹表面的涂层是耐高温的物质。将铝粉、二氧化钛粉和石墨粉按一定比例混合在高温下煅烧,所得物质可作耐高温材料,反应的热化学方程式为 △H =-1176 kJ·mol-1。则反应过程中,每转移 2 mol 电子,放出的热量为______ kJ。
三、实验题
25.分别取50 mL0.50 mol/L盐酸与50 mL0.55 mol/LNaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应体现中和热的热化学方程式___________________________。
(2)下图装置缺少一种玻璃仪器,该仪器的名称为____________;若用铜棒代替该仪器,会导致ΔH计算结果_______(偏低、偏高或无影响),原因是______________________。
(3)某学生实验记录数据如下:(已知ρ溶液=1 g/cm3,c溶液=4.18 J/(g·℃))依据该学生的实验数据计算,该实验测得的中和热为ΔH=_______。(保留小数点后1位)
实验序号 起始温度t1/℃ 终止温度t2/℃
盐酸 氢氧化钠 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
参考答案
1.C
解析:
A.燃料的燃烧一定为放热反应,故燃料的充分利用是让燃料充分燃烧并充分利用热能,若燃烧放出的热量不能充分利用,则造成燃料的浪费,故A正确;
B.固体燃料燃烧前粉碎,能够增大固体表面积,有利于燃料的充分燃烧,故B正确;
C.燃料燃烧时要通入适量的空气,若空气过多,会导致带走部分热量,所以不是空气量越多越好,故C错误;
D.液体燃料喷成雾状,能增大和助燃剂的接触面积,有利于燃料的充分燃烧,故D正确;
故选C。
2.B
解析:
A.燃烧是发光发热的化学反应,木炭燃烧是放热反应,A错误;
B. 大多数分解反应是吸热反应,CaCO3受热分解是吸热反应,B正确;
C. Na与水反应过程中钠融化为光亮的小球,是放热反应,C错误;
D. 中和反应是放热反应,盐酸与NaOH溶液反应是放热反应,D错误;
答案选B。
3.C
解析:
A.反应为非氧化还原反应,故A不符合题意;
B.反应为放热反应,故B不符合题意;
C.反应为吸热的氧化还原反应,故C符合题意;
D.反应为非氧化还原反应,故D不符合题意;
故选C。
4.D
解析:
标准燃烧热是指在101 kPa条件下,1 mol物质完全燃烧的反应热,1 mol氢气完全燃烧生成液态水的反应热是氢气的标准燃烧热,则氢气的标准燃烧热为-285.8kJ/mol,1 mol丙烷完全燃烧生成气体和液态水的反应热是丙烷的标准燃烧热,则丙烷的标准燃烧热为-2220kJ/mol;
故选D。
5.A
解析:
由题可得1mol P4 中含有6mol P-P键,5mol氧气中含有5mol O=O键,1mol P4O10中含有12mol P-O键和4mol P=O键,反应热=反应物的键能总和-生成物的键能总和,因此该反应的反应热=6a+5d-4c-12b,故答案为A。
6.B
解析:
在适量的中完全燃烧生成液态,放出热量,则2g氢气即1mol在适量的中完全燃烧生成液态,放出285.8kJ热量。表示燃烧热的热化学方程式是必须将氢气物质的量定为1mol,且生成液态水,故B符合题意。
综上所述,答案为B。
7.A
解析:
A.H2S解离成氢原子和硫原子的过程有化学键的断裂,化学键断裂需要吸收能量,故A错误;
B.分析题图中箭头的指向及有关物质可知,反应中H2S转化为H2O、H2、S、SO2、CS2等物质,故B正确;
C.分析题图可知,反应过程中既有H—S的断裂,又有H—S的形成,硫化氢分解生成的氢气和硫会再次化合成硫化氢,所以硫化氢的脱除率小于100%,故C正确;
D.该过程生成的S单质在常温下就能与Hg反应生成HgS,可实现H2S和Hg的协同脱除,故D正确;
故选A。
8.C
解析:
A.H2O、NH3、NH的VSEPR模型为四面体,NH无孤电子对、NH3有1对孤电子对、H2O有2对孤电子对,由于孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力,所以键角∶NH>NH3>H2O,故A错误;
B.氨水导电,一水合氨为电解质,而氨气为非电解质,故B错误;
C.焓变=反应物的键能和-生成物的键能和,所以△H=E(N≡N)+3E(H—H)-6E(N—H),故C正确;
D.N2与H2的反应为可逆反应,加入的1molN2不可能完全反应,所以放出的热量小于92.4kJ,故D错误;
故选C。
9.C
解析:
A. 石油与煤是化石燃料,属于不可再生资源,A项错误;
B. 煤、石油燃烧会生成二氧化碳,生成的二氧化碳参与光合作用形成淀粉与纤维素等,因此二氧化碳不是催化剂,而是该过程的中间产物,B项错误;
C. 光合作用是绿色植物在叶绿体内吸收太阳光把二氧化碳和水合成葡萄糖,同时放出氧气,将太阳能转化为化学能,C项正确;
D. 图中所出现的物质中淀粉与纤维素分子式中的n值不同,因此不属于同分异构体,D项错误;
答案选C。
10.B
解析:
A.断键化学键需要吸收能量,则过程①中钛氧键断裂会吸收能量,故A错误;
B.该图中以TiO2为催化剂、光和热条件下分解CO2反应生成CO和氧气,根据能量守恒定律知,该反应中,光能和热能转化为化学能,故B正确;
C.催化剂降低反应所需活化能,不影响反应热,反应热与反应物和生成物总能量的差有关,故C错误;
D.二氧化碳分解生成CO和氧气,且该反应焓变=反应物总能量-生成物总能量,焓变与其方程式计量数成正比,则热化学方程式为2CO2(g)═2CO(g)+O2(g)△H=(1598×2-1072×2-496)kJ/mol=+556 kJ/mol,故D错误;
故选B。
11.B
解析:
A. 燃烧为放热反应,△H3<0,焓变等于断裂化学键吸收的能量减去成键释放的能量,则由△H3可知,该步反应的反应物键能总和小于生成物的键能总和,故A正确;
B. 由盖斯定律可知,△H1=△H2+△H3,△H1-△H2-△H3=0,故B错误;
C. △H2>0,而△H1<0,则△H1<△H2,故C正确;
D. C与水蒸气的反应为吸热反应,且气态水的能量比液态水的能量高,若用C(s)和H2O(l)转化为H2(g)和CO(g),则△H2变大,故D正确;
故选B。
12.D
解析:
A.由组成,是一种单质,是氮气的同素异形体,而化合物是由不同元素组成的纯净物,故A错误;
B.和都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,沸点越高,所以白磷的沸点高,故B错误;
C.同位素是同种元素不同种原子之间的互称,故C错误;
D.气体中含有键,可生成,形成键,则气体转变为化学键断裂断裂吸收的热量为:,形成化学键放出的热量为,所以反应放热,放出的热量为:,故应为放出热量,故D正确;
故选:D。
13.C
解析:
A. 测定中和热时,分别测量盐酸和氢氧化钠溶液的起始温度并记录、迅速将氢氧化钠溶液和盐酸混合后、立即盖上杯盖、搅拌均匀,读取反应的最高温度并记录,A错误;
B. 将燃尽的火柴头浸入水中,加入硝酸银溶液和稀硝酸,通过观察是否产生白色沉淀来检验其中是否含有氯元素,B错误;
C.由安全守则知,溴腐浊致伤,先用甘油洗伤口,目的是溶解溴,然后再用水洗,C正确;
D. 用纸层析法分离和,若将滤纸上的试样点完全浸入展开剂,则和溶解而无法分离,滤纸上的试样点不能浸入展开剂中,D错误;
答案选C。
14.B
解析:
由题意可得如下反应:①,②,③ ,④ ,由盖斯定律可知,①-②+③+④得反应,则,2 mol氢气完全燃烧生成气态水的热化学方程式为,故选B。
15.C
解析:
A.反应Ⅰ和反应Ⅲ都是燃烧反应,都是放热反应, H1<0、 H3<0,选项A错误;
B.反应Ⅰ-反应Ⅱ-反应Ⅲ=反应Ⅳ,方程式相加减,焓变也是对应相加减, H4= H1- H2- H3,选项B错误;
C.反应Ⅳ=反应Ⅰ-反应Ⅱ-反应Ⅲ,反应Ⅳ为吸热反应, H2+ H3< H1,选项C正确;
D.标准燃烧热是指在101kPa时,1mol物质完全燃烧的反应热,H2的产物为气体,应该是生成液态水,选项D错误;
答案选C。
16.B
解析:
焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2═2NO,△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,反应是吸热反应。
答案选B。
17.C
解析:
A.分子中含有极性共价键,分子中含有键、键、键、键,均为极性共价键,选项A错误;
B.断裂化学键吸收能量,形成化学键释放能量,过程②中结合形成了键释放能量,过程③中与结合形成键释放能量,选项B错误;
C.根据图示可知,在催化转化为的过程①中,在之间形成了一种特殊的化学键,选项C正确;
D.在中C元素为价,在中C元素为价,生成甲酸时,加入的物质的量为,选项D错误。
答案选C。
18.C
解析:
A.燃烧热指101kPa时,1mol纯物质完全燃烧生成指定产物所放出的热量,由可知的燃烧热,A错误;
B.反应中有硫酸钡沉淀生成,为放热反应,则,B错误;
C.令和的质量都为1g,则完全燃烧放出的热量为,完全燃烧放出的热量为,所以等质量的和完全燃烧生成和液态水,放出的热量多,C正确;
D.液态水转化为气态水,需要吸收热量,则,完全燃烧生成气态水放出的热量小于571.6kJ,D错误;
故选C。
19.B
解析:
A.催化剂不改变反应的焓变,反应③使用催化剂,不变,故A错误;
B.根据盖斯定律,得,氢气燃烧放出热量,则,故B正确;
C.由题图可知,反应④中正反应的活化能小于逆反应的活化能,故C错误;
D.根据盖斯定律可知,可以得到 ,故D错误;
答案选B。
20.B
解析:
A.根据CO2加氢制CH4的催化机理图示,催化过程使用的催化剂为La2O3,La2O2CO3为中间产物,故A错误;
B.H2经过Ni活性中心裂解产生活化态 H的过程中,分子混乱度增大,△S>0, 故B正确;
C.根据图示,La2O2CO3可以释放出·CO, 故C错误;
D.催化剂不能降低反应的焓变,可降低反应的活化能,从而提高化学反应速率,故D错误;
故选B。
21.a+50.7 N2H4(g)=N2(g)+2H2(g) H=+50.7kJ·mol-1 > 高温 D Q2-Q3-3Q1 kJ
解析:
(1)①正反应活化能即反应物能量与反应过程中最高能量的差值,为a+50.7 kJ·mol-1;据图可知生成物能量之和-反应物能量之和=50.7 kJ·mol-1,即该反应 H=+50.7kJ·mol-1,所以气态肼分解的热化学方程式为N2H4(g)=N2(g)+2H2(g) H=+50.7kJ·mol-1;
②该反应气体系数之和增大,所以 S>0;该反应 H>0,所以在高温条件下可以满足 H-T S<0,反应可以自发进行;
(2)①根据总反应焓变小于0可知A+B的能量之和大于C的能量,根据反应(i)可知A+B的能量之和小于X,根据反应(ii)可知X的能量高于C,则符合条件的图像为D;
②将已知反应依次标号为a、b、c,根据盖斯定律b-c-3a可得C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的 H=Q2-Q3-3Q1kJ·mol-1;根据酒精燃烧的热化学方程式可知1mol液态无水酒精完全燃烧并恢复到室温放出Q3-Q2+3Q1kJ热量,23g酒精的物质的量为=0.5mol,所以完全燃烧,并恢复到室温放出的热量为kJ。
22.= > < >
解析:
(1)反应热只与反应物和生成物的相对能量大小有关,而与反应条件无关,因此同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH相同,故答案为:=;
(2)2mol氢原子结合形成1mol氢分子时形成化学键,而形成化学键的过程释放能量,可知2 mol氢原子所具有的能量大于1 mol 氢分子所具有的能量,故答案为:>;
(3)常温时红磷比白磷稳定,可知相同条件下,白磷的能量高于红磷,则白磷和红磷燃烧得到相同产物时,白磷放出的热量更多,而放热越多反应热越小,故答案为:<;
(4)浓硫酸与稀氢氧化钠溶液反应生成1 mol水,除了氢离子与氢氧根反应放热外,还伴随着浓硫酸溶解放出的热量,因此放热量大于57.3 kJ,故答案为:>;
(5)1 mol 甲烷与氧气在t ℃、p kPa 时,完全反应生成二氧化碳气体和液态水,可得该反应的热化学方程式为:,故答案为:;
23.①、④ 1425kJ C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol -246.1kJ·mol-1
解析:
Ⅰ. (1)<0表示放热反应,故上述反应中属于放热反应的是①、④,故答案为:①、④;
(2)根据反应①可知,燃烧10gH2生成液态水,放出的热量为1425kJ,故答案为:1425 kJ;
(3)燃烧热是指1mol燃料完全燃烧生成稳定的氧化物时的热效应,有反应④可推知,C(s)的燃烧热的热化学方程式为C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol ,故答案为:C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol;
Ⅱ.(4)根据该斯定律可知,反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)可由2①+②+③,故该反应的ΔH=2ΔH1+ΔH2+ΔH3=2×(-90.7kJ·mol-1)+(-23.5kJ·mol-1)+(-41.2kJ·mol-1)=-246.1kJ·mol-1,故答案为:-246.1kJ·mol-1。
24.< > △H=-290 kJ·mol-1 196
解析:
(1)有机物 M 经过太阳光光照可转化成有机物 N,△H>0,吸收能量,能量越低越稳定,故两者稳定性大小是:N(2)燃烧热为完全燃烧生成稳定化合物,中水为气态,气态水转为液态水需要放出热量,故△H1>△H2;故答案为:>;
(3)使 Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和 CO2(g)。每消耗1mol Cl2(g)放出 145 kJ 热量,则该反应的热化学方程式为: △H=-290 kJ·mol-1;故答案为: △H=-290 kJ·mol-1;
(4) △H =-1176 kJ·mol-1,由反应方程式可知,反应过程中,每转移12mol电子,放出1176kJ的热量,所以每转移 2 mol 电子,放出的热量为:×2=196kJ,故答案为:196。
25.
(1)NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
(2) 环形玻璃搅拌棒 偏高 铜导热快,导致热量散失快
(3)ΔH=-52.1 kJ/mol
解析:
(1)硫酸与NaOH反应方程式为:H2SO4+2NaOH=Na2SO4+2H2O,由于稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,则表示稀硫酸与稀NaOH溶液反应体现中和热的热化学方程式为:NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol。
(2)要测定中和热,需要仪器有量热计、温度计、环形玻璃搅拌棒、隔热板,根据装置图可知缺少仪器是环形玻璃搅拌棒。
由于Cu具有良好的导热性,会导致热量散失较快,所以若用铜棒代替该仪器,会导致反应放出热量因损失而减小,反应放出热量越小,反应热就越大,故最终使ΔH计算结果偏高。
(3)三次实验温度差分别是3.15℃、3.1℃、3.15℃,三次实验数据相差不大,均有效,实验所得的平均温度差是△t=。n(HCl)=cV=0.50 mol/L ×0.05 L=0.025 mol,n(NaOH)=cV=0.55 mol/L ×0.05 L=0.0275 mol>0.025 mol,由于HCl+NaOH=NaCl+H2O二者反应的物质的量的比是1:1,所以反应产生水的物质的量要以不足量的HCl为标准计算。n(H2O)=n(HCl)=0.025 mol,反应产生0.025 mol水放出热量Q=cm△t=4.18 J/(g·℃)×100 g×3.117℃=1302.906 J=1.302 kJ,则中和热△H=-kJ/mol。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
选修4第一章化学反应与能量章末同步练习
第I卷(选择题)
一、单选题
1.下列关于燃料充分燃烧的说法中,不正确的是( )
A.热能要充分利用 B.固体燃料要粉碎
C.空气的量越多越好 D.液体燃料喷成雾状
2.下列反应属于吸热反应的是( )
A.木炭燃烧 B.CaCO3受热分解 C.Na与水反应 D.盐酸与NaOH溶液反应
3.属于氧化还原反应且反应过程中能量变化符合如图所示的是( )
A. B.
C. D.
4.分析下表中的四个热化学方程式,可判断出氢气和丙烷的标准燃烧热分别是( )
“嫦娥一号”发射火箭的主要燃料 液氢() ① ②
北京奥运会“祥云”火炬的燃料 丙烷() ③ ④
A.、 B.、
C.、 D.、
5.白磷与氧可发生如下反应:P4+5O2=P4O10,已知断裂下列化学键需要吸收的能量分别为:P—PakJ·、P—ObkJ·、P=OckJ·、O=OdkJ·根据图示的分子结构和有关数据计算该反应的反应热( )
A.6a+5d-4c-12b B.4a+5d-4c-12b
C.6a+5d-4c-6b D.4a+5d-4c-6b
6.在适量的中完全燃烧生成液态,放出热量。能正确表示燃烧热的热化学方程式是( )
A.
B.
C.
D.
7.我国科学家研究了活性炭催化条件下煤气中和Hg的协同脱除,部分反应机理如图所示(吸附在催化剂表面的物种用*标注),下列说法不正确的是( )
A.H2S解离成氢原子和硫原子的过程释放能量
B.反应中H2S转化为H2O、H2、S、SO2、CS2等物质
C.反应过程中既有H—S的断裂,又有H—S的形成,脱除率小于100%
D.该过程生成的S单质能与Hg反应生成HgS,实现H2S和Hg的协同脱除
8.氨气是一种重要的化工原料,极易溶于水,合成氨反应为N2(g)+3H2(g)2NH3(g)△H=-92.4kJ mol-1。下列说法正确的是( )
A.键角:H2O>NH3>NH
B.NH3的水溶液氨水可以导电,所以NH3是电解质
C.合成氨反应的△H=E(N≡N)+3E(H—H)-6E(N—H)(E表示键能)
D.1molN2与足量H2发生合成氨反应,放出的热量为92.4kJ
9.研究表明,地球上的碳循环,光合作用是必不可少的(如下图所示)。下列叙述正确的是( )
A.石油与煤是可再生能源
B.CO2是煤、石油形成淀粉、纤维素等的催化剂
C.光合作用将太阳能转化为化学能
D.图中所出现的物质中淀粉与纤维素为同分异构体
10.以为催化剂的光热化学循环分解反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
下列说法正确的是( )
A.该反应①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用作催化剂可降低反应热,从而提高化学反应速率
D.分解反应的热化学方程式为
11.已知煤转化成水煤气及其燃烧过程的能量变化如图,下列说法不正确的是( )
A.由△H3可知,该步反应的反应物键能总和小于生成物的键能总和
B.△H1-△H2+△H3=0
C.△H1<△H2
D.若用C(s)和H2O(l)转化为H2(g)和CO(g),则△H2变大
12.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的分子。分子结构与相似,已知断裂吸收热量,生成放出热量。根据以上信息和数据,下列说法正确的是( )
A.属于一种新型的化合物 B.沸点比(白磷)高
C.与是氮元素的同位素 D.气体转变为将放出热量
13.下列说法正确的是( )
A.测定中和热时将氢氧化钠溶液和盐酸混合后,立即读数并记录溶液的起始温度
B.将火柴头直接浸入水中,加入硝酸银溶液和稀硝酸,通过观察是否产生白色沉淀来检验其中是否含有氯元素
C.溴腐浊致伤,先用甘油洗伤口,再用水洗
D.用纸层析法分离和,将滤纸上的试样点完全浸入展开剂可提高分离效果
14.已知 。已知的标准燃烧热,的标准燃烧热,1 mol液态水蒸发为气态水的焓变。则2 mol氢气完全燃烧生成气态水的为( )
A.-658 B.-48 C.-329 D.-285
15.已知:(I)C(s)+O2(g)=CO2(g) H1
(II) H2(g)+O2(g)=H2O (g) H2
(III)CO(g)+O2(g)=CO2(g) H3
(IV)C(s)+H2O(g)=CO(g)+H2(g) H4
下列说法正确的是( )
A. H1<0、 H3>0
B. H4= H2+ H3+ H1
C. H2+ H3< H1
D. H1 、 H2 、 H3分别对应为C、、CO的标准燃烧热
16.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,则该反应的反应热为( )
A.-180 kJ·mol-1 B.+180 kJ·mol-1
C.+812 kJ·mol-1 D.-812 kJ·mol-1
17.近年来,利用电化学催化方法进行转化的研究引起了世界范围内的高度关注。下图是以作为催化剂催化转化为甲酸的反应过程。下列有关说法正确的是( )
A.和中均含有极性共价键和非极性共价键
B.过程②和③分别在形成键和键时吸收能量
C.过程①说明在催化剂的表面形成了一种特殊的化学键
D.若该催化转化过程的催化效率为80%,则生成甲酸时,加入的为
18.已知:①
②
③
则下列说法正确的是( )
A.的燃烧热
B.
C.等质量的和完全燃烧生成和液态水,放出的热量多
D.在足量氧气中完全燃烧生成气态水放出的热量大于571.6kJ
19.我国利用合成气直接制取烯烃获重大突破,其原理是( )
反应①:
反应②:
反应③:
反应④:
能量变化如图所示
反应⑤:
下列说法正确的是( )
A.反应③使用催化剂,减小
B.
C.反应④中正反应的活化能(反应物转化为活化分子所吸收的能量)大于逆反应的活化能
D.
20.资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为:CO2+4H2CH4+2H2O。CO2与氢气反应制CH4的一种催化机理如图所示,下列说法正确的是( )
A.反应中La2O3是中间产物
B.H2在Ni催化作用下产生 H过程的△S>0
C.反应中La2O2CO3释放出CO2
D.使用催化剂可以降低反应的焓变,从而提高化学反应速率
第II卷(非选择题)
二、填空题
21.氢元素单质及其化合物是人类赖以生活的重要能源。回答下列问题
(1)肼(N2H4)是一种液态火箭推进剂。N2H4分解的能量变化如图所示:
①正反应的活化能为__________kJ·mol-1,气态肼分解的热化学方程式为_______________。
②该反应的△S_________(填“>”“<”或“=”)0,该反应自发进行的条件为__________(填“高温”“低温”或“任意温度”)。
(2)盖斯定律认为:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①反应A+B→C(△H<0)分两步进行:
(i)A+B→X(△H>0)
(ii)X→C(△H<0)
下列示意图中,能正确表示总反应过程中能量变化的是__________(填字母)。
②已知:H2O(g)=H2O(l) △H1=-Q1 kJ·mol-1
C2H5OH(g)=C2H5OH(1) △H2=-Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ·mol-1
则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的△H=_________kJ·mol-1,若将23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为__________。
22.请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1_______ΔH2(填“>”“<”或“=”,下同)。
(2)相同条件下,2 mol氢原子所具有的能量_______1 mol 氢分子所具有的能量。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_______ΔH2。
①4P(白磷,s)+5O2(g)=2P2O5(s) ΔH1 ②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(4)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_______57.3 kJ。
(5)已知:1 mol 甲烷与氧气在t ℃、p kPa 时,完全反应生成二氧化碳气体和液态水,放出了a kJ 热量,该反应的热化学方程式是_______。
23.Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______(填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为_______。
(3)C(s)的燃烧热的热化学方程式为__________________________________________
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),计算该反应的ΔH=_______。
24.根据要求,回答下列问题:
(1)有机物 M 经过太阳光光照可转化成有机物 N,转化过程如下:
两者稳定性大小是:N ______M(填“>”“<”或“=”)。
(2)已知:CH3OH(l)的燃烧热△H1=-726.5 k·mol-1; △H2。则△H1______△H2(填“>”“<”或“=”)。
(3)使 Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和 CO2(g)。每消耗1mol Cl2(g)放出 145 kJ 热量,则该反应的热化学方程式为__________________________。
(4)火箭和导弹表面的涂层是耐高温的物质。将铝粉、二氧化钛粉和石墨粉按一定比例混合在高温下煅烧,所得物质可作耐高温材料,反应的热化学方程式为 △H =-1176 kJ·mol-1。则反应过程中,每转移 2 mol 电子,放出的热量为______ kJ。
三、实验题
25.分别取50 mL0.50 mol/L盐酸与50 mL0.55 mol/LNaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应体现中和热的热化学方程式___________________________。
(2)下图装置缺少一种玻璃仪器,该仪器的名称为____________;若用铜棒代替该仪器,会导致ΔH计算结果_______(偏低、偏高或无影响),原因是______________________。
(3)某学生实验记录数据如下:(已知ρ溶液=1 g/cm3,c溶液=4.18 J/(g·℃))依据该学生的实验数据计算,该实验测得的中和热为ΔH=_______。(保留小数点后1位)
实验序号 起始温度t1/℃ 终止温度t2/℃
盐酸 氢氧化钠 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
参考答案
1.C
解析:
A.燃料的燃烧一定为放热反应,故燃料的充分利用是让燃料充分燃烧并充分利用热能,若燃烧放出的热量不能充分利用,则造成燃料的浪费,故A正确;
B.固体燃料燃烧前粉碎,能够增大固体表面积,有利于燃料的充分燃烧,故B正确;
C.燃料燃烧时要通入适量的空气,若空气过多,会导致带走部分热量,所以不是空气量越多越好,故C错误;
D.液体燃料喷成雾状,能增大和助燃剂的接触面积,有利于燃料的充分燃烧,故D正确;
故选C。
2.B
解析:
A.燃烧是发光发热的化学反应,木炭燃烧是放热反应,A错误;
B. 大多数分解反应是吸热反应,CaCO3受热分解是吸热反应,B正确;
C. Na与水反应过程中钠融化为光亮的小球,是放热反应,C错误;
D. 中和反应是放热反应,盐酸与NaOH溶液反应是放热反应,D错误;
答案选B。
3.C
解析:
A.反应为非氧化还原反应,故A不符合题意;
B.反应为放热反应,故B不符合题意;
C.反应为吸热的氧化还原反应,故C符合题意;
D.反应为非氧化还原反应,故D不符合题意;
故选C。
4.D
解析:
标准燃烧热是指在101 kPa条件下,1 mol物质完全燃烧的反应热,1 mol氢气完全燃烧生成液态水的反应热是氢气的标准燃烧热,则氢气的标准燃烧热为-285.8kJ/mol,1 mol丙烷完全燃烧生成气体和液态水的反应热是丙烷的标准燃烧热,则丙烷的标准燃烧热为-2220kJ/mol;
故选D。
5.A
解析:
由题可得1mol P4 中含有6mol P-P键,5mol氧气中含有5mol O=O键,1mol P4O10中含有12mol P-O键和4mol P=O键,反应热=反应物的键能总和-生成物的键能总和,因此该反应的反应热=6a+5d-4c-12b,故答案为A。
6.B
解析:
在适量的中完全燃烧生成液态,放出热量,则2g氢气即1mol在适量的中完全燃烧生成液态,放出285.8kJ热量。表示燃烧热的热化学方程式是必须将氢气物质的量定为1mol,且生成液态水,故B符合题意。
综上所述,答案为B。
7.A
解析:
A.H2S解离成氢原子和硫原子的过程有化学键的断裂,化学键断裂需要吸收能量,故A错误;
B.分析题图中箭头的指向及有关物质可知,反应中H2S转化为H2O、H2、S、SO2、CS2等物质,故B正确;
C.分析题图可知,反应过程中既有H—S的断裂,又有H—S的形成,硫化氢分解生成的氢气和硫会再次化合成硫化氢,所以硫化氢的脱除率小于100%,故C正确;
D.该过程生成的S单质在常温下就能与Hg反应生成HgS,可实现H2S和Hg的协同脱除,故D正确;
故选A。
8.C
解析:
A.H2O、NH3、NH的VSEPR模型为四面体,NH无孤电子对、NH3有1对孤电子对、H2O有2对孤电子对,由于孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力,所以键角∶NH>NH3>H2O,故A错误;
B.氨水导电,一水合氨为电解质,而氨气为非电解质,故B错误;
C.焓变=反应物的键能和-生成物的键能和,所以△H=E(N≡N)+3E(H—H)-6E(N—H),故C正确;
D.N2与H2的反应为可逆反应,加入的1molN2不可能完全反应,所以放出的热量小于92.4kJ,故D错误;
故选C。
9.C
解析:
A. 石油与煤是化石燃料,属于不可再生资源,A项错误;
B. 煤、石油燃烧会生成二氧化碳,生成的二氧化碳参与光合作用形成淀粉与纤维素等,因此二氧化碳不是催化剂,而是该过程的中间产物,B项错误;
C. 光合作用是绿色植物在叶绿体内吸收太阳光把二氧化碳和水合成葡萄糖,同时放出氧气,将太阳能转化为化学能,C项正确;
D. 图中所出现的物质中淀粉与纤维素分子式中的n值不同,因此不属于同分异构体,D项错误;
答案选C。
10.B
解析:
A.断键化学键需要吸收能量,则过程①中钛氧键断裂会吸收能量,故A错误;
B.该图中以TiO2为催化剂、光和热条件下分解CO2反应生成CO和氧气,根据能量守恒定律知,该反应中,光能和热能转化为化学能,故B正确;
C.催化剂降低反应所需活化能,不影响反应热,反应热与反应物和生成物总能量的差有关,故C错误;
D.二氧化碳分解生成CO和氧气,且该反应焓变=反应物总能量-生成物总能量,焓变与其方程式计量数成正比,则热化学方程式为2CO2(g)═2CO(g)+O2(g)△H=(1598×2-1072×2-496)kJ/mol=+556 kJ/mol,故D错误;
故选B。
11.B
解析:
A. 燃烧为放热反应,△H3<0,焓变等于断裂化学键吸收的能量减去成键释放的能量,则由△H3可知,该步反应的反应物键能总和小于生成物的键能总和,故A正确;
B. 由盖斯定律可知,△H1=△H2+△H3,△H1-△H2-△H3=0,故B错误;
C. △H2>0,而△H1<0,则△H1<△H2,故C正确;
D. C与水蒸气的反应为吸热反应,且气态水的能量比液态水的能量高,若用C(s)和H2O(l)转化为H2(g)和CO(g),则△H2变大,故D正确;
故选B。
12.D
解析:
A.由组成,是一种单质,是氮气的同素异形体,而化合物是由不同元素组成的纯净物,故A错误;
B.和都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,沸点越高,所以白磷的沸点高,故B错误;
C.同位素是同种元素不同种原子之间的互称,故C错误;
D.气体中含有键,可生成,形成键,则气体转变为化学键断裂断裂吸收的热量为:,形成化学键放出的热量为,所以反应放热,放出的热量为:,故应为放出热量,故D正确;
故选:D。
13.C
解析:
A. 测定中和热时,分别测量盐酸和氢氧化钠溶液的起始温度并记录、迅速将氢氧化钠溶液和盐酸混合后、立即盖上杯盖、搅拌均匀,读取反应的最高温度并记录,A错误;
B. 将燃尽的火柴头浸入水中,加入硝酸银溶液和稀硝酸,通过观察是否产生白色沉淀来检验其中是否含有氯元素,B错误;
C.由安全守则知,溴腐浊致伤,先用甘油洗伤口,目的是溶解溴,然后再用水洗,C正确;
D. 用纸层析法分离和,若将滤纸上的试样点完全浸入展开剂,则和溶解而无法分离,滤纸上的试样点不能浸入展开剂中,D错误;
答案选C。
14.B
解析:
由题意可得如下反应:①,②,③ ,④ ,由盖斯定律可知,①-②+③+④得反应,则,2 mol氢气完全燃烧生成气态水的热化学方程式为,故选B。
15.C
解析:
A.反应Ⅰ和反应Ⅲ都是燃烧反应,都是放热反应, H1<0、 H3<0,选项A错误;
B.反应Ⅰ-反应Ⅱ-反应Ⅲ=反应Ⅳ,方程式相加减,焓变也是对应相加减, H4= H1- H2- H3,选项B错误;
C.反应Ⅳ=反应Ⅰ-反应Ⅱ-反应Ⅲ,反应Ⅳ为吸热反应, H2+ H3< H1,选项C正确;
D.标准燃烧热是指在101kPa时,1mol物质完全燃烧的反应热,H2的产物为气体,应该是生成液态水,选项D错误;
答案选C。
16.B
解析:
焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2═2NO,△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,反应是吸热反应。
答案选B。
17.C
解析:
A.分子中含有极性共价键,分子中含有键、键、键、键,均为极性共价键,选项A错误;
B.断裂化学键吸收能量,形成化学键释放能量,过程②中结合形成了键释放能量,过程③中与结合形成键释放能量,选项B错误;
C.根据图示可知,在催化转化为的过程①中,在之间形成了一种特殊的化学键,选项C正确;
D.在中C元素为价,在中C元素为价,生成甲酸时,加入的物质的量为,选项D错误。
答案选C。
18.C
解析:
A.燃烧热指101kPa时,1mol纯物质完全燃烧生成指定产物所放出的热量,由可知的燃烧热,A错误;
B.反应中有硫酸钡沉淀生成,为放热反应,则,B错误;
C.令和的质量都为1g,则完全燃烧放出的热量为,完全燃烧放出的热量为,所以等质量的和完全燃烧生成和液态水,放出的热量多,C正确;
D.液态水转化为气态水,需要吸收热量,则,完全燃烧生成气态水放出的热量小于571.6kJ,D错误;
故选C。
19.B
解析:
A.催化剂不改变反应的焓变,反应③使用催化剂,不变,故A错误;
B.根据盖斯定律,得,氢气燃烧放出热量,则,故B正确;
C.由题图可知,反应④中正反应的活化能小于逆反应的活化能,故C错误;
D.根据盖斯定律可知,可以得到 ,故D错误;
答案选B。
20.B
解析:
A.根据CO2加氢制CH4的催化机理图示,催化过程使用的催化剂为La2O3,La2O2CO3为中间产物,故A错误;
B.H2经过Ni活性中心裂解产生活化态 H的过程中,分子混乱度增大,△S>0, 故B正确;
C.根据图示,La2O2CO3可以释放出·CO, 故C错误;
D.催化剂不能降低反应的焓变,可降低反应的活化能,从而提高化学反应速率,故D错误;
故选B。
21.a+50.7 N2H4(g)=N2(g)+2H2(g) H=+50.7kJ·mol-1 > 高温 D Q2-Q3-3Q1 kJ
解析:
(1)①正反应活化能即反应物能量与反应过程中最高能量的差值,为a+50.7 kJ·mol-1;据图可知生成物能量之和-反应物能量之和=50.7 kJ·mol-1,即该反应 H=+50.7kJ·mol-1,所以气态肼分解的热化学方程式为N2H4(g)=N2(g)+2H2(g) H=+50.7kJ·mol-1;
②该反应气体系数之和增大,所以 S>0;该反应 H>0,所以在高温条件下可以满足 H-T S<0,反应可以自发进行;
(2)①根据总反应焓变小于0可知A+B的能量之和大于C的能量,根据反应(i)可知A+B的能量之和小于X,根据反应(ii)可知X的能量高于C,则符合条件的图像为D;
②将已知反应依次标号为a、b、c,根据盖斯定律b-c-3a可得C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的 H=Q2-Q3-3Q1kJ·mol-1;根据酒精燃烧的热化学方程式可知1mol液态无水酒精完全燃烧并恢复到室温放出Q3-Q2+3Q1kJ热量,23g酒精的物质的量为=0.5mol,所以完全燃烧,并恢复到室温放出的热量为kJ。
22.= > < >
解析:
(1)反应热只与反应物和生成物的相对能量大小有关,而与反应条件无关,因此同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH相同,故答案为:=;
(2)2mol氢原子结合形成1mol氢分子时形成化学键,而形成化学键的过程释放能量,可知2 mol氢原子所具有的能量大于1 mol 氢分子所具有的能量,故答案为:>;
(3)常温时红磷比白磷稳定,可知相同条件下,白磷的能量高于红磷,则白磷和红磷燃烧得到相同产物时,白磷放出的热量更多,而放热越多反应热越小,故答案为:<;
(4)浓硫酸与稀氢氧化钠溶液反应生成1 mol水,除了氢离子与氢氧根反应放热外,还伴随着浓硫酸溶解放出的热量,因此放热量大于57.3 kJ,故答案为:>;
(5)1 mol 甲烷与氧气在t ℃、p kPa 时,完全反应生成二氧化碳气体和液态水,可得该反应的热化学方程式为:,故答案为:;
23.①、④ 1425kJ C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol -246.1kJ·mol-1
解析:
Ⅰ. (1)<0表示放热反应,故上述反应中属于放热反应的是①、④,故答案为:①、④;
(2)根据反应①可知,燃烧10gH2生成液态水,放出的热量为1425kJ,故答案为:1425 kJ;
(3)燃烧热是指1mol燃料完全燃烧生成稳定的氧化物时的热效应,有反应④可推知,C(s)的燃烧热的热化学方程式为C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol ,故答案为:C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol;
Ⅱ.(4)根据该斯定律可知,反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)可由2①+②+③,故该反应的ΔH=2ΔH1+ΔH2+ΔH3=2×(-90.7kJ·mol-1)+(-23.5kJ·mol-1)+(-41.2kJ·mol-1)=-246.1kJ·mol-1,故答案为:-246.1kJ·mol-1。
24.< > △H=-290 kJ·mol-1 196
解析:
(1)有机物 M 经过太阳光光照可转化成有机物 N,△H>0,吸收能量,能量越低越稳定,故两者稳定性大小是:N
(3)使 Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和 CO2(g)。每消耗1mol Cl2(g)放出 145 kJ 热量,则该反应的热化学方程式为: △H=-290 kJ·mol-1;故答案为: △H=-290 kJ·mol-1;
(4) △H =-1176 kJ·mol-1,由反应方程式可知,反应过程中,每转移12mol电子,放出1176kJ的热量,所以每转移 2 mol 电子,放出的热量为:×2=196kJ,故答案为:196。
25.
(1)NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
(2) 环形玻璃搅拌棒 偏高 铜导热快,导致热量散失快
(3)ΔH=-52.1 kJ/mol
解析:
(1)硫酸与NaOH反应方程式为:H2SO4+2NaOH=Na2SO4+2H2O,由于稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,则表示稀硫酸与稀NaOH溶液反应体现中和热的热化学方程式为:NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol。
(2)要测定中和热,需要仪器有量热计、温度计、环形玻璃搅拌棒、隔热板,根据装置图可知缺少仪器是环形玻璃搅拌棒。
由于Cu具有良好的导热性,会导致热量散失较快,所以若用铜棒代替该仪器,会导致反应放出热量因损失而减小,反应放出热量越小,反应热就越大,故最终使ΔH计算结果偏高。
(3)三次实验温度差分别是3.15℃、3.1℃、3.15℃,三次实验数据相差不大,均有效,实验所得的平均温度差是△t=。n(HCl)=cV=0.50 mol/L ×0.05 L=0.025 mol,n(NaOH)=cV=0.55 mol/L ×0.05 L=0.0275 mol>0.025 mol,由于HCl+NaOH=NaCl+H2O二者反应的物质的量的比是1:1,所以反应产生水的物质的量要以不足量的HCl为标准计算。n(H2O)=n(HCl)=0.025 mol,反应产生0.025 mol水放出热量Q=cm△t=4.18 J/(g·℃)×100 g×3.117℃=1302.906 J=1.302 kJ,则中和热△H=-kJ/mol。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
