鲁教版(五四制)化学九年级全一册 第二单元 常见的酸和碱 复习 课件 (共25张PPT)
文档属性
| 名称 | 鲁教版(五四制)化学九年级全一册 第二单元 常见的酸和碱 复习 课件 (共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 572.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-06 16:27:43 | ||
图片预览








文档简介
(共25张PPT)
第二单元 常见的酸和碱
复习课件
项目 (1)浓盐酸 (2)浓硫酸
性质 浓盐酸是________色、有_________气味的液体,在空气中形成白雾,这是由于挥发出来的氯化氢气体跟空气中的水蒸气接触,形成盐酸小液滴的缘故 浓硫酸是_______色黏稠状的
_________体,敞口放置时易吸收
空气中的水蒸气而变稀,具有
_______性,可作干燥剂。浓硫酸
具有强烈的_______性,能使木
材、纸张变黑
用途 ①除锈;②胃酸,助消化; ③制药等 ①除锈;②作干燥剂;③精炼石
油;④制化肥、农药、火药等
考点一:浓酸的性质和用途
1.浓硫酸和浓盐酸的主要性质与用途
无
刺激性
无
液
吸水
脱水
2.浓硫酸的稀释与使用安全
(1)浓硫酸的稀释。
浓硫酸溶于水时放出大量的热,故在稀释浓
硫酸时,一定要把浓硫酸沿着器壁慢慢注入水中,
并用玻璃棒不断搅拌,切不可将水倒进________中。
(2)浓硫酸的安全使用。
在使用浓硫酸时,如果不慎沾到皮肤或衣服上,应先立即
用干布擦掉,再用大量__________冲洗,然后涂上3%~5%的
__________________溶液。
浓硫酸
水
NaHCO3(或小苏打)
温馨提示
1.稀释浓硫酸的要诀:酸入水,沿器壁,并搅拌。
2.浓硫酸用作干燥剂就是利用浓硫酸的吸水性,一般认为浓硫酸的吸水性是物理性质。浓硫酸能把有机物中的氢、氧原子以2∶1的个数比(即H2O的形式)脱去,此性质为浓硫酸的脱水性,属于化学性质。
考点二:稀硫酸和稀盐酸的化学性质
1.与指示剂反应
红
不能
盐
(1)酸能使紫色石蕊溶液变________色。
(2)酸________使无色酚酞溶液变色。
2.酸与活泼金属反应
酸+活泼金属→________+________,属于________反应。
3.酸与金属氧化物反应
酸+金属氧化物→________+_________,属于________
反应。
盐
H2O
复分解
置换
H2
4.酸与碱反应
盐
H2O
复分解
中和
酸+碱→________+________,属于________反应,又叫
做________反应。
5.酸与盐反应
酸
盐
复分解
酸+盐→________+________,属于________反应。
温馨提示
酸的通性:①与指示剂反应使石蕊变红;②与金属反应生
成盐和氢气;③与金属氧化物反应生成盐和水;④与碱中和生
成盐和水;⑤与盐反应生成新酸和新盐。
考点三:常见的碱
1.酸碱的定义
氢
氢氧根
(1)酸:由________离子和酸根离子构成的化合物(在水溶液中能电离出唯一的阳离子H+的化合物),命名为“某酸”。
(2)碱:由金属离子和________构成的化合物(在水溶液中能电离出唯一的阴离子OH-的化合物),命名为“氢氧化某”。
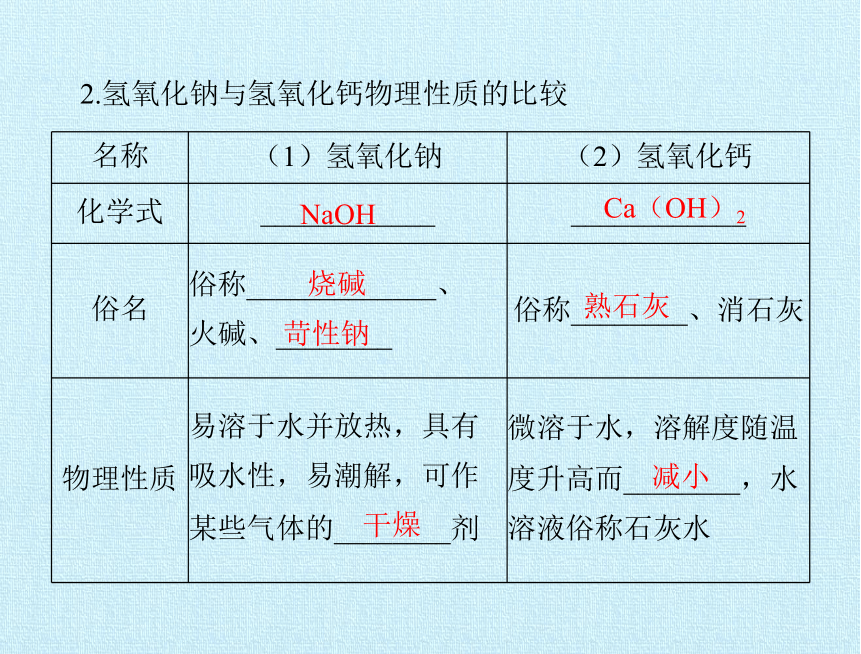
名称 (1)氢氧化钠 (2)氢氧化钙
化学式 ____________ ____________
俗名 俗称_____________、 火碱、________ 俗称________、消石灰
物理性质 易溶于水并放热,具有 吸水性,易潮解,可作 某些气体的________剂 微溶于水,溶解度随温
度升高而________,水
溶液俗称石灰水
2.氢氧化钠与氢氧化钙物理性质的比较
熟石灰
减小
NaOH
烧碱
苛性钠
干燥
Ca(OH)2
考点四:碱的化学性质
1.碱与指示剂反应
蓝
红
盐
水
碱能使紫色石蕊溶液变________,又能使无色酚酞溶液变
________。
盐
水
复分解
中和
2.碱与非金属氧化物反应
碱+非金属氧化物→________+________。
3.碱与酸反应
酸+碱→________+________,属于________反应,又叫
做________反应。
4.碱与盐反应
碱+盐→________+________,属于________反应。
温馨提示
碱的通性:①与指示剂反应使石蕊变蓝、酚酞变红;②与
非金属氧化物反应生成盐和水;③与酸中和生成盐和水;④与
盐反应生成新碱新盐。
碱
盐
复分解
指示剂 酸性溶液 碱性溶液 中性溶液
(1)紫色石蕊溶液 ______色 ______色 ______色
(2)无色酚酞溶液 ______色 ______色 ______色
红
蓝
考点五:酸碱性与酸碱度
1.溶液酸碱性的定性表示
无
红
无
溶液的酸性、碱性、中性——用酸碱指示剂测定。
紫
项目 pH
作用 可比较溶液酸碱性的强弱
范围 从_____到______
变化规律 pH越小,表示溶液的________越强;pH越大,
表示溶液的________越强
溶液的酸碱性 的判断 pH<7,表示溶液呈________
pH>7,表示溶液呈________
pH=7,表示溶液呈________
测定方法 在玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与______________对照,读出pH
2.溶液酸碱性的定量表示——酸碱度
pH 常用__________________测定。
pH试纸(或pH计)
0
14
酸性
碱性
酸性
碱性
中性
标准比色卡
考点六:酸碱中和反应
1.定义
________和_______反 应 生 成 _______和 _______的反
应,叫做中和反应。
酸
碱
盐
水
2.应用
熟石灰
熟石灰
(1)改良土壤酸碱性。例如:土壤酸化可用________改良。
(2)处理工厂废水。例如:硫酸厂的废水可加入________中
和处理后排放。
(3)用于医药。例如:蚊子叮咬后(含蚁酸)可涂________等
碱性物质;可用________中和过多的胃酸(盐酸),其反应方程
式为:__________________________________。
肥皂水
Al(OH)3
Al(OH)3+3HCl===AlCl3+3H2O
1.(2014年北京)氢氧化钙可用于改良酸性土壤,其俗称是
(
)。
A.小苏打
B.熟石灰
C.生石灰
D.纯碱
2.鸡蛋壳的主要成分是碳酸钙,将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可以观察到鸡蛋冒气泡,该气泡的
主要成分是(
)。
B
B
A.H2
B.CO2
C.O2
D.N2
3.下列数据是一些物质的pH,其中呈碱性的是(
)。
A.液体肥皂
C.酱油
B.西瓜汁
D.柠檬汁
A
加入稀盐酸的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 12.9 12.7 12.5 12.3 11.9 7.0 2.1 1.9
4.向盛有10mLNaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
(1)当加入稀盐酸的体积为______mL时,NaOH溶液和稀
盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3mL时,溶液显______色;当
加入稀盐酸的体积为14mL时,溶液显______色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有_______。
答案:(1)10 (2)红、无 (3)NaCl和HCl
题型一:常见酸的主要性质和用途
【例1】物质X可发生下列所示的两个反应,
则X可能是(
)。
①X+碱→盐+水 ②X+金属氧化物→盐+水。
A.HCl
B.CO
C.NaOH
D.CaO
解析:解答本题可采用代入验证法,结合酸的化学性质(能与活泼金属、金属氧化物、碱、碳酸盐等反应)、碱的化学性质(能与非金属氧化物、酸、盐等反应),进行分析判断。
答案:A
题型二:常见碱的主要性质和用途
【例2】“烧碱同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过,如下图。
(1)请你在图中用“连续线”画出烧碱应走的路线。
(2)烧碱在刚进迷宫时,碰到了两种阻止他前进的物质,请
写出化学反应的方程式:______________,________________。
解析:(1)因为氢氧化钠不能和铁、氯化钠、碳、硝酸钾等
物质反应,因此烧碱应走的路线如图中所示。
(2)烧碱在刚进迷宫时,碰到了两种阻止他前进的物质是二
氧化碳和氯化铜。
答案:(1)
(2)2NaOH+CO2===Na2CO3+H2O
CuCl2+2NaOH===Cu(OH)2↓+2NaCl
题型三:中和反应及其应用
【例3】(2014年广州)向含有酚酞的NaOH溶液中滴加盐酸,
溶液红色褪去变为无色,此时溶液pH可能是(
)。
A.5
C.12
B.9
D.13
解析:酚酞在酸性和中性条件下都为无色,向含有酚酞NaOH溶液中滴加盐酸,溶液红色褪去变为无色,此时溶液可能是酸性也可能是中性,pH≤7。
答案:A
题型四:酸和碱的综合运用
【例4】(2013年广东)粗盐中含泥沙、氯化钙、氯化镁等杂质。
如下图甲某同学自制的简易净水器中放置的物质顺序错误,使
净水效果不理想。
甲
(1)请把图甲中的物质按由上到下的顺序重新排列:______
(填字母)。
(2)调整后净化的盐水仍含可溶性杂质,他设计了下面的除
杂流程:
乙
步骤①②都需要进行________操作,步骤④需要进行
________操作。
(3)已知试剂X是碱溶液,则沉淀I为________(写化学式),
A.氢氧化钠溶液
C.氢氧化钾溶液
B.氢氧化钡溶液
D.氢氧化钙溶液
(4)步骤②除去氯化钙的反应方程式:_________________
___________________;步骤③中发生中和反应的化学方程式:
________________________________________。
答案:(1)BADC (2)过滤、蒸发 (3)Mg(OH)2、C
(4)CaCl2+Na2CO3===CaCO3↓+2NaCl
NaOH+HCl===NaCl+H2O
谢 谢
第二单元 常见的酸和碱
复习课件
项目 (1)浓盐酸 (2)浓硫酸
性质 浓盐酸是________色、有_________气味的液体,在空气中形成白雾,这是由于挥发出来的氯化氢气体跟空气中的水蒸气接触,形成盐酸小液滴的缘故 浓硫酸是_______色黏稠状的
_________体,敞口放置时易吸收
空气中的水蒸气而变稀,具有
_______性,可作干燥剂。浓硫酸
具有强烈的_______性,能使木
材、纸张变黑
用途 ①除锈;②胃酸,助消化; ③制药等 ①除锈;②作干燥剂;③精炼石
油;④制化肥、农药、火药等
考点一:浓酸的性质和用途
1.浓硫酸和浓盐酸的主要性质与用途
无
刺激性
无
液
吸水
脱水
2.浓硫酸的稀释与使用安全
(1)浓硫酸的稀释。
浓硫酸溶于水时放出大量的热,故在稀释浓
硫酸时,一定要把浓硫酸沿着器壁慢慢注入水中,
并用玻璃棒不断搅拌,切不可将水倒进________中。
(2)浓硫酸的安全使用。
在使用浓硫酸时,如果不慎沾到皮肤或衣服上,应先立即
用干布擦掉,再用大量__________冲洗,然后涂上3%~5%的
__________________溶液。
浓硫酸
水
NaHCO3(或小苏打)
温馨提示
1.稀释浓硫酸的要诀:酸入水,沿器壁,并搅拌。
2.浓硫酸用作干燥剂就是利用浓硫酸的吸水性,一般认为浓硫酸的吸水性是物理性质。浓硫酸能把有机物中的氢、氧原子以2∶1的个数比(即H2O的形式)脱去,此性质为浓硫酸的脱水性,属于化学性质。
考点二:稀硫酸和稀盐酸的化学性质
1.与指示剂反应
红
不能
盐
(1)酸能使紫色石蕊溶液变________色。
(2)酸________使无色酚酞溶液变色。
2.酸与活泼金属反应
酸+活泼金属→________+________,属于________反应。
3.酸与金属氧化物反应
酸+金属氧化物→________+_________,属于________
反应。
盐
H2O
复分解
置换
H2
4.酸与碱反应
盐
H2O
复分解
中和
酸+碱→________+________,属于________反应,又叫
做________反应。
5.酸与盐反应
酸
盐
复分解
酸+盐→________+________,属于________反应。
温馨提示
酸的通性:①与指示剂反应使石蕊变红;②与金属反应生
成盐和氢气;③与金属氧化物反应生成盐和水;④与碱中和生
成盐和水;⑤与盐反应生成新酸和新盐。
考点三:常见的碱
1.酸碱的定义
氢
氢氧根
(1)酸:由________离子和酸根离子构成的化合物(在水溶液中能电离出唯一的阳离子H+的化合物),命名为“某酸”。
(2)碱:由金属离子和________构成的化合物(在水溶液中能电离出唯一的阴离子OH-的化合物),命名为“氢氧化某”。
名称 (1)氢氧化钠 (2)氢氧化钙
化学式 ____________ ____________
俗名 俗称_____________、 火碱、________ 俗称________、消石灰
物理性质 易溶于水并放热,具有 吸水性,易潮解,可作 某些气体的________剂 微溶于水,溶解度随温
度升高而________,水
溶液俗称石灰水
2.氢氧化钠与氢氧化钙物理性质的比较
熟石灰
减小
NaOH
烧碱
苛性钠
干燥
Ca(OH)2
考点四:碱的化学性质
1.碱与指示剂反应
蓝
红
盐
水
碱能使紫色石蕊溶液变________,又能使无色酚酞溶液变
________。
盐
水
复分解
中和
2.碱与非金属氧化物反应
碱+非金属氧化物→________+________。
3.碱与酸反应
酸+碱→________+________,属于________反应,又叫
做________反应。
4.碱与盐反应
碱+盐→________+________,属于________反应。
温馨提示
碱的通性:①与指示剂反应使石蕊变蓝、酚酞变红;②与
非金属氧化物反应生成盐和水;③与酸中和生成盐和水;④与
盐反应生成新碱新盐。
碱
盐
复分解
指示剂 酸性溶液 碱性溶液 中性溶液
(1)紫色石蕊溶液 ______色 ______色 ______色
(2)无色酚酞溶液 ______色 ______色 ______色
红
蓝
考点五:酸碱性与酸碱度
1.溶液酸碱性的定性表示
无
红
无
溶液的酸性、碱性、中性——用酸碱指示剂测定。
紫
项目 pH
作用 可比较溶液酸碱性的强弱
范围 从_____到______
变化规律 pH越小,表示溶液的________越强;pH越大,
表示溶液的________越强
溶液的酸碱性 的判断 pH<7,表示溶液呈________
pH>7,表示溶液呈________
pH=7,表示溶液呈________
测定方法 在玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与______________对照,读出pH
2.溶液酸碱性的定量表示——酸碱度
pH 常用__________________测定。
pH试纸(或pH计)
0
14
酸性
碱性
酸性
碱性
中性
标准比色卡
考点六:酸碱中和反应
1.定义
________和_______反 应 生 成 _______和 _______的反
应,叫做中和反应。
酸
碱
盐
水
2.应用
熟石灰
熟石灰
(1)改良土壤酸碱性。例如:土壤酸化可用________改良。
(2)处理工厂废水。例如:硫酸厂的废水可加入________中
和处理后排放。
(3)用于医药。例如:蚊子叮咬后(含蚁酸)可涂________等
碱性物质;可用________中和过多的胃酸(盐酸),其反应方程
式为:__________________________________。
肥皂水
Al(OH)3
Al(OH)3+3HCl===AlCl3+3H2O
1.(2014年北京)氢氧化钙可用于改良酸性土壤,其俗称是
(
)。
A.小苏打
B.熟石灰
C.生石灰
D.纯碱
2.鸡蛋壳的主要成分是碳酸钙,将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可以观察到鸡蛋冒气泡,该气泡的
主要成分是(
)。
B
B
A.H2
B.CO2
C.O2
D.N2
3.下列数据是一些物质的pH,其中呈碱性的是(
)。
A.液体肥皂
C.酱油
B.西瓜汁
D.柠檬汁
A
加入稀盐酸的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 12.9 12.7 12.5 12.3 11.9 7.0 2.1 1.9
4.向盛有10mLNaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
(1)当加入稀盐酸的体积为______mL时,NaOH溶液和稀
盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3mL时,溶液显______色;当
加入稀盐酸的体积为14mL时,溶液显______色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有_______。
答案:(1)10 (2)红、无 (3)NaCl和HCl
题型一:常见酸的主要性质和用途
【例1】物质X可发生下列所示的两个反应,
则X可能是(
)。
①X+碱→盐+水 ②X+金属氧化物→盐+水。
A.HCl
B.CO
C.NaOH
D.CaO
解析:解答本题可采用代入验证法,结合酸的化学性质(能与活泼金属、金属氧化物、碱、碳酸盐等反应)、碱的化学性质(能与非金属氧化物、酸、盐等反应),进行分析判断。
答案:A
题型二:常见碱的主要性质和用途
【例2】“烧碱同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过,如下图。
(1)请你在图中用“连续线”画出烧碱应走的路线。
(2)烧碱在刚进迷宫时,碰到了两种阻止他前进的物质,请
写出化学反应的方程式:______________,________________。
解析:(1)因为氢氧化钠不能和铁、氯化钠、碳、硝酸钾等
物质反应,因此烧碱应走的路线如图中所示。
(2)烧碱在刚进迷宫时,碰到了两种阻止他前进的物质是二
氧化碳和氯化铜。
答案:(1)
(2)2NaOH+CO2===Na2CO3+H2O
CuCl2+2NaOH===Cu(OH)2↓+2NaCl
题型三:中和反应及其应用
【例3】(2014年广州)向含有酚酞的NaOH溶液中滴加盐酸,
溶液红色褪去变为无色,此时溶液pH可能是(
)。
A.5
C.12
B.9
D.13
解析:酚酞在酸性和中性条件下都为无色,向含有酚酞NaOH溶液中滴加盐酸,溶液红色褪去变为无色,此时溶液可能是酸性也可能是中性,pH≤7。
答案:A
题型四:酸和碱的综合运用
【例4】(2013年广东)粗盐中含泥沙、氯化钙、氯化镁等杂质。
如下图甲某同学自制的简易净水器中放置的物质顺序错误,使
净水效果不理想。
甲
(1)请把图甲中的物质按由上到下的顺序重新排列:______
(填字母)。
(2)调整后净化的盐水仍含可溶性杂质,他设计了下面的除
杂流程:
乙
步骤①②都需要进行________操作,步骤④需要进行
________操作。
(3)已知试剂X是碱溶液,则沉淀I为________(写化学式),
A.氢氧化钠溶液
C.氢氧化钾溶液
B.氢氧化钡溶液
D.氢氧化钙溶液
(4)步骤②除去氯化钙的反应方程式:_________________
___________________;步骤③中发生中和反应的化学方程式:
________________________________________。
答案:(1)BADC (2)过滤、蒸发 (3)Mg(OH)2、C
(4)CaCl2+Na2CO3===CaCO3↓+2NaCl
NaOH+HCl===NaCl+H2O
谢 谢
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
