11-12版高中化学全程学习方略配套课件:1认识化学科学(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:1认识化学科学(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-14 08:08:43 | ||
图片预览




文档简介
(共29张PPT)
钠及其化合物的性质
【例1】某化工厂的库房中六、七个装有金属钠的桶突然发生爆炸,库房被炸塌,据了解,当地当天晚上有较大降雨。下面是某校高一的几位同学对此事的推测,其中正确的是
甲同学:钠能与水反应,且熔点低,爆炸可能与大雨有关。
乙同学:钠燃烧,生成过氧化钠,过氧化钠又与雨水反应生成氧气,会加快反应。
丙同学:大雨可以扑灭火,下雨不利于钠燃烧。
丁同学:钠燃烧的火焰为黄色,生成氧化钠,放出大量的热。
A.甲、乙、丙 B.甲、丁
C.甲、乙 D.甲、乙、丙、丁
【解析】选C。本题主要考查了钠与水反应以及钠与氧气反应这两个化学性质,同时考查了过氧化钠与水反应这一钠的化合物的一个性质。根据这些性质可知,甲、乙两位同学的说法是正确的;下雨后钠可以与水反应放出大量的热,可以加速钠的燃烧,丙同学的说法错误;钠燃烧的产物为过氧化钠而非氧化钠,所以丁同学的说法错误。根据以上分析答案选C。
【名师点拨】1.钠与水反应的实验现象及所体现的钠的性质:
2.过氧化钠的性质
(1)强氧化性
①Na2O2投入FeCl2溶液中,可将Fe2+氧化为Fe3+,同时生成Fe(OH)3沉淀。
②将Na2O2投入酚酞溶液中,溶液先由无色变为红色,之后又变为无色,同时有无色气泡产生。
(2)与CO2和H2O的反应
2Na2O2+2H2O====4NaOH+O2↑
2Na2O2+2CO2====2Na2CO3+O2
氯气及其化合物的性质
【例2】(双选)下列物质中存在Cl-的是
A.氯酸钾溶液 B.液氯
C.氯水 D.漂白粉溶液
【解析】选C、D。氯酸钾溶液中存在ClO3-,无Cl-;液氯中
只存在Cl2,无Cl-;氯水中存在反应Cl2+H2O====HCl+
HClO,因而有Cl-;漂白粉的主要成分是CaCl2、Ca(ClO)2,
因而漂白粉溶液中存在Cl-。
【名师点拨】液氯、氯水等物质的组成一直是考查的重点,应注意辨析掌握。液氯的成分为氯气分子,是氯气的液态
形式;氯水是氯气的水溶液,由于氯气与水反应,氯水中
含有三种分子(H2O、Cl2、HClO)和四种离子(ClO-、Cl-、H+、OH-);ClO3-、ClO-与ClO4-等中的氯元素并不能体现Cl-
的性质。
以阿伏加德罗常数为核心的相关计算
【例3】(2010·福建高考)NA表示阿伏加德罗常数,下列判断正确的是
A.在18 g18O2中含有NA个氧原子
B.标准状况下,22.4L空气含有NA个单质分子
C.1 mol Cl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L
【解析】选A。选项A:18 g18O2 物质的量为0.5 mol,所以它所含氧原子的物质的量为1 mol,即为NA,A正确;选项B:空气是多种成分的混合物,不只是单质,B错误;选项C:在氯气与水的反应中,1 mol氯气参加反应只转移NA电子,所以C项错误;选项D:由含有NA个Na+可知氢氧化钠的物质的量为1 mol,但溶液体积不是1L,所以溶液的物质的量浓度不是1 mol/L,D错误。
【名师点拨】解答与阿伏加德罗常数有关的计算时应注意的问题
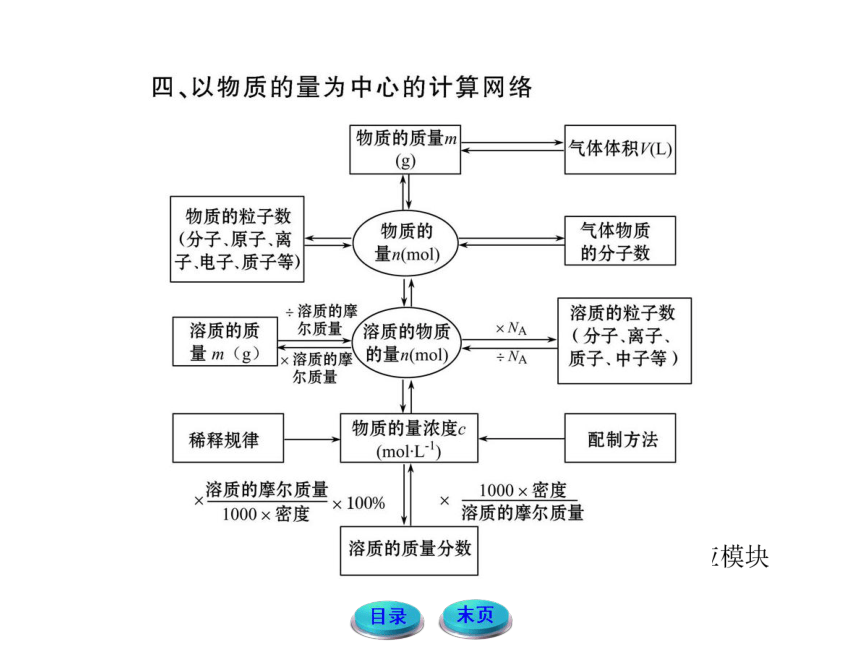
1.解答以N=m/M·NA为中心的有关基本粒子计算时,应注意看清所求粒子的种类。
2. 以气体物质为中心的计算,解答时应注意:
(1)若题目给出物质的体积,一要看是否是标准状况,若不是标准状况,则1 mol气体的体积不一定是22.4 L;二要看是不是气体,如不是气体,则无法求算其物质的量及其分子数。
(2)若题目给出气体的质量或物质的量,则粒子数目与外界条件无关。
(3)若气体为稀有气体,须注意它是单原子分子。
3.若与物质结构基本知识联系,考查物质所含的电子数、质子数、中子数等。解答此类题目应弄清物质的构成,正确运用粒子之间的求算关系。
4.与氧化还原知识结合,着重考查氧化还原过程中电子的转移数目。解答此类题目时,应把握氧化还原反应的实质和电子守恒规律。
物质的量应用于化学方程式的计算
【例4】现有250 mL盐酸和硫酸混合溶液,加入1 mol·L-1的NaOH溶液250 mL恰好中和,在中和后的溶液中加过量的Ba(OH)2溶液所得沉淀质量为17.475 g。求混合溶液中盐酸和硫酸的物质的量浓度各为多少?
【解析】由题意知,向中和后的溶液中加入Ba(OH)2溶液得
到的沉淀为BaSO4,则
n(BaSO4)=
即n(H2SO4)=0.075 mol,
c(H2SO4)=
=0.30 mol·L-1
n(NaOH)=1 mol·L-1×0.25 L=0.25 mol
H2SO4 + 2NaOH====Na2SO4+2H2O
1 mol 2 mol
0.075 mol 0.15 mol
则与盐酸反应的NaOH:
n(NaOH)=0.25 mol-0.15 mol=0.1 mol
HCl + NaOH====NaCl+H2O
1 mol 1 mol
0.1 mol 0.1 mol
c(HCl)=
答案:盐酸:0.40 mol·L-1 硫酸:0.30 mol·L-1
【名师点拨】利用化学方程式进行物质的量的有关计算的解题步骤有:
(1)明确各物质间的反应;(2)写出有关的化学方程式,并在有关的物质下面注明有关的量(若同时给出两种反应物的量,则应先进行过量判断);(3)列出比例式并求解;(4)写出答案。
一定物质的量浓度的溶液的配制
【例5】用质量分数为36.5%的浓盐酸(密度为1.16 g/cm3)配制成1 mol/L的稀盐酸。现实验室仅需要这种盐酸220 mL。试回答下列问题:
(1)配制稀盐酸时,应选用容量为_____mL的容量瓶;
(2)经计算需要_____mL浓盐酸,在量取时宜选用下列量筒中的_____。
A.5 mL B.10 mL C.25 mL D.50 mL
五
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近刻度线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹液面的最低处与瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。上述操作中,正确的顺序是(填序号)_____。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度_____(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度_____(填“偏高”、“偏低”、“无影响”)。
【解析】(1)由于实验室里没有220 mL容量瓶,所以必须选
用250 mL容量瓶,先配制250 mL溶液,再从其中取出
220 mL即可。(2)c浓(HCl)=
加水稀释前后HCl
的物质的量不变,所以11.6 mol/L·V浓(HCl)=250 mL×
1 mol/L,解得V浓(HCl)=21.6 mL,应该选择25 mL的量筒
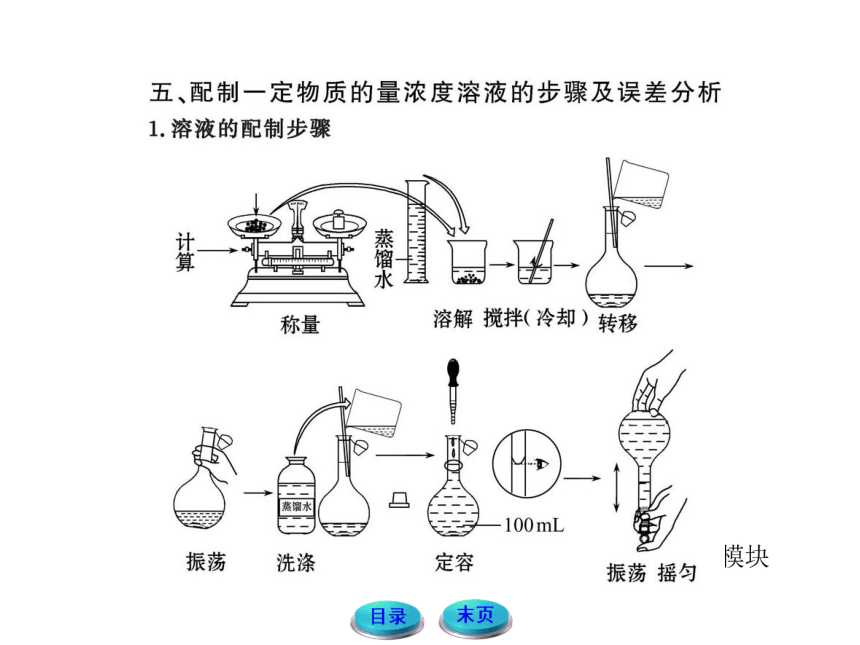
量取。(3)配制一定物质的量浓度的溶液基本步骤为:计算
→称量或量取→溶解→冷却后转移振荡→洗涤后定容→倒
转摇匀,所以正确的顺序是③①④②。(4)用刚刚洗涤洁净
的量筒来量取浓盐酸,量取的盐酸被稀释了,其物质的量比实际偏小,所配制溶液的浓度偏低;若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则一部分溶质损失,所配制溶液的浓度偏低。
答案:(1)250 (2)21.6 C
(3)③①④② (4)偏低 偏低
【名师点拨】在进行溶液配制时要掌握常用仪器(容量瓶、量筒、天平、胶头滴管、玻璃棒、烧杯等)的使用方法和溶液配制的基本操作步骤;要熟练运用物质的量浓度的计算公式进行有关的误差分析。
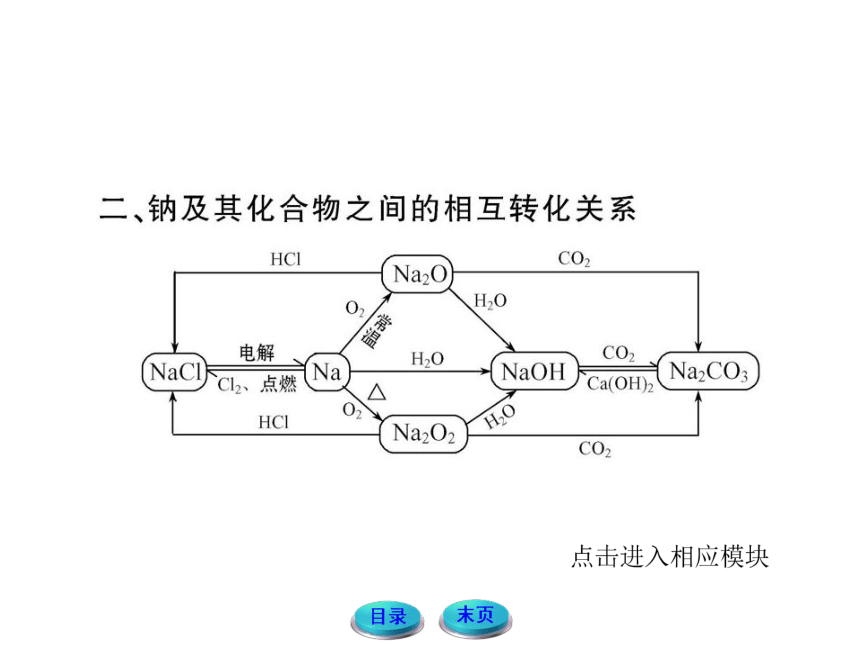
钠及其化合物的性质
【例1】某化工厂的库房中六、七个装有金属钠的桶突然发生爆炸,库房被炸塌,据了解,当地当天晚上有较大降雨。下面是某校高一的几位同学对此事的推测,其中正确的是
甲同学:钠能与水反应,且熔点低,爆炸可能与大雨有关。
乙同学:钠燃烧,生成过氧化钠,过氧化钠又与雨水反应生成氧气,会加快反应。
丙同学:大雨可以扑灭火,下雨不利于钠燃烧。
丁同学:钠燃烧的火焰为黄色,生成氧化钠,放出大量的热。
A.甲、乙、丙 B.甲、丁
C.甲、乙 D.甲、乙、丙、丁
【解析】选C。本题主要考查了钠与水反应以及钠与氧气反应这两个化学性质,同时考查了过氧化钠与水反应这一钠的化合物的一个性质。根据这些性质可知,甲、乙两位同学的说法是正确的;下雨后钠可以与水反应放出大量的热,可以加速钠的燃烧,丙同学的说法错误;钠燃烧的产物为过氧化钠而非氧化钠,所以丁同学的说法错误。根据以上分析答案选C。
【名师点拨】1.钠与水反应的实验现象及所体现的钠的性质:
2.过氧化钠的性质
(1)强氧化性
①Na2O2投入FeCl2溶液中,可将Fe2+氧化为Fe3+,同时生成Fe(OH)3沉淀。
②将Na2O2投入酚酞溶液中,溶液先由无色变为红色,之后又变为无色,同时有无色气泡产生。
(2)与CO2和H2O的反应
2Na2O2+2H2O====4NaOH+O2↑
2Na2O2+2CO2====2Na2CO3+O2
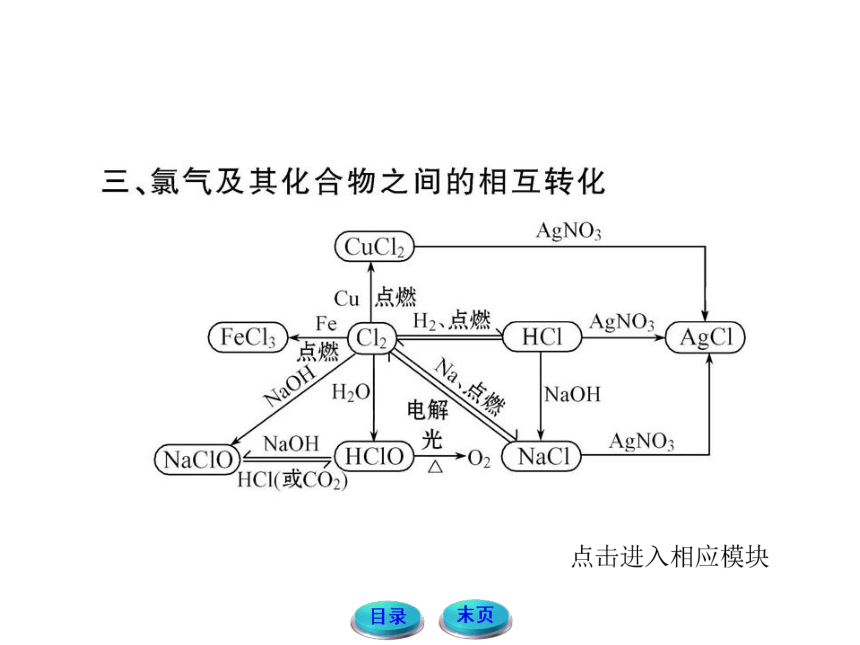
氯气及其化合物的性质
【例2】(双选)下列物质中存在Cl-的是
A.氯酸钾溶液 B.液氯
C.氯水 D.漂白粉溶液
【解析】选C、D。氯酸钾溶液中存在ClO3-,无Cl-;液氯中
只存在Cl2,无Cl-;氯水中存在反应Cl2+H2O====HCl+
HClO,因而有Cl-;漂白粉的主要成分是CaCl2、Ca(ClO)2,
因而漂白粉溶液中存在Cl-。
【名师点拨】液氯、氯水等物质的组成一直是考查的重点,应注意辨析掌握。液氯的成分为氯气分子,是氯气的液态
形式;氯水是氯气的水溶液,由于氯气与水反应,氯水中
含有三种分子(H2O、Cl2、HClO)和四种离子(ClO-、Cl-、H+、OH-);ClO3-、ClO-与ClO4-等中的氯元素并不能体现Cl-
的性质。
以阿伏加德罗常数为核心的相关计算
【例3】(2010·福建高考)NA表示阿伏加德罗常数,下列判断正确的是
A.在18 g18O2中含有NA个氧原子
B.标准状况下,22.4L空气含有NA个单质分子
C.1 mol Cl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L
【解析】选A。选项A:18 g18O2 物质的量为0.5 mol,所以它所含氧原子的物质的量为1 mol,即为NA,A正确;选项B:空气是多种成分的混合物,不只是单质,B错误;选项C:在氯气与水的反应中,1 mol氯气参加反应只转移NA电子,所以C项错误;选项D:由含有NA个Na+可知氢氧化钠的物质的量为1 mol,但溶液体积不是1L,所以溶液的物质的量浓度不是1 mol/L,D错误。
【名师点拨】解答与阿伏加德罗常数有关的计算时应注意的问题
1.解答以N=m/M·NA为中心的有关基本粒子计算时,应注意看清所求粒子的种类。
2. 以气体物质为中心的计算,解答时应注意:
(1)若题目给出物质的体积,一要看是否是标准状况,若不是标准状况,则1 mol气体的体积不一定是22.4 L;二要看是不是气体,如不是气体,则无法求算其物质的量及其分子数。
(2)若题目给出气体的质量或物质的量,则粒子数目与外界条件无关。
(3)若气体为稀有气体,须注意它是单原子分子。
3.若与物质结构基本知识联系,考查物质所含的电子数、质子数、中子数等。解答此类题目应弄清物质的构成,正确运用粒子之间的求算关系。
4.与氧化还原知识结合,着重考查氧化还原过程中电子的转移数目。解答此类题目时,应把握氧化还原反应的实质和电子守恒规律。
物质的量应用于化学方程式的计算
【例4】现有250 mL盐酸和硫酸混合溶液,加入1 mol·L-1的NaOH溶液250 mL恰好中和,在中和后的溶液中加过量的Ba(OH)2溶液所得沉淀质量为17.475 g。求混合溶液中盐酸和硫酸的物质的量浓度各为多少?
【解析】由题意知,向中和后的溶液中加入Ba(OH)2溶液得
到的沉淀为BaSO4,则
n(BaSO4)=
即n(H2SO4)=0.075 mol,
c(H2SO4)=
=0.30 mol·L-1
n(NaOH)=1 mol·L-1×0.25 L=0.25 mol
H2SO4 + 2NaOH====Na2SO4+2H2O
1 mol 2 mol
0.075 mol 0.15 mol
则与盐酸反应的NaOH:
n(NaOH)=0.25 mol-0.15 mol=0.1 mol
HCl + NaOH====NaCl+H2O
1 mol 1 mol
0.1 mol 0.1 mol
c(HCl)=
答案:盐酸:0.40 mol·L-1 硫酸:0.30 mol·L-1
【名师点拨】利用化学方程式进行物质的量的有关计算的解题步骤有:
(1)明确各物质间的反应;(2)写出有关的化学方程式,并在有关的物质下面注明有关的量(若同时给出两种反应物的量,则应先进行过量判断);(3)列出比例式并求解;(4)写出答案。
一定物质的量浓度的溶液的配制
【例5】用质量分数为36.5%的浓盐酸(密度为1.16 g/cm3)配制成1 mol/L的稀盐酸。现实验室仅需要这种盐酸220 mL。试回答下列问题:
(1)配制稀盐酸时,应选用容量为_____mL的容量瓶;
(2)经计算需要_____mL浓盐酸,在量取时宜选用下列量筒中的_____。
A.5 mL B.10 mL C.25 mL D.50 mL
五
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近刻度线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹液面的最低处与瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。上述操作中,正确的顺序是(填序号)_____。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度_____(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度_____(填“偏高”、“偏低”、“无影响”)。
【解析】(1)由于实验室里没有220 mL容量瓶,所以必须选
用250 mL容量瓶,先配制250 mL溶液,再从其中取出
220 mL即可。(2)c浓(HCl)=
加水稀释前后HCl
的物质的量不变,所以11.6 mol/L·V浓(HCl)=250 mL×
1 mol/L,解得V浓(HCl)=21.6 mL,应该选择25 mL的量筒
量取。(3)配制一定物质的量浓度的溶液基本步骤为:计算
→称量或量取→溶解→冷却后转移振荡→洗涤后定容→倒
转摇匀,所以正确的顺序是③①④②。(4)用刚刚洗涤洁净
的量筒来量取浓盐酸,量取的盐酸被稀释了,其物质的量比实际偏小,所配制溶液的浓度偏低;若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则一部分溶质损失,所配制溶液的浓度偏低。
答案:(1)250 (2)21.6 C
(3)③①④② (4)偏低 偏低
【名师点拨】在进行溶液配制时要掌握常用仪器(容量瓶、量筒、天平、胶头滴管、玻璃棒、烧杯等)的使用方法和溶液配制的基本操作步骤;要熟练运用物质的量浓度的计算公式进行有关的误差分析。
