11-12版高中化学全程学习方略配套课件:3自然界中的元素(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:3自然界中的元素(鲁科版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-14 00:00:00 | ||
图片预览









文档简介
(共31张PPT)
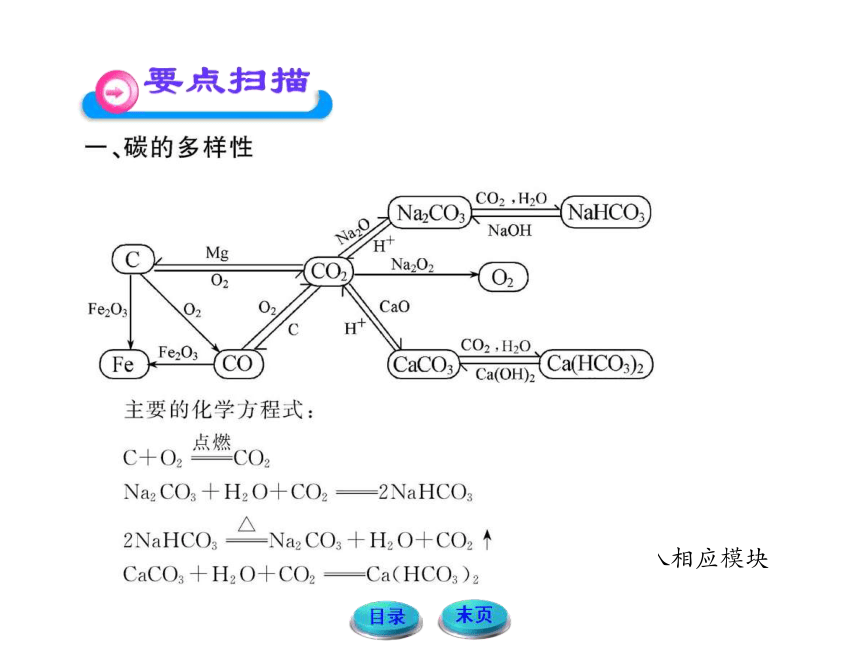
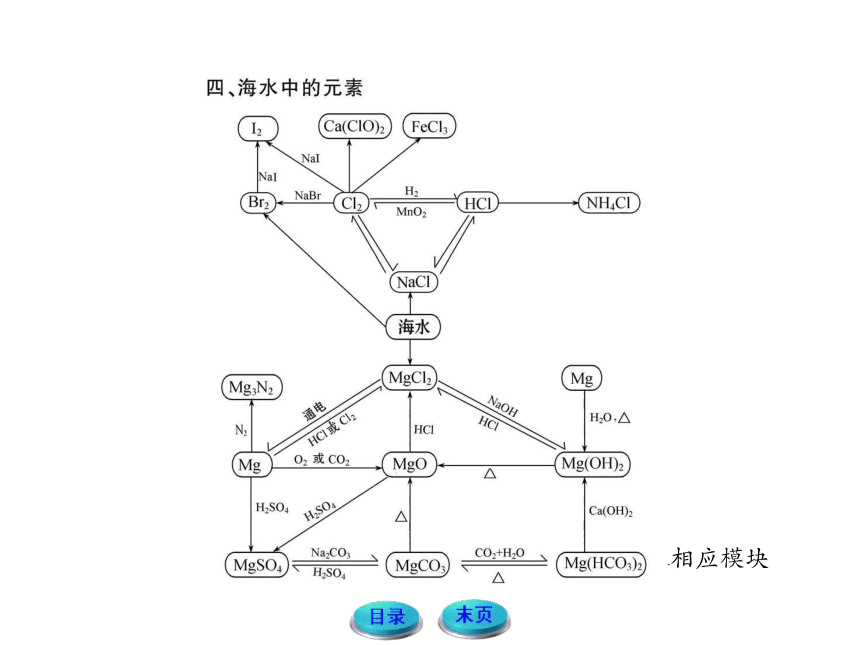
物质之间的转化
【例1】下列关系图中,A是一种正盐,D的式量比C大16,E是酸。当X无论是强酸还是强碱时都有如下转化关系:
当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素。
回答下列问题(用化学式填写):
(1)A是_____,Y是_____,Z是_____。
(2)当X是强碱时,E是_____。
(3)当X是强酸时,E是_____。
(4)写出A与X反应的离子方程式_____。
【解析】D的式量比C大16,猜想Y是O2。B C D
的连锁反应中,中心元素的价态接连升高,且可能出现一
种这样的中心元素,猜想中心元素是硫或氮。
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的
化合物,说明A是弱酸的铵盐(NH4)2S。
答案:(1)(NH4)2S O2 H2O
(2)HNO3 (3)H2SO4
(4)NH4++OH- NH3↑+H2O或S2-+2H+====H2S↑
O2
O2
△
====
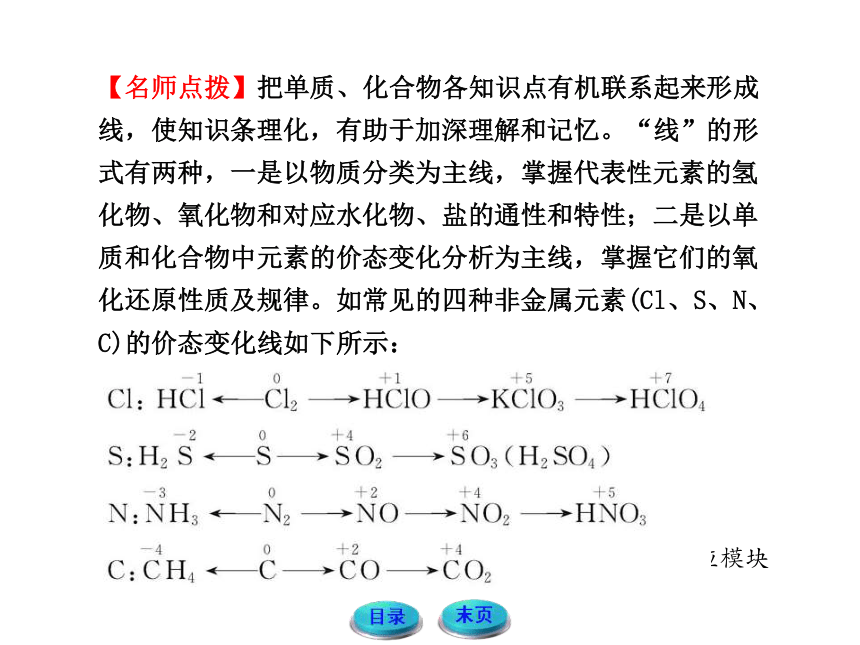
【名师点拨】把单质、化合物各知识点有机联系起来形成线,使知识条理化,有助于加深理解和记忆。“线”的形式有两种,一是以物质分类为主线,掌握代表性元素的氢化物、氧化物和对应水化物、盐的通性和特性;二是以单质和化合物中元素的价态变化分析为主线,掌握它们的氧化还原性质及规律。如常见的四种非金属元素(Cl、S、N、C)的价态变化线如下所示:
离子检验
【例2】甲、乙、丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42-。
(1)乙认为甲的实验不严谨,因为试样A中若含有_____(仅填一种),也会有此现象。
(2)丙认为乙的实验也不严谨,因为试样B中若含有_____(仅填一种),也会有此现象。
(3)其中试剂Ⅰ是____,现象Ⅰ是____;试剂Ⅱ是____,现象Ⅱ是____。(若你认为丙方案不合理,以上四空可以不填)
【解析】若溶液中有Ag+,加入BaCl2溶液后会发生Ag++Cl-
====AgCl↓,而AgCl是一种不溶于稀盐酸的白色沉淀。若溶
液中有SO32-,加入Ba(NO3)2溶液后会发生反应Ba2++SO32-
====BaSO3↓(白色),而加足量稀硝酸时,BaSO3会被氧化为
白色的BaSO4沉淀,沉淀仍不溶解。故检验SO42-要排除诸多
离子的干扰,正确的操作为先向试样中加入足量稀盐酸,
若无白色沉淀生成,证明试样中无Ag+,再向试样中(若有沉
淀则取清液)滴加BaCl2溶液[不能用Ba(NO3)2溶液,因为若
原试样中有SO32-,加入足量盐酸后会生成SO2,而SO2在水
中的溶解度较大,且在酸性条件下,SO2会被NO3-氧化为
SO42-,又会与Ba2+结合生成难溶于酸的BaSO4白色沉淀]。
答案:(1)Ag+ (2)SO32-
(3)稀盐酸 无白色沉淀 BaCl2溶液 产生白色沉淀
【名师点拨】(1)SO42-的检验要避免杂质离子如SO32-、Ag+
的干扰,故应注意试剂的选择和加入顺序:①必须先加盐
酸后加BaCl2溶液,若两试剂顺序颠倒则Ag+干扰;②不能
用HNO3代替盐酸,所用钡盐也不能用Ba(NO3)2溶液,因为在
酸性条件下,SO32-、HSO3-等会被溶液中的NO3-氧化为SO42-,从而得出错误的结论。(2)一般来讲,检验物质时能用物理
方法就不用化学方法,能用一种试剂就不用两种试剂。
硝酸和浓硫酸的强氧化性
【例3】(双选)关于浓硝酸与浓硫酸的叙述正确的是( )
A.常温下都可用铁质容器贮存
B.常温下都能与铜较快反应
C.铁粉与足量稀硝酸反应时,氧化剂与还原剂的物质的量之比为2∶3
D.浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳
【解析】选A、D。常温下铁遇浓硝酸或浓硫酸发生钝化;浓硝酸常温下能与铜较快反应,但浓硫酸常温下与铜不能反应;铁粉与足量稀硝酸反应时反应方程式为Fe+4HNO3====Fe(NO3)3+NO↑+2H2O,氧化剂硝酸与还原剂铁的物质的量之比为1∶1。
【名师点拨】浓硫酸的氧化性与硝酸具有相似性,分别是由其中的+6价硫元素和+5价氮元素体现,两种酸与大多数金属反应一般都不生成氢气,而是高价态的 S(+6)和N(+5)被还原,生成SO2、NO2(NO)气体,浓硫酸和浓硝酸常温下都能使铁、铝钝化,需注意的是:浓硝酸与Cu反应时,若Cu过量,反应开始时的还原产物为NO2,但随着反应的进行,硝酸变稀,其还原产物变为NO,最终应得到NO2与NO的混合气体。
有关实验
【例4】(2010·新课标全国卷)某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_______,其中发生反应的化学方程式为____________________________。
(2)实验过程中,装置B、C中的现象分别是_____、_____,这些现象分别说明SO2具有的性质是_____和_____;装置B中发生反应的离子方程式为________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:__________________________________;
(4)尾气可采用_____溶液吸收。
【解析】由图中试剂可知A是制取SO2的装置,SO2通入酸性KMnO4溶液被氧化,再通入Na2S溶液中,被S2-还原成硫单质,最后剩余的SO2不能直接排放,否则会污染空气,可用碱溶液如NaOH溶液吸收。
答案:(1)蒸馏烧瓶 Na2SO3+H2SO4(浓)====Na2SO4+SO2↑+H2O
(2)溶液由紫红色变为无色 无色溶液中出现黄色浑浊
还原性 氧化性
5SO2+2MnO4-+2H2O====2Mn2++5SO42-+4H+
(3)品红溶液退色后,关闭分液漏斗的旋塞,点燃D处酒精灯加热,溶液恢复为红色
(4)NaOH
【名师点拨】有关探究性实验的解答,分析过程中应将每种药品的作用、每步实验的目的弄清楚,再结合已有实验常识和元素化合物的知识的常考点不难得出正确结论。对于有有毒物质参加或生成的实验,设计时须考虑尾气吸收,防止污染。
有关计算
【例5】38.4 g铜跟一定量的浓硝酸反应,铜全部溶解后,共收集到22.4 L(标准状况)NO、NO2混合气体,反应后溶液中所含H+为a mol,则:
(1)该反应消耗的HNO3的物质的量是多少?反应后溶液中所含NO3-的物质的量是多少?
(2)若将盛有该22.4 L(标准状况)气体的容器倒扣在水槽中,通入标准状况下的O2,恰好使气体完全溶于水,则通入O2的体积是多少?22.4 L气体中含NO、NO2各多少?
(3)向铜与硝酸反应后的溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是多少?
【解析】(1)根据N原子守恒:反应消耗的HNO3等于起酸性作用的硝酸与起氧化作用的硝酸之和。
即n(HNO3)=2n(Cu)+n(气体)
=
=2.2 mol
反应后溶液中的NO3-存在于Cu(NO3)2和剩余的HNO3中,则n(NO3-)=2n(Cu)+n(H+)
=(a+1.2)mol
(2)根据电子守恒知:2n(Cu)=4n(O2)
V(O2)=6.72 L
又据电子守恒知:2n(Cu)=3n(NO)+n(NO2)
解得:V(NO)=2.24 L V(NO2)=20.16 L
(3)n(OH-)=2n(Cu2+)+n(H+)
=(a+1.2) mol
所以V(NaOH)=
答案:(1)2.2 mol、(a+1.2)mol
(2)6.72 L、2.24 L、20.16 L (3)
【例6】某硫酸厂用接触法制硫酸的生产过程中,在燃烧硫黄时,有5%的硫损失掉;在SO2的催化氧化时有92%的二氧化硫转化为三氧化硫;在吸收塔中损失SO3的质量分数为0.6%。现有含硫95%的硫黄100 t,问可制得98%的浓硫酸多少吨
【解析】设可制得98%的浓硫酸的质量为x,生产硫酸过
程中发生反应的化学方程式分别为:
S+O2 SO2
2SO2+O2====2SO3
SO3+H2O====H2SO4
由化学方程式可得关系式S~H2SO4
S ~ H2SO4
32 98
100×95%×92%×
(1-0.6%)×(1-5%) t x·98%
解得x=257.9 t
答案:257.9 t
点燃
====
【名师点拨】与元素化合物有关的计算方法主要有:
1.依据方程式计算。
2.依据守恒法计算,包括原子守恒、电子转移守恒等。
3.依据关系式计算,该方法主要应用于多步反应的计算中。
在化学反应的计算中,往往不是直接给出相关的量。而是用其他的量以信息的形式给出,要善于把信息和已学的知识联系起来挖掘新的关系量。
物质之间的转化
【例1】下列关系图中,A是一种正盐,D的式量比C大16,E是酸。当X无论是强酸还是强碱时都有如下转化关系:
当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素。
回答下列问题(用化学式填写):
(1)A是_____,Y是_____,Z是_____。
(2)当X是强碱时,E是_____。
(3)当X是强酸时,E是_____。
(4)写出A与X反应的离子方程式_____。
【解析】D的式量比C大16,猜想Y是O2。B C D
的连锁反应中,中心元素的价态接连升高,且可能出现一
种这样的中心元素,猜想中心元素是硫或氮。
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的
化合物,说明A是弱酸的铵盐(NH4)2S。
答案:(1)(NH4)2S O2 H2O
(2)HNO3 (3)H2SO4
(4)NH4++OH- NH3↑+H2O或S2-+2H+====H2S↑
O2
O2
△
====
【名师点拨】把单质、化合物各知识点有机联系起来形成线,使知识条理化,有助于加深理解和记忆。“线”的形式有两种,一是以物质分类为主线,掌握代表性元素的氢化物、氧化物和对应水化物、盐的通性和特性;二是以单质和化合物中元素的价态变化分析为主线,掌握它们的氧化还原性质及规律。如常见的四种非金属元素(Cl、S、N、C)的价态变化线如下所示:
离子检验
【例2】甲、乙、丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42-。
(1)乙认为甲的实验不严谨,因为试样A中若含有_____(仅填一种),也会有此现象。
(2)丙认为乙的实验也不严谨,因为试样B中若含有_____(仅填一种),也会有此现象。
(3)其中试剂Ⅰ是____,现象Ⅰ是____;试剂Ⅱ是____,现象Ⅱ是____。(若你认为丙方案不合理,以上四空可以不填)
【解析】若溶液中有Ag+,加入BaCl2溶液后会发生Ag++Cl-
====AgCl↓,而AgCl是一种不溶于稀盐酸的白色沉淀。若溶
液中有SO32-,加入Ba(NO3)2溶液后会发生反应Ba2++SO32-
====BaSO3↓(白色),而加足量稀硝酸时,BaSO3会被氧化为
白色的BaSO4沉淀,沉淀仍不溶解。故检验SO42-要排除诸多
离子的干扰,正确的操作为先向试样中加入足量稀盐酸,
若无白色沉淀生成,证明试样中无Ag+,再向试样中(若有沉
淀则取清液)滴加BaCl2溶液[不能用Ba(NO3)2溶液,因为若
原试样中有SO32-,加入足量盐酸后会生成SO2,而SO2在水
中的溶解度较大,且在酸性条件下,SO2会被NO3-氧化为
SO42-,又会与Ba2+结合生成难溶于酸的BaSO4白色沉淀]。
答案:(1)Ag+ (2)SO32-
(3)稀盐酸 无白色沉淀 BaCl2溶液 产生白色沉淀
【名师点拨】(1)SO42-的检验要避免杂质离子如SO32-、Ag+
的干扰,故应注意试剂的选择和加入顺序:①必须先加盐
酸后加BaCl2溶液,若两试剂顺序颠倒则Ag+干扰;②不能
用HNO3代替盐酸,所用钡盐也不能用Ba(NO3)2溶液,因为在
酸性条件下,SO32-、HSO3-等会被溶液中的NO3-氧化为SO42-,从而得出错误的结论。(2)一般来讲,检验物质时能用物理
方法就不用化学方法,能用一种试剂就不用两种试剂。
硝酸和浓硫酸的强氧化性
【例3】(双选)关于浓硝酸与浓硫酸的叙述正确的是( )
A.常温下都可用铁质容器贮存
B.常温下都能与铜较快反应
C.铁粉与足量稀硝酸反应时,氧化剂与还原剂的物质的量之比为2∶3
D.浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳
【解析】选A、D。常温下铁遇浓硝酸或浓硫酸发生钝化;浓硝酸常温下能与铜较快反应,但浓硫酸常温下与铜不能反应;铁粉与足量稀硝酸反应时反应方程式为Fe+4HNO3====Fe(NO3)3+NO↑+2H2O,氧化剂硝酸与还原剂铁的物质的量之比为1∶1。
【名师点拨】浓硫酸的氧化性与硝酸具有相似性,分别是由其中的+6价硫元素和+5价氮元素体现,两种酸与大多数金属反应一般都不生成氢气,而是高价态的 S(+6)和N(+5)被还原,生成SO2、NO2(NO)气体,浓硫酸和浓硝酸常温下都能使铁、铝钝化,需注意的是:浓硝酸与Cu反应时,若Cu过量,反应开始时的还原产物为NO2,但随着反应的进行,硝酸变稀,其还原产物变为NO,最终应得到NO2与NO的混合气体。
有关实验
【例4】(2010·新课标全国卷)某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_______,其中发生反应的化学方程式为____________________________。
(2)实验过程中,装置B、C中的现象分别是_____、_____,这些现象分别说明SO2具有的性质是_____和_____;装置B中发生反应的离子方程式为________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:__________________________________;
(4)尾气可采用_____溶液吸收。
【解析】由图中试剂可知A是制取SO2的装置,SO2通入酸性KMnO4溶液被氧化,再通入Na2S溶液中,被S2-还原成硫单质,最后剩余的SO2不能直接排放,否则会污染空气,可用碱溶液如NaOH溶液吸收。
答案:(1)蒸馏烧瓶 Na2SO3+H2SO4(浓)====Na2SO4+SO2↑+H2O
(2)溶液由紫红色变为无色 无色溶液中出现黄色浑浊
还原性 氧化性
5SO2+2MnO4-+2H2O====2Mn2++5SO42-+4H+
(3)品红溶液退色后,关闭分液漏斗的旋塞,点燃D处酒精灯加热,溶液恢复为红色
(4)NaOH
【名师点拨】有关探究性实验的解答,分析过程中应将每种药品的作用、每步实验的目的弄清楚,再结合已有实验常识和元素化合物的知识的常考点不难得出正确结论。对于有有毒物质参加或生成的实验,设计时须考虑尾气吸收,防止污染。
有关计算
【例5】38.4 g铜跟一定量的浓硝酸反应,铜全部溶解后,共收集到22.4 L(标准状况)NO、NO2混合气体,反应后溶液中所含H+为a mol,则:
(1)该反应消耗的HNO3的物质的量是多少?反应后溶液中所含NO3-的物质的量是多少?
(2)若将盛有该22.4 L(标准状况)气体的容器倒扣在水槽中,通入标准状况下的O2,恰好使气体完全溶于水,则通入O2的体积是多少?22.4 L气体中含NO、NO2各多少?
(3)向铜与硝酸反应后的溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是多少?
【解析】(1)根据N原子守恒:反应消耗的HNO3等于起酸性作用的硝酸与起氧化作用的硝酸之和。
即n(HNO3)=2n(Cu)+n(气体)
=
=2.2 mol
反应后溶液中的NO3-存在于Cu(NO3)2和剩余的HNO3中,则n(NO3-)=2n(Cu)+n(H+)
=(a+1.2)mol
(2)根据电子守恒知:2n(Cu)=4n(O2)
V(O2)=6.72 L
又据电子守恒知:2n(Cu)=3n(NO)+n(NO2)
解得:V(NO)=2.24 L V(NO2)=20.16 L
(3)n(OH-)=2n(Cu2+)+n(H+)
=(a+1.2) mol
所以V(NaOH)=
答案:(1)2.2 mol、(a+1.2)mol
(2)6.72 L、2.24 L、20.16 L (3)
【例6】某硫酸厂用接触法制硫酸的生产过程中,在燃烧硫黄时,有5%的硫损失掉;在SO2的催化氧化时有92%的二氧化硫转化为三氧化硫;在吸收塔中损失SO3的质量分数为0.6%。现有含硫95%的硫黄100 t,问可制得98%的浓硫酸多少吨
【解析】设可制得98%的浓硫酸的质量为x,生产硫酸过
程中发生反应的化学方程式分别为:
S+O2 SO2
2SO2+O2====2SO3
SO3+H2O====H2SO4
由化学方程式可得关系式S~H2SO4
S ~ H2SO4
32 98
100×95%×92%×
(1-0.6%)×(1-5%) t x·98%
解得x=257.9 t
答案:257.9 t
点燃
====
【名师点拨】与元素化合物有关的计算方法主要有:
1.依据方程式计算。
2.依据守恒法计算,包括原子守恒、电子转移守恒等。
3.依据关系式计算,该方法主要应用于多步反应的计算中。
在化学反应的计算中,往往不是直接给出相关的量。而是用其他的量以信息的形式给出,要善于把信息和已学的知识联系起来挖掘新的关系量。
