11-12版高中化学全程学习方略配套课件:4.1硅 无机非金属材料(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:4.1硅 无机非金属材料(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-14 08:21:47 | ||
图片预览











文档简介
(共122张PPT)
【典例1】(2010·福建高考)下列各组物质中,
满足如图物质一步转化关系的选项是
【思路点拨】解答本题应注意以下两点:
【自主解答】选C。选项A:NaHCO3不能一步得到Na,所以A是错误选项;选项B:Cu(OH)2不能一步得到Cu,所以B是错误选项;选项C:C在氧气中不完全燃烧会得到CO,CO在氧气中燃烧会得到CO2,CO2在一定条件下与单质镁反应可以生成碳单质和氧化镁,所以C是正确选项;选项D:SiO2不能一步生成H2SiO3,H2SiO3也不能一步生成Si,所以D项错误。
【互动探究】如何由二氧化硅制硅酸?
提示:可向二氧化硅与氢氧化钠反应后的溶液中加入盐酸或通入二氧化碳气体,有关反应方程式为:
SiO2+2NaOH====Na2SiO3+H2O,
Na2SiO3+2HCl====2NaCl+H2SiO3↓
或Na2SiO3+CO2+H2O====Na2CO3+H2SiO3↓
【变式训练】下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色的,有金属光泽
B.硅的导电能力界于导体和绝缘体之间,是良好的半导体材料
C.当加热到一定温度时,硅能与O2、Cl2等非金属单质反应
D.硅的化学性质不活泼,常温下不与任何物质反应
【解析】选D。硅的化学性质不活泼,常温下可与强碱溶液、氢氟酸等反应。
【典例2】下列关于二氧化硅和二氧化碳的性质叙述正确的是
A.都能与NaOH溶液反应
B.氧化物都能溶于水生成相应的酸
C.都是酸性氧化物,都不能与任何酸反应
D.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
【思路点拨】解答本题要注意以下两点:
【自主解答】选A。SiO2不溶于水,能与氢氟酸反应;判断酸性强弱是在溶液中进行的,故D不能作为判断酸性强弱的条件。
【互动探究】(1)二氧化硅与碳酸钠反应是氧化还原反应吗?
提示:不是,反应过程中元素的化合价都没有改变。
(2)如何证明碳酸的酸性比硅酸强?
提示:根据复分解反应中强酸能制弱酸的规律,可向硅酸钠溶液中通入二氧化碳,若有白色沉淀生成,就说明碳酸的酸性比硅酸强。
【变式训练】下列叙述中不正确的是( )
A.CO2与水反应生成碳酸,是酸性氧化物,SiO2不能与水反应生成相应的硅酸,不是酸性氧化物
B.C、Si的最外层电子数相同,而次外层电子数不同
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D.碳和硅元素的主要化合价是+4价和+2价
【解析】选A。酸性氧化物是与碱反应生成盐和水的氧化物,而不是与水反应生成酸的氧化物。碳原子的次外层有2个电子,硅原子次外层有8个电子,B对。CO2、SiO2均能与CaO反应生成盐,C对。碳、硅常见的化合价为+2价、+4价,D对。
【典例】含硅材料有广泛用途。
(1)氮化硅陶瓷是一种新型无机非金属材料,它的硬度大、熔点高,化学性质稳定。请回答下列问题。
①工业上普遍采用高纯度硅与纯氮在1 300 ℃反应获得,写出反应的化学方程式__________________。
②根据性质推测氮化硅的用途_____(填字母);
A.制气轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造轴承
(2)某硅酸盐样品中锌的质量分数为58.6%,其化学组成用氧化物形式可表示为nZnO·SiO2,则n值等于_____。
(3)下列有关硅材料的说法正确的是_____(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅熔点高,硬度大,可用于制作高温陶瓷
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.钢化玻璃通常用于制车窗玻璃,破碎时没有尖锐的棱角
【思路点拨】按照“性质决定用途”的思路解答,如氮化
硅强度大,熔点高,性质稳定,可用作耐磨材料。
【自主解答】(1)氮化硅中氮显-3价,硅显+4价,3Si+2N2
Si3N4;氮化硅是一种重要的结构材料,是一种超
硬材料,性质决定用途,A、C、D都是氮化硅的用途。
(2)65n/(81n+60)=58.6%,n=2。
(3)A项,碳化硅熔点高、性质稳定,可用于生产耐高温水
泥。B项,氮化硅熔点高,硬度大,可用于制作高温陶瓷或
轴承。D项,普通玻璃的主要成分是Na2SiO3、CaSiO3、
SiO2,属于混合物,无固定的熔点。
1 300 ℃
======
答案:(1)①3Si+2N2 Si3N4
②A、C、D
(2)2
(3)A、B、C、E
1 300 ℃
======
【互动探究】(1)若题中(2)中n=1,则该硅酸盐的化学式是什么?
提示:是ZnSiO3。
(2)普通玻璃与钢化玻璃的成分有区别吗?
提示:没有。钢化玻璃是将普通玻璃先骤热后再骤冷得到的,两者的成分没有区别。
【变式训练】下列表述正确的是( )
①太阳能电池可采用硅材料制造,其应用有利于环保、节能
②化学家采用玛瑙研钵研磨固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
A.②③ B.②④
C.①③④ D.①③
【解析】选C。太阳能电池无污染;玛瑙的主要成分是二氧化硅;水泥是硅酸盐产品;变色眼镜的有色玻璃片添加了某些有色物质。
【典例1】下列关于硅及硅的化合物的叙述中正确的是
A.粗硅制备时,发生的反应为:C+SiO2 Si+CO2↑
B.硅元素在地壳中的含量居第二位,自然界中既有游离态的硅,又有化合态的硅
C.水晶项链和瓷盘都是硅酸盐产品
D.二氧化硅是制造光导纤维的重要原料
【易错选项】A
高温
====
【易错剖析】(1)易错选项分析
本题易错选A的原因在于对基础知识掌握不牢,粗硅制备时
的反应原理是2C+SiO2 Si+2CO↑,产物中生成的是
CO,而不是CO2。
高温
====
(2)其他错误选项分析:
【标准答案】D
【典例2】下列有关硅的化合物说法正确的是
A.SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子
B.硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分
C.H2SiO3既可由SiO2溶于水制得,也可由Na2SiO3和其他酸(如盐酸)反应制得
D.SiO2是酸性氧化物,能和碱反应,不能和酸反应
【易错选项】A
【易错剖析】(1)易错选项分析
错选A的原因在于对SiO2这个化学式分析不到位。SiO2并不是说一个硅原子结合两个氧原子形成一个SiO2分子;正确的是SiO2是由硅原子和氧原子形成的立体网状结构,在这个网状结构中,硅原子与氧原子个数比是1∶2。
(2)其他错误选项分析
【标准答案】B
1.下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③
C.①④ D.③④
【解析】选C。光导纤维的成分是SiO2,③错;水晶的主要成分是SiO2,而不是硅酸盐,②错。硅酸盐是一些岩石的成分,①对,陶瓷的主要成分为硅酸盐,④对。
2.石灰石是许多工业的原料之一,但生产下列物质时不需要石灰石的是( )
A.硅酸 B.水泥
C.玻璃 D.生石灰
【解析】选A。硅酸的制取需要硅酸盐和较强的酸,不需要石灰石,A项符合题意。
3.对于化学方程式SiO2+3C SiC+2CO↑,有关叙述正确
的是( )
A.反应中SiO2是氧化剂,C是还原剂
B.硅元素被还原了,碳元素被氧化了
C.在反应中C既是氧化剂又是还原剂
D.在反应中氧化剂与还原剂的物质的量之比为2∶1
【解析】选C。从反应方程式可以看出,只有碳元素化合价
发生了变化,在反应中碳既是氧化剂又是还原剂,且氧化
剂和还原剂质量比为1∶2。
高温
====
4.(双选)2010年11月11日,乾隆官窑“青花红彩龙纹如意耳葫芦瓶”以8 344万元成交,创下国内瓷器拍卖最高纪录。瓷器是传统的无机硅酸盐产品,下列试剂可用于洗涤瓷器的是( )
A.烧碱溶液 B.氢氟酸
C.水 D.硝酸溶液
【解析】选C、D。瓷器的成分中含有二氧化硅,二氧化硅可与烧碱溶液、氢氟酸反应。
5.硅是重要的工业原料。
(1)写出工业制硅的化学方程式____________________。
(2)工业上由粗硅制取高纯硅有如下反应:
①Si(s)+3HCl(g) SiHCl3(g)+H2(g)(放热381 kJ)
②SiHCl3(g)+H2(g) Si(s)+3HCl(g)
对上述反应的说法,正确的是_____。
A.均为置换反应和氧化还原反应
B.反应①、②实际上互为可逆反应
C.由于反应①放热,则反应②一定吸热
D.由上述反应可知硅的还原性比氢气强
950 ℃
====
高温
====
【解析】工业上用炭还原二氧化硅制硅;从粗硅制取高纯硅的两反应分析,两反应均为置换反应,也必然是氧化还原反应。两反应条件不同,所以不是可逆反应。反应①放热,相反反应②必吸热。由方程式并不能比较出H2和硅还原性的强弱。
答案:(1)SiO2+2C Si+2CO↑
(2)A、C
高温
====
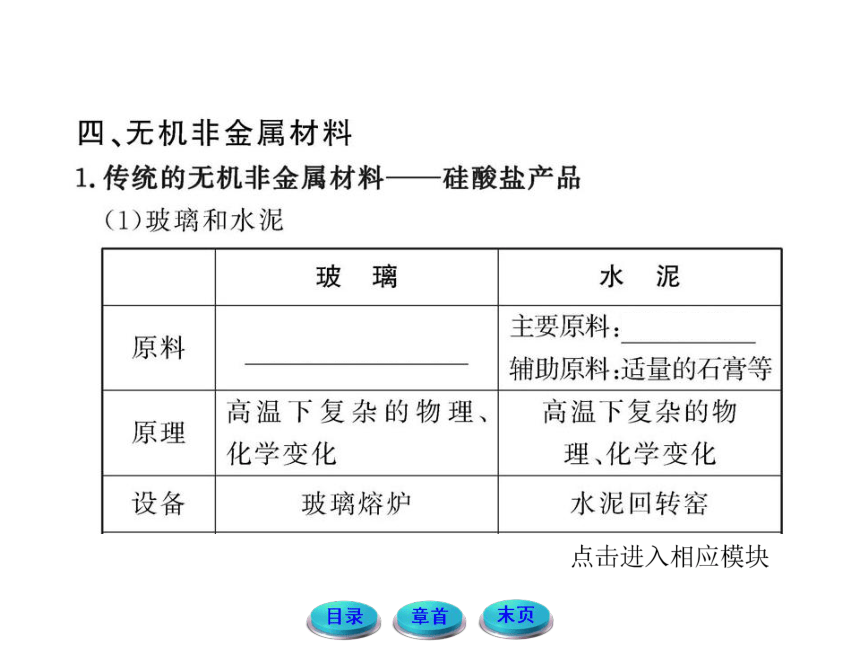
6.无机非金属材料分为传统无机非金属材料和新型无机非金属材料两类。
(1)硅酸盐材料是传统无机非金属材料,下列属于硅酸盐产品的是______________________________________。
①玻璃 ②陶瓷
③石英玻璃 ④硅芯片
⑤光导纤维 ⑥水泥
⑦砖瓦
(2)制造普通玻璃的主要原料是_____、_____、_____,发生的主要反应有________、________。
(3)水泥是重要的工业原料,据统计,2010年二季度我国水泥产量为51 262万吨,同比增长14.7%。水泥具有_____性,与水掺和搅拌并静置后,很容易凝固变硬。
(4)磷酸钙陶瓷是一种新型无机非金属材料,可用于制造人造骨骼,这是利用了这类材料具有_____。
A.耐高温的特性 B.电学特性
C.光学特性 D.生物功能
【解析】石英玻璃、光导纤维的主要成分都是二氧化硅,硅芯片是高纯度的硅;制造普通玻璃的主要原料有纯碱、石灰石、石英;水泥具有水硬性;磷酸钙陶瓷可用于人体,则是利用其生物功能。
答案:(1)①②⑥⑦
(2)纯碱 石灰石 石英
Na2CO3+SiO2 Na2SiO3+CO2↑
CaCO3+SiO2 CaSiO3+CO2↑
(3)水硬
(4)D
高温
====
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.在一定条件下,下列物质不能和SiO2反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸
⑤硝酸 ⑥氢氧化钾 ⑦氧化钙
A.③⑤⑦ B.⑤⑦ C.①⑤ D.⑤
【解析】选D。SiO2与焦炭反应生成硅,与纯碱、碳酸钙反应制玻璃,氢氟酸可雕刻玻璃,SiO2是酸性氧化物可与碱、碱性氧化物反应。
2.下列叙述中,正确的是( )
A.自然界中存在大量的单质硅、二氧化硅和硅酸盐
B.地壳中含量占第一、二位的两种元素组成的一种化合物为SiO2
C.除去SiO2中混有的Fe2O3杂质时可用氢氧化钠溶液充分洗涤后,过滤
D.硅酸钠溶液与盐酸不能反应
【解析】选B。自然界中不存在单质硅;地壳中含量占第一、二位的两种元素分别是O、Si;除去SiO2中混有的Fe2O3杂质时应用盐酸充分洗涤后,过滤;硅酸钠溶液与盐酸反应生成硅酸和氯化钠。
3.(2011·黄石高一检测)下列叙述正确的是( )
A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强
B.陶瓷、玻璃、水泥容器都能贮存氢氟酸
C.石灰抹墙、水泥砌墙的硬化过程原理相同
D.玻璃窑中出来的气体的主要成分是二氧化碳
【解析】选D。二氧化硅与碳酸钠反应放出二氧化碳,不能说明硅酸的酸性比碳酸强;陶瓷、玻璃的成分都含有二氧化硅,可与氢氟酸反应;石灰抹墙是氢氧化钙与二氧化碳反应生成碳酸钙,水泥砌墙是利用水泥具有水硬性;玻璃窑中二氧化硅分别与碳酸钙、碳酸钠反应都可生成二氧化碳气体。
4.兵马俑中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.易溶解于强酸和强碱
D.x等于6
【解析】选C。根据化合物中化合价的代数和为0,所以有2+2+4×2+(-2)×x=0,所以x=6,硅酸铜钡的化学式为BaCuSi2O6,写成氧化物形式为BaO·CuO·2SiO2,又因硅酸盐性质稳定,故C错。
【方法技巧】氧化物改写遵循原则
氧化物改写一般遵循“三不变”原则:元素化合价不变、元素种类不变和原子个数比不变。氧化物排列顺序一般是:金属氧化物·非金属氧化物·水
5.(双选)将过量CO2通入下列溶液中,能产生沉淀的是( )
A.CaCl2溶液
B.Ba(OH)2溶液
C.Na2CO3饱和溶液
D.Na2SiO3水溶液
【解析】选C、 D。A项中,弱酸(CO2水溶液)不能与强酸盐CaCl2发生复分解反应;B项中,少量CO2可与碱Ba(OH)2反应产生白色沉淀BaCO3,CO2过量时生成可溶性的Ba(HCO3)2;C项中,因在相同条件(温度)下,NaHCO3的溶解度小于Na2CO3,会发生反应Na2CO3+CO2+H2O====2NaHCO3↓,故会析出NaHCO3晶体;D项中,碳酸的酸性强于硅酸,有Na2SiO3
+CO2+H2O====H2SiO3↓+Na2CO3,生成白色的胶状沉淀。
二、非选择题(本题包括3小题,共30分)
6.(10分)硅是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题:
(1)硅在自然界最主要的存在形式是_____。
①硅单质 ②二氧化硅 ③硅酸盐
A.①② B.①③ C.②③ D.①②③
(2)如图为某玻璃上精美的花纹图案,雕刻此图案所用的刻蚀液为__________________________________________。
(3)诺贝尔物理奖得主之一——美籍华裔物理学家高锟被誉为“光纤之父”,光导纤维的使用,让人们的生活更加丰富精彩。_____是制备光导纤维的基本原料。
(4)硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源。与“氢能源”比较,“硅能源”具有_______等更加优越的特点,从而得到全球的关注和期待。
(5)三硅酸镁(2MgO·3SiO2·nH2O)被用来治疗胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。写出三硅酸镁与胃酸(盐酸)反应的化学方程式:_________。
【解析】硅在自然界中无游离态,全部以化合态的形式存在,最主要的存在形式是二氧化硅和硅酸盐;玻璃中含有二氧化硅,能与氢氟酸反应生成四氟化硅。光导纤维的主要成分是二氧化硅;三硅酸镁与胃酸反应生成氯化镁、二氧化硅和水。
答案:(1)C
(2)氢氟酸
(3)SiO2(或二氧化硅)
(4)便于储运,比较安全
(5)2MgO·3SiO2·nH2O+4HCl====2MgCl2+3SiO2+(n+2)H2O
7.(10分)已知含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物B可用于制造高性能的现代通讯材料——光导纤维,B与烧碱反应生成化合物C。将B与纯碱混合高温熔融时发生化学反应生成C和D。
(1)写出C的名称______。
(2)B与烧碱反应的化学方程式是____________________。
(3)写出生成D和C的化学反应方程式:_______________。
(4)将D通入C的水溶液,实验现象为_________________。
【解析】A元素单质可作半导体材料,含A元素的某化合物是制造光导纤维的原料,可知A为硅元素,B为SiO2,C为Na2SiO3,SiO2与纯碱高温时生成Na2SiO3和CO2,CO2与Na2SiO3溶液反应生成白色沉淀硅酸。
答案:(1)硅酸钠
(2)SiO2+2NaOH====Na2SiO3+H2O
(3)SiO2+Na2CO3 Na2SiO3+CO2↑
(4)产生白色沉淀
高温
====
8.(10分)(挑战能力)用多种方法鉴别下列第一组白色粉末物质(注:①能够写化学方程式的写出化学反应方程式;
②鉴别方法可以不用填满,若序号不够也可以自己再添)。
(1)Na2CO3和SiO2
①__________________________________________;
②__________________________________________;
③__________________________________________。
(2)欲鉴别CaCO3和Na2SiO3,某同学分别取少许待测粉末,滴加稀盐酸,指出他观察到的现象:
CaCO3_______________________________________;
Na2SiO3_____________________________________。
【解析】(1)①可利用加水溶解的办法,能溶于水的是Na2CO3,不溶于水的是SiO2。
②焰色反应法:焰色反应为黄色的是Na2CO3,余者为SiO2。
③酸液产气法:分别取少许待测粉末,滴加稀盐酸,能够产生气体的是Na2CO3;不反应的是SiO2。化学方程式:Na2CO3+2HCl====2NaCl+H2O+CO2↑
(2)分别取少许待测粉末,滴加稀盐酸,CaCO3能够产生气泡,Na2SiO3能产生白色沉淀。
答案:(1)①加水溶解法:能溶于水的是Na2CO3,不溶于水的是SiO2
②焰色反应法:焰色反应为黄色的是Na2CO3,余者为SiO2
③酸液产气法:分别取少许待测粉末,滴加稀盐酸,能够产生气体的是Na2CO3;不反应的是SiO2。化学方程式:Na2CO3+2HCl====2NaCl+H2O+CO2↑
(2)产生气泡 产生白色沉淀
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用炭还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3;
Si+3HCl====SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。(已知SiHCl3能与H2O剧烈反应,在空气中易自燃。)
用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去);
【思考探究】
(1)请写出第①步制备粗硅、装置D中发生反应的化学反应
方程式,并指出三个步骤中发生的反应属于置换反应的是
哪几个?
提示:在高温条件下,用C还原SiO2生成CO和粗硅,化学反
应为2C+SiO2 2CO↑+Si;据步骤③可写出装置D中发生
的反应为SiHCl3+H2 Si+3HCl。所以三个步骤
中发生的反应都属于置换反应。
高温
====
1 000~1 100 ℃
===========
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点
33.0 ℃)中含有少量SiCl3(沸点57.6 ℃)和HCl(沸点
-84.7 ℃),那么该如何提纯SiHCl3
提示:分离、提纯不同沸点的液体可以采用分馏或蒸馏的方法。
(3)装置B中的试剂是什么?其作用是什么?
提示:用Zn、稀硫酸制得的H2中会混有少量H2O,而SiHCl3能与H2O剧烈反应,所以要进行干燥,根据装置应选择液态干燥剂浓硫酸。
(4)为保证制备纯硅实验的成功,操作的关键之一是控制好反应温度,除此之外还应注意什么?
提示:首先要检查实验装置的气密性,同时因为SiHCl3在空气中易自燃,实验中还要注意先通一段时间H2以排尽装置中的空气。
【典例1】(2010·福建高考)下列各组物质中,
满足如图物质一步转化关系的选项是
【思路点拨】解答本题应注意以下两点:
【自主解答】选C。选项A:NaHCO3不能一步得到Na,所以A是错误选项;选项B:Cu(OH)2不能一步得到Cu,所以B是错误选项;选项C:C在氧气中不完全燃烧会得到CO,CO在氧气中燃烧会得到CO2,CO2在一定条件下与单质镁反应可以生成碳单质和氧化镁,所以C是正确选项;选项D:SiO2不能一步生成H2SiO3,H2SiO3也不能一步生成Si,所以D项错误。
【互动探究】如何由二氧化硅制硅酸?
提示:可向二氧化硅与氢氧化钠反应后的溶液中加入盐酸或通入二氧化碳气体,有关反应方程式为:
SiO2+2NaOH====Na2SiO3+H2O,
Na2SiO3+2HCl====2NaCl+H2SiO3↓
或Na2SiO3+CO2+H2O====Na2CO3+H2SiO3↓
【变式训练】下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色的,有金属光泽
B.硅的导电能力界于导体和绝缘体之间,是良好的半导体材料
C.当加热到一定温度时,硅能与O2、Cl2等非金属单质反应
D.硅的化学性质不活泼,常温下不与任何物质反应
【解析】选D。硅的化学性质不活泼,常温下可与强碱溶液、氢氟酸等反应。
【典例2】下列关于二氧化硅和二氧化碳的性质叙述正确的是
A.都能与NaOH溶液反应
B.氧化物都能溶于水生成相应的酸
C.都是酸性氧化物,都不能与任何酸反应
D.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
【思路点拨】解答本题要注意以下两点:
【自主解答】选A。SiO2不溶于水,能与氢氟酸反应;判断酸性强弱是在溶液中进行的,故D不能作为判断酸性强弱的条件。
【互动探究】(1)二氧化硅与碳酸钠反应是氧化还原反应吗?
提示:不是,反应过程中元素的化合价都没有改变。
(2)如何证明碳酸的酸性比硅酸强?
提示:根据复分解反应中强酸能制弱酸的规律,可向硅酸钠溶液中通入二氧化碳,若有白色沉淀生成,就说明碳酸的酸性比硅酸强。
【变式训练】下列叙述中不正确的是( )
A.CO2与水反应生成碳酸,是酸性氧化物,SiO2不能与水反应生成相应的硅酸,不是酸性氧化物
B.C、Si的最外层电子数相同,而次外层电子数不同
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D.碳和硅元素的主要化合价是+4价和+2价
【解析】选A。酸性氧化物是与碱反应生成盐和水的氧化物,而不是与水反应生成酸的氧化物。碳原子的次外层有2个电子,硅原子次外层有8个电子,B对。CO2、SiO2均能与CaO反应生成盐,C对。碳、硅常见的化合价为+2价、+4价,D对。
【典例】含硅材料有广泛用途。
(1)氮化硅陶瓷是一种新型无机非金属材料,它的硬度大、熔点高,化学性质稳定。请回答下列问题。
①工业上普遍采用高纯度硅与纯氮在1 300 ℃反应获得,写出反应的化学方程式__________________。
②根据性质推测氮化硅的用途_____(填字母);
A.制气轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造轴承
(2)某硅酸盐样品中锌的质量分数为58.6%,其化学组成用氧化物形式可表示为nZnO·SiO2,则n值等于_____。
(3)下列有关硅材料的说法正确的是_____(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅熔点高,硬度大,可用于制作高温陶瓷
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.钢化玻璃通常用于制车窗玻璃,破碎时没有尖锐的棱角
【思路点拨】按照“性质决定用途”的思路解答,如氮化
硅强度大,熔点高,性质稳定,可用作耐磨材料。
【自主解答】(1)氮化硅中氮显-3价,硅显+4价,3Si+2N2
Si3N4;氮化硅是一种重要的结构材料,是一种超
硬材料,性质决定用途,A、C、D都是氮化硅的用途。
(2)65n/(81n+60)=58.6%,n=2。
(3)A项,碳化硅熔点高、性质稳定,可用于生产耐高温水
泥。B项,氮化硅熔点高,硬度大,可用于制作高温陶瓷或
轴承。D项,普通玻璃的主要成分是Na2SiO3、CaSiO3、
SiO2,属于混合物,无固定的熔点。
1 300 ℃
======
答案:(1)①3Si+2N2 Si3N4
②A、C、D
(2)2
(3)A、B、C、E
1 300 ℃
======
【互动探究】(1)若题中(2)中n=1,则该硅酸盐的化学式是什么?
提示:是ZnSiO3。
(2)普通玻璃与钢化玻璃的成分有区别吗?
提示:没有。钢化玻璃是将普通玻璃先骤热后再骤冷得到的,两者的成分没有区别。
【变式训练】下列表述正确的是( )
①太阳能电池可采用硅材料制造,其应用有利于环保、节能
②化学家采用玛瑙研钵研磨固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
A.②③ B.②④
C.①③④ D.①③
【解析】选C。太阳能电池无污染;玛瑙的主要成分是二氧化硅;水泥是硅酸盐产品;变色眼镜的有色玻璃片添加了某些有色物质。
【典例1】下列关于硅及硅的化合物的叙述中正确的是
A.粗硅制备时,发生的反应为:C+SiO2 Si+CO2↑
B.硅元素在地壳中的含量居第二位,自然界中既有游离态的硅,又有化合态的硅
C.水晶项链和瓷盘都是硅酸盐产品
D.二氧化硅是制造光导纤维的重要原料
【易错选项】A
高温
====
【易错剖析】(1)易错选项分析
本题易错选A的原因在于对基础知识掌握不牢,粗硅制备时
的反应原理是2C+SiO2 Si+2CO↑,产物中生成的是
CO,而不是CO2。
高温
====
(2)其他错误选项分析:
【标准答案】D
【典例2】下列有关硅的化合物说法正确的是
A.SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子
B.硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分
C.H2SiO3既可由SiO2溶于水制得,也可由Na2SiO3和其他酸(如盐酸)反应制得
D.SiO2是酸性氧化物,能和碱反应,不能和酸反应
【易错选项】A
【易错剖析】(1)易错选项分析
错选A的原因在于对SiO2这个化学式分析不到位。SiO2并不是说一个硅原子结合两个氧原子形成一个SiO2分子;正确的是SiO2是由硅原子和氧原子形成的立体网状结构,在这个网状结构中,硅原子与氧原子个数比是1∶2。
(2)其他错误选项分析
【标准答案】B
1.下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③
C.①④ D.③④
【解析】选C。光导纤维的成分是SiO2,③错;水晶的主要成分是SiO2,而不是硅酸盐,②错。硅酸盐是一些岩石的成分,①对,陶瓷的主要成分为硅酸盐,④对。
2.石灰石是许多工业的原料之一,但生产下列物质时不需要石灰石的是( )
A.硅酸 B.水泥
C.玻璃 D.生石灰
【解析】选A。硅酸的制取需要硅酸盐和较强的酸,不需要石灰石,A项符合题意。
3.对于化学方程式SiO2+3C SiC+2CO↑,有关叙述正确
的是( )
A.反应中SiO2是氧化剂,C是还原剂
B.硅元素被还原了,碳元素被氧化了
C.在反应中C既是氧化剂又是还原剂
D.在反应中氧化剂与还原剂的物质的量之比为2∶1
【解析】选C。从反应方程式可以看出,只有碳元素化合价
发生了变化,在反应中碳既是氧化剂又是还原剂,且氧化
剂和还原剂质量比为1∶2。
高温
====
4.(双选)2010年11月11日,乾隆官窑“青花红彩龙纹如意耳葫芦瓶”以8 344万元成交,创下国内瓷器拍卖最高纪录。瓷器是传统的无机硅酸盐产品,下列试剂可用于洗涤瓷器的是( )
A.烧碱溶液 B.氢氟酸
C.水 D.硝酸溶液
【解析】选C、D。瓷器的成分中含有二氧化硅,二氧化硅可与烧碱溶液、氢氟酸反应。
5.硅是重要的工业原料。
(1)写出工业制硅的化学方程式____________________。
(2)工业上由粗硅制取高纯硅有如下反应:
①Si(s)+3HCl(g) SiHCl3(g)+H2(g)(放热381 kJ)
②SiHCl3(g)+H2(g) Si(s)+3HCl(g)
对上述反应的说法,正确的是_____。
A.均为置换反应和氧化还原反应
B.反应①、②实际上互为可逆反应
C.由于反应①放热,则反应②一定吸热
D.由上述反应可知硅的还原性比氢气强
950 ℃
====
高温
====
【解析】工业上用炭还原二氧化硅制硅;从粗硅制取高纯硅的两反应分析,两反应均为置换反应,也必然是氧化还原反应。两反应条件不同,所以不是可逆反应。反应①放热,相反反应②必吸热。由方程式并不能比较出H2和硅还原性的强弱。
答案:(1)SiO2+2C Si+2CO↑
(2)A、C
高温
====
6.无机非金属材料分为传统无机非金属材料和新型无机非金属材料两类。
(1)硅酸盐材料是传统无机非金属材料,下列属于硅酸盐产品的是______________________________________。
①玻璃 ②陶瓷
③石英玻璃 ④硅芯片
⑤光导纤维 ⑥水泥
⑦砖瓦
(2)制造普通玻璃的主要原料是_____、_____、_____,发生的主要反应有________、________。
(3)水泥是重要的工业原料,据统计,2010年二季度我国水泥产量为51 262万吨,同比增长14.7%。水泥具有_____性,与水掺和搅拌并静置后,很容易凝固变硬。
(4)磷酸钙陶瓷是一种新型无机非金属材料,可用于制造人造骨骼,这是利用了这类材料具有_____。
A.耐高温的特性 B.电学特性
C.光学特性 D.生物功能
【解析】石英玻璃、光导纤维的主要成分都是二氧化硅,硅芯片是高纯度的硅;制造普通玻璃的主要原料有纯碱、石灰石、石英;水泥具有水硬性;磷酸钙陶瓷可用于人体,则是利用其生物功能。
答案:(1)①②⑥⑦
(2)纯碱 石灰石 石英
Na2CO3+SiO2 Na2SiO3+CO2↑
CaCO3+SiO2 CaSiO3+CO2↑
(3)水硬
(4)D
高温
====
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.在一定条件下,下列物质不能和SiO2反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸
⑤硝酸 ⑥氢氧化钾 ⑦氧化钙
A.③⑤⑦ B.⑤⑦ C.①⑤ D.⑤
【解析】选D。SiO2与焦炭反应生成硅,与纯碱、碳酸钙反应制玻璃,氢氟酸可雕刻玻璃,SiO2是酸性氧化物可与碱、碱性氧化物反应。
2.下列叙述中,正确的是( )
A.自然界中存在大量的单质硅、二氧化硅和硅酸盐
B.地壳中含量占第一、二位的两种元素组成的一种化合物为SiO2
C.除去SiO2中混有的Fe2O3杂质时可用氢氧化钠溶液充分洗涤后,过滤
D.硅酸钠溶液与盐酸不能反应
【解析】选B。自然界中不存在单质硅;地壳中含量占第一、二位的两种元素分别是O、Si;除去SiO2中混有的Fe2O3杂质时应用盐酸充分洗涤后,过滤;硅酸钠溶液与盐酸反应生成硅酸和氯化钠。
3.(2011·黄石高一检测)下列叙述正确的是( )
A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强
B.陶瓷、玻璃、水泥容器都能贮存氢氟酸
C.石灰抹墙、水泥砌墙的硬化过程原理相同
D.玻璃窑中出来的气体的主要成分是二氧化碳
【解析】选D。二氧化硅与碳酸钠反应放出二氧化碳,不能说明硅酸的酸性比碳酸强;陶瓷、玻璃的成分都含有二氧化硅,可与氢氟酸反应;石灰抹墙是氢氧化钙与二氧化碳反应生成碳酸钙,水泥砌墙是利用水泥具有水硬性;玻璃窑中二氧化硅分别与碳酸钙、碳酸钠反应都可生成二氧化碳气体。
4.兵马俑中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.易溶解于强酸和强碱
D.x等于6
【解析】选C。根据化合物中化合价的代数和为0,所以有2+2+4×2+(-2)×x=0,所以x=6,硅酸铜钡的化学式为BaCuSi2O6,写成氧化物形式为BaO·CuO·2SiO2,又因硅酸盐性质稳定,故C错。
【方法技巧】氧化物改写遵循原则
氧化物改写一般遵循“三不变”原则:元素化合价不变、元素种类不变和原子个数比不变。氧化物排列顺序一般是:金属氧化物·非金属氧化物·水
5.(双选)将过量CO2通入下列溶液中,能产生沉淀的是( )
A.CaCl2溶液
B.Ba(OH)2溶液
C.Na2CO3饱和溶液
D.Na2SiO3水溶液
【解析】选C、 D。A项中,弱酸(CO2水溶液)不能与强酸盐CaCl2发生复分解反应;B项中,少量CO2可与碱Ba(OH)2反应产生白色沉淀BaCO3,CO2过量时生成可溶性的Ba(HCO3)2;C项中,因在相同条件(温度)下,NaHCO3的溶解度小于Na2CO3,会发生反应Na2CO3+CO2+H2O====2NaHCO3↓,故会析出NaHCO3晶体;D项中,碳酸的酸性强于硅酸,有Na2SiO3
+CO2+H2O====H2SiO3↓+Na2CO3,生成白色的胶状沉淀。
二、非选择题(本题包括3小题,共30分)
6.(10分)硅是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题:
(1)硅在自然界最主要的存在形式是_____。
①硅单质 ②二氧化硅 ③硅酸盐
A.①② B.①③ C.②③ D.①②③
(2)如图为某玻璃上精美的花纹图案,雕刻此图案所用的刻蚀液为__________________________________________。
(3)诺贝尔物理奖得主之一——美籍华裔物理学家高锟被誉为“光纤之父”,光导纤维的使用,让人们的生活更加丰富精彩。_____是制备光导纤维的基本原料。
(4)硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源。与“氢能源”比较,“硅能源”具有_______等更加优越的特点,从而得到全球的关注和期待。
(5)三硅酸镁(2MgO·3SiO2·nH2O)被用来治疗胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。写出三硅酸镁与胃酸(盐酸)反应的化学方程式:_________。
【解析】硅在自然界中无游离态,全部以化合态的形式存在,最主要的存在形式是二氧化硅和硅酸盐;玻璃中含有二氧化硅,能与氢氟酸反应生成四氟化硅。光导纤维的主要成分是二氧化硅;三硅酸镁与胃酸反应生成氯化镁、二氧化硅和水。
答案:(1)C
(2)氢氟酸
(3)SiO2(或二氧化硅)
(4)便于储运,比较安全
(5)2MgO·3SiO2·nH2O+4HCl====2MgCl2+3SiO2+(n+2)H2O
7.(10分)已知含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物B可用于制造高性能的现代通讯材料——光导纤维,B与烧碱反应生成化合物C。将B与纯碱混合高温熔融时发生化学反应生成C和D。
(1)写出C的名称______。
(2)B与烧碱反应的化学方程式是____________________。
(3)写出生成D和C的化学反应方程式:_______________。
(4)将D通入C的水溶液,实验现象为_________________。
【解析】A元素单质可作半导体材料,含A元素的某化合物是制造光导纤维的原料,可知A为硅元素,B为SiO2,C为Na2SiO3,SiO2与纯碱高温时生成Na2SiO3和CO2,CO2与Na2SiO3溶液反应生成白色沉淀硅酸。
答案:(1)硅酸钠
(2)SiO2+2NaOH====Na2SiO3+H2O
(3)SiO2+Na2CO3 Na2SiO3+CO2↑
(4)产生白色沉淀
高温
====
8.(10分)(挑战能力)用多种方法鉴别下列第一组白色粉末物质(注:①能够写化学方程式的写出化学反应方程式;
②鉴别方法可以不用填满,若序号不够也可以自己再添)。
(1)Na2CO3和SiO2
①__________________________________________;
②__________________________________________;
③__________________________________________。
(2)欲鉴别CaCO3和Na2SiO3,某同学分别取少许待测粉末,滴加稀盐酸,指出他观察到的现象:
CaCO3_______________________________________;
Na2SiO3_____________________________________。
【解析】(1)①可利用加水溶解的办法,能溶于水的是Na2CO3,不溶于水的是SiO2。
②焰色反应法:焰色反应为黄色的是Na2CO3,余者为SiO2。
③酸液产气法:分别取少许待测粉末,滴加稀盐酸,能够产生气体的是Na2CO3;不反应的是SiO2。化学方程式:Na2CO3+2HCl====2NaCl+H2O+CO2↑
(2)分别取少许待测粉末,滴加稀盐酸,CaCO3能够产生气泡,Na2SiO3能产生白色沉淀。
答案:(1)①加水溶解法:能溶于水的是Na2CO3,不溶于水的是SiO2
②焰色反应法:焰色反应为黄色的是Na2CO3,余者为SiO2
③酸液产气法:分别取少许待测粉末,滴加稀盐酸,能够产生气体的是Na2CO3;不反应的是SiO2。化学方程式:Na2CO3+2HCl====2NaCl+H2O+CO2↑
(2)产生气泡 产生白色沉淀
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用炭还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3;
Si+3HCl====SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。(已知SiHCl3能与H2O剧烈反应,在空气中易自燃。)
用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去);
【思考探究】
(1)请写出第①步制备粗硅、装置D中发生反应的化学反应
方程式,并指出三个步骤中发生的反应属于置换反应的是
哪几个?
提示:在高温条件下,用C还原SiO2生成CO和粗硅,化学反
应为2C+SiO2 2CO↑+Si;据步骤③可写出装置D中发生
的反应为SiHCl3+H2 Si+3HCl。所以三个步骤
中发生的反应都属于置换反应。
高温
====
1 000~1 100 ℃
===========
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点
33.0 ℃)中含有少量SiCl3(沸点57.6 ℃)和HCl(沸点
-84.7 ℃),那么该如何提纯SiHCl3
提示:分离、提纯不同沸点的液体可以采用分馏或蒸馏的方法。
(3)装置B中的试剂是什么?其作用是什么?
提示:用Zn、稀硫酸制得的H2中会混有少量H2O,而SiHCl3能与H2O剧烈反应,所以要进行干燥,根据装置应选择液态干燥剂浓硫酸。
(4)为保证制备纯硅实验的成功,操作的关键之一是控制好反应温度,除此之外还应注意什么?
提示:首先要检查实验装置的气密性,同时因为SiHCl3在空气中易自燃,实验中还要注意先通一段时间H2以排尽装置中的空气。
