11-12版高中化学全程学习方略配套课件:1.3.2 气体摩尔体积(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:1.3.2 气体摩尔体积(鲁科版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-14 00:00:00 | ||
图片预览











文档简介
(共101张PPT)
【典例1】下列叙述中,正确的是
A.1 mol H2的质量只有在标准状况下才约为2 g
B.在标准状况下某气体的体积是22.4 L,则可认为该气体的物质的量约是1 mol
C.在20 ℃时,1 mol的任何气体的体积总比22.4 L大
D.1 mol H2和O2的混合气体,在标准状况下的体积是
44.8 L
【思路点拨】解答本题应注意以下两点:
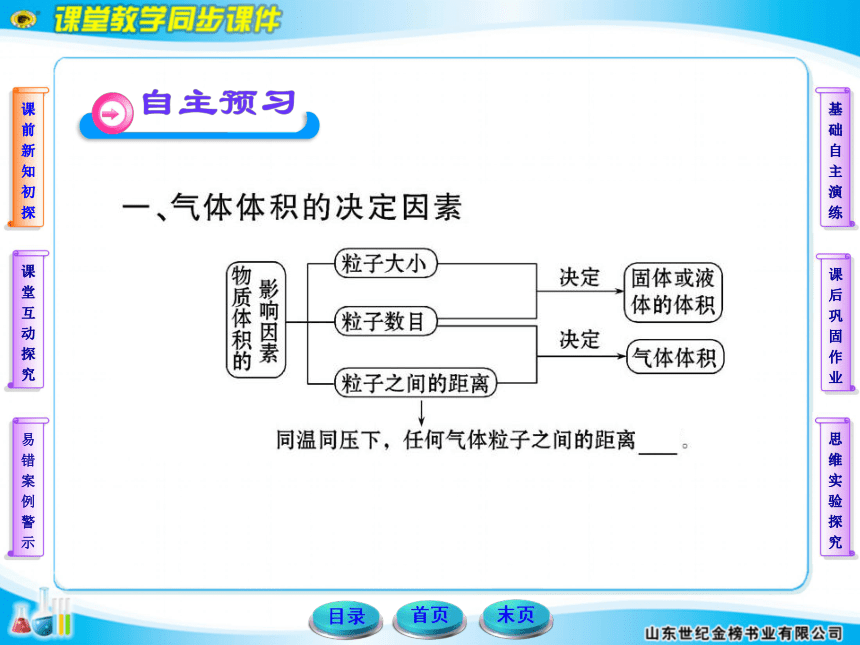
(1)气体的质量、物质的量与温度、压强无关。
(2)应用气体摩尔体积22.4 L·mol-1计算时,应注意是标
准状况下的气体。
【自主解答】选B。气体的质量只与气体的摩尔质量和气体
的物质的量有关,与气体的温度、压强无关,A选项不正
确;22.4 L·mol-1是在特定条件下的气体摩尔体积,所以
在标准状况下,某气体的体积是22.4 L,则可以认为该气
体的物质的量约是1 mol,B选项正确;由于气体摩尔体
积与气体的温度、压强有关,因此仅温度确定,而压强不定,1 mol气体的体积自然不能确定,也就是说在20 ℃时,1 mol的任何气体的体积可能比22.4 L大,也可能比22.4 L小,还可能等于22.4 L,C选项不正确;在标准状况下,1 mol任何气体(可以是纯净气体,也可以是混合气体)的体积都约是22.4 L,包括混合气体, D项错误。
【互动探究】上述C项改成“在20 ℃,1个大气压时,1 mol的任何气体的体积总比22.4 L大”是否正确?
提示:正确。该状况下与标准状况下的大气压相同,但是温度比标准状况下的温度高,而温度升高,气体分子间的平均距离要变大,所以气体体积变大。
【变式训练】下列叙述正确的是( )
A.气体的摩尔体积为22.4 L/mol
B.1 mol O2的质量为32 g,它所占的体积是22.4 L
C.标准状况下,1 mol H2O所占的体积是22.4 L
D.标准状况下,22.4 L的任何气体的物质的量都是1 mol
【解析】选D。在标准状况下气体摩尔体积为
22.4 L/mol,A项没有指出所处的状况,A项错误;1 mol O2的质量为32 g,B项未指明是在标准状况下,故它所占的体积不一定是22.4 L,B项错误;气体摩尔体积仅适用于气体,水在标准状况下不是气体,C项错误。
【典例2】(双选)两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温、同压下,两容器内的气体一定具有相同的
A.原子总数 B.质子总数
C.分子总数 D.质量
【思路点拨】解本题的关键点有两个:
【自主解答】选A、C。由阿伏加德罗定律可知,在同温、同压下,同体积的任何气体含有相同的分子数,故两容器内分子总数相等。由于3种气体都是双原子分子,故原子总数一定相等。又由于N和O原子的质子数和摩尔质量不同,则质子总数和质量不一定相同,只有当N2和O2的物质的量之比为1∶1时,两容器内质子总数和质量才相同。
【互动探究】若把题设条件改成“另一个盛有等物质的量的N2和O2”,则选择项应该是什么?
提示:若把题设改成“另一个盛有等物质的量的N2和O2”,则由于等物质的量的两种气体恰好反应生成与第一个容器体积相等的NO气体,所以选择项中的四个选项均为正确选项。
【变式训练】在同温同压下,分子数目相同的任意两种气体,下列说法正确的是( )
A.体积都是22.4 L B.密度相同
C.所占的体积相同 D.原子数目一定相同
【解析】选C。“同温同压”不一定指标准状况,“分子数目相同”不能确定具体的物质的量,无法算出准确体积,故A错误;同温同压,密度之比等于相对分子质量之比,两种气体的相对分子质量不一定相等,B项错;同温同压下,相同体积的任何气体的分子数相同,C项正确;气体的分子式不确定,原子数目也能不确定,D项错误。
【典例】(2011·绍兴高一检测)在一定条件下,某化合物X受热分解:
2X A↑+2B↑+4C↑
测得反应后生成的混合气体对H2的相对密度为11.43,在相同条件下,X的相对分子质量是
A.11.43 B.22.85 C.80.01 D.160.02
△
====
【思路点拨】根据相对密度求混合气体的平均相对分子质量→根据质量守恒求2 mol X的质量→X的相对分子质量。
【自主解答】选C。根据质量守恒定律,2 mol X生成7 mol混合气体,X的摩尔质量为
【互动探究】如何通过相对密度求算混合气体的平均相对分子质量?
提示:由阿伏加德罗定律的推论可得:同温、同压下:ρ1/ρ2=M1/M2 =ρ(相对),所以知道相对密度只需要用M1=M2ρ(相对),即可求出相对分子质量。
【变式训练】(2011·延边高一检测)同温同压下,某容器充满O2重116 g,若充满N2重114 g。现充满某气体重
122 g,则该气体的相对分子质量为( )
A.16 B.44 C.32 D.28
【解析】选B。解答本题关键是容器质量不变体积不变,再
根据阿伏加德罗定律推论:同温同压下,相同体积的气体
具有相同物质的量,可得: =
,解得m(容器)=100 g,
则n(气体)= ,
则M(气体)= ,
故该气体的相对分子质量为44。
【典例】下列说法中正确的是
A.标准状况下,33.6 L H2O含有9.03×1023个H2O分子
B.常温常压下,2 g氢气含有的原子数为1.204×1024个
C.同温同压下,相同体积的任何气体所含的原子数相等
D.22.4 L气体所含分子数一定大于11.2 L气体所含分子数
【易错选项】D
【易错剖析】(1)易错选项分析
本题易错选D的原因在于忽略了气体体积大小主要取决于气体分子之间平均距离的大小,而气体分子之间平均距离的大小又与温度和压强有关,在未指明温度和压强的情况下,气体体积大小及所含分子数的多少是无法进行比较的。上述D项说法中未指明气体体积是否在相同条件下测定,所以错误。
(2)其他错误选项分析:
【标准答案】B
1.下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由气体的物质的量的多少决定
C.气体摩尔体积是指1 mol 任何气体所占的体积为22.4 L
D.不同的气体,若体积相等,则它们所含的分子数一定相等
【解析】选B。一定温度和压强下,气体体积主要由其物质的量决定;气体摩尔体积是指在一定的温度和压强下,单位物质的量的气体所占的体积,其不一定是22.4 L;不同的气体,体积相等时,物质的量不一定相等,因为不一定在相同状况下,所以分子数也不一定相等。
2.(2011·合肥高一检测)下列叙述正确的是( )
A.1 mol H2O的质量为18 g/mol
B.CH4的摩尔质量为16 g
C.3.01×1023个SO2分子的质量为32 g
D.标准状况下,1 mol任何物质的体积均为22.4 L
【解析】选C。质量的单位为g,而不是g·mol-1,A错;摩尔质量的单位为g·mol-1而不是g,B错;3.01×1023个SO2分子的物质的量为0.5 mol,则质量为0.5 mol×64 g·mol-1
=32 g,C正确;标准状况下1 mol任何“气体”的体积均为22.4 L,而非“物质”,D不正确。
3.NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.标准状况下,相同体积的氢气与水所含的分子数目相同
B.标准状况下,22.4 L以任意比混合的氢气、二氧化碳的混合气体所含的分子数为NA
C.常温常压下,铁与盐酸发生置换反应,生成22.4 L氢气,则参加反应的铁原子的个数为NA
D.标准状况下,22.4 L He所含核外电子数为4NA
【解析】选B。
4.(2011·成都高一检测)在体积相同的两个密闭容器中分别充满O2和O3气体,当这两个密闭容器中温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子数相等
D.两种气体的氧原子数相等
【解析】选D。由m=ρV可知,体积和密度均相同的O2和O3质量也相等。
N(O2)∶N(O3)=n(O2)∶n(O3)
设m(O2)=m(O3)=x
O2中N(O)=N(O2)×2
O3中N(O)=N(O3)×3
故两种气体的原子数相等,T和V相同,则
p(O2)∶p(O3)=n(O2)∶n(O3)=3∶2
5.下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 L HCl和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③④ B.②③⑥⑦⑧
C.⑤⑥⑦⑧ D.④⑦⑧
【解析】选D。
综合以上分析,答案选D。
6.(1)2 mol O2和3 mol O2的质量之比为_____,分子数之比为_____,同温同压的密度之比为_____,含氧原子数之比为_____,同温同压的体积之比为_____。
(2)气体化合物A分子式可表示为OxFy,已知同温同压下
10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为_____,推断的依据为_____________。
【解析】(1)本题考查的是物质的量的应用,根据物质的量
与其他量的关系把物质的量转化成要求的量,还考查了阿
伏加德罗定律的运用,运用时注意所处的条件。
(2)根据质量守恒定律和阿伏加德罗定律,写出分解方程式
为2OxFy 3O2+2F2,则A的化学式为O3F2。
答案:(1)2∶3 2∶3 1∶1 2∶3 2∶3
(2)O3F2 阿伏加德罗定律和质量守恒定律
△
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列说法正确的是( )
A.1 mol任何气体的体积都约是22.4 L
B.20 ℃,1.0×105 Pa,同体积的O2、CO2含有相同的分子数
C.1 mol气态物质,当体积为22.4 L时,该气体一定处于标准状况
D.2 mol气体体积约为44.8 L
【解析】选B。A、D中未指明是否在标准状况下,无法计算;根据阿伏加德罗定律,同温同压下,同体积的任何气体都含有相同数目的分子,故B正确;C中,1 mol气态物质在非标准状况时,体积也有可能等于22.4 L。
2.同温同压下,等质量的下列气体所占有的体积最大的是
( )
A.O2 B.CH4 C.CO2 D.SO2
【解析】选B。质量相等的气体,摩尔质量越小,其物质的量越大,同温同压下所占有的体积越大。四个选项中CH4的摩尔质量最小,所以选B。
3.下列各组中两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2
B.质量相等、密度不等的N2和CO
C.体积相同、压强相等的CO和N2
D.压强相同、体积相同的O2和H2
【解析】选B。A中温度、体积相同时,压强不一定相同,所以A不正确。B中质量相等,由于N2和CO的摩尔质量相等,根据公式n=m/M可知,两者的物质的量一定相等,所以分子数一定相等。C中温度不一定相等,所以两者在体积相等的条件下分子数不一定相等。D项同C项的原理相同。综合以上分析,答案选B。
4.(2011·福州高一检测)下列说法正确的是( )
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含有阿伏加德罗常数个氮分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g CO2与标准状况下11.2 L HCl含有相同的分子数
【解析】选D。A项,32 g O2的体积只有在标准状况下才约是22.4 L;B项,22.4 L N2只有在标准状况下,其物质的量才是1 mol,才含有阿伏加德罗常数个氮分子;C项,标准状况下,水不是气体,22.4 L水的物质的量不是1 mol,质量不是18 g;D项,22 g CO2和标准状况下11.2 L HCl的物质的量相等,含有相同的分子数。
5.下列说法不正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温、常压下,11.2 L氯气中含有的分子数小于0.5NA
B.在常温、常压下,氦气为1 mol时含有的原子数为NA
C.32 g氧气所含电子数为16NA
D.28 g CO和CO2的混合物含有的分子数为NA
【解析】选D。A项,常温是25 ℃,对于气体,温度越高,
分子间的距离越大,体积越大。所以常温常压下11.2 L氯
气若在标准状况下,其体积小于11.2 L,物质的量小于
0.5 mol,分子数小于0.5NA;B项,氦气是单原子分子,
1 mol氦气含NA个原子;C项,32 g氧气的物质的量为
1 mol,1个O2分子含16个电子,所以C项正确;CO和CO2的
混合气体的平均摩尔质量大于28 g·mol-1,所以28 g混合
气体的物质的量小于1 mol,分子数小于NA。
二、非选择题(本题包括3小题,共30分)
6.(8分)(2011·绍兴高一检测)(1)质量相等的HCl、CO2、
NH3、CH4四种气体中,含有分子数由多到少的顺序是___,
在相同温度和相同压强条件下,体积最大的是___。
(2)2 g H2所含原子的数目是_____,标准状况下的体积是
_____L。
(3)在一定温度和压强下,30体积气体A2跟10体积的气体B2
化合生成20体积某气体C,则该反应的化学方程式为(气体C
的化学式用A、B表示)________________。
【解析】(1)由于四种气体质量相等,由n= 可得,摩尔
质量越大,物质的量越小,所含分子数目就越少,则分子
数目由多到少的顺序是CH4>NH3>HCl>CO2,同温同压下,
体积之比等于物质的量之比,则体积最大的是CH4。
(2)2 g H2的物质的量为: =1 mol,又由于H2是双
原子分子,则原子数为:1 mol×2×6.02×1023 mol-1
=1.204×1024
标准状况下体积:1 mol×22.4 L·mol-1=22.4 L
(3)根据阿伏加德罗定律推论可知,同温同压下体积之比等于物质的量之比等于分子数之比,则由题可知,
N(A2)∶N(B2)∶N(C)=3∶1∶2。则由质量守恒定律可得方程式为:3A2+B2====2A3B。
答案:(1)CH4>NH3>HCl>CO2 CH4
(2)1.204×1024 22.4
(3)3A2+B2====2A3B
7.(10分)标准状况下的甲烷和一氧化碳的混合气体
8.96 L,其质量为7.60 g,则混合气体平均相对分子质量为_____;混合气体中甲烷的体积为_____;一氧化碳的质量为_____。
【解析】混合气体的物质的量为 =0.4 mol,
,平均相对分子质量为19,设
CO的物质的量为x,则有:
7.60 g=x×28 g·mol-1+(0.4 mol-x)×16 g·mol-1,求得
x=0.1 mol。
n(CH4)=0.3 mol,V(CH4)=6.72 L,
m(CO)=0.1 mol×28 g·mol-1=2.8 g。
答案:19 6.72 L 2.8 g
8.(12分)(挑战能力)一定量的液态化合物XY2,在一定量O2中恰好完全反应:XY2(l)+3O2(g)====XO2(g)+2YO2(g),冷却后在标准状况下,测得生成物的体积为672 mL,则:
(1)反应前O2的体积是_____mL;
(2)化合物XY2的物质的量是_____;
(3)在XY2分子中,X、Y两元素质量比为3∶16,则X、Y两元素相对原子质量之比为______。
【解析】由方程式可知:反应前后气体体积不变,所以反
应前氧气体积为672 mL。
n(XY2)= =0.01 mol。
设X、Y的摩尔质量分别为x、y,由XY2中X、Y质量比为
3∶16得: =1∶2,故
答案:(1)672 (2)0.01 mol (3)3∶8
【实验设计】已知化学反应:S(s)+O2(g) SO2(g),加
热使硫粉与O2反应,冷却至室温时观察水银柱变化,通过
水银柱是否变化确定大试管中气体体积与分子数之间的关
系。
【实验用品】大试管、带弯曲玻璃管的橡皮塞、铁架台、
酒精灯、研细的硫粉、氧气、水银、红笔。
点燃
====
【实验装置及步骤】
(1)将如图装置装好后固定到铁架台上。
待内外气体压强不再变化时,用红笔在
玻璃管上标出水银柱液面刻度。
(2)用酒精灯加热试管底部,可以看到研
细的硫粉在试管中燃烧,当瓶中氧气消耗
完时火焰熄灭。已知该反应是放热反应。
(3)反应结束后,让其自然冷却。
【思考探究】
(1)保证本实验成功的关键是什么?
提示:应保证装置气密性良好。
(2)硫粉在大试管中充分燃烧后,水银柱液面如何变化?
提示:水银柱左管液面上升,右管液面下降。
(3)大试管自然冷却到室温,水银柱液面如何变化?
提示:水银柱液面又回到原来标定的刻度。
(4)硫粉燃烧后,再恢复到室温时,水银柱液面和硫粉燃烧前相同。据此,你能得出什么样的结论?
提示:相同温度和压强下,相同体积的任何气体都具有相同的分子数。(合理即可)
【典例1】下列叙述中,正确的是
A.1 mol H2的质量只有在标准状况下才约为2 g
B.在标准状况下某气体的体积是22.4 L,则可认为该气体的物质的量约是1 mol
C.在20 ℃时,1 mol的任何气体的体积总比22.4 L大
D.1 mol H2和O2的混合气体,在标准状况下的体积是
44.8 L
【思路点拨】解答本题应注意以下两点:
(1)气体的质量、物质的量与温度、压强无关。
(2)应用气体摩尔体积22.4 L·mol-1计算时,应注意是标
准状况下的气体。
【自主解答】选B。气体的质量只与气体的摩尔质量和气体
的物质的量有关,与气体的温度、压强无关,A选项不正
确;22.4 L·mol-1是在特定条件下的气体摩尔体积,所以
在标准状况下,某气体的体积是22.4 L,则可以认为该气
体的物质的量约是1 mol,B选项正确;由于气体摩尔体
积与气体的温度、压强有关,因此仅温度确定,而压强不定,1 mol气体的体积自然不能确定,也就是说在20 ℃时,1 mol的任何气体的体积可能比22.4 L大,也可能比22.4 L小,还可能等于22.4 L,C选项不正确;在标准状况下,1 mol任何气体(可以是纯净气体,也可以是混合气体)的体积都约是22.4 L,包括混合气体, D项错误。
【互动探究】上述C项改成“在20 ℃,1个大气压时,1 mol的任何气体的体积总比22.4 L大”是否正确?
提示:正确。该状况下与标准状况下的大气压相同,但是温度比标准状况下的温度高,而温度升高,气体分子间的平均距离要变大,所以气体体积变大。
【变式训练】下列叙述正确的是( )
A.气体的摩尔体积为22.4 L/mol
B.1 mol O2的质量为32 g,它所占的体积是22.4 L
C.标准状况下,1 mol H2O所占的体积是22.4 L
D.标准状况下,22.4 L的任何气体的物质的量都是1 mol
【解析】选D。在标准状况下气体摩尔体积为
22.4 L/mol,A项没有指出所处的状况,A项错误;1 mol O2的质量为32 g,B项未指明是在标准状况下,故它所占的体积不一定是22.4 L,B项错误;气体摩尔体积仅适用于气体,水在标准状况下不是气体,C项错误。
【典例2】(双选)两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温、同压下,两容器内的气体一定具有相同的
A.原子总数 B.质子总数
C.分子总数 D.质量
【思路点拨】解本题的关键点有两个:
【自主解答】选A、C。由阿伏加德罗定律可知,在同温、同压下,同体积的任何气体含有相同的分子数,故两容器内分子总数相等。由于3种气体都是双原子分子,故原子总数一定相等。又由于N和O原子的质子数和摩尔质量不同,则质子总数和质量不一定相同,只有当N2和O2的物质的量之比为1∶1时,两容器内质子总数和质量才相同。
【互动探究】若把题设条件改成“另一个盛有等物质的量的N2和O2”,则选择项应该是什么?
提示:若把题设改成“另一个盛有等物质的量的N2和O2”,则由于等物质的量的两种气体恰好反应生成与第一个容器体积相等的NO气体,所以选择项中的四个选项均为正确选项。
【变式训练】在同温同压下,分子数目相同的任意两种气体,下列说法正确的是( )
A.体积都是22.4 L B.密度相同
C.所占的体积相同 D.原子数目一定相同
【解析】选C。“同温同压”不一定指标准状况,“分子数目相同”不能确定具体的物质的量,无法算出准确体积,故A错误;同温同压,密度之比等于相对分子质量之比,两种气体的相对分子质量不一定相等,B项错;同温同压下,相同体积的任何气体的分子数相同,C项正确;气体的分子式不确定,原子数目也能不确定,D项错误。
【典例】(2011·绍兴高一检测)在一定条件下,某化合物X受热分解:
2X A↑+2B↑+4C↑
测得反应后生成的混合气体对H2的相对密度为11.43,在相同条件下,X的相对分子质量是
A.11.43 B.22.85 C.80.01 D.160.02
△
====
【思路点拨】根据相对密度求混合气体的平均相对分子质量→根据质量守恒求2 mol X的质量→X的相对分子质量。
【自主解答】选C。根据质量守恒定律,2 mol X生成7 mol混合气体,X的摩尔质量为
【互动探究】如何通过相对密度求算混合气体的平均相对分子质量?
提示:由阿伏加德罗定律的推论可得:同温、同压下:ρ1/ρ2=M1/M2 =ρ(相对),所以知道相对密度只需要用M1=M2ρ(相对),即可求出相对分子质量。
【变式训练】(2011·延边高一检测)同温同压下,某容器充满O2重116 g,若充满N2重114 g。现充满某气体重
122 g,则该气体的相对分子质量为( )
A.16 B.44 C.32 D.28
【解析】选B。解答本题关键是容器质量不变体积不变,再
根据阿伏加德罗定律推论:同温同压下,相同体积的气体
具有相同物质的量,可得: =
,解得m(容器)=100 g,
则n(气体)= ,
则M(气体)= ,
故该气体的相对分子质量为44。
【典例】下列说法中正确的是
A.标准状况下,33.6 L H2O含有9.03×1023个H2O分子
B.常温常压下,2 g氢气含有的原子数为1.204×1024个
C.同温同压下,相同体积的任何气体所含的原子数相等
D.22.4 L气体所含分子数一定大于11.2 L气体所含分子数
【易错选项】D
【易错剖析】(1)易错选项分析
本题易错选D的原因在于忽略了气体体积大小主要取决于气体分子之间平均距离的大小,而气体分子之间平均距离的大小又与温度和压强有关,在未指明温度和压强的情况下,气体体积大小及所含分子数的多少是无法进行比较的。上述D项说法中未指明气体体积是否在相同条件下测定,所以错误。
(2)其他错误选项分析:
【标准答案】B
1.下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由气体的物质的量的多少决定
C.气体摩尔体积是指1 mol 任何气体所占的体积为22.4 L
D.不同的气体,若体积相等,则它们所含的分子数一定相等
【解析】选B。一定温度和压强下,气体体积主要由其物质的量决定;气体摩尔体积是指在一定的温度和压强下,单位物质的量的气体所占的体积,其不一定是22.4 L;不同的气体,体积相等时,物质的量不一定相等,因为不一定在相同状况下,所以分子数也不一定相等。
2.(2011·合肥高一检测)下列叙述正确的是( )
A.1 mol H2O的质量为18 g/mol
B.CH4的摩尔质量为16 g
C.3.01×1023个SO2分子的质量为32 g
D.标准状况下,1 mol任何物质的体积均为22.4 L
【解析】选C。质量的单位为g,而不是g·mol-1,A错;摩尔质量的单位为g·mol-1而不是g,B错;3.01×1023个SO2分子的物质的量为0.5 mol,则质量为0.5 mol×64 g·mol-1
=32 g,C正确;标准状况下1 mol任何“气体”的体积均为22.4 L,而非“物质”,D不正确。
3.NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.标准状况下,相同体积的氢气与水所含的分子数目相同
B.标准状况下,22.4 L以任意比混合的氢气、二氧化碳的混合气体所含的分子数为NA
C.常温常压下,铁与盐酸发生置换反应,生成22.4 L氢气,则参加反应的铁原子的个数为NA
D.标准状况下,22.4 L He所含核外电子数为4NA
【解析】选B。
4.(2011·成都高一检测)在体积相同的两个密闭容器中分别充满O2和O3气体,当这两个密闭容器中温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子数相等
D.两种气体的氧原子数相等
【解析】选D。由m=ρV可知,体积和密度均相同的O2和O3质量也相等。
N(O2)∶N(O3)=n(O2)∶n(O3)
设m(O2)=m(O3)=x
O2中N(O)=N(O2)×2
O3中N(O)=N(O3)×3
故两种气体的原子数相等,T和V相同,则
p(O2)∶p(O3)=n(O2)∶n(O3)=3∶2
5.下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 L HCl和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③④ B.②③⑥⑦⑧
C.⑤⑥⑦⑧ D.④⑦⑧
【解析】选D。
综合以上分析,答案选D。
6.(1)2 mol O2和3 mol O2的质量之比为_____,分子数之比为_____,同温同压的密度之比为_____,含氧原子数之比为_____,同温同压的体积之比为_____。
(2)气体化合物A分子式可表示为OxFy,已知同温同压下
10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为_____,推断的依据为_____________。
【解析】(1)本题考查的是物质的量的应用,根据物质的量
与其他量的关系把物质的量转化成要求的量,还考查了阿
伏加德罗定律的运用,运用时注意所处的条件。
(2)根据质量守恒定律和阿伏加德罗定律,写出分解方程式
为2OxFy 3O2+2F2,则A的化学式为O3F2。
答案:(1)2∶3 2∶3 1∶1 2∶3 2∶3
(2)O3F2 阿伏加德罗定律和质量守恒定律
△
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列说法正确的是( )
A.1 mol任何气体的体积都约是22.4 L
B.20 ℃,1.0×105 Pa,同体积的O2、CO2含有相同的分子数
C.1 mol气态物质,当体积为22.4 L时,该气体一定处于标准状况
D.2 mol气体体积约为44.8 L
【解析】选B。A、D中未指明是否在标准状况下,无法计算;根据阿伏加德罗定律,同温同压下,同体积的任何气体都含有相同数目的分子,故B正确;C中,1 mol气态物质在非标准状况时,体积也有可能等于22.4 L。
2.同温同压下,等质量的下列气体所占有的体积最大的是
( )
A.O2 B.CH4 C.CO2 D.SO2
【解析】选B。质量相等的气体,摩尔质量越小,其物质的量越大,同温同压下所占有的体积越大。四个选项中CH4的摩尔质量最小,所以选B。
3.下列各组中两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2
B.质量相等、密度不等的N2和CO
C.体积相同、压强相等的CO和N2
D.压强相同、体积相同的O2和H2
【解析】选B。A中温度、体积相同时,压强不一定相同,所以A不正确。B中质量相等,由于N2和CO的摩尔质量相等,根据公式n=m/M可知,两者的物质的量一定相等,所以分子数一定相等。C中温度不一定相等,所以两者在体积相等的条件下分子数不一定相等。D项同C项的原理相同。综合以上分析,答案选B。
4.(2011·福州高一检测)下列说法正确的是( )
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含有阿伏加德罗常数个氮分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g CO2与标准状况下11.2 L HCl含有相同的分子数
【解析】选D。A项,32 g O2的体积只有在标准状况下才约是22.4 L;B项,22.4 L N2只有在标准状况下,其物质的量才是1 mol,才含有阿伏加德罗常数个氮分子;C项,标准状况下,水不是气体,22.4 L水的物质的量不是1 mol,质量不是18 g;D项,22 g CO2和标准状况下11.2 L HCl的物质的量相等,含有相同的分子数。
5.下列说法不正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温、常压下,11.2 L氯气中含有的分子数小于0.5NA
B.在常温、常压下,氦气为1 mol时含有的原子数为NA
C.32 g氧气所含电子数为16NA
D.28 g CO和CO2的混合物含有的分子数为NA
【解析】选D。A项,常温是25 ℃,对于气体,温度越高,
分子间的距离越大,体积越大。所以常温常压下11.2 L氯
气若在标准状况下,其体积小于11.2 L,物质的量小于
0.5 mol,分子数小于0.5NA;B项,氦气是单原子分子,
1 mol氦气含NA个原子;C项,32 g氧气的物质的量为
1 mol,1个O2分子含16个电子,所以C项正确;CO和CO2的
混合气体的平均摩尔质量大于28 g·mol-1,所以28 g混合
气体的物质的量小于1 mol,分子数小于NA。
二、非选择题(本题包括3小题,共30分)
6.(8分)(2011·绍兴高一检测)(1)质量相等的HCl、CO2、
NH3、CH4四种气体中,含有分子数由多到少的顺序是___,
在相同温度和相同压强条件下,体积最大的是___。
(2)2 g H2所含原子的数目是_____,标准状况下的体积是
_____L。
(3)在一定温度和压强下,30体积气体A2跟10体积的气体B2
化合生成20体积某气体C,则该反应的化学方程式为(气体C
的化学式用A、B表示)________________。
【解析】(1)由于四种气体质量相等,由n= 可得,摩尔
质量越大,物质的量越小,所含分子数目就越少,则分子
数目由多到少的顺序是CH4>NH3>HCl>CO2,同温同压下,
体积之比等于物质的量之比,则体积最大的是CH4。
(2)2 g H2的物质的量为: =1 mol,又由于H2是双
原子分子,则原子数为:1 mol×2×6.02×1023 mol-1
=1.204×1024
标准状况下体积:1 mol×22.4 L·mol-1=22.4 L
(3)根据阿伏加德罗定律推论可知,同温同压下体积之比等于物质的量之比等于分子数之比,则由题可知,
N(A2)∶N(B2)∶N(C)=3∶1∶2。则由质量守恒定律可得方程式为:3A2+B2====2A3B。
答案:(1)CH4>NH3>HCl>CO2 CH4
(2)1.204×1024 22.4
(3)3A2+B2====2A3B
7.(10分)标准状况下的甲烷和一氧化碳的混合气体
8.96 L,其质量为7.60 g,则混合气体平均相对分子质量为_____;混合气体中甲烷的体积为_____;一氧化碳的质量为_____。
【解析】混合气体的物质的量为 =0.4 mol,
,平均相对分子质量为19,设
CO的物质的量为x,则有:
7.60 g=x×28 g·mol-1+(0.4 mol-x)×16 g·mol-1,求得
x=0.1 mol。
n(CH4)=0.3 mol,V(CH4)=6.72 L,
m(CO)=0.1 mol×28 g·mol-1=2.8 g。
答案:19 6.72 L 2.8 g
8.(12分)(挑战能力)一定量的液态化合物XY2,在一定量O2中恰好完全反应:XY2(l)+3O2(g)====XO2(g)+2YO2(g),冷却后在标准状况下,测得生成物的体积为672 mL,则:
(1)反应前O2的体积是_____mL;
(2)化合物XY2的物质的量是_____;
(3)在XY2分子中,X、Y两元素质量比为3∶16,则X、Y两元素相对原子质量之比为______。
【解析】由方程式可知:反应前后气体体积不变,所以反
应前氧气体积为672 mL。
n(XY2)= =0.01 mol。
设X、Y的摩尔质量分别为x、y,由XY2中X、Y质量比为
3∶16得: =1∶2,故
答案:(1)672 (2)0.01 mol (3)3∶8
【实验设计】已知化学反应:S(s)+O2(g) SO2(g),加
热使硫粉与O2反应,冷却至室温时观察水银柱变化,通过
水银柱是否变化确定大试管中气体体积与分子数之间的关
系。
【实验用品】大试管、带弯曲玻璃管的橡皮塞、铁架台、
酒精灯、研细的硫粉、氧气、水银、红笔。
点燃
====
【实验装置及步骤】
(1)将如图装置装好后固定到铁架台上。
待内外气体压强不再变化时,用红笔在
玻璃管上标出水银柱液面刻度。
(2)用酒精灯加热试管底部,可以看到研
细的硫粉在试管中燃烧,当瓶中氧气消耗
完时火焰熄灭。已知该反应是放热反应。
(3)反应结束后,让其自然冷却。
【思考探究】
(1)保证本实验成功的关键是什么?
提示:应保证装置气密性良好。
(2)硫粉在大试管中充分燃烧后,水银柱液面如何变化?
提示:水银柱左管液面上升,右管液面下降。
(3)大试管自然冷却到室温,水银柱液面如何变化?
提示:水银柱液面又回到原来标定的刻度。
(4)硫粉燃烧后,再恢复到室温时,水银柱液面和硫粉燃烧前相同。据此,你能得出什么样的结论?
提示:相同温度和压强下,相同体积的任何气体都具有相同的分子数。(合理即可)
