11-12版高中化学全程学习方略配套课件:2.2.2电解质在水溶液中的反应(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:2.2.2电解质在水溶液中的反应(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-14 08:53:45 | ||
图片预览











文档简介
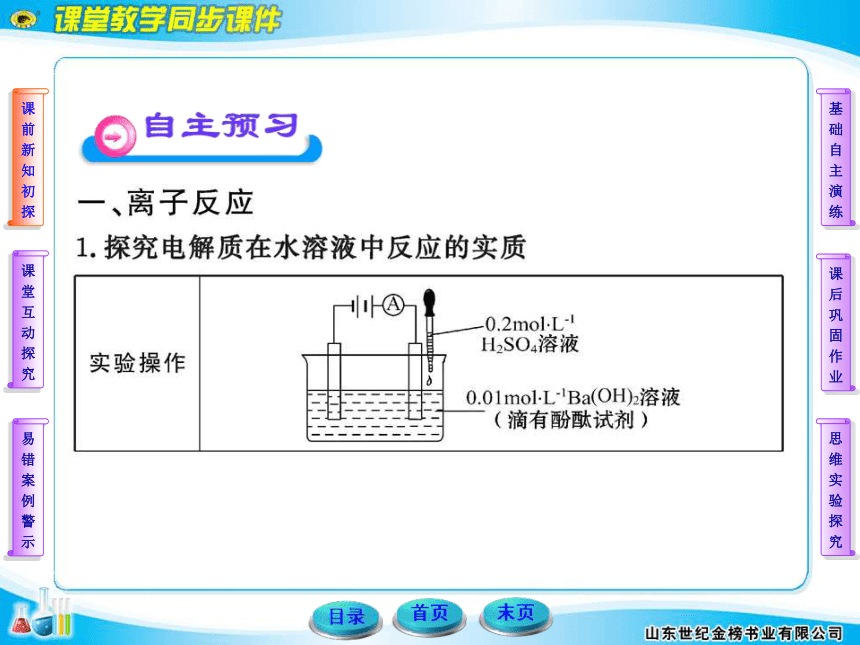
(共83张PPT)
【典例1】下列化学反应的离子方程式正确的
是
A.用小苏打治疗胃酸过多:
HCO3- + H+==== CO2↑ + H2O
B.往碳酸镁中滴加稀盐酸:
CO32- + 2H+==== CO2↑+ H2O
C.少量金属钠放入冷水中:
Na + 2H2O====Na++ 2OH- + H2↑
D.将少量二氧化碳气体通入澄清石灰水中:
2OH-+ CO2====CO32-+ H2O
【思路点拨】本题中的D选项关键是看清CO2的用量是“少量”,说明CO2的量是不足的。
【自主解答】选A。B中碳酸镁为难溶盐,不能拆分;C中电荷不守恒;D中少量CO2应该生成碳酸钙沉淀。
【互动探究】若把D选项改成“将过量CO2通入澄清石灰水中”,则离子方程式如何书写?
提示:OH- + CO2====HCO3-。
【变式训练】(双选)下列离子方程式中错误的是( )
A.铁跟稀硫酸反应2Fe+6H+====2Fe3++3H2↑
B.碳酸氢钙溶液跟盐酸反应
Ca(HCO3)2+2H+====Ca2++2H2O+2CO2↑
C.醋酸跟氢氧化钾溶液反应
CH3COOH+OH-====CH3COO-+H2O
D.碳酸镁跟稀硫酸溶液反应
MgCO3+2H+====Mg2++H2O+CO2↑
【解析】选A、B。解本题时采用正向思维,对每一个离子方程式进行分析。而每一个离子方程式都应与其化学方程式及实际情况相吻合,不能臆造。稀硫酸与铁反应生成二价铁,故A选项不正确;Ca(HCO3)2是可溶于水的盐,应写成离子形式,反应前后Ca2+的数目并没有变,因此离子方程式中不应出现Ca2+,故B选项也不正确;醋酸是弱酸,在离子方程式中应写成化学式;MgCO3难溶于水,不能写成离子,故C、D选项正确。
【典例2】下列各组中的离子,能在溶液中大量共存的是
A.Ba2+、Na+、CO32-、OH-
B.Mg2+、Ba2+、OH-、NO3-
C.H+、K+、CO32-、SO42-
D.Al3+、Fe3+、SO42-、Cl-
【思路点拨】解答本题需要注意以下三点:
【自主解答】选D。A组中,Ba2++CO32-====BaCO3↓;B组
中,Mg2++2OH-====Mg(OH)2↓;C组中,2H++CO32-====
CO2↑+H2O;D组中,各种离子能在溶液中大量共存。
【互动探究】(1)若把A组中“CO32-”改成“SO42-”可否共存?为什么?
提示:不能。因为Ba2++SO42-====BaSO4↓,所以不能大量共存。
(2)若把B组中“Mg2+”改成“K+”能否共存?
提示:能。当“Mg2+”换成“K+”时没有可以发生反应的离子,故可大量共存。
【变式训练】下列各组离子,能在强酸溶液里大量共存,并且溶液呈无色透明的是( )
A.MnO4-,K+,Na+,SO42-
B.Na+,K+,HCO3-,Cl-
C.Mg2+,NH4+,Cl-,NO3-
D.Ba2+,K+,S2-,SO42-
【解析】选C。对于离子能否共存问题:必须考虑两个问题,一看同组离子是否发生反应,二看是否满足题干要求。A项中的MnO4-为紫色;B项中的HCO3-能与强酸反应;C项各离子均不能发生反应;D项中的Ba2+和SO42-可反应生成BaSO4沉淀,且S2-能与强酸反应。
【典例】某溶液中可能含有较大量的Cl-、CO32-、OH- 3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验而得出结论,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
【思路点拨】做本题的关键点是注意本题要求“只取一次溶液”,每次只能检验出一种离子,故明确离子检验的顺序是做本题的关键。
【自主解答】选B。首先滴加足量Ba(NO3)2溶液,如果出现白色沉淀,证明有CO32-,同时除去CO32-;过滤后,在滤液中加入足量Mg(NO3)2溶液,如果出现白色沉淀,证明有OH-,同时除去OH-;过滤后,滴加AgNO3溶液,如果出现白色沉淀,证明有Cl-。
【互动探究】从上题所给溶液中找出一种,使其与上述三种离子都能发生反应。
提示:AgNO3溶液,Ag++Cl-====AgCl↓、2Ag++CO32-====
Ag2CO3↓、Ag++OH-====AgOH↓。
【变式训练】某同学从一瓶未知的无色溶液中检验出有
Ba2+、Ag+,同时溶液的酸性较强,他还准备继续检验溶液中是否含有Cu2+、Cl-、CO32-、K+、SO42-、NO3-等离子。显然,有些离子还必须检验,有些离子已不需检验。你认为还必须检验的离子有___________________________。
【解析】由溶液呈无色,推知无Cu2+;因含有大量H+、
Ba2+、Ag+,故与之不能大量共存的离子有Cl-、SO42-、CO32-,其中阴离子只有NO3-,根据电中性原理,无需检验。剩余离子还须检验。
答案:K+
【典例】能正确表示下列化学反应的离子方程式的是
A.澄清的石灰水与稀盐酸反应:
OH-+H+====H2O
B.氢氧化钡溶液与稀硫酸反应:
Ba2++OH-+SO42-+H+====BaSO4↓+H2O
C.足量CO2通入NaOH溶液中的反应:
CO2+2OH-====CO32-+H2O
D.氯气与水反应:Cl2+H2O====2H++Cl-+ClO-
【易错选项】B
【易错剖析】(1)易错选项分析
本题易错选B的原因在于思维不严密,忽略了反应方程式中物质组成的比例关系,氢氧化钡溶液与稀硫酸反应,不仅仅生成H2O,还有BaSO4沉淀生成,且反应物中Ba2+与OH-的物质的量之比为1∶2,n(H+)∶n(SO42-)=2∶1,故其反应的离子方程式为:Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O。
(2)其他错误选项分析
【标准答案】A
1.离子方程式CO32-+2H+====H2O+CO2↑中的CO32-代表的物质可以是( )
A.CaCO3 B.Na2CO3 C.BaCO3 D.MgCO3
【解析】选B。可写成CO32-形式的应是可溶性碳酸盐,而上述四个选项中只有B(Na2CO3)可溶。
2.加入NaOH溶液后,溶液中下列离子数目会减小的是( )
A.CO32- B.Fe3+ C.SO42- D.Cl-
【解析】选B。加入NaOH溶液后,Fe3++3OH-====
Fe(OH)3↓,其他离子与NaOH溶液不反应。
3.下列化学方程式改写成离子方程式不正确的是( )
A.CuCl2+2NaOH====Cu(OH)2↓+2NaCl
Cu2++2OH-====Cu(OH)2↓
B.BaCO3+2HCl====BaCl2+CO2↑+H2O
CO32-+2H+====CO2↑+H2O
C.Ca(NO3)2+Na2CO3====CaCO3↓+2NaNO3
Ca2++CO32-====CaCO3↓
D.2KOH+H2SO4====K2SO4+2H2O
H++OH-====H2O
【解析】选B。B中BaCO3是不溶物不能拆分成离子形式。
4.离子方程式BaCO3+2H+====CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A.①③ B.①④⑤ C.②④⑤ D.①⑤
【解析】选C。H2SO4和NaHSO4中可电离出SO42-,能与Ba2+形成BaSO4沉淀,CH3COOH为弱酸,故在此离子方程式中的H+不能代表物质②④⑤。
5.用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂及有关反应的离子方程式。
(1)FeSO4溶液(CuSO4):试剂________________________;
离子方程式______________________________________。
(2)CO(CO2):试剂_________________________________,
离子方程式_______________________________________。
【解析】本题是一道关于物质除杂的问题,对于此类问题解题的关键点是在加入除杂的试剂时不要引入新杂质。
答案:(1)铁粉 Fe+Cu2+====Cu+Fe2+
(2)NaOH溶液 CO2+2OH-====CO32-+H2O
6.现有一包固体粉末,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CuSO4。进行如下实验:①溶于水得无色溶液;②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失。根据上述实验现象推断:
(1)一定不存在的物质是___________________________;
(2)一定存在的物质是_____________________________;
(3)可能存在的物质是_____________________________;
(4)对于可能存在的物质的检验方法是(写出简要步骤和有关的离子方程式)_________________________________。
【解析】根据“溶于水得无色溶液”的信息可知CaCO3和CuSO4一定不存在,因为CaCO3难溶于水,CuSO4溶于水得蓝色溶液;根据“向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失”的信息可知Na2SO4一定不存在,因为假设有Na2SO4,生成的沉淀在加入盐酸后不会消失,而这种易溶于稀盐酸的物质一定是BaCO3,则可判断Na2CO3一定存在;有无NaCl对整个过程和现象无影响,因此,无法判断NaCl的存在。
答案:(1)CaCO3、Na2SO4、CuSO4
(2)Na2CO3
(3)NaCl
(4)取无色溶液少量于试管中,滴加足量稀硝酸,待无气泡产生后,加AgNO3试剂,看是否产生白色沉淀。若有,则含有NaCl,反之则无。2H++CO32-====CO2↑+H2O,Ag++Cl-====AgCl↓
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列反应中,不属于离子反应的是( )
A.H2和O2的反应
B.铁与CuSO4溶液的反应
C.Ba(OH)2溶液和H2SO4溶液的反应
D.Na与水的反应
【解析】选A。在溶液中发生的有离子参加或生成的化学反应都是离子反应,酸、碱、盐溶于水后都能电离出离子,B、C两项均有离子参加反应,故均属于离子反应;A项中H2和O2均为气体单质,反应不在溶液中进行,也不能电离出离子,且生成的水也不能电离出大量的离子,故A项不属于离子反应;D项中Na为金属单质,水也不能电离出大量的离子,但生成的NaOH能电离出Na+和OH-,即有离子生成,故D项属于离子反应。
2.对于某些离子的检验及结论正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
【解析】选C。A中有HCO3-也可有此现象,B中不能排除Ag+的干扰,D中不能排除Ca2+的干扰。
3.在下列化学方程式中,不能用离子方程式Ba2++SO42-====BaSO4↓来表示的是( )
A.Ba(NO3)2+H2SO4====BaSO4↓+2HNO3
B.BaCl2+Na2SO4====BaSO4↓+2NaCl
C.BaCO3+H2SO4====BaSO4↓+H2O+CO2↑
D.BaCl2+H2SO4====BaSO4↓+2HCl
【解析】选C。BaCO3不可拆,H2O、CO2均不可拆,故C的离子方程式为BaCO3+2H++SO42-====BaSO4↓+H2O+CO2↑。
4.(2011·潍坊高一检测)在某无色透明的酸性溶液中,能共存的离子组是( )
A.Na+、K+、SO42-、HCO3-
B.Cu2+、K+、SO42-、NO3-
C.Na+、 K+、Cl-、 NO3-
D.Fe3+、K+、SO42-、Cl-
【解析】选C。A中酸性溶液H+和HCO3-可以发生反应;B中Cu2+有颜色;D中Fe3+有颜色。
5.下列离子方程式中不正确的是( )
A.澄清的石灰水跟盐酸反应:H++OH-====H2O
B.氯气与水反应:Cl2+H2O====2H++Cl-+ClO-
C.亚硫酸钡与盐酸反应:
BaSO3+2H+==== Ba2++SO2↑+H2O
D.亚硫酸氢钠溶液与NaOH溶液反应:
HSO3-+OH-====SO32-+H2O
【解析】选B。判断离子方程式的正误应注意:①是否符合客观实际;②应该用化学式表示的(气体、沉淀、水、弱酸、弱碱、氧化物、单质等)是否写对,应该删掉的离子是否已删掉;③是否配平,电子转移是否合理。据此检查各选项,A、C、D正确,B错,因为HClO是弱酸,不能拆开写。正确的写法为:Cl2+H2O====H++Cl-+HClO。
【方法技巧】离子方程式的正误判断方法
(1)抓住两易、两等、两查
两易:即易溶、易电离的物质(包括强酸、强碱、大多数可溶性盐)用实际参加反应的离子符号表示,非电解质、难电离的物质(包括弱酸、弱碱、水等)、难溶物、单质、气体、氧化物等用化学式表示。
两等:离子方程式两边的原子个数、电荷总数均对应相等。
两查:检查反应物或产物的配比是否正确,是否漏掉离子等。
(2)注意的问题
①微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式;微溶物作为生成物,一般写化学式(标↓),如Ca(OH)2等。
②两种可溶性酸式盐的电离(主要)
NaHSO4====Na++H++SO42-
NaHCO3====Na++HCO3-
二、非选择题(本题包括3小题,共30分)
6.(12分)用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)试剂:________;离子方程式:________。
(2)Cu(Fe):________;离子方程式:________________。
(3)Na2SO4(Na2CO3)试剂:______________;离子方程式:_______________________________________________。
【解析】除杂要符合以下三个原则,一是不减;二是除尽;三是易操作。(1)由于两物质的阴离子相同,除去HCl,实际是除去H+,且不能引入新的阳离子,所以应选用BaCO3。(2)根据铁能与稀盐酸或稀硫酸反应而铜不能反应,可加入过量稀盐酸或稀硫酸,然后过滤即可。
(3)由于两物质的阳离子相同,除去Na2CO3实际是除去
CO32-,且不能引入新的阴离子,所以应选用稀硫酸。
答案:(1)BaCO3 BaCO3+2H+====Ba2++H2O+CO2↑
(2)稀盐酸或稀硫酸 Fe+2H+====Fe2++H2↑
(3)稀硫酸 CO32-+2H+====H2O+CO2↑
7.(10分)(2011·龙岩高一检测)有一包从海水中获得的粗盐,已经经过初步的提纯。课外活动小组对它的成分进行探究。根据海水的成分和初步提纯的实验操作,估计该粗盐可能还含有的杂质是CaCl2和MgCl2。现用实验验证这种推测,并完成实验报告:
实验目的:______________________________________。
【解析】题中实验目的就在所给的信息中,“估计该粗盐可能还含有的杂质是CaCl2和MgCl2”这句话告诉我们接下来要做的实验就是要验证粗盐中是否含有氯化钙、氯化镁。第一个实验结论说明该粗盐中没有MgCl2,那就想能用来验证MgCl2的方法,考虑到含有氯化钠的因素,只能选择一种碱溶液,另外,碱与盐要能反应的话要在水溶液中,所以首先要将样品溶于水。加入碱溶液后无白色沉淀,则说明该粗盐中没有MgCl2。排除MgCl2后,CaCl2可以用碳酸盐检验。
答案:验证粗盐中是否含有氯化钙、氯化镁
①溶于水中 NaOH 无白色沉淀
②Na2CO3 该粗盐中有CaCl2
8.(8分)(挑战能力)“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,其中阴影方块是障碍物,不能通过,迷宫中的空白区域是路,路上有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
(1)请你帮助它走出迷宫(请用图中物质前的序号按序排列
表示所走的路线)。
________________________________________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应
的有_____个,其中能“吃掉”盐酸的盐是_____(填写物质
序号),写出该反应的离子方程式___________________。
(3)在不能与盐酸反应的物质中,属于电解质的是______
(填写物质序号),属于非电解质的是____(填写物质序号)。
【解析】(1)盐酸必须避开与它发生反应的物质,行走路线
应为③→⑥→⑩→⑦→ → 。
(2)能与盐酸反应的物质中,属于碱的只有④和⑧,能与盐
酸反应的盐为②,反应的离子方程式为CO32-+2H+====CO2↑
+H2O或CO32-+H+====HCO3-。
(3)不能与盐酸反应的物质中,属于电解质的是⑥和,属于
非电解质的是③和⑩。
答案:(1)③⑥⑩⑦
(2)2 ② CO32-+2H+===CO2↑+H2O(或CO32-+H+====HCO3-)
(3)⑥ ③⑩
某同学在学习过程中了解到蛋壳的主要成分是碳酸钙。于是,该同学设想是不是所有蛋壳中的含钙量都一样,如果都一样的话,大约是多少?如果不一样的话,蛋壳中的含钙量与什么因素有关呢?于是该同学就以此为课题与其他同学一起开展了一次研究性学习。在研究性学习中,该同学的分工是设计测量蛋壳中含钙量的方案。
下面是他设计的一个方案,请你为他补全方案,并回答相关问题。
第一步:收集蛋壳,并洗涤干净备用。
第二步:称量蛋壳质量(m1)。
第三步:溶解蛋壳。将蛋壳放入盛有_____的烧杯中,搅拌,使其充分反应,过滤除去不溶性杂质,保留滤液备用。蛋壳溶解过程中发生反应的离子方程式为______________。
第四步:沉淀Ca2+。向滤液中加入过量的_____溶液。
第五步:过滤,洗涤沉淀。
第六步:称量沉淀质量(m2)。
蛋壳中含钙量(即该元素的质量分数)的表达式为
w(Ca)=_____。
【解析】第三步,溶解CaCO3可用盐酸,反应的离子方程式
为:CaCO3+2H+====Ca2++CO2↑+H2O。第四步沉淀Ca2+时可加
入一种可溶性碳酸盐溶液,如Na2CO3溶液,为了使Ca2+沉淀
完全,加入的碳酸盐要过量。第五步,过滤时,在沉淀物
表面会附着一些可溶性杂质,可用水洗法除去。
含钙量计算,可根据Ca守恒:
Ca2+ ~ CaCO3
40 100
m(Ca2+) m2
则m(Ca2+)=
所以w(Ca)= 。
答案:盐酸 CaCO3+2H+====Ca2++CO2↑+H2O
Na2CO3(合理即可) ×100%
【典例1】下列化学反应的离子方程式正确的
是
A.用小苏打治疗胃酸过多:
HCO3- + H+==== CO2↑ + H2O
B.往碳酸镁中滴加稀盐酸:
CO32- + 2H+==== CO2↑+ H2O
C.少量金属钠放入冷水中:
Na + 2H2O====Na++ 2OH- + H2↑
D.将少量二氧化碳气体通入澄清石灰水中:
2OH-+ CO2====CO32-+ H2O
【思路点拨】本题中的D选项关键是看清CO2的用量是“少量”,说明CO2的量是不足的。
【自主解答】选A。B中碳酸镁为难溶盐,不能拆分;C中电荷不守恒;D中少量CO2应该生成碳酸钙沉淀。
【互动探究】若把D选项改成“将过量CO2通入澄清石灰水中”,则离子方程式如何书写?
提示:OH- + CO2====HCO3-。
【变式训练】(双选)下列离子方程式中错误的是( )
A.铁跟稀硫酸反应2Fe+6H+====2Fe3++3H2↑
B.碳酸氢钙溶液跟盐酸反应
Ca(HCO3)2+2H+====Ca2++2H2O+2CO2↑
C.醋酸跟氢氧化钾溶液反应
CH3COOH+OH-====CH3COO-+H2O
D.碳酸镁跟稀硫酸溶液反应
MgCO3+2H+====Mg2++H2O+CO2↑
【解析】选A、B。解本题时采用正向思维,对每一个离子方程式进行分析。而每一个离子方程式都应与其化学方程式及实际情况相吻合,不能臆造。稀硫酸与铁反应生成二价铁,故A选项不正确;Ca(HCO3)2是可溶于水的盐,应写成离子形式,反应前后Ca2+的数目并没有变,因此离子方程式中不应出现Ca2+,故B选项也不正确;醋酸是弱酸,在离子方程式中应写成化学式;MgCO3难溶于水,不能写成离子,故C、D选项正确。
【典例2】下列各组中的离子,能在溶液中大量共存的是
A.Ba2+、Na+、CO32-、OH-
B.Mg2+、Ba2+、OH-、NO3-
C.H+、K+、CO32-、SO42-
D.Al3+、Fe3+、SO42-、Cl-
【思路点拨】解答本题需要注意以下三点:
【自主解答】选D。A组中,Ba2++CO32-====BaCO3↓;B组
中,Mg2++2OH-====Mg(OH)2↓;C组中,2H++CO32-====
CO2↑+H2O;D组中,各种离子能在溶液中大量共存。
【互动探究】(1)若把A组中“CO32-”改成“SO42-”可否共存?为什么?
提示:不能。因为Ba2++SO42-====BaSO4↓,所以不能大量共存。
(2)若把B组中“Mg2+”改成“K+”能否共存?
提示:能。当“Mg2+”换成“K+”时没有可以发生反应的离子,故可大量共存。
【变式训练】下列各组离子,能在强酸溶液里大量共存,并且溶液呈无色透明的是( )
A.MnO4-,K+,Na+,SO42-
B.Na+,K+,HCO3-,Cl-
C.Mg2+,NH4+,Cl-,NO3-
D.Ba2+,K+,S2-,SO42-
【解析】选C。对于离子能否共存问题:必须考虑两个问题,一看同组离子是否发生反应,二看是否满足题干要求。A项中的MnO4-为紫色;B项中的HCO3-能与强酸反应;C项各离子均不能发生反应;D项中的Ba2+和SO42-可反应生成BaSO4沉淀,且S2-能与强酸反应。
【典例】某溶液中可能含有较大量的Cl-、CO32-、OH- 3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验而得出结论,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
【思路点拨】做本题的关键点是注意本题要求“只取一次溶液”,每次只能检验出一种离子,故明确离子检验的顺序是做本题的关键。
【自主解答】选B。首先滴加足量Ba(NO3)2溶液,如果出现白色沉淀,证明有CO32-,同时除去CO32-;过滤后,在滤液中加入足量Mg(NO3)2溶液,如果出现白色沉淀,证明有OH-,同时除去OH-;过滤后,滴加AgNO3溶液,如果出现白色沉淀,证明有Cl-。
【互动探究】从上题所给溶液中找出一种,使其与上述三种离子都能发生反应。
提示:AgNO3溶液,Ag++Cl-====AgCl↓、2Ag++CO32-====
Ag2CO3↓、Ag++OH-====AgOH↓。
【变式训练】某同学从一瓶未知的无色溶液中检验出有
Ba2+、Ag+,同时溶液的酸性较强,他还准备继续检验溶液中是否含有Cu2+、Cl-、CO32-、K+、SO42-、NO3-等离子。显然,有些离子还必须检验,有些离子已不需检验。你认为还必须检验的离子有___________________________。
【解析】由溶液呈无色,推知无Cu2+;因含有大量H+、
Ba2+、Ag+,故与之不能大量共存的离子有Cl-、SO42-、CO32-,其中阴离子只有NO3-,根据电中性原理,无需检验。剩余离子还须检验。
答案:K+
【典例】能正确表示下列化学反应的离子方程式的是
A.澄清的石灰水与稀盐酸反应:
OH-+H+====H2O
B.氢氧化钡溶液与稀硫酸反应:
Ba2++OH-+SO42-+H+====BaSO4↓+H2O
C.足量CO2通入NaOH溶液中的反应:
CO2+2OH-====CO32-+H2O
D.氯气与水反应:Cl2+H2O====2H++Cl-+ClO-
【易错选项】B
【易错剖析】(1)易错选项分析
本题易错选B的原因在于思维不严密,忽略了反应方程式中物质组成的比例关系,氢氧化钡溶液与稀硫酸反应,不仅仅生成H2O,还有BaSO4沉淀生成,且反应物中Ba2+与OH-的物质的量之比为1∶2,n(H+)∶n(SO42-)=2∶1,故其反应的离子方程式为:Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O。
(2)其他错误选项分析
【标准答案】A
1.离子方程式CO32-+2H+====H2O+CO2↑中的CO32-代表的物质可以是( )
A.CaCO3 B.Na2CO3 C.BaCO3 D.MgCO3
【解析】选B。可写成CO32-形式的应是可溶性碳酸盐,而上述四个选项中只有B(Na2CO3)可溶。
2.加入NaOH溶液后,溶液中下列离子数目会减小的是( )
A.CO32- B.Fe3+ C.SO42- D.Cl-
【解析】选B。加入NaOH溶液后,Fe3++3OH-====
Fe(OH)3↓,其他离子与NaOH溶液不反应。
3.下列化学方程式改写成离子方程式不正确的是( )
A.CuCl2+2NaOH====Cu(OH)2↓+2NaCl
Cu2++2OH-====Cu(OH)2↓
B.BaCO3+2HCl====BaCl2+CO2↑+H2O
CO32-+2H+====CO2↑+H2O
C.Ca(NO3)2+Na2CO3====CaCO3↓+2NaNO3
Ca2++CO32-====CaCO3↓
D.2KOH+H2SO4====K2SO4+2H2O
H++OH-====H2O
【解析】选B。B中BaCO3是不溶物不能拆分成离子形式。
4.离子方程式BaCO3+2H+====CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A.①③ B.①④⑤ C.②④⑤ D.①⑤
【解析】选C。H2SO4和NaHSO4中可电离出SO42-,能与Ba2+形成BaSO4沉淀,CH3COOH为弱酸,故在此离子方程式中的H+不能代表物质②④⑤。
5.用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂及有关反应的离子方程式。
(1)FeSO4溶液(CuSO4):试剂________________________;
离子方程式______________________________________。
(2)CO(CO2):试剂_________________________________,
离子方程式_______________________________________。
【解析】本题是一道关于物质除杂的问题,对于此类问题解题的关键点是在加入除杂的试剂时不要引入新杂质。
答案:(1)铁粉 Fe+Cu2+====Cu+Fe2+
(2)NaOH溶液 CO2+2OH-====CO32-+H2O
6.现有一包固体粉末,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CuSO4。进行如下实验:①溶于水得无色溶液;②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失。根据上述实验现象推断:
(1)一定不存在的物质是___________________________;
(2)一定存在的物质是_____________________________;
(3)可能存在的物质是_____________________________;
(4)对于可能存在的物质的检验方法是(写出简要步骤和有关的离子方程式)_________________________________。
【解析】根据“溶于水得无色溶液”的信息可知CaCO3和CuSO4一定不存在,因为CaCO3难溶于水,CuSO4溶于水得蓝色溶液;根据“向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失”的信息可知Na2SO4一定不存在,因为假设有Na2SO4,生成的沉淀在加入盐酸后不会消失,而这种易溶于稀盐酸的物质一定是BaCO3,则可判断Na2CO3一定存在;有无NaCl对整个过程和现象无影响,因此,无法判断NaCl的存在。
答案:(1)CaCO3、Na2SO4、CuSO4
(2)Na2CO3
(3)NaCl
(4)取无色溶液少量于试管中,滴加足量稀硝酸,待无气泡产生后,加AgNO3试剂,看是否产生白色沉淀。若有,则含有NaCl,反之则无。2H++CO32-====CO2↑+H2O,Ag++Cl-====AgCl↓
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列反应中,不属于离子反应的是( )
A.H2和O2的反应
B.铁与CuSO4溶液的反应
C.Ba(OH)2溶液和H2SO4溶液的反应
D.Na与水的反应
【解析】选A。在溶液中发生的有离子参加或生成的化学反应都是离子反应,酸、碱、盐溶于水后都能电离出离子,B、C两项均有离子参加反应,故均属于离子反应;A项中H2和O2均为气体单质,反应不在溶液中进行,也不能电离出离子,且生成的水也不能电离出大量的离子,故A项不属于离子反应;D项中Na为金属单质,水也不能电离出大量的离子,但生成的NaOH能电离出Na+和OH-,即有离子生成,故D项属于离子反应。
2.对于某些离子的检验及结论正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
【解析】选C。A中有HCO3-也可有此现象,B中不能排除Ag+的干扰,D中不能排除Ca2+的干扰。
3.在下列化学方程式中,不能用离子方程式Ba2++SO42-====BaSO4↓来表示的是( )
A.Ba(NO3)2+H2SO4====BaSO4↓+2HNO3
B.BaCl2+Na2SO4====BaSO4↓+2NaCl
C.BaCO3+H2SO4====BaSO4↓+H2O+CO2↑
D.BaCl2+H2SO4====BaSO4↓+2HCl
【解析】选C。BaCO3不可拆,H2O、CO2均不可拆,故C的离子方程式为BaCO3+2H++SO42-====BaSO4↓+H2O+CO2↑。
4.(2011·潍坊高一检测)在某无色透明的酸性溶液中,能共存的离子组是( )
A.Na+、K+、SO42-、HCO3-
B.Cu2+、K+、SO42-、NO3-
C.Na+、 K+、Cl-、 NO3-
D.Fe3+、K+、SO42-、Cl-
【解析】选C。A中酸性溶液H+和HCO3-可以发生反应;B中Cu2+有颜色;D中Fe3+有颜色。
5.下列离子方程式中不正确的是( )
A.澄清的石灰水跟盐酸反应:H++OH-====H2O
B.氯气与水反应:Cl2+H2O====2H++Cl-+ClO-
C.亚硫酸钡与盐酸反应:
BaSO3+2H+==== Ba2++SO2↑+H2O
D.亚硫酸氢钠溶液与NaOH溶液反应:
HSO3-+OH-====SO32-+H2O
【解析】选B。判断离子方程式的正误应注意:①是否符合客观实际;②应该用化学式表示的(气体、沉淀、水、弱酸、弱碱、氧化物、单质等)是否写对,应该删掉的离子是否已删掉;③是否配平,电子转移是否合理。据此检查各选项,A、C、D正确,B错,因为HClO是弱酸,不能拆开写。正确的写法为:Cl2+H2O====H++Cl-+HClO。
【方法技巧】离子方程式的正误判断方法
(1)抓住两易、两等、两查
两易:即易溶、易电离的物质(包括强酸、强碱、大多数可溶性盐)用实际参加反应的离子符号表示,非电解质、难电离的物质(包括弱酸、弱碱、水等)、难溶物、单质、气体、氧化物等用化学式表示。
两等:离子方程式两边的原子个数、电荷总数均对应相等。
两查:检查反应物或产物的配比是否正确,是否漏掉离子等。
(2)注意的问题
①微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式;微溶物作为生成物,一般写化学式(标↓),如Ca(OH)2等。
②两种可溶性酸式盐的电离(主要)
NaHSO4====Na++H++SO42-
NaHCO3====Na++HCO3-
二、非选择题(本题包括3小题,共30分)
6.(12分)用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)试剂:________;离子方程式:________。
(2)Cu(Fe):________;离子方程式:________________。
(3)Na2SO4(Na2CO3)试剂:______________;离子方程式:_______________________________________________。
【解析】除杂要符合以下三个原则,一是不减;二是除尽;三是易操作。(1)由于两物质的阴离子相同,除去HCl,实际是除去H+,且不能引入新的阳离子,所以应选用BaCO3。(2)根据铁能与稀盐酸或稀硫酸反应而铜不能反应,可加入过量稀盐酸或稀硫酸,然后过滤即可。
(3)由于两物质的阳离子相同,除去Na2CO3实际是除去
CO32-,且不能引入新的阴离子,所以应选用稀硫酸。
答案:(1)BaCO3 BaCO3+2H+====Ba2++H2O+CO2↑
(2)稀盐酸或稀硫酸 Fe+2H+====Fe2++H2↑
(3)稀硫酸 CO32-+2H+====H2O+CO2↑
7.(10分)(2011·龙岩高一检测)有一包从海水中获得的粗盐,已经经过初步的提纯。课外活动小组对它的成分进行探究。根据海水的成分和初步提纯的实验操作,估计该粗盐可能还含有的杂质是CaCl2和MgCl2。现用实验验证这种推测,并完成实验报告:
实验目的:______________________________________。
【解析】题中实验目的就在所给的信息中,“估计该粗盐可能还含有的杂质是CaCl2和MgCl2”这句话告诉我们接下来要做的实验就是要验证粗盐中是否含有氯化钙、氯化镁。第一个实验结论说明该粗盐中没有MgCl2,那就想能用来验证MgCl2的方法,考虑到含有氯化钠的因素,只能选择一种碱溶液,另外,碱与盐要能反应的话要在水溶液中,所以首先要将样品溶于水。加入碱溶液后无白色沉淀,则说明该粗盐中没有MgCl2。排除MgCl2后,CaCl2可以用碳酸盐检验。
答案:验证粗盐中是否含有氯化钙、氯化镁
①溶于水中 NaOH 无白色沉淀
②Na2CO3 该粗盐中有CaCl2
8.(8分)(挑战能力)“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,其中阴影方块是障碍物,不能通过,迷宫中的空白区域是路,路上有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
(1)请你帮助它走出迷宫(请用图中物质前的序号按序排列
表示所走的路线)。
________________________________________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应
的有_____个,其中能“吃掉”盐酸的盐是_____(填写物质
序号),写出该反应的离子方程式___________________。
(3)在不能与盐酸反应的物质中,属于电解质的是______
(填写物质序号),属于非电解质的是____(填写物质序号)。
【解析】(1)盐酸必须避开与它发生反应的物质,行走路线
应为③→⑥→⑩→⑦→ → 。
(2)能与盐酸反应的物质中,属于碱的只有④和⑧,能与盐
酸反应的盐为②,反应的离子方程式为CO32-+2H+====CO2↑
+H2O或CO32-+H+====HCO3-。
(3)不能与盐酸反应的物质中,属于电解质的是⑥和,属于
非电解质的是③和⑩。
答案:(1)③⑥⑩⑦
(2)2 ② CO32-+2H+===CO2↑+H2O(或CO32-+H+====HCO3-)
(3)⑥ ③⑩
某同学在学习过程中了解到蛋壳的主要成分是碳酸钙。于是,该同学设想是不是所有蛋壳中的含钙量都一样,如果都一样的话,大约是多少?如果不一样的话,蛋壳中的含钙量与什么因素有关呢?于是该同学就以此为课题与其他同学一起开展了一次研究性学习。在研究性学习中,该同学的分工是设计测量蛋壳中含钙量的方案。
下面是他设计的一个方案,请你为他补全方案,并回答相关问题。
第一步:收集蛋壳,并洗涤干净备用。
第二步:称量蛋壳质量(m1)。
第三步:溶解蛋壳。将蛋壳放入盛有_____的烧杯中,搅拌,使其充分反应,过滤除去不溶性杂质,保留滤液备用。蛋壳溶解过程中发生反应的离子方程式为______________。
第四步:沉淀Ca2+。向滤液中加入过量的_____溶液。
第五步:过滤,洗涤沉淀。
第六步:称量沉淀质量(m2)。
蛋壳中含钙量(即该元素的质量分数)的表达式为
w(Ca)=_____。
【解析】第三步,溶解CaCO3可用盐酸,反应的离子方程式
为:CaCO3+2H+====Ca2++CO2↑+H2O。第四步沉淀Ca2+时可加
入一种可溶性碳酸盐溶液,如Na2CO3溶液,为了使Ca2+沉淀
完全,加入的碳酸盐要过量。第五步,过滤时,在沉淀物
表面会附着一些可溶性杂质,可用水洗法除去。
含钙量计算,可根据Ca守恒:
Ca2+ ~ CaCO3
40 100
m(Ca2+) m2
则m(Ca2+)=
所以w(Ca)= 。
答案:盐酸 CaCO3+2H+====Ca2++CO2↑+H2O
Na2CO3(合理即可) ×100%
