11-12版高中化学全程学习方略配套课件:2.3.3探究铁及其化合物的氧化性或还原性(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:2.3.3探究铁及其化合物的氧化性或还原性(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-14 08:58:03 | ||
图片预览









文档简介
(共111张PPT)
【典例1】用下面两种方法可以制得白色的
Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀硫酸和_____。
(2)除去蒸馏水中溶解的O2常采用_____的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是____________________________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备。
(1)在试管Ⅰ里加入的试剂是_____________________。
(2)在试管Ⅱ里加入的试剂是_____________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是____________________________________________。
【思路点拨】解答本题应注意以下几点:
【自主解答】方法一:(1)由于Fe2+具有较强的还原性易被
氧化为Fe3+,故在配好的溶液中常加一枚铁钉或适量铁屑以
防止其氧化。(2)由于气体的溶解度随温度升高而迅速减
小,故可用加热煮沸的方法除去蒸馏水中溶解的O2。(3)空
气中含有大量的O2,为防止生成的Fe(OH)2沉淀与空气接
触,需将吸取NaOH溶液的长滴管插入液面以下后再挤出溶
液。方法二:(1)由所给试剂及装置特点知,试管Ⅰ为封闭
系统,应为产生H2并赶尽溶液中空气及液面上方空气的装
置,故Ⅰ中加入的试剂为铁屑和稀硫酸。(2)试管Ⅱ中加入
的试剂为NaOH溶液。(3)为确保实验在无氧状态下进行,必须把系统中的O2排除干净,故接下来的操作应为检验试管Ⅱ出口处排出的氢气的纯度,当产生氢气较纯时再夹紧止水夹。(4)由于试管Ⅰ中产生的H2充满了Ⅰ、Ⅱ两支试管,外界空气不易进入,即Fe(OH)2是在H2的还原性气氛中产生的,故Fe(OH)2沉淀的白色可保持较长的时间。
答案:方法一:(1)铁屑 (2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2
方法二:(1)稀硫酸、铁屑 (2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
【互动探究】在制取Fe(OH)2时,若直接向FeSO4溶液中滴入未经煮沸的NaOH溶液,会有什么现象?
提示:现象是首先出现白色沉淀,然后白色沉淀迅速变成灰绿色,最后变成红褐色。
【变式训练】下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应;②Fe与过量稀硫酸反应后,再向其中通入O2;③FeCl2溶于稀硝酸中;④Fe和Fe2O3的混合物溶于盐酸中。
A.只有① B.只有①②
C.只有①②③ D.全部
【解析】选C。①中的Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原。②中Fe与稀硫酸反应只能生成Fe2+,但要注意,由于稀硫酸过量,通入O2后,O2能将Fe2+氧化。③硝酸有强氧化性,能将Fe2+氧化成Fe3+。④中首先发生Fe与盐酸生成FeCl2、Fe2O3与盐酸生成FeCl3的反应,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
【典例2】将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是
A.FeO B.Fe2O3
C.FeCl3 D.Fe2(SO4)3
【思路点拨】解答本题的关键点是:
【自主解答】选A。由题意可知,A中的Fe2+与SCN-结合没有颜色改变,但加入氯水后发生反应,生成Fe3+,溶液变为红色。方程式为2Fe2++Cl2====2Fe3++2Cl-,Fe3++3SCN- ====Fe(SCN)3。
【互动探究】上题中若改成“将下列四种铁的化合物溶于水中,滴加KSCN溶液即呈红色的是”答案是什么?
提示:滴加KSCN溶液即呈红色,即溶于水后能电离出Fe3+,则选C、D。
【变式训练】在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,将所剩余的固体滤出,固体能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+
C.Fe2+ D.H+
【解析】选C。本题考查的知识点是铁单质的物理性质及离子共存问题。解答此题要考虑到铁的物理性质:能被磁铁吸引,说明铁有剩余。铁具有还原性,而Cu2+、Fe3+、Fe2+、H+等都具有氧化性,能够与铁反应的离子不能大量存在。Cu2+、Fe3+以及H+三种离子不能大量存在,其中Fe被氧化成Fe2+,而Cu2+、Fe3+、H+三种离子被还原成Cu、Fe2+、H2,所以溶液中Fe2+最多。Fe与Fe2+相互间不反应。
【典例】已知X为FeO和CuO的混合物,取两份等质量的X样品进行如图所示实验:
(1)写出第③步反应的离子方程式:_________________。
(2)实验从第③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L。试计算取用的每份X中FeO与CuO的质量比。
【思路点拨】做本题的关键点有两个:
【自主解答】(1)按图顺序正推,依次写出①~③各步反应
即得答案:
①FeO+2HCl====FeCl2+H2O
CuO+2HCl====CuCl2+H2O
②FeO+CO Fe+CO2
CuO+CO Cu+CO2
③Fe+Cu2+====Fe2++Cu
Fe+2H+====Fe2++H2↑
△
====
△
====
(2)由E为酸性溶液,可知固体D是铜单质。根据铜原子守恒,每份X中CuO的物质的量为:
32 g/64 g·mol-1×1/2=0.25 mol
其质量为:0.25 mol×80 g·mol-1=20 g
每份X中FeO的物质的量为:
0.25 mol+5.6 L/22.4 L·mol-1=0.50 mol
其质量为:0.50 mol×72 g·mol-1=36 g
所以,每份X中FeO与CuO的质量比为:36 g∶20 g=9∶5。
答案:(1)Fe+Cu2+====Fe2++Cu,
Fe+2H+====Fe2++H2↑
(2)9∶5
【互动探究】请写出上题中第①步反应的离子方程式。
提示:上题中第一步反应的离子方程式如下:
FeO+2H+====Fe2++H2O
CuO+2H+====Cu2++H2O
【变式训练】某酸性工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
(1)方框内物质A和B的化学式:
A______,B______。
(2)根据图示可知,第①步有关离子方程式为__________。
(3)第②步的化学方程式为__________________________。
【解析】(1)由图示可知,当加入过量的A时,铜未溶解而铁已经完全溶解,说明加入的是一种酸,这种酸只溶解铁,又因为不能加入杂质离子,所以只能是盐酸。所以得到的滤液是FeCl2溶液,所以要转化成FeCl3,只能是通入氯气。
(2)第①步的有关离子方程式为:Fe+2H+====Fe2++H2↑、 Fe+2Fe3+====3Fe2+、Cu2++Fe====Cu+Fe2+
(3)第②步的化学方程式为:2FeCl2+Cl2====2FeCl3
答案:(1)盐酸 Cl2
(2)Fe+2H+====Fe2++H2↑、Fe+2Fe3+====3Fe2+、Cu2++Fe====Cu+Fe2+
(3)2FeCl2+Cl2====2FeCl3
【典例1】下列关于铁及其化合物的说法正确的是
A.铁是地壳中含量最多的金属元素,因此在日常生活中应用最广
B.FeCl2溶液存放时,在溶液中放入少量的铁粉,目的是防止Fe2+被氧化
C.隔绝空气的情况下,FeCl2溶液中加入Na2O2后得到白色沉淀Fe(OH)2
D.FeO、Fe2O3、Fe3O4均为铁的氧化物,并且都是碱性氧化物
【易错选项】C
【易错剖析】(1)易错选项分析
错选C原因在于对知识的掌握不熟练,导致不能很好的利用所学知识解决实际问题。虽然隔绝空气,但Na2O2加入到FeCl2溶液中后,Na2O2与水反应生成NaOH,同时Na2O2本身具有较强的氧化性,会把Fe2+氧化成Fe3+。因此FeCl2溶液中加入Na2O2后得到的应该是红褐色的Fe(OH)3沉淀。
(2)其他错误选项分析
【标准答案】B
【典例2】要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③②
C.③① D.①②③
【易错选项】B
【易错剖析】(1)易错选项分析
本题易错选B的原因在于不能将理论与实际相结合来分析问题。本题考查Fe3+的检验和Fe2+的还原性,及Fe3+遇SCN-会生成红色物质的特性。加入NH4SCN证明无Fe3+,再加KMnO4溶液,如有Fe2+则可被氧化为Fe3+而使NH4SCN变红色。但KMnO4本身为紫色,使Fe3+和NH4SCN显色不易观察。故B选项错误。
(2)其他错误选项分析:
①错选A项:
原因在于逻辑思维不条理。抓不住问题的关键点。该实验目的是为了证明某溶液中不含Fe3+而可能含有Fe2+,二者是有先后顺序的,且顺序不能颠倒。若先加入足量氯水,再加入少量NH4SCN,Fe3+和Fe2+是否存在均得不到证明。
②错选D项:
原因在于知识欠缺,不具备应用所学知识去解决问题的能力。
【标准答案】C
1.盐酸和氯气都可以与铁反应,化学方程式: 2Fe+3Cl2
2FeCl3、Fe+2HCl====FeCl2+H2↑,从产物的比较可得出氯
气比盐酸强的性质是( )
A.氧化性 B.还原性
C.酸性 D.金属性
【解析】选A。根据两个反应可知,氯气将铁氧化为
FeCl3,而盐酸只是把铁氧化为FeCl2,所以在氧化性上氯
气强于盐酸。
点燃
====
2.下列物质能将Fe2+氧化为Fe3+,且能使单质Fe由0价变为+3价的是( )
A.氢气 B.氯气
C.浓盐酸 D.稀硫酸
【解析】选B。能将Fe2+氧化为Fe3+的物质,就能使单质Fe由0价变为+3价;能使单质Fe由0价变为+3价的物质,也就能将Fe2+氧化为Fe3+。氯气符合题意,氢气不能氧化Fe2+,浓盐酸和稀硫酸只能使单质Fe由0价变为+2价,A、C、D三项不符合题意。
3.下面是有关操作或者常见现象,其中不属于氧化还原反应的是( )
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气[主要成分为甲烷(CH4)]为炒菜提供热量
C.牛奶久置变质
D.把1 mL饱和三氯化铁溶液逐滴加入到20 mL沸水中
【解析】选D。FeCl3溶液滴入沸水中可生成Fe(OH)3胶体,不是氧化还原反应,而其他选项均是生活中常见的反应,且都是氧化还原反应。
4.(2011·哈尔滨高一检测)下列关于Fe2+和Fe3+的叙述中,错误的是( )
A.Fe2+的水溶液为浅绿色
B.Fe2+既有氧化性,又有还原性
C.Fe3+的水溶液为黄色
D.Fe3+溶液中滴入SCN-,立即出现红色沉淀
【解析】选D。Fe2+为浅绿色,Fe3+为黄色,A、C均正确;由于Fe2+处于中间价态,既有氧化性又有还原性,B正确;Fe3+溶液中滴入SCN-,溶液变红色而非生成红色沉淀,D错误。
5.怎样用化学方法除去下列物质中混有的少量杂质,写出有关反应的离子方程式。
(1)铜粉中混有铁粉____________________________;
(2)铁粉中混有铝粉____________________________;
(3)FeCl2溶液中混有FeCl3_______________________;
(4)FeCl2溶液中混有CuCl2_______________________;
(5)FeCl3溶液中混有FeCl2_______________________。
【解析】根据“铁三角”中的有关转化方程式就可以得出答案。
答案:(1)加入过量盐酸过滤,Fe+2H+====Fe2++H2↑
(2)加入过量NaOH过滤,
2Al+2OH-+2H2O====2AlO2- +3H2↑
(3)加入过量铁粉,Fe+2Fe3+====3Fe2+
(4)加入过量铁粉过滤,Cu2++Fe====Fe2++Cu
(5)通入Cl2,2Fe2++Cl2====2Fe3++2Cl-
6.(2011·广州高一检测)铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行Fe2+ Fe3+的转化,A中Fe2+做____
剂,B中Fe3+做_____剂。
(2)“服用维生素C,可使食物中的三价铁离子还原成二价
铁离子。”这句话指出维生素C在这一反应中做_____剂,
具有_____性。
A
B
【解析】(1)A反应是由Fe2+转化为Fe3+的反应,这个过程是一个化合价升高的过程,所以Fe2+作还原剂。反之,B中Fe3+作氧化剂。
(2)由于维生素C可以将Fe3+转化成Fe2+,所以维生素C作还原剂,具有还原性。
答案:(1)还原 氧化 (2)还原 还原
一、选择题(本题包括9小题,每小题3分,共27分)
1.纯净铁的物理性质有( )
①光亮的银白色 ②黑色
③在潮湿空气中易腐蚀 ④有延展性
⑤能导电导热 ⑥硬而脆
⑦能被磁铁吸引,易被磁化 ⑧密度比铝小
A.①③④⑤⑦ B.①④⑤⑦ C.①③⑤⑦ D.全部
【解析】选B。通常情况下,纯净的铁是一种银白色的重金属,具有金属的通性(导电性、导热性和延展性),密度比铝的大,能够被磁铁吸引产生磁性。在潮湿空气中易生锈而被腐蚀,但该性质属于化学性质,故③不合题意。通常我们所见的铁是灰黑色的,所以在冶金工业上被称为“黑色金属”。
2.能与Fe3+作用,且可证明Fe3+具有氧化性的微粒是( )
①SCN- ②Fe ③Fe2+ ④Cu ⑤OH-
A.②④ B.①③⑤ C.①②⑤ D.除③外
【解析】选A。由于选证明Fe3+具有氧化性的微粒,所以应该选可以和Fe3+发生反应且具有还原性且现象比较明显的物质。
3.(2011·济南高一检测)在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
A.Fe2+ B.Fe3+和Fe2+
C.Cu2+和Fe2+ D.Cu2+
【解析】选A。加入的铁粉是过量的,所以铁粉会和FeCl3、CuCl2完全反应,方程式为:Cu2++Fe====Fe2++Cu,Fe+2Fe3+====3Fe2+。所以,反应完后溶液中的离子就完全变成了Fe2+。
4.将铁片放入下列各溶液中,反应后溶液质量增加,但无气体产生的是( )
A.CuCl2溶液 B.AgNO3溶液
C.Fe2(SO4)3溶液 D.稀硫酸
【解析】选C。
5.下列微粒中,没有氧化性的是( )
A.Cl- B.H+ C.Cl2 D.Fe3+
【解析】选A。元素的最高价态只有氧化性,没有还原性,如B项H+,D项的Fe3+;元素的最低价态只有还原性,没有氧化性,如A项Cl-;Cl2中Cl处于中间价态既有氧化性又有还原性。
6.下列物质能通过化合反应直接制得的是( )
①FeCl2 ②FeCl3 ③Fe(OH)3 ④HCl
A.只有①②③ B.只有②③
C.只有①③④ D.全部
【解析】选D。2FeCl3+Fe====3FeCl2;2Fe+3Cl2
2FeCl3;4Fe(OH)2+O2+2H2O====4Fe(OH)3;H2+Cl2
2HCl。
点燃
====
光照或点燃
=======
7.将足量铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2
溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液
中含有大量的阳离子是( )
A.Cu2+和Fe2+ B.Fe2+和Mg2+
C.Fe3+和Fe2+ D.H+和Cu2+
【解析】选B。溶液中加入过量铁粉发生的反应为:
2Fe3++Fe====3Fe2+ Cu2++Fe====Cu+Fe2+ Fe+2H+====Fe2+
+H2↑,反应后溶液中含有的大量阳离子为Fe2+和Mg2+。
8.(2011·厦门高一检测)根据Fe+Cu2+====Fe2++Cu、
2FeCl3+Cu====2FeCl2+CuCl2两个反应,判断Fe3+、Fe2+、
Cu2+的氧化性顺序为( )
A.Cu2+>Fe2+>Fe3+
B.Fe3+>Fe2+>Cu2+
C.Fe3+>Cu2+>Fe2+
D.Fe2+>Fe3+>Cu2+
【解析】选C。依方程Fe+Cu2+====Fe2++Cu,氧化性Cu2+
>Fe2+。又因为2FeCl3+Cu====2FeCl2+CuCl2,氧化性
Fe3+>Cu2+。所以选C。
9.只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、FeCl3、Al2(SO4)3、(NH4)2SO4六种溶液,这种试剂是( )
A.Ba(OH)2 B.H2S
C.NaOH D.AgNO3
【解析】选C。本题极易错选A。在选Ba(OH)2的时候,Na2SO4和Al2(SO4)3不易区分,因为都能生成BaSO4沉淀。虽然Al2(SO4)3在Ba(OH)2过量时,会部分溶解,但现象不会很明显。
二、非选择题(本题包括4小题,共23分)
10.(6分)在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成_____而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的_____气体。它们把该红色物质还原成黑色的化合物是_____,同时还有未燃烧的碳的颗粒而制得了青色砖瓦。
【解析】从窑顶向下加水发生下列反应:C+H2O(g)
CO+H2。CO和H2都具有还原性,可将Fe2O3还原至Fe3O4、
FeO,需注意铁的氧化物的颜色。
答案:Fe2O3 CO和H2 Fe3O4和FeO
高温
====
11.(6分)印刷电路板是由塑料和铜箔复合而成的,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下:
Cu+2FeCl3====CuCl2+2FeCl2
(1)请在上式中标出电子转移的方向和数目。
(2)该反应的氧化剂是_____。
(3)写出FeCl3的电离方程式_____。
(4)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是_____(填序号)。
A.氯气 B.铁 C.铜 D.稀硫酸
【解析】使用过的腐蚀液中含有CuCl2、FeCl2和FeCl3,要想将其中的Fe2+转化为Fe3+,首先要加入足量的铁粉将Cu2+转化为Cu,同时Fe转化为Fe2+,过滤后通入足量氯气将Fe2+氧化为Fe3+。
答案:(1)
(2)FeCl3 (3)FeCl3====Fe3++3Cl- (4)A
12.(4分)将一定量的铁粉加入含稀硝酸、Fe(NO3)3和Cu(NO3)2的混合溶液中,充分反应后过滤,将滤出的固体物质加入稀盐酸中。
(1)若有气体放出,则滤液中存在的金属阳离子为______
_________________________________________________。
(2)若无气体放出,则滤液中存在的金属阳离子为______
_________________________________________________。
【解析】本题考查铁的单质及化合物的性质,分析中宜从终态考虑。据题意(1)中剩余物是铁,因此与铁反应的微粒(或物质)均不能存在,溶液中金属阳离子只有Fe2+;(2)中剩余物为铜;与铜反应的物质均不存在,溶液中阳离子一定有Fe2+(铁都转化为Fe2+),Cu2+有可能存在,也可能不存在。
答案:(1)Fe2+ (2)一定有Fe2+,可能有Cu2+
13.(7分)(挑战能力)某物质A的水溶液有如下性质:
根据以上实验现象分析可得:
(1)A_____,B_____,C_____(填化学式)。
(2)加入氯气后溶液变为红色的离子方程式是__________。
【解析】A与Ag+反应生成不溶于稀硝酸的白色沉淀,说明沉淀为AgCl,A中必定含有Cl-。而往滤液C中加NH4SCN溶液后无现象,但通入氯气后溶液变为红色,说明加入氯气后溶液中生成了Fe3+,Fe3+从何而来是解决问题的关键。通入氯气后才会出现Fe3+,说明原溶液中一定含有Fe2+。
答案:(1)FeCl2 AgCl Fe(NO3)2
(2)2Fe2++Cl2====2Fe3++2Cl-,
Fe3++3SCN-====Fe(SCN)3
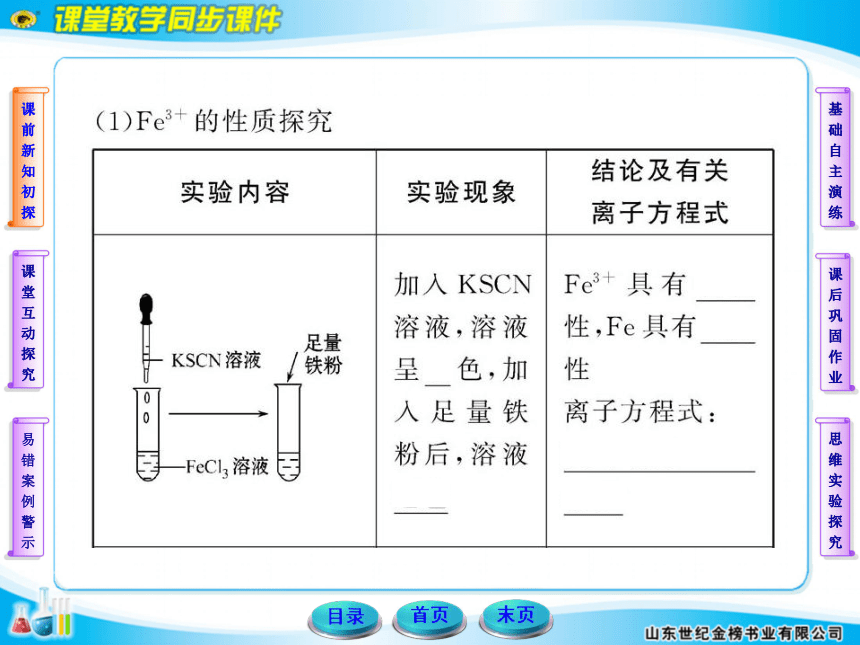
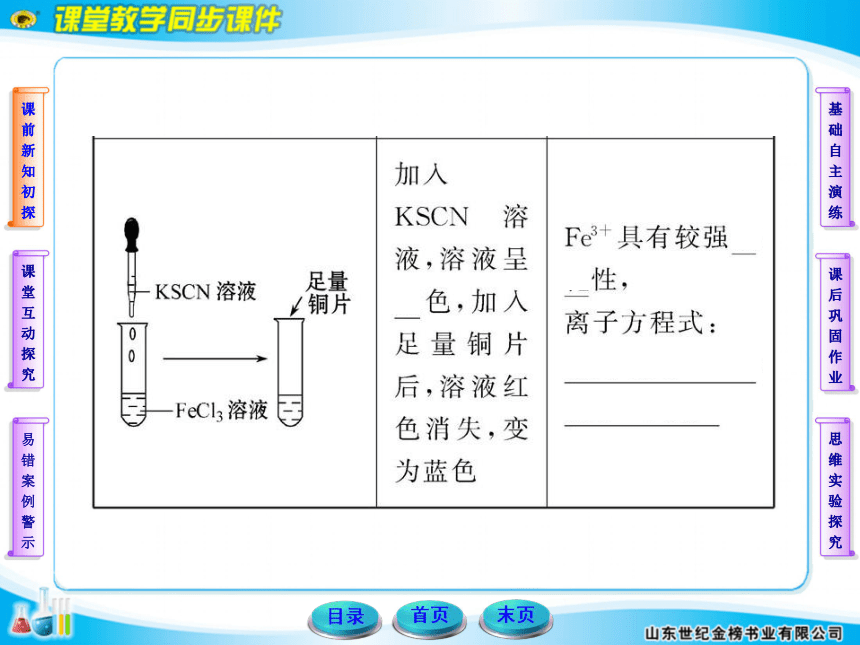
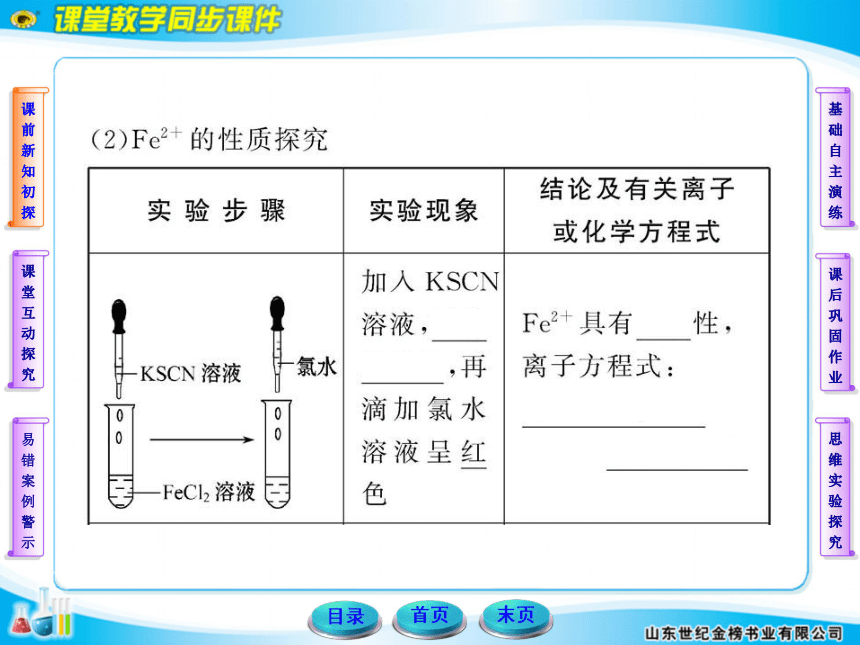
某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可少的一种玻璃仪器是___________。
(2)请帮他们完成以下实验报告:
【实验目的】_____________________________________。
【试剂】铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
【实验记录】(划斜线部分不必填写)
【实验结论】
Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
【联想发散】
简述Fe2+的检验方法:______________________________。
【解析】本题是根据新课标对考生探究能力的要求而设计
的,包括设计实验、选择仪器、填写实验报告以及对结果
进行分析、综合、迁移的能力。其中,相对较难的是最后
的联想发散部分。检验Fe2+的方法不止一种,例如在含有
Fe2+的溶液中加入NaOH溶液,可以生成白色的氢氧化亚铁
沉淀,而氢氧化亚铁具有很强的还原性,少量氢氧化亚铁
立即被溶解在水中的氧气氧化,使沉淀颜色变为灰绿色,
然后逐渐被空气中的氧气氧化,直至完全转化成红褐色的
氢氧化铁沉淀;再如,在含有Fe2+的溶液中加入KSCN溶
液,不会出现红色,然后滴加适量氯水,可以把Fe2+氧化成
Fe3+,Fe3+与SCN-反应得到红色溶液。将FeCl2溶液加热蒸干过程中,HCl挥发,促使Fe2+的水解平衡向右移动,生成的氢氧化亚铁很快被氧化成氢氧化铁,灼烧时氢氧化铁分解生成Fe2O3。
答案:(1)试管
(2)【实验目的】探究铁及其化合物的氧化性和还原性
【实验记录】①Cl2+2Fe2+====2Cl-+2Fe3+②Fe2+具有氧化性
③铁粉逐渐溶解,溶液由棕黄色变为浅绿色
④在FeCl3溶液中加入铜片
【联想发散】取适量待测液于试管中,滴加少量KSCN溶液,无红色出现,在混合液中滴入少量氯水,溶液变为红色,则证明有Fe2+(或其他合理答案)
【典例1】用下面两种方法可以制得白色的
Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀硫酸和_____。
(2)除去蒸馏水中溶解的O2常采用_____的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是____________________________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备。
(1)在试管Ⅰ里加入的试剂是_____________________。
(2)在试管Ⅱ里加入的试剂是_____________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是____________________________________________。
【思路点拨】解答本题应注意以下几点:
【自主解答】方法一:(1)由于Fe2+具有较强的还原性易被
氧化为Fe3+,故在配好的溶液中常加一枚铁钉或适量铁屑以
防止其氧化。(2)由于气体的溶解度随温度升高而迅速减
小,故可用加热煮沸的方法除去蒸馏水中溶解的O2。(3)空
气中含有大量的O2,为防止生成的Fe(OH)2沉淀与空气接
触,需将吸取NaOH溶液的长滴管插入液面以下后再挤出溶
液。方法二:(1)由所给试剂及装置特点知,试管Ⅰ为封闭
系统,应为产生H2并赶尽溶液中空气及液面上方空气的装
置,故Ⅰ中加入的试剂为铁屑和稀硫酸。(2)试管Ⅱ中加入
的试剂为NaOH溶液。(3)为确保实验在无氧状态下进行,必须把系统中的O2排除干净,故接下来的操作应为检验试管Ⅱ出口处排出的氢气的纯度,当产生氢气较纯时再夹紧止水夹。(4)由于试管Ⅰ中产生的H2充满了Ⅰ、Ⅱ两支试管,外界空气不易进入,即Fe(OH)2是在H2的还原性气氛中产生的,故Fe(OH)2沉淀的白色可保持较长的时间。
答案:方法一:(1)铁屑 (2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2
方法二:(1)稀硫酸、铁屑 (2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
【互动探究】在制取Fe(OH)2时,若直接向FeSO4溶液中滴入未经煮沸的NaOH溶液,会有什么现象?
提示:现象是首先出现白色沉淀,然后白色沉淀迅速变成灰绿色,最后变成红褐色。
【变式训练】下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应;②Fe与过量稀硫酸反应后,再向其中通入O2;③FeCl2溶于稀硝酸中;④Fe和Fe2O3的混合物溶于盐酸中。
A.只有① B.只有①②
C.只有①②③ D.全部
【解析】选C。①中的Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原。②中Fe与稀硫酸反应只能生成Fe2+,但要注意,由于稀硫酸过量,通入O2后,O2能将Fe2+氧化。③硝酸有强氧化性,能将Fe2+氧化成Fe3+。④中首先发生Fe与盐酸生成FeCl2、Fe2O3与盐酸生成FeCl3的反应,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
【典例2】将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是
A.FeO B.Fe2O3
C.FeCl3 D.Fe2(SO4)3
【思路点拨】解答本题的关键点是:
【自主解答】选A。由题意可知,A中的Fe2+与SCN-结合没有颜色改变,但加入氯水后发生反应,生成Fe3+,溶液变为红色。方程式为2Fe2++Cl2====2Fe3++2Cl-,Fe3++3SCN- ====Fe(SCN)3。
【互动探究】上题中若改成“将下列四种铁的化合物溶于水中,滴加KSCN溶液即呈红色的是”答案是什么?
提示:滴加KSCN溶液即呈红色,即溶于水后能电离出Fe3+,则选C、D。
【变式训练】在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,将所剩余的固体滤出,固体能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+
C.Fe2+ D.H+
【解析】选C。本题考查的知识点是铁单质的物理性质及离子共存问题。解答此题要考虑到铁的物理性质:能被磁铁吸引,说明铁有剩余。铁具有还原性,而Cu2+、Fe3+、Fe2+、H+等都具有氧化性,能够与铁反应的离子不能大量存在。Cu2+、Fe3+以及H+三种离子不能大量存在,其中Fe被氧化成Fe2+,而Cu2+、Fe3+、H+三种离子被还原成Cu、Fe2+、H2,所以溶液中Fe2+最多。Fe与Fe2+相互间不反应。
【典例】已知X为FeO和CuO的混合物,取两份等质量的X样品进行如图所示实验:
(1)写出第③步反应的离子方程式:_________________。
(2)实验从第③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L。试计算取用的每份X中FeO与CuO的质量比。
【思路点拨】做本题的关键点有两个:
【自主解答】(1)按图顺序正推,依次写出①~③各步反应
即得答案:
①FeO+2HCl====FeCl2+H2O
CuO+2HCl====CuCl2+H2O
②FeO+CO Fe+CO2
CuO+CO Cu+CO2
③Fe+Cu2+====Fe2++Cu
Fe+2H+====Fe2++H2↑
△
====
△
====
(2)由E为酸性溶液,可知固体D是铜单质。根据铜原子守恒,每份X中CuO的物质的量为:
32 g/64 g·mol-1×1/2=0.25 mol
其质量为:0.25 mol×80 g·mol-1=20 g
每份X中FeO的物质的量为:
0.25 mol+5.6 L/22.4 L·mol-1=0.50 mol
其质量为:0.50 mol×72 g·mol-1=36 g
所以,每份X中FeO与CuO的质量比为:36 g∶20 g=9∶5。
答案:(1)Fe+Cu2+====Fe2++Cu,
Fe+2H+====Fe2++H2↑
(2)9∶5
【互动探究】请写出上题中第①步反应的离子方程式。
提示:上题中第一步反应的离子方程式如下:
FeO+2H+====Fe2++H2O
CuO+2H+====Cu2++H2O
【变式训练】某酸性工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
(1)方框内物质A和B的化学式:
A______,B______。
(2)根据图示可知,第①步有关离子方程式为__________。
(3)第②步的化学方程式为__________________________。
【解析】(1)由图示可知,当加入过量的A时,铜未溶解而铁已经完全溶解,说明加入的是一种酸,这种酸只溶解铁,又因为不能加入杂质离子,所以只能是盐酸。所以得到的滤液是FeCl2溶液,所以要转化成FeCl3,只能是通入氯气。
(2)第①步的有关离子方程式为:Fe+2H+====Fe2++H2↑、 Fe+2Fe3+====3Fe2+、Cu2++Fe====Cu+Fe2+
(3)第②步的化学方程式为:2FeCl2+Cl2====2FeCl3
答案:(1)盐酸 Cl2
(2)Fe+2H+====Fe2++H2↑、Fe+2Fe3+====3Fe2+、Cu2++Fe====Cu+Fe2+
(3)2FeCl2+Cl2====2FeCl3
【典例1】下列关于铁及其化合物的说法正确的是
A.铁是地壳中含量最多的金属元素,因此在日常生活中应用最广
B.FeCl2溶液存放时,在溶液中放入少量的铁粉,目的是防止Fe2+被氧化
C.隔绝空气的情况下,FeCl2溶液中加入Na2O2后得到白色沉淀Fe(OH)2
D.FeO、Fe2O3、Fe3O4均为铁的氧化物,并且都是碱性氧化物
【易错选项】C
【易错剖析】(1)易错选项分析
错选C原因在于对知识的掌握不熟练,导致不能很好的利用所学知识解决实际问题。虽然隔绝空气,但Na2O2加入到FeCl2溶液中后,Na2O2与水反应生成NaOH,同时Na2O2本身具有较强的氧化性,会把Fe2+氧化成Fe3+。因此FeCl2溶液中加入Na2O2后得到的应该是红褐色的Fe(OH)3沉淀。
(2)其他错误选项分析
【标准答案】B
【典例2】要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③②
C.③① D.①②③
【易错选项】B
【易错剖析】(1)易错选项分析
本题易错选B的原因在于不能将理论与实际相结合来分析问题。本题考查Fe3+的检验和Fe2+的还原性,及Fe3+遇SCN-会生成红色物质的特性。加入NH4SCN证明无Fe3+,再加KMnO4溶液,如有Fe2+则可被氧化为Fe3+而使NH4SCN变红色。但KMnO4本身为紫色,使Fe3+和NH4SCN显色不易观察。故B选项错误。
(2)其他错误选项分析:
①错选A项:
原因在于逻辑思维不条理。抓不住问题的关键点。该实验目的是为了证明某溶液中不含Fe3+而可能含有Fe2+,二者是有先后顺序的,且顺序不能颠倒。若先加入足量氯水,再加入少量NH4SCN,Fe3+和Fe2+是否存在均得不到证明。
②错选D项:
原因在于知识欠缺,不具备应用所学知识去解决问题的能力。
【标准答案】C
1.盐酸和氯气都可以与铁反应,化学方程式: 2Fe+3Cl2
2FeCl3、Fe+2HCl====FeCl2+H2↑,从产物的比较可得出氯
气比盐酸强的性质是( )
A.氧化性 B.还原性
C.酸性 D.金属性
【解析】选A。根据两个反应可知,氯气将铁氧化为
FeCl3,而盐酸只是把铁氧化为FeCl2,所以在氧化性上氯
气强于盐酸。
点燃
====
2.下列物质能将Fe2+氧化为Fe3+,且能使单质Fe由0价变为+3价的是( )
A.氢气 B.氯气
C.浓盐酸 D.稀硫酸
【解析】选B。能将Fe2+氧化为Fe3+的物质,就能使单质Fe由0价变为+3价;能使单质Fe由0价变为+3价的物质,也就能将Fe2+氧化为Fe3+。氯气符合题意,氢气不能氧化Fe2+,浓盐酸和稀硫酸只能使单质Fe由0价变为+2价,A、C、D三项不符合题意。
3.下面是有关操作或者常见现象,其中不属于氧化还原反应的是( )
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气[主要成分为甲烷(CH4)]为炒菜提供热量
C.牛奶久置变质
D.把1 mL饱和三氯化铁溶液逐滴加入到20 mL沸水中
【解析】选D。FeCl3溶液滴入沸水中可生成Fe(OH)3胶体,不是氧化还原反应,而其他选项均是生活中常见的反应,且都是氧化还原反应。
4.(2011·哈尔滨高一检测)下列关于Fe2+和Fe3+的叙述中,错误的是( )
A.Fe2+的水溶液为浅绿色
B.Fe2+既有氧化性,又有还原性
C.Fe3+的水溶液为黄色
D.Fe3+溶液中滴入SCN-,立即出现红色沉淀
【解析】选D。Fe2+为浅绿色,Fe3+为黄色,A、C均正确;由于Fe2+处于中间价态,既有氧化性又有还原性,B正确;Fe3+溶液中滴入SCN-,溶液变红色而非生成红色沉淀,D错误。
5.怎样用化学方法除去下列物质中混有的少量杂质,写出有关反应的离子方程式。
(1)铜粉中混有铁粉____________________________;
(2)铁粉中混有铝粉____________________________;
(3)FeCl2溶液中混有FeCl3_______________________;
(4)FeCl2溶液中混有CuCl2_______________________;
(5)FeCl3溶液中混有FeCl2_______________________。
【解析】根据“铁三角”中的有关转化方程式就可以得出答案。
答案:(1)加入过量盐酸过滤,Fe+2H+====Fe2++H2↑
(2)加入过量NaOH过滤,
2Al+2OH-+2H2O====2AlO2- +3H2↑
(3)加入过量铁粉,Fe+2Fe3+====3Fe2+
(4)加入过量铁粉过滤,Cu2++Fe====Fe2++Cu
(5)通入Cl2,2Fe2++Cl2====2Fe3++2Cl-
6.(2011·广州高一检测)铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行Fe2+ Fe3+的转化,A中Fe2+做____
剂,B中Fe3+做_____剂。
(2)“服用维生素C,可使食物中的三价铁离子还原成二价
铁离子。”这句话指出维生素C在这一反应中做_____剂,
具有_____性。
A
B
【解析】(1)A反应是由Fe2+转化为Fe3+的反应,这个过程是一个化合价升高的过程,所以Fe2+作还原剂。反之,B中Fe3+作氧化剂。
(2)由于维生素C可以将Fe3+转化成Fe2+,所以维生素C作还原剂,具有还原性。
答案:(1)还原 氧化 (2)还原 还原
一、选择题(本题包括9小题,每小题3分,共27分)
1.纯净铁的物理性质有( )
①光亮的银白色 ②黑色
③在潮湿空气中易腐蚀 ④有延展性
⑤能导电导热 ⑥硬而脆
⑦能被磁铁吸引,易被磁化 ⑧密度比铝小
A.①③④⑤⑦ B.①④⑤⑦ C.①③⑤⑦ D.全部
【解析】选B。通常情况下,纯净的铁是一种银白色的重金属,具有金属的通性(导电性、导热性和延展性),密度比铝的大,能够被磁铁吸引产生磁性。在潮湿空气中易生锈而被腐蚀,但该性质属于化学性质,故③不合题意。通常我们所见的铁是灰黑色的,所以在冶金工业上被称为“黑色金属”。
2.能与Fe3+作用,且可证明Fe3+具有氧化性的微粒是( )
①SCN- ②Fe ③Fe2+ ④Cu ⑤OH-
A.②④ B.①③⑤ C.①②⑤ D.除③外
【解析】选A。由于选证明Fe3+具有氧化性的微粒,所以应该选可以和Fe3+发生反应且具有还原性且现象比较明显的物质。
3.(2011·济南高一检测)在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
A.Fe2+ B.Fe3+和Fe2+
C.Cu2+和Fe2+ D.Cu2+
【解析】选A。加入的铁粉是过量的,所以铁粉会和FeCl3、CuCl2完全反应,方程式为:Cu2++Fe====Fe2++Cu,Fe+2Fe3+====3Fe2+。所以,反应完后溶液中的离子就完全变成了Fe2+。
4.将铁片放入下列各溶液中,反应后溶液质量增加,但无气体产生的是( )
A.CuCl2溶液 B.AgNO3溶液
C.Fe2(SO4)3溶液 D.稀硫酸
【解析】选C。
5.下列微粒中,没有氧化性的是( )
A.Cl- B.H+ C.Cl2 D.Fe3+
【解析】选A。元素的最高价态只有氧化性,没有还原性,如B项H+,D项的Fe3+;元素的最低价态只有还原性,没有氧化性,如A项Cl-;Cl2中Cl处于中间价态既有氧化性又有还原性。
6.下列物质能通过化合反应直接制得的是( )
①FeCl2 ②FeCl3 ③Fe(OH)3 ④HCl
A.只有①②③ B.只有②③
C.只有①③④ D.全部
【解析】选D。2FeCl3+Fe====3FeCl2;2Fe+3Cl2
2FeCl3;4Fe(OH)2+O2+2H2O====4Fe(OH)3;H2+Cl2
2HCl。
点燃
====
光照或点燃
=======
7.将足量铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2
溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液
中含有大量的阳离子是( )
A.Cu2+和Fe2+ B.Fe2+和Mg2+
C.Fe3+和Fe2+ D.H+和Cu2+
【解析】选B。溶液中加入过量铁粉发生的反应为:
2Fe3++Fe====3Fe2+ Cu2++Fe====Cu+Fe2+ Fe+2H+====Fe2+
+H2↑,反应后溶液中含有的大量阳离子为Fe2+和Mg2+。
8.(2011·厦门高一检测)根据Fe+Cu2+====Fe2++Cu、
2FeCl3+Cu====2FeCl2+CuCl2两个反应,判断Fe3+、Fe2+、
Cu2+的氧化性顺序为( )
A.Cu2+>Fe2+>Fe3+
B.Fe3+>Fe2+>Cu2+
C.Fe3+>Cu2+>Fe2+
D.Fe2+>Fe3+>Cu2+
【解析】选C。依方程Fe+Cu2+====Fe2++Cu,氧化性Cu2+
>Fe2+。又因为2FeCl3+Cu====2FeCl2+CuCl2,氧化性
Fe3+>Cu2+。所以选C。
9.只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、FeCl3、Al2(SO4)3、(NH4)2SO4六种溶液,这种试剂是( )
A.Ba(OH)2 B.H2S
C.NaOH D.AgNO3
【解析】选C。本题极易错选A。在选Ba(OH)2的时候,Na2SO4和Al2(SO4)3不易区分,因为都能生成BaSO4沉淀。虽然Al2(SO4)3在Ba(OH)2过量时,会部分溶解,但现象不会很明显。
二、非选择题(本题包括4小题,共23分)
10.(6分)在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成_____而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的_____气体。它们把该红色物质还原成黑色的化合物是_____,同时还有未燃烧的碳的颗粒而制得了青色砖瓦。
【解析】从窑顶向下加水发生下列反应:C+H2O(g)
CO+H2。CO和H2都具有还原性,可将Fe2O3还原至Fe3O4、
FeO,需注意铁的氧化物的颜色。
答案:Fe2O3 CO和H2 Fe3O4和FeO
高温
====
11.(6分)印刷电路板是由塑料和铜箔复合而成的,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下:
Cu+2FeCl3====CuCl2+2FeCl2
(1)请在上式中标出电子转移的方向和数目。
(2)该反应的氧化剂是_____。
(3)写出FeCl3的电离方程式_____。
(4)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是_____(填序号)。
A.氯气 B.铁 C.铜 D.稀硫酸
【解析】使用过的腐蚀液中含有CuCl2、FeCl2和FeCl3,要想将其中的Fe2+转化为Fe3+,首先要加入足量的铁粉将Cu2+转化为Cu,同时Fe转化为Fe2+,过滤后通入足量氯气将Fe2+氧化为Fe3+。
答案:(1)
(2)FeCl3 (3)FeCl3====Fe3++3Cl- (4)A
12.(4分)将一定量的铁粉加入含稀硝酸、Fe(NO3)3和Cu(NO3)2的混合溶液中,充分反应后过滤,将滤出的固体物质加入稀盐酸中。
(1)若有气体放出,则滤液中存在的金属阳离子为______
_________________________________________________。
(2)若无气体放出,则滤液中存在的金属阳离子为______
_________________________________________________。
【解析】本题考查铁的单质及化合物的性质,分析中宜从终态考虑。据题意(1)中剩余物是铁,因此与铁反应的微粒(或物质)均不能存在,溶液中金属阳离子只有Fe2+;(2)中剩余物为铜;与铜反应的物质均不存在,溶液中阳离子一定有Fe2+(铁都转化为Fe2+),Cu2+有可能存在,也可能不存在。
答案:(1)Fe2+ (2)一定有Fe2+,可能有Cu2+
13.(7分)(挑战能力)某物质A的水溶液有如下性质:
根据以上实验现象分析可得:
(1)A_____,B_____,C_____(填化学式)。
(2)加入氯气后溶液变为红色的离子方程式是__________。
【解析】A与Ag+反应生成不溶于稀硝酸的白色沉淀,说明沉淀为AgCl,A中必定含有Cl-。而往滤液C中加NH4SCN溶液后无现象,但通入氯气后溶液变为红色,说明加入氯气后溶液中生成了Fe3+,Fe3+从何而来是解决问题的关键。通入氯气后才会出现Fe3+,说明原溶液中一定含有Fe2+。
答案:(1)FeCl2 AgCl Fe(NO3)2
(2)2Fe2++Cl2====2Fe3++2Cl-,
Fe3++3SCN-====Fe(SCN)3
某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可少的一种玻璃仪器是___________。
(2)请帮他们完成以下实验报告:
【实验目的】_____________________________________。
【试剂】铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
【实验记录】(划斜线部分不必填写)
【实验结论】
Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
【联想发散】
简述Fe2+的检验方法:______________________________。
【解析】本题是根据新课标对考生探究能力的要求而设计
的,包括设计实验、选择仪器、填写实验报告以及对结果
进行分析、综合、迁移的能力。其中,相对较难的是最后
的联想发散部分。检验Fe2+的方法不止一种,例如在含有
Fe2+的溶液中加入NaOH溶液,可以生成白色的氢氧化亚铁
沉淀,而氢氧化亚铁具有很强的还原性,少量氢氧化亚铁
立即被溶解在水中的氧气氧化,使沉淀颜色变为灰绿色,
然后逐渐被空气中的氧气氧化,直至完全转化成红褐色的
氢氧化铁沉淀;再如,在含有Fe2+的溶液中加入KSCN溶
液,不会出现红色,然后滴加适量氯水,可以把Fe2+氧化成
Fe3+,Fe3+与SCN-反应得到红色溶液。将FeCl2溶液加热蒸干过程中,HCl挥发,促使Fe2+的水解平衡向右移动,生成的氢氧化亚铁很快被氧化成氢氧化铁,灼烧时氢氧化铁分解生成Fe2O3。
答案:(1)试管
(2)【实验目的】探究铁及其化合物的氧化性和还原性
【实验记录】①Cl2+2Fe2+====2Cl-+2Fe3+②Fe2+具有氧化性
③铁粉逐渐溶解,溶液由棕黄色变为浅绿色
④在FeCl3溶液中加入铜片
【联想发散】取适量待测液于试管中,滴加少量KSCN溶液,无红色出现,在混合液中滴入少量氯水,溶液变为红色,则证明有Fe2+(或其他合理答案)
