11-12版高中化学全程学习方略配套课件:3.2.1自然界中的氮的循环 氮气 一氧化氮和二氧化氮(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:3.2.1自然界中的氮的循环 氮气 一氧化氮和二氧化氮(鲁科版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-14 09:09:30 | ||
图片预览








文档简介
(共56张PPT)
【典例】用排水法收集12 mL NO于试管中,
然后向倒立于水槽中的该试管内间歇地通入O2共12 mL,下面的说法中,正确的是
A.剩余NO
B.剩余NO2
C.试管中气体为红棕色
D.试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无色气体
【思路点拨】解答本题要注意以下两点:
【自主解答】选D。向NO中间歇通入O2发生的反应为:2NO+O2====2NO2①,3NO2+H2O====2HNO3+NO②,由①×3+②×2得:4NO+3O2+2H2O====4HNO3,等体积的NO和O2反应最后剩余O2。
【互动探究】1.若将通入O2的体积改为6 mL,剩余气体是什么?体积是多少?
提示:根据4NO+3O2+2H2O====4HNO3知6 mL O2可消耗8 mL NO,剩余气体是NO,体积是4 mL。
2.若将题中的12 mL NO 换作54 mL NO2,剩余气体是什么?体积是多少?
提示:根据总反应式4NO2+O2+2H2O====4HNO3可知12 mL O2可消耗48 mL NO2,NO2过量6 mL,根据3NO2+H2O====2HNO3+
NO,剩余气体为2 mL NO。
【规律方法】(1)“4NO2+O2”和“4NO+3O2”从组成上均相当于“2N2O5”的组成,也就是两种情况均可利用混合气体中的N、O原子个数比进行分析:
(2)若是NO、NO2、O2三种气体溶于水时,可先由反应3NO2+H2O====2HNO3+NO求出生成的NO的体积,再加上原气体中的NO的体积即为NO的总体积,再按4NO+3O2+2H2O
====4HNO3进行计算。
【变式训练】同温同压下,在3支相同体积的试管中分别充有以下三种气体,①等体积混合的NO和NO2,②NO2,③等体积混合的NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3>V1>V2
【解析】选B。①NO不与水反应,设原有NO、NO2各3体积,则由反应3NO2+H2O====2HNO3+NO知3体积的NO2与H2O反应后,变为1体积NO,此时剩余NO的总体积与原来气体的体积比为4∶6;
②剩余气体体积与原来体积比为1∶3;③N2不与水反应,NH3极易溶于水,所以气体剩余体积为原来一半。显然有V1>V3>V2。
【典例】标准状况下,一烧瓶中盛有200 mL NO和NO2的混合气体,现将烧瓶倒扣于水槽中并缓慢通入O2,当通入
100 mL O2充分反应后,烧瓶内无气体剩余,NO和NO2的体积分别是多少?
【思路点拨】
【自主解答】整个过程中NO和NO2失电子生成HNO3, O2得电子从0价降低到-2价,设NO和NO2的体积分别是x、y
由得失电子数相等列式:
3x+y=100 mL×4
又:x+y=200 mL
解得,x=100 mL y=100 mL
答案:NO:100 mL NO2:100 mL
【互动探究】(1)烧瓶内所得溶液的物质的量浓度是多少?
提示:由原子守恒n(HNO3)=n(NO+ NO2)=(200×10-3 L)/
22.4 L·mol-1,c(HNO3)=n(HNO3)/(200×10-3 L)=
0.045 mol·L-1
(2)若烧瓶内的气体全部是NO2或NO,烧瓶内所得溶液的物质的量浓度有区别吗?
提示:没有。由氮原子守恒知n(HNO3)相同。
【变式训练】有一在空气中暴露过的KOH固体,经分析知其内含水7.62%,K2CO3 2.38%,KOH 90%,若将此样品1 g加到1 mol/L的46.00 mL硝酸里,过量的酸再用1.07 mol/L的KOH溶液中和,蒸发中和后的溶液可得固体多少克?
【解析】蒸发溶液后的固体为KNO3,NO3-全部来源于硝酸,即n(KNO3)=n(HNO3)=0.046 mol,故m(KNO3)=0.046 mol×
101 g·mol-1=4.646 g
答案:4.646 g
【典例】下列有关氮气的说法正确的是
A.氮气是由氮原子构成的双原子分子,所以化学性质不活
泼
B.1 mol N2可与3 mol H2完全反应生成2 mol NH3
C.电闪雷鸣的雨天,雨水中会含有一定量的硝酸,其中发
生的反应之一是N2+2O2 2NO2
D.NO、NO2在一定条件下可相互转化,且二者都是引起光化
学烟雾的大气污染物
【易错选项】B
放电
====
【易错剖析】(1)易错选项分析
本题易错选B的原因在于抓不住可逆反应的特征,N2与H2的反应属于可逆反应,不能进行彻底,所以1 molN2和3 mol
H2不可能完全反应生成2 molNH3。
(2)其他错误选项分析
①错选A项:
原因在于不能充分利用结构决定性质的关系分析解决问题。氮气性质稳定的原因是两个氮原子之间共用三对电子,破坏这种结构时需要很高的能量,所以氮气化学性质不活泼。
②错选C项:
原因在于知识记忆不准确,N2与O2放电时可生成NO,不能直接生成NO2。
【标准答案】D
1.下列关于一氧化氮的叙述正确的是( )
A.一氧化氮没有毒
B.二氧化氮溶于水可制得一氧化氮
C.一氧化氮可以由氮气和氧气在高温条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
【解析】选B 。一氧化氮是难溶于水、有毒的气体,可用排水法收集;二氧化氮与水反应可制得一氧化氮和硝酸;氮气和氧气在放电条件下生成一氧化氮,不能在高温条件下直接化合。
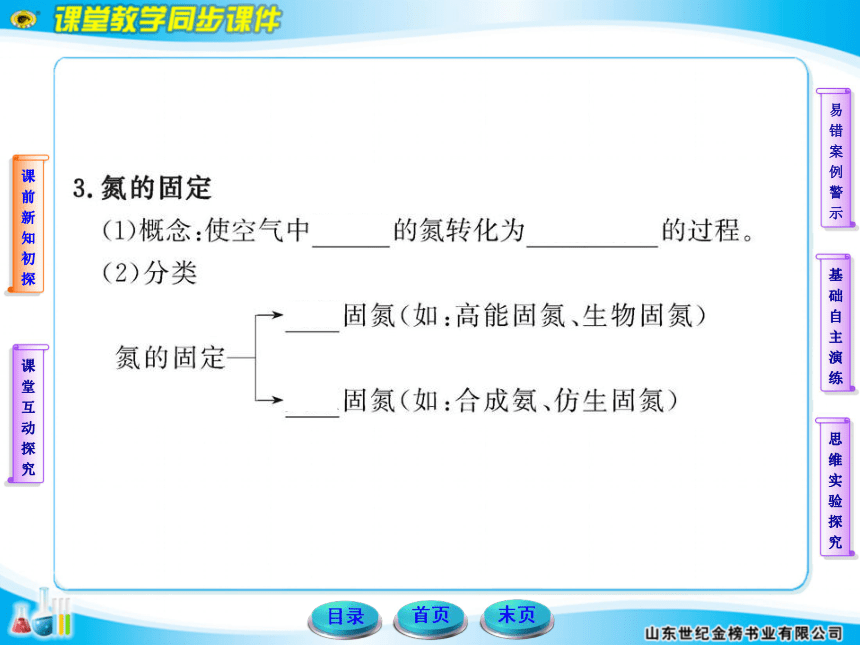
2.下列反应属于氮的固定的是( )
A.工业合成氨
B.由氨气制备碳酸氢铵
C.铜与浓硝酸反应产生NO2
D.NH4Cl与Ca(OH)2反应生成NH3
【解析】选A。氮的固定是指使空气中游离态的氮转化为化合态的氮,B 、C、D三个选项中的反应物都是氮的化合物,不符合题意。
3.搭载着“嫦娥二号”卫星的“长征三号”丙运载火箭的推进剂引燃后产生的气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红色烟雾。产生红色烟雾的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2遇NO反应生成CO和NO2
D.NO和 H2O反应生成H2和NO2
【解析】选B。根据火箭喷出的大量红色烟雾可推知其应是NO2,而高温下N2与O2不能生成NO2。
4.在体积为V L的密闭容器中通入a mol NO、b mol O2,反
应容器内氮原子数和氧原子数之比为( )
A. B. C. D.
【解析】选C。反应前a mol NO中含N、O的原子数都是
a mol,b mol O2中含2b mol 氧原子,根据质量守恒定律,
N原子和O原子的个数比在反应前后不变,应等于 ,
故正确答案为C。
5.NO是一种剧毒气体,但近年来发现许多生物体组织中存在少量NO,它有扩张血管、提高免疫力、增强记忆的功能,因而成为当前生命科学的研究热点。
(1)写出自然界形成NO的化学方程式:______________。
(2)地球外层空间存在着微量的臭氧和氧原子,臭氧层的存
在能吸收和阻挡太阳中有害的紫外线辐射,人为大气污染
可破坏臭氧层,如超音速飞机排放物中的氮氧化物可在大
气层中发生反应:
NO+O3====NO2+O2…………………………①
NO2+O====NO+O2 …………………………②
上述反应①中,NO是_____剂,上述反应②中,NO是_____
产物;整个过程中的总反应方程式为______,整个过程中
NO所起的作用是_________。
(3)为了消除NO对环境的污染,根据氧化还原反应原理,可选用NH3使NO与之反应转化为两种无毒气体(其中之一是水蒸气),该反应需要催化剂参加,其化学方程式为_______。
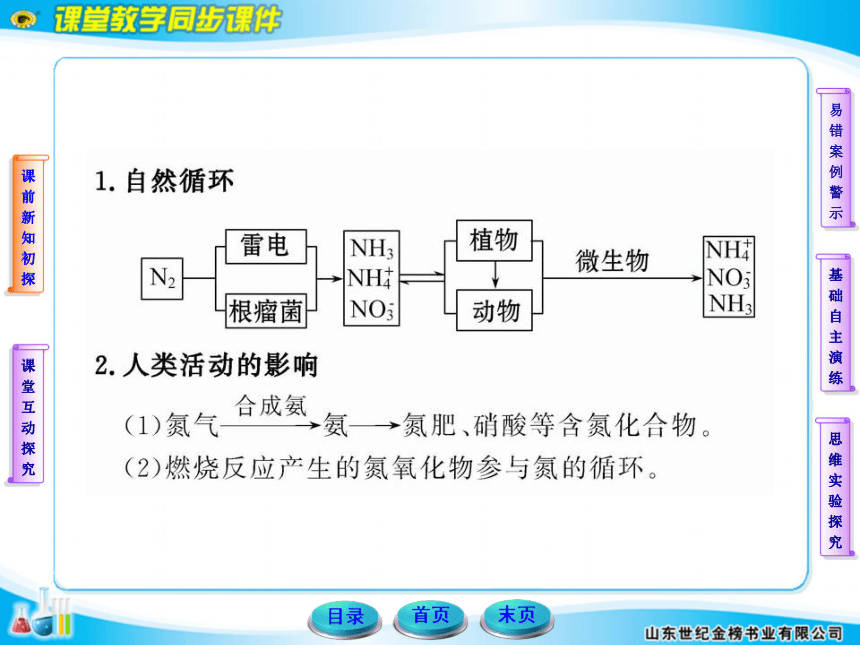
【解析】(1)自然界中氮气和氧气在闪电作用下可生成一氧化氮;
(2)反应①和反应②相加即得总反应方程式;
(3)NH3使NO转化成的无毒气体应是氮气和水蒸气。
答案:(1)N2+O2 2NO
(2)还原 还原 O3+O====2O2 催化剂
(3)4NH3+6NO 5N2+6H2O
放电
====
催化剂
====
6.氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
2NO2+2NO+4NaOH====4NaNO2+2H2O ①,
2NO2+2NaOH====NaNO2+NaNO3+H2O ②,
在反应①中,氧化剂是_____,还原剂是_____。
在反应②中,氧化剂和还原剂的物质的量之比为_____。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成N2和CO2,该反应的化学方程式为______________________________。
【解析】(1)在反应①中NO2中的氮元素化合价降低作氧化剂,NO中氮元素化合价升高作还原剂;在反应②中氧化剂和还原剂都是NO2,2 mol NO2中有1 mol化合价升高(生成NaNO3)作还原剂,1 mol化合价降低(生成NaNO2)作氧化剂,故氧化剂和还原剂的物质的量之比为1∶1。
(2)根据质量守恒定律结合题目信息可写出反应的化学方程式。
答案:(1)NO2 NO 1∶1
(2)2CO+2NO 2CO2+N2
催化剂
====
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理(装置气密性已检查完毕)。
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,从滴定管中向广口瓶①中加入水
②从导管a通入一定量的NO,并记录滴定管液面变化的示数为V L(V<0.05 L,气体体积已换算为标准状况)。
(2)验证NO的还原性;探究工业生产硝酸的原理
①停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可观察到的现象是____,写出对应现象的化学反应方程式_____、_____;
②继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
Ⅰ.当通入氧气的体积为 V时,则广口瓶①中剩余的气体
体积为_______;
Ⅱ.当广口瓶①中刚好充满液体时,所得溶液的物质的量浓
度为_________mol/L。
【解析】(2)NO遇到O2,生成红棕色的NO2,NO2遇水又生成
无色的NO;化学方程式相加可得
4NO+3O2+2H2O====4HNO3
V(NO)=4/3 V(O2)= V×4/3= V
剩余气体体积为V/3
生成n(HNO3)=n(NO)=V÷22.4 L/ mol
c(HNO3)= mol÷0.5 L=V/11.2 mol/L
答案:(2)①气体先变为红棕色,然后逐渐变淡
2NO+O2====2NO2 3NO2+H2O====2HNO3 + NO
②Ⅰ.V/3 Ⅱ.V/11.2
【典例】用排水法收集12 mL NO于试管中,
然后向倒立于水槽中的该试管内间歇地通入O2共12 mL,下面的说法中,正确的是
A.剩余NO
B.剩余NO2
C.试管中气体为红棕色
D.试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无色气体
【思路点拨】解答本题要注意以下两点:
【自主解答】选D。向NO中间歇通入O2发生的反应为:2NO+O2====2NO2①,3NO2+H2O====2HNO3+NO②,由①×3+②×2得:4NO+3O2+2H2O====4HNO3,等体积的NO和O2反应最后剩余O2。
【互动探究】1.若将通入O2的体积改为6 mL,剩余气体是什么?体积是多少?
提示:根据4NO+3O2+2H2O====4HNO3知6 mL O2可消耗8 mL NO,剩余气体是NO,体积是4 mL。
2.若将题中的12 mL NO 换作54 mL NO2,剩余气体是什么?体积是多少?
提示:根据总反应式4NO2+O2+2H2O====4HNO3可知12 mL O2可消耗48 mL NO2,NO2过量6 mL,根据3NO2+H2O====2HNO3+
NO,剩余气体为2 mL NO。
【规律方法】(1)“4NO2+O2”和“4NO+3O2”从组成上均相当于“2N2O5”的组成,也就是两种情况均可利用混合气体中的N、O原子个数比进行分析:
(2)若是NO、NO2、O2三种气体溶于水时,可先由反应3NO2+H2O====2HNO3+NO求出生成的NO的体积,再加上原气体中的NO的体积即为NO的总体积,再按4NO+3O2+2H2O
====4HNO3进行计算。
【变式训练】同温同压下,在3支相同体积的试管中分别充有以下三种气体,①等体积混合的NO和NO2,②NO2,③等体积混合的NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3>V1>V2
【解析】选B。①NO不与水反应,设原有NO、NO2各3体积,则由反应3NO2+H2O====2HNO3+NO知3体积的NO2与H2O反应后,变为1体积NO,此时剩余NO的总体积与原来气体的体积比为4∶6;
②剩余气体体积与原来体积比为1∶3;③N2不与水反应,NH3极易溶于水,所以气体剩余体积为原来一半。显然有V1>V3>V2。
【典例】标准状况下,一烧瓶中盛有200 mL NO和NO2的混合气体,现将烧瓶倒扣于水槽中并缓慢通入O2,当通入
100 mL O2充分反应后,烧瓶内无气体剩余,NO和NO2的体积分别是多少?
【思路点拨】
【自主解答】整个过程中NO和NO2失电子生成HNO3, O2得电子从0价降低到-2价,设NO和NO2的体积分别是x、y
由得失电子数相等列式:
3x+y=100 mL×4
又:x+y=200 mL
解得,x=100 mL y=100 mL
答案:NO:100 mL NO2:100 mL
【互动探究】(1)烧瓶内所得溶液的物质的量浓度是多少?
提示:由原子守恒n(HNO3)=n(NO+ NO2)=(200×10-3 L)/
22.4 L·mol-1,c(HNO3)=n(HNO3)/(200×10-3 L)=
0.045 mol·L-1
(2)若烧瓶内的气体全部是NO2或NO,烧瓶内所得溶液的物质的量浓度有区别吗?
提示:没有。由氮原子守恒知n(HNO3)相同。
【变式训练】有一在空气中暴露过的KOH固体,经分析知其内含水7.62%,K2CO3 2.38%,KOH 90%,若将此样品1 g加到1 mol/L的46.00 mL硝酸里,过量的酸再用1.07 mol/L的KOH溶液中和,蒸发中和后的溶液可得固体多少克?
【解析】蒸发溶液后的固体为KNO3,NO3-全部来源于硝酸,即n(KNO3)=n(HNO3)=0.046 mol,故m(KNO3)=0.046 mol×
101 g·mol-1=4.646 g
答案:4.646 g
【典例】下列有关氮气的说法正确的是
A.氮气是由氮原子构成的双原子分子,所以化学性质不活
泼
B.1 mol N2可与3 mol H2完全反应生成2 mol NH3
C.电闪雷鸣的雨天,雨水中会含有一定量的硝酸,其中发
生的反应之一是N2+2O2 2NO2
D.NO、NO2在一定条件下可相互转化,且二者都是引起光化
学烟雾的大气污染物
【易错选项】B
放电
====
【易错剖析】(1)易错选项分析
本题易错选B的原因在于抓不住可逆反应的特征,N2与H2的反应属于可逆反应,不能进行彻底,所以1 molN2和3 mol
H2不可能完全反应生成2 molNH3。
(2)其他错误选项分析
①错选A项:
原因在于不能充分利用结构决定性质的关系分析解决问题。氮气性质稳定的原因是两个氮原子之间共用三对电子,破坏这种结构时需要很高的能量,所以氮气化学性质不活泼。
②错选C项:
原因在于知识记忆不准确,N2与O2放电时可生成NO,不能直接生成NO2。
【标准答案】D
1.下列关于一氧化氮的叙述正确的是( )
A.一氧化氮没有毒
B.二氧化氮溶于水可制得一氧化氮
C.一氧化氮可以由氮气和氧气在高温条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
【解析】选B 。一氧化氮是难溶于水、有毒的气体,可用排水法收集;二氧化氮与水反应可制得一氧化氮和硝酸;氮气和氧气在放电条件下生成一氧化氮,不能在高温条件下直接化合。
2.下列反应属于氮的固定的是( )
A.工业合成氨
B.由氨气制备碳酸氢铵
C.铜与浓硝酸反应产生NO2
D.NH4Cl与Ca(OH)2反应生成NH3
【解析】选A。氮的固定是指使空气中游离态的氮转化为化合态的氮,B 、C、D三个选项中的反应物都是氮的化合物,不符合题意。
3.搭载着“嫦娥二号”卫星的“长征三号”丙运载火箭的推进剂引燃后产生的气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红色烟雾。产生红色烟雾的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2遇NO反应生成CO和NO2
D.NO和 H2O反应生成H2和NO2
【解析】选B。根据火箭喷出的大量红色烟雾可推知其应是NO2,而高温下N2与O2不能生成NO2。
4.在体积为V L的密闭容器中通入a mol NO、b mol O2,反
应容器内氮原子数和氧原子数之比为( )
A. B. C. D.
【解析】选C。反应前a mol NO中含N、O的原子数都是
a mol,b mol O2中含2b mol 氧原子,根据质量守恒定律,
N原子和O原子的个数比在反应前后不变,应等于 ,
故正确答案为C。
5.NO是一种剧毒气体,但近年来发现许多生物体组织中存在少量NO,它有扩张血管、提高免疫力、增强记忆的功能,因而成为当前生命科学的研究热点。
(1)写出自然界形成NO的化学方程式:______________。
(2)地球外层空间存在着微量的臭氧和氧原子,臭氧层的存
在能吸收和阻挡太阳中有害的紫外线辐射,人为大气污染
可破坏臭氧层,如超音速飞机排放物中的氮氧化物可在大
气层中发生反应:
NO+O3====NO2+O2…………………………①
NO2+O====NO+O2 …………………………②
上述反应①中,NO是_____剂,上述反应②中,NO是_____
产物;整个过程中的总反应方程式为______,整个过程中
NO所起的作用是_________。
(3)为了消除NO对环境的污染,根据氧化还原反应原理,可选用NH3使NO与之反应转化为两种无毒气体(其中之一是水蒸气),该反应需要催化剂参加,其化学方程式为_______。
【解析】(1)自然界中氮气和氧气在闪电作用下可生成一氧化氮;
(2)反应①和反应②相加即得总反应方程式;
(3)NH3使NO转化成的无毒气体应是氮气和水蒸气。
答案:(1)N2+O2 2NO
(2)还原 还原 O3+O====2O2 催化剂
(3)4NH3+6NO 5N2+6H2O
放电
====
催化剂
====
6.氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
2NO2+2NO+4NaOH====4NaNO2+2H2O ①,
2NO2+2NaOH====NaNO2+NaNO3+H2O ②,
在反应①中,氧化剂是_____,还原剂是_____。
在反应②中,氧化剂和还原剂的物质的量之比为_____。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成N2和CO2,该反应的化学方程式为______________________________。
【解析】(1)在反应①中NO2中的氮元素化合价降低作氧化剂,NO中氮元素化合价升高作还原剂;在反应②中氧化剂和还原剂都是NO2,2 mol NO2中有1 mol化合价升高(生成NaNO3)作还原剂,1 mol化合价降低(生成NaNO2)作氧化剂,故氧化剂和还原剂的物质的量之比为1∶1。
(2)根据质量守恒定律结合题目信息可写出反应的化学方程式。
答案:(1)NO2 NO 1∶1
(2)2CO+2NO 2CO2+N2
催化剂
====
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理(装置气密性已检查完毕)。
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,从滴定管中向广口瓶①中加入水
②从导管a通入一定量的NO,并记录滴定管液面变化的示数为V L(V<0.05 L,气体体积已换算为标准状况)。
(2)验证NO的还原性;探究工业生产硝酸的原理
①停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可观察到的现象是____,写出对应现象的化学反应方程式_____、_____;
②继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
Ⅰ.当通入氧气的体积为 V时,则广口瓶①中剩余的气体
体积为_______;
Ⅱ.当广口瓶①中刚好充满液体时,所得溶液的物质的量浓
度为_________mol/L。
【解析】(2)NO遇到O2,生成红棕色的NO2,NO2遇水又生成
无色的NO;化学方程式相加可得
4NO+3O2+2H2O====4HNO3
V(NO)=4/3 V(O2)= V×4/3= V
剩余气体体积为V/3
生成n(HNO3)=n(NO)=V÷22.4 L/ mol
c(HNO3)= mol÷0.5 L=V/11.2 mol/L
答案:(2)①气体先变为红棕色,然后逐渐变淡
2NO+O2====2NO2 3NO2+H2O====2HNO3 + NO
②Ⅰ.V/3 Ⅱ.V/11.2
