11-12版高中化学全程学习方略配套课件:3.3.1自然界中的硫(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:3.3.1自然界中的硫(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-14 09:16:04 | ||
图片预览



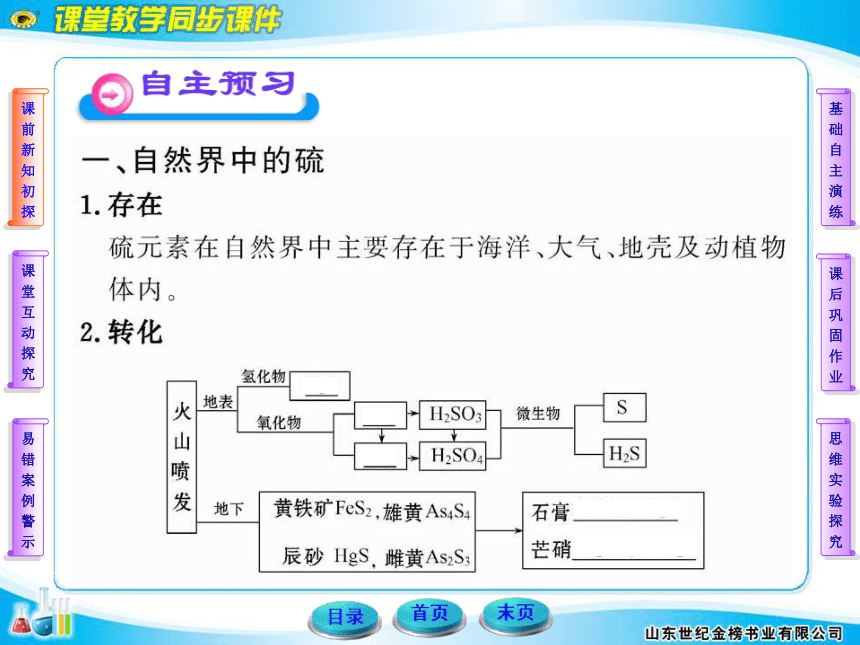








文档简介
(共90张PPT)
【典例】下列关于硫的说法正确的是
A.硫是一种淡黄色的不溶于水的固体
B.铜丝擦亮后伸入硫蒸气中产物是CuS
C.硫与非金属反应均作还原剂
D.1.6 g硫与5.6 g铁反应能得到7.2 g纯净硫化物
【思路点拨】解答本题应注意以下两点:
【自主解答】选A。B项,铜与硫反应生成Cu2S ;C项,硫与非金属H2反应时作氧化剂,与非金属O2反应时作还原剂;D项,Fe与S反应时
Fe + S FeS
56 32 88
2.8 g 1.6 g 4.4 g
即5.6 g 铁和1.6 g S反应时铁过量,反应后得到混合物。
△
====
【互动探究】(1)硫与金属反应时,硫一定作氧化剂吗
提示:金属元素只有正价,没有负价,硫与金属反应时,金属一定被氧化,硫一定作氧化剂。
(2)上述D项反应中转移电子的物质的量是多少?
提示:1.6 g S完全反应,硫元素从0价降低到-2价,转移电子的物质的量为1.6 g/32 g·mol-1×2=0.1 mol。
【变式训练】对于反应:3S+6KOH====2K2S+K2SO3+3H2O,下列说法中正确的是( )
A.硫是氧化剂,KOH是还原剂
B.反应中共转移8 mol电子
C.还原剂和氧化剂的质量比是1∶2
D.氧化产物和还原产物的质量比是1∶2
【解析】选C。从化学方程式看,反应中只有硫元素的化合价变化,硫既是氧化剂又是还原剂;3 mol S中有
2 mol 化合价降低,1 mol化合价升高,氧化剂和还原剂的质量比是2∶1,氧化产物和还原产物的物质的量比是1∶2;3 mol S反应时生成1 mol Na2SO3,转移4 mol电子。
【典例】下列各选项中的杂质,欲用括号内物质除去,其中能达到目的的是
A.CO中混有少量CO2(澄清石灰水)
B.CO2中混有少量氯化氢气体 (NaOH溶液)
C.氯化氢气体中混有少量水蒸气(碱石灰)
D.N2中混有少量O2 (灼热的氧化铜)
【思路点拨】解答本题要注意以下两点:
【自主解答】选A。A项,澄清石灰水能吸收CO2,不能吸收CO,可达到目的;B项,CO2与HCl都和NaOH溶液反应,故不能达到目的;C项,碱石灰能吸收氯化氢;D项,除去O2应选择灼热的铜网。
【互动探究】1.如何除去CO2中混有的CO?
提示:通过灼热的氧化铜,CuO+CO Cu+CO2。
2.除去酸性气体中的水蒸气应选用何种干燥剂?
提示:应选酸性干燥剂,如浓硫酸、五氧化二磷等。
△
====
【变式训练】除去试管壁上附着的硫,可采用的方法是
( )
A.通入氢气后加热
B.伸入灼热的铁丝
C.用水洗涤
D.用二硫化碳洗后再用水洗
【解析】选D。硫与氢气、铁丝在加热条件下反应依然进行很慢,不适于除去试管壁上附着的硫;硫不溶于水,易溶于二硫化碳,可用二硫化碳洗后再用水洗。
【典例】下列说法正确的是
A.硫元素在自然界中既能以游离态形式存在,又能以化合态形式存在
B.Cu与S粉混合加热,可得到CuS
C.洗涤试管内壁上附着的硫黄,可用酒精洗涤,也可用热的NaOH溶液清洗
D.硫在空气中燃烧时生成SO2,在纯氧气中燃烧时生成SO3
【易错选项】D
【易错剖析】(1)易错选项分析
本题易错选D的原因在于知识掌握不扎实,不能很好地掌握
各物质之间的转化方式及转化条件。S与O2点燃时只生成
SO2(S+O2 SO2),与O2量的多少、O2的浓度无关,而要实
现SO2→SO3的转化,必须要改变条件(2SO2+O2
2SO3),所以该反应中产物与反应物的量无关,与反应条件
有关。
点燃
====
催化剂
△
(2)其他错误选项分析:
【标准答案】A
1.下列反应中,硫表现还原性的是( )
A.硫与氧气 B.硫与氢气
C.硫与铁 D.硫与铜
【解析】选A。硫与铁、氢气及铜反应时,硫都得到电子生成-2价的硫的化合物,表现氧化性,只有硫与氧气反应生成的SO2中硫显+4价,表现还原性,故正确答案为A。
2.下列关于硫的叙述正确的是( )
A.硫的非金属性较强,所以只能以化合态存在于自然界
B.硫单质有多种同素异形体,常见的有斜方硫和单斜硫
C.在标准状况下,1 mol硫单质的体积约为22.4 L
D.硫在空气中燃烧时,火焰呈明亮的蓝紫色
【解析】选B。硫在自然界中既有游离态又有化合态;在标准状况下,S为固体,不能用气体摩尔体积计算;S在空气中燃烧时,火焰呈微弱的淡蓝色,在氧气中燃烧时火焰呈明亮的蓝紫色。
3.下列化合物可由两种单质直接化合得到的是( )
A.SO3 B.NO2
C.CuS D.FeCl3
【解析】选D。S与O2、Cu反应分别生成SO2和Cu2S,Fe与Cl2反应生成FeCl3,N2与O2反应生成NO。
4.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。下列说法中正确的是( )
A.S6、S4、S2互为同素异形体
B.S6、S4、S2在氧气中完全燃烧时的产物可能不同
C.S6分子的摩尔质量是192 g
D.S8转化为S6、S4、S2属于物理变化
【解析】选A。硫单质之间的转化为化学变化,相互间称为同素异形体,完全燃烧的产物都为SO2,摩尔质量的单位为g·mol-1。
5.在空气中加热S粉和Fe粉的混合物,可观察到下列现象,请写出有关反应的化学方程式。
(1)有淡蓝色火焰,且生成有刺激性气味的气体_______。
(2)混合粉末变红,放出热量,最后变为黑色固体_____。
(3)不时有火星从混合物中射出_____________________。
【解析】Fe粉与S粉反应时,会伴随其他反应的发生,有淡
蓝色火焰,说明S在空气中燃烧生成了SO2。Fe+S
FeS,FeS是黑色固体,且反应放热。有火星从混合物中射
出,说明Fe粉与空气中的O2反应生成Fe3O4。
答案:(1)S+O2 SO2 (2)Fe+S FeS
(3)3Fe+2O2 Fe3O4
点燃
====
△
====
△
====
△
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列化合物不能用相应元素的单质直接化合生成的是
( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S
⑥FeCl2 ⑦H2S
A.②⑤⑦ B.①④⑥ C.③④ D.④⑥
【解析】选B。硫与具有可变化合价的金属反应时生成低价金属硫化物,如金属Fe和Cu与硫单质反应时,只能生成FeS和Cu2S,而不是Fe2S3和CuS。而氯气与变价金属反应时生成高价氯化物,在与Fe、Cu反应时可将其氧化为高价态,故反应产物为FeCl3、CuCl2,而不是FeCl2、CuCl。
2.(2011·六安高一检测)下列事实能够说明单质氯气的氧化性比硫强的事实有( )
①硫的沸点比氯气高
②与金属单质反应,硫被还原为-2价,氯被还原为-1价
③铜与Cl2反应生成CuCl2,与S反应生成Cu2S
④将Cl2通入氢硫酸(H2S)溶液中溶液变浑浊
A.①②③ B.②④ C.②③④ D.③④
【解析】选D。①为物理性质,①错。氧化性强弱是指得失电子能力强弱,与得失电子多少无直接关系,②错。Cl2通入氢硫酸(H2S)溶液中溶液变浑浊说明氯气将硫置换出来,由氧化剂的氧化性强于氧化产物的氧化性知④对。③④均能说明Cl2得电子能力比S强,即Cl2的氧化性比硫强。
3.8 g硫能与0.5 mol某单质在一定条件下完全反应,该单
质可能是( )
A.H2 B.O2 C.Cu D.Fe
【解析】选C。n(S)=0.25 mol,该单质与硫的物质的量之
比是2∶1,所以该单质为Cu。反应的方程式为:2Cu+S
Cu2S。
△
====
4.关于硫的叙述正确的是( )
A.硫在空气中燃烧生成大量SO3
B.分离黑火药中的硝酸钾、木炭、硫黄要用到二硫化碳、水以及过滤操作
C.洗涤试管内壁上附着的硫黄,可用酒精洗涤,也可用热的NaOH溶液清洗
D.黑火药爆炸的反应中,硫元素化合价降低,显还原性,硫与金属或非金属反应均作氧化剂
【解析】选B。A项,硫在空气中燃烧生成SO2而不是SO3。B项,分离黑火药中的三组分可利用它们溶解性的差异,先用CS2处理,使硫黄溶解,滤渣再用水处理,溶解硝酸钾,过滤,滤渣为木炭。滤液蒸发、浓缩、结晶,得到硝酸钾。C项,洗涤试管内壁上附着的硫黄,可用CS2洗涤,不能用酒精洗涤,也可用热碱液洗涤。D项,黑火药爆炸的反应中,硫单质得电子,生成K2S,化合价降低,显氧化性。
5.(双选)取一定量的铁粉和硫粉的混合物隔绝空气加热,充分反应后冷却,再加入足量的稀盐酸,标准状况下生成2.24 L气体,已知:FeS+2HCl====FeCl2+H2S↑,下列说法正确的是( )
A.原混合物中可能含3.2 g硫粉
B.生成的气体一定是纯净物
C.原混合物中一定含有5.6 g铁粉
D.2.24 L气体的质量可能大于3.4 g
【解析】选A、C。Fe+S FeS,若S过量,则与盐酸反应
的只有FeS,FeS+2HCl====FeCl2+H2S↑,由此可见
n(H2S)=n(FeS)=n(Fe),则
n(Fe)=n(H2S)= ,
m(Fe)=56 g·mol-1×0.1 mol=5.6 g 。
若Fe过量,则与盐酸反应的物质是FeS及剩余的Fe。
FeS+2HCl====FeCl2+H2S↑
Fe+2HCl====FeCl2+H2↑
△
====
分析以上两个方程式可知不论Fe与S反应是谁过量,生成气
体的物质的量与原混合物中Fe的物质的量相等。已知生成
标准状况下2.24 L气体,则一定有0.1 mol Fe(5.6 g)存
在,C正确。当5.6 g铁粉恰好与3.2 g硫粉反应,生成
8.8 g FeS;若硫粉过量,则硫粉的质量大于3.2 g,混合物
的质量大于8.8 g,A正确。
2.24 L气体都是H2S气体,则H2S气体的质量等于3.4 g,若
2.24 L气体是H2S与H2的混合气体,则气体的质量小于
3.4 g,D错误。
二、非选择题(本题包括3小题,共30分)
6.(9分) 写出下列化学方程式并从氧化还原的角度说明硫在下列反应中表现出的性质
(1)硫在氧气中燃烧_____________________________。
(2)铜粉与硫粉共热_____________________________。
(3)硫蒸气与氢气反应___________________________。
【解析】硫与氧气反应生成二氧化硫,硫体现还原性;铜粉与硫粉共热生成硫化亚铜,硫体现氧化性;硫蒸气与氢气反应生成硫化氢,硫体现氧化性。
答案:(1)S+O2 SO2,还原性
(2)2Cu+S Cu2S,氧化性
(3)S+H2 H2S,氧化性
点燃
====
△
====
△
====
7.(9分)(2011·龙岩高一检测)2010年4月30日世博会开幕
式当晚,10万余发烟花绽放在浦江上空,组成了盛典上绚
丽夺目的烟花美景。而我国古代四大发明之一的黑火药是
由木炭、硫黄、硝石(硝酸钾)按一定比例混合而成的,爆
炸时生成硫化钾、氮气和二氧化碳。爆炸时反应的化学方
程式为:2KNO3+3C+S K2S+N2↑+3CO2↑。
(1)该反应中的氧化剂是_____,还原剂是_____。
(2)现有一定量的黑火药爆炸,产生了标准状况下的气体
44.8 L,反应过程中转移电子的物质的量是_____。
点燃
====
【解析】(1)KNO3中+5价的氮元素和S元素在反应中化合价都降低,KNO3和S都作氧化剂,C作还原剂。
(2)产生的气体的物质的量是2 mol,产生CO2的物质的量是1.5 mol,转移电子的物质的量是1.5 mol×4=6 mol。
答案:(1)KNO3、S C (2)6 mol
【方法技巧】氧化还原反应中电子转移的计算方法
首先判断反应中有关元素化合价的变化,化合价的变化总数即电子转移的总数。计算电子转移总数可只计算失电子总数(化合价升高总数)或只计算得电子总数(化合价降低总数)。
8.(12分)(挑战能力)硫是自然界中广泛存在的元素。
(1)自然界中的单质硫俗称____。
(2)自然界中的硫单质每个硫分子中所含硫原子的个数不同,现有某种硫蒸气的密度折算到标准状况下是
11.42 g·L-1,则它的化学式为_____。
(3)实验室将钠和硫混合研磨时能发生轻微爆炸,写出反应的化学方程式____________________________________。
【解析】单质硫俗称硫黄,硫蒸气的相对分子质量为22.4×11.42=256,分子式为S8。硫与钠反应生成硫化钠。
答案:(1)硫黄 (2)S8
(3)S+2Na====Na2S
某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)_______________________________________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
【思考探究】(1)步骤(3)中缺少的实验操作是什么?
提示:检查装置的气密性。
(2)关闭电源后,反应仍继续进行的原因是什么?
提示:Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全。
(3)如果将盛有NaOH溶液的瓶中A、B导管位置反接是否可以,为什么?
提示:不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?
提示:不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果。
【典例】下列关于硫的说法正确的是
A.硫是一种淡黄色的不溶于水的固体
B.铜丝擦亮后伸入硫蒸气中产物是CuS
C.硫与非金属反应均作还原剂
D.1.6 g硫与5.6 g铁反应能得到7.2 g纯净硫化物
【思路点拨】解答本题应注意以下两点:
【自主解答】选A。B项,铜与硫反应生成Cu2S ;C项,硫与非金属H2反应时作氧化剂,与非金属O2反应时作还原剂;D项,Fe与S反应时
Fe + S FeS
56 32 88
2.8 g 1.6 g 4.4 g
即5.6 g 铁和1.6 g S反应时铁过量,反应后得到混合物。
△
====
【互动探究】(1)硫与金属反应时,硫一定作氧化剂吗
提示:金属元素只有正价,没有负价,硫与金属反应时,金属一定被氧化,硫一定作氧化剂。
(2)上述D项反应中转移电子的物质的量是多少?
提示:1.6 g S完全反应,硫元素从0价降低到-2价,转移电子的物质的量为1.6 g/32 g·mol-1×2=0.1 mol。
【变式训练】对于反应:3S+6KOH====2K2S+K2SO3+3H2O,下列说法中正确的是( )
A.硫是氧化剂,KOH是还原剂
B.反应中共转移8 mol电子
C.还原剂和氧化剂的质量比是1∶2
D.氧化产物和还原产物的质量比是1∶2
【解析】选C。从化学方程式看,反应中只有硫元素的化合价变化,硫既是氧化剂又是还原剂;3 mol S中有
2 mol 化合价降低,1 mol化合价升高,氧化剂和还原剂的质量比是2∶1,氧化产物和还原产物的物质的量比是1∶2;3 mol S反应时生成1 mol Na2SO3,转移4 mol电子。
【典例】下列各选项中的杂质,欲用括号内物质除去,其中能达到目的的是
A.CO中混有少量CO2(澄清石灰水)
B.CO2中混有少量氯化氢气体 (NaOH溶液)
C.氯化氢气体中混有少量水蒸气(碱石灰)
D.N2中混有少量O2 (灼热的氧化铜)
【思路点拨】解答本题要注意以下两点:
【自主解答】选A。A项,澄清石灰水能吸收CO2,不能吸收CO,可达到目的;B项,CO2与HCl都和NaOH溶液反应,故不能达到目的;C项,碱石灰能吸收氯化氢;D项,除去O2应选择灼热的铜网。
【互动探究】1.如何除去CO2中混有的CO?
提示:通过灼热的氧化铜,CuO+CO Cu+CO2。
2.除去酸性气体中的水蒸气应选用何种干燥剂?
提示:应选酸性干燥剂,如浓硫酸、五氧化二磷等。
△
====
【变式训练】除去试管壁上附着的硫,可采用的方法是
( )
A.通入氢气后加热
B.伸入灼热的铁丝
C.用水洗涤
D.用二硫化碳洗后再用水洗
【解析】选D。硫与氢气、铁丝在加热条件下反应依然进行很慢,不适于除去试管壁上附着的硫;硫不溶于水,易溶于二硫化碳,可用二硫化碳洗后再用水洗。
【典例】下列说法正确的是
A.硫元素在自然界中既能以游离态形式存在,又能以化合态形式存在
B.Cu与S粉混合加热,可得到CuS
C.洗涤试管内壁上附着的硫黄,可用酒精洗涤,也可用热的NaOH溶液清洗
D.硫在空气中燃烧时生成SO2,在纯氧气中燃烧时生成SO3
【易错选项】D
【易错剖析】(1)易错选项分析
本题易错选D的原因在于知识掌握不扎实,不能很好地掌握
各物质之间的转化方式及转化条件。S与O2点燃时只生成
SO2(S+O2 SO2),与O2量的多少、O2的浓度无关,而要实
现SO2→SO3的转化,必须要改变条件(2SO2+O2
2SO3),所以该反应中产物与反应物的量无关,与反应条件
有关。
点燃
====
催化剂
△
(2)其他错误选项分析:
【标准答案】A
1.下列反应中,硫表现还原性的是( )
A.硫与氧气 B.硫与氢气
C.硫与铁 D.硫与铜
【解析】选A。硫与铁、氢气及铜反应时,硫都得到电子生成-2价的硫的化合物,表现氧化性,只有硫与氧气反应生成的SO2中硫显+4价,表现还原性,故正确答案为A。
2.下列关于硫的叙述正确的是( )
A.硫的非金属性较强,所以只能以化合态存在于自然界
B.硫单质有多种同素异形体,常见的有斜方硫和单斜硫
C.在标准状况下,1 mol硫单质的体积约为22.4 L
D.硫在空气中燃烧时,火焰呈明亮的蓝紫色
【解析】选B。硫在自然界中既有游离态又有化合态;在标准状况下,S为固体,不能用气体摩尔体积计算;S在空气中燃烧时,火焰呈微弱的淡蓝色,在氧气中燃烧时火焰呈明亮的蓝紫色。
3.下列化合物可由两种单质直接化合得到的是( )
A.SO3 B.NO2
C.CuS D.FeCl3
【解析】选D。S与O2、Cu反应分别生成SO2和Cu2S,Fe与Cl2反应生成FeCl3,N2与O2反应生成NO。
4.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。下列说法中正确的是( )
A.S6、S4、S2互为同素异形体
B.S6、S4、S2在氧气中完全燃烧时的产物可能不同
C.S6分子的摩尔质量是192 g
D.S8转化为S6、S4、S2属于物理变化
【解析】选A。硫单质之间的转化为化学变化,相互间称为同素异形体,完全燃烧的产物都为SO2,摩尔质量的单位为g·mol-1。
5.在空气中加热S粉和Fe粉的混合物,可观察到下列现象,请写出有关反应的化学方程式。
(1)有淡蓝色火焰,且生成有刺激性气味的气体_______。
(2)混合粉末变红,放出热量,最后变为黑色固体_____。
(3)不时有火星从混合物中射出_____________________。
【解析】Fe粉与S粉反应时,会伴随其他反应的发生,有淡
蓝色火焰,说明S在空气中燃烧生成了SO2。Fe+S
FeS,FeS是黑色固体,且反应放热。有火星从混合物中射
出,说明Fe粉与空气中的O2反应生成Fe3O4。
答案:(1)S+O2 SO2 (2)Fe+S FeS
(3)3Fe+2O2 Fe3O4
点燃
====
△
====
△
====
△
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列化合物不能用相应元素的单质直接化合生成的是
( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S
⑥FeCl2 ⑦H2S
A.②⑤⑦ B.①④⑥ C.③④ D.④⑥
【解析】选B。硫与具有可变化合价的金属反应时生成低价金属硫化物,如金属Fe和Cu与硫单质反应时,只能生成FeS和Cu2S,而不是Fe2S3和CuS。而氯气与变价金属反应时生成高价氯化物,在与Fe、Cu反应时可将其氧化为高价态,故反应产物为FeCl3、CuCl2,而不是FeCl2、CuCl。
2.(2011·六安高一检测)下列事实能够说明单质氯气的氧化性比硫强的事实有( )
①硫的沸点比氯气高
②与金属单质反应,硫被还原为-2价,氯被还原为-1价
③铜与Cl2反应生成CuCl2,与S反应生成Cu2S
④将Cl2通入氢硫酸(H2S)溶液中溶液变浑浊
A.①②③ B.②④ C.②③④ D.③④
【解析】选D。①为物理性质,①错。氧化性强弱是指得失电子能力强弱,与得失电子多少无直接关系,②错。Cl2通入氢硫酸(H2S)溶液中溶液变浑浊说明氯气将硫置换出来,由氧化剂的氧化性强于氧化产物的氧化性知④对。③④均能说明Cl2得电子能力比S强,即Cl2的氧化性比硫强。
3.8 g硫能与0.5 mol某单质在一定条件下完全反应,该单
质可能是( )
A.H2 B.O2 C.Cu D.Fe
【解析】选C。n(S)=0.25 mol,该单质与硫的物质的量之
比是2∶1,所以该单质为Cu。反应的方程式为:2Cu+S
Cu2S。
△
====
4.关于硫的叙述正确的是( )
A.硫在空气中燃烧生成大量SO3
B.分离黑火药中的硝酸钾、木炭、硫黄要用到二硫化碳、水以及过滤操作
C.洗涤试管内壁上附着的硫黄,可用酒精洗涤,也可用热的NaOH溶液清洗
D.黑火药爆炸的反应中,硫元素化合价降低,显还原性,硫与金属或非金属反应均作氧化剂
【解析】选B。A项,硫在空气中燃烧生成SO2而不是SO3。B项,分离黑火药中的三组分可利用它们溶解性的差异,先用CS2处理,使硫黄溶解,滤渣再用水处理,溶解硝酸钾,过滤,滤渣为木炭。滤液蒸发、浓缩、结晶,得到硝酸钾。C项,洗涤试管内壁上附着的硫黄,可用CS2洗涤,不能用酒精洗涤,也可用热碱液洗涤。D项,黑火药爆炸的反应中,硫单质得电子,生成K2S,化合价降低,显氧化性。
5.(双选)取一定量的铁粉和硫粉的混合物隔绝空气加热,充分反应后冷却,再加入足量的稀盐酸,标准状况下生成2.24 L气体,已知:FeS+2HCl====FeCl2+H2S↑,下列说法正确的是( )
A.原混合物中可能含3.2 g硫粉
B.生成的气体一定是纯净物
C.原混合物中一定含有5.6 g铁粉
D.2.24 L气体的质量可能大于3.4 g
【解析】选A、C。Fe+S FeS,若S过量,则与盐酸反应
的只有FeS,FeS+2HCl====FeCl2+H2S↑,由此可见
n(H2S)=n(FeS)=n(Fe),则
n(Fe)=n(H2S)= ,
m(Fe)=56 g·mol-1×0.1 mol=5.6 g 。
若Fe过量,则与盐酸反应的物质是FeS及剩余的Fe。
FeS+2HCl====FeCl2+H2S↑
Fe+2HCl====FeCl2+H2↑
△
====
分析以上两个方程式可知不论Fe与S反应是谁过量,生成气
体的物质的量与原混合物中Fe的物质的量相等。已知生成
标准状况下2.24 L气体,则一定有0.1 mol Fe(5.6 g)存
在,C正确。当5.6 g铁粉恰好与3.2 g硫粉反应,生成
8.8 g FeS;若硫粉过量,则硫粉的质量大于3.2 g,混合物
的质量大于8.8 g,A正确。
2.24 L气体都是H2S气体,则H2S气体的质量等于3.4 g,若
2.24 L气体是H2S与H2的混合气体,则气体的质量小于
3.4 g,D错误。
二、非选择题(本题包括3小题,共30分)
6.(9分) 写出下列化学方程式并从氧化还原的角度说明硫在下列反应中表现出的性质
(1)硫在氧气中燃烧_____________________________。
(2)铜粉与硫粉共热_____________________________。
(3)硫蒸气与氢气反应___________________________。
【解析】硫与氧气反应生成二氧化硫,硫体现还原性;铜粉与硫粉共热生成硫化亚铜,硫体现氧化性;硫蒸气与氢气反应生成硫化氢,硫体现氧化性。
答案:(1)S+O2 SO2,还原性
(2)2Cu+S Cu2S,氧化性
(3)S+H2 H2S,氧化性
点燃
====
△
====
△
====
7.(9分)(2011·龙岩高一检测)2010年4月30日世博会开幕
式当晚,10万余发烟花绽放在浦江上空,组成了盛典上绚
丽夺目的烟花美景。而我国古代四大发明之一的黑火药是
由木炭、硫黄、硝石(硝酸钾)按一定比例混合而成的,爆
炸时生成硫化钾、氮气和二氧化碳。爆炸时反应的化学方
程式为:2KNO3+3C+S K2S+N2↑+3CO2↑。
(1)该反应中的氧化剂是_____,还原剂是_____。
(2)现有一定量的黑火药爆炸,产生了标准状况下的气体
44.8 L,反应过程中转移电子的物质的量是_____。
点燃
====
【解析】(1)KNO3中+5价的氮元素和S元素在反应中化合价都降低,KNO3和S都作氧化剂,C作还原剂。
(2)产生的气体的物质的量是2 mol,产生CO2的物质的量是1.5 mol,转移电子的物质的量是1.5 mol×4=6 mol。
答案:(1)KNO3、S C (2)6 mol
【方法技巧】氧化还原反应中电子转移的计算方法
首先判断反应中有关元素化合价的变化,化合价的变化总数即电子转移的总数。计算电子转移总数可只计算失电子总数(化合价升高总数)或只计算得电子总数(化合价降低总数)。
8.(12分)(挑战能力)硫是自然界中广泛存在的元素。
(1)自然界中的单质硫俗称____。
(2)自然界中的硫单质每个硫分子中所含硫原子的个数不同,现有某种硫蒸气的密度折算到标准状况下是
11.42 g·L-1,则它的化学式为_____。
(3)实验室将钠和硫混合研磨时能发生轻微爆炸,写出反应的化学方程式____________________________________。
【解析】单质硫俗称硫黄,硫蒸气的相对分子质量为22.4×11.42=256,分子式为S8。硫与钠反应生成硫化钠。
答案:(1)硫黄 (2)S8
(3)S+2Na====Na2S
某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)_______________________________________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
【思考探究】(1)步骤(3)中缺少的实验操作是什么?
提示:检查装置的气密性。
(2)关闭电源后,反应仍继续进行的原因是什么?
提示:Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全。
(3)如果将盛有NaOH溶液的瓶中A、B导管位置反接是否可以,为什么?
提示:不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?
提示:不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果。
