11-12版高中化学全程学习方略配套课件:单元质量评估(三)(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:单元质量评估(三)(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 221.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-14 09:21:53 | ||
图片预览











文档简介
(共35张PPT)
(三)
第3章 自然界中的元素
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1.(2010·上海高考)下列做法不能体现低碳生活的是( )
A.减少食物加工过程
B.注意节约用电
C.尽量购买本地的、当季的食物
D.大量使用薪柴为燃料
【解析】选D。低碳生活的核心是减少二氧化碳的排放,减少食物加工过程,可减少能源的消耗,也就减少了二氧化碳的排放,A项符合低碳生活的要求;目前电力的主要来源是火电,节约用电,可减少煤炭的燃烧,也就减少了二氧化碳的排放,B项符合低碳生活的要求;本地食物能减少运输消耗,当季食物能减少贮存的能量消耗,C项符合低碳生活的要求;薪柴为燃料会产生大量二氧化碳,不符合低碳生活的要求,故选D。
2.(2011·锦州高一检测)以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是( )
C CO2 H2CO3 CaCO3 CO2
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
CuO
高温
H2O
Ca(OH)2
高温
【解析】选D。反应方程式依次为:
C+2CuO CO2↑+2Cu CO2+H2O====H2CO3
H2CO3+Ca(OH)2====CaCO3↓+2H2O
CaCO3 CaO+CO2↑
高温
====
高温
====
3.下列有关氮气的叙述中,正确的是( )
A.医学上常用液氮作冷冻剂,在冷冻麻醉条件下做手术,
是利用氮气化学性质的不活泼性
B.高温条件下,N2和O2可反应生成NO
C.氮气只能作氧化剂
D.1 mol N2可与3 mol H2完全反应生成2 mol NH3
【解析】选A。N2与O2放电时可生成NO,N2既能作氧化剂又
能作还原剂;N2与H2的反应属于可逆反应,1 mol N2和
3 mol H2不可能完全反应生成2 mol NH3。
4.稀硝酸是一种较强的氧化剂,在溶液中下列微粒能将HNO3还原成NO的是( )
①Fe2+;②Mg2+;③SO32-;④S2-;⑤I-;⑥SO42-
A.①③④⑤ B.①②③④⑤⑥
C.②③④⑥ D.①③④⑥
【解析】选A。Fe2+、SO32-、 S2-、I-都具有较强的还原性,可将NO3-还原,Mg2+无还原性,SO42-在反应中不表现还原性。
5.目前,世界上生产的镁有60%来自海水。从海水中提取
镁,最基本的方法就是往海水里加石灰乳,使镁沉淀出
来,然后经过一系列处理,最终得到单质镁。试判断在海
水提镁的过程中,不可能发生的反应是( )
A.2MgO====2Mg+O2
B.MgCl2 Mg+Cl2↑
C.Mg(OH)2+2HCl====MgCl2+2H2O
D.Mg2++2OH-====Mg(OH)2↓
通电
====
【解析】选A。海水中加入Ca(OH)2后,发生反应:Mg2++
2OH-====Mg(OH)2↓;再加入盐酸溶解Mg(OH)2,发生反应:
Mg(OH)2+2HCl====MgCl2+2H2O;得到无水MgCl2后,电解
熔融MgCl2,发生反应:MgCl2 Mg+Cl2↑。
通电
====
6.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4是N2的同素异形体
B.N4是2个N2构成的
C.相同质量的N4和N2所含原子个数比为1∶2
D.N4的摩尔质量是56 g
【解析】选A。一个N4分子是由4个N原子构成的,B错;相同质量的N4和N2所含原子个数比为1∶1,C错;摩尔质量的单位是g·mol-1。
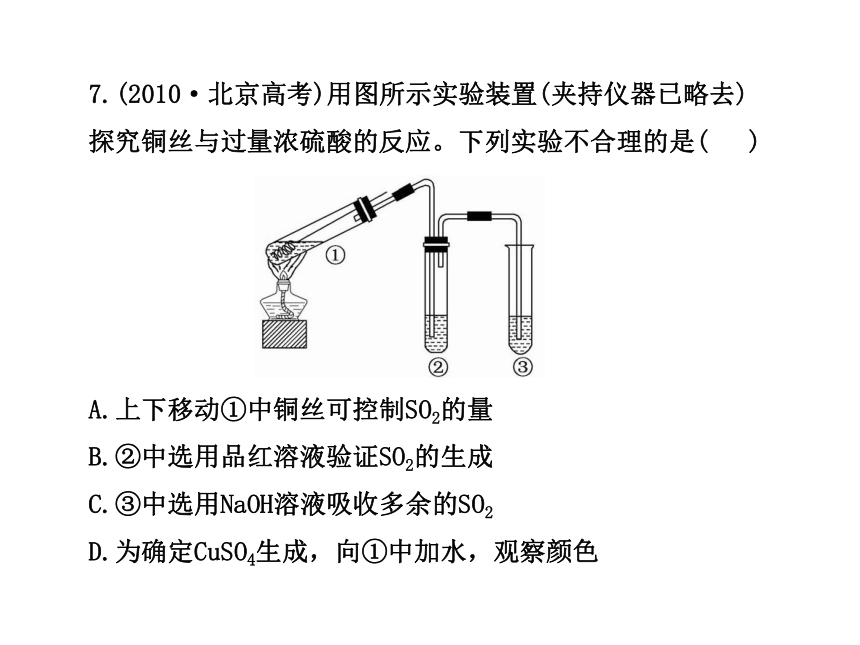
7.(2010·北京高考)用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确定CuSO4生成,向①中加水,观察颜色
【解析】选D。Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑,题
中当向上移动①中铜丝时,铜丝与浓硫酸脱离接触,反应
停止;当向下移动铜丝时,铜丝与浓硫酸接触,生成SO2,
因此上下移动①中铜丝可控制SO2的量,故A正确。SO2可以
使品红溶液退色,加热后又可恢复原色,因此可用品红溶
液检验SO2,故B正确。SO2能污染大气造成酸雨,因此不能
直接排放,可用NaOH溶液吸收,故C正确。反应后,①中含
有大量硫酸,若直接向①中加水,容易使水沸腾而溅出,
造成危险,可以先将上清液倒出,然后再向残留固体的试
管中加入水,若溶液变蓝,则可以确定有CuSO4生成,故D
不正确。
△
====
8.为了检验NaHCO3固体中是否含有Na2CO3,下列实验及判断正确的是( )
A.加热,观察是否有气体放出
B.溶于水后加石灰水,看有无沉淀
C.溶于水后加BaCl2溶液,看有无沉淀
D.加热后称量,看质量是否变化
【解析】选C。不管NaHCO3中是否含有Na2CO3,加热均有气体生成,A错;加入Ca(OH)2均有沉淀生成,B错;加热后质量一定减少,D错;加入BaCl2如果有沉淀生成则证明有Na2CO3,发生的反应为Ba2++CO32-====BaCO3↓,而Ba2+和HCO3-不反应。
9.在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向该溶液中加入溴水,再加入淀粉,溶液变蓝。由此可推断溶液中( )
A.一定含有I-,不能确定是否含有Cl-
B.可能含有NO3-、Cl-和I-
C.可能含有NO3-
D.一定含有Fe3+
【解析】选A。加溴水后再加入淀粉,溶液变蓝说明溶液中一定含I-,则一定不含Fe3+、NO3-,不能确定是否含Cl-。
【方法技巧】离子共存的判断
离子共存问题判断时可先根据题中的已知条件判断出确定存在或确定不存在的离子,再根据离子共存原则,与确定存在的离子能发生反应的离子则不能存在,最后还要注意溶液中电荷守恒问题,即溶液呈电中性,阳离子存在时,一定存在阴离子。
10.用加热法可以分离的一组物质是( )
A.氯化铵和消石灰
B.碳酸氢铵和过氧化钠
C.氯化铵和氯化钠
D.碘和氯化铵
【解析】选C。铵盐可与碱反应,因此选项A在加热时发生
反应2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2,不能用于分
离两者的混合物。选项B中的NH4HCO3分解,且产生的H2O及
CO2能与Na2O2反应,也无法达到分离的目的。碘在受热时升
华,NH4Cl受热分解再重新化合后仍与碘混合,故选项D无
法达到分离的目的。选项C,NH4Cl受热分解后可从体系中
脱离,遇冷又重新化合为NH4Cl晶体,从而达到与NaCl分离
的目的。
△
====
11.将磁性氧化铁放入稀硝酸中可发生如下反应:
3Fe3O4+28HNO3====9Fe(NO3)x+NO↑+14H2O。
下列判断合理的是( )
A.Fe(NO3)x中的x为2
B.反应中每生成0.2 mol还原产物,就有0.6 mol电子转移
C.稀硝酸在反应中只作氧化剂
D.磁性氧化铁中的所有铁元素全部被氧化
【解析】选B。根据方程式中氮原子守恒知x=3;Fe3O4中+2价铁元素被氧化,+3价铁元素未被氧化,HNO3在反应中部分被还原;还原产物为NO,每生成0.2 mol NO时转移电子0.2 mol×(5-2)=0.6 mol。
12.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
A.②③④ B.①②④ C.①③④ D.①②③
【解析】选C。①中发生的反应为Ca(OH)2+CO2====CaCO3↓
+H2O;Ca(OH)2+SO2====CaSO3↓+H2O,能产生CaCO3和CaSO3沉
淀;②中HCl的含量若很高,可以将CaCO3溶解,发生的反
应为CaCO3+2HCl====CaCl2+H2O+CO2↑,故②不一定能产生
沉淀;③CO2、SO2通入Ba(NO3)2溶液中使溶液呈酸性,NO3-、
H+会氧化SO2而得到BaSO4沉淀;④中发生的反应为
CaCl2+2NH3+CO2+H2O====CaCO3↓+2NH4Cl,得到CaCO3沉淀,
故选C。
二、非选择题(本题包括4小题,共52分)
13.(8分)海水是一个非常丰富的化学资源,以海水为原料可制取Mg、氯气、Br2、碘等。
(1)写出镁在二氧化碳中燃烧的化学方程式____________。(2)下列有关海水综合利用的说法正确的是_____。
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备镁
D.从海带中提取碘单质的过程不涉及氧化还原反应
(3)液溴呈_________色,提取单质溴时常将氯气通入苦卤(海水晒盐后得到的母液)中,将其中的溴离子氧化,反应的离子方程式为__________________________。
(4)加碘食盐中的含碘物质是__________,碘加热时变成紫色的碘蒸气,这一过程叫___________。
【解析】由海水提取钾、碘等单质都需经过氧化还原反应,制盐过程经过物理变化,如蒸发。
答案:(1)2Mg+CO2 2MgO+C
(2)C
(3)深红棕色 Cl2+2Br-====2Cl-+Br2
(4) KIO3 升华
点燃
====
14.(12分)(2011·烟台高一检测)某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验。
甲组取a g铜片和一定量的浓硫酸放入试管中加热,直到反应完毕,最后发现试管中还有一定量的H2SO4和Cu剩余。
(1)写出装置A中所发生反应的化学方程式_____________。
(2)若用含0.2 mol H2SO4的浓硫酸与过量铜片共热,能否收集到0.1 mol SO2?_____(填“能”或“不能”)。
(3)当集气瓶B中的气体收集满时,装置C中有可能观察到的现象是___________________________________________。
(4)为什么有一定量的余酸却未能使Cu完全溶解,你认为原因是_____________________________________________。
(5)乙组同学认为:实验装置C有可能造成环境污染,乙组学生设计了最简单方法给予解决:在C试管口塞上一团沾有_____(填化学式)溶液的棉花。
(6)为了证明反应结束后的试管中的确有剩余的稀硫酸,可选择的试剂是_____。
A.铁粉 B.Na2CO3溶液 C.BaCl2溶液
【解析】铜只能与浓硫酸反应,与稀硫酸不反应;二氧化硫可以使品红退色,可以用氢氧化钠溶液吸收,为防止污染,在试管口用浸有氢氧化钠溶液的棉花团堵住;证明剩余稀硫酸应检验其中的H+,不能检验SO42-,因为产物CuSO4中也含SO42-。
答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑ + 2H2O
(2)不能
(3)品红溶液退色
(4)稀硫酸不能与Cu反应
(5)NaOH
(6)A、B
△
====
15.(16分)(2011·冀州高一检测)已知A、B、C、D、E、F是
含有同一种元素的化合物,其中F是能使湿润红色石蕊试纸
变蓝的气体,它们之间能发生如下反应:
①A+H2O B+C ②C+F D
③D+NaOH F+E+H2O
(1)写化学式:C_____、D_____、E_____。
(2)写出下列反应的离子方程式
①__________________________________;
③__________________________________。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生
成B和H2O,写出该步反应的化学方程式________________。
△
【解析】本题题眼为F,根据题意,F为NH3,即A、B、C、D、
E、F均含有N元素。根据②C+F D和③D+NaOH F+E+H2O,推知D为铵盐,所以C为HNO3,E为硝酸钠,又由
①A+H2O B+C推知A为NO2,B为NO。
答案:(1)HNO3 NH4NO3 NaNO3
(2)3NO2+H2O====2HNO3+NO
NH4NO3+NaOH NaNO3+NH3↑+H2O
(3)4NH3+5O2 4NO+6H2O
△
△
====
高温
催化剂
====
16.(16分)已知SO2+I2+2H2O====H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
(1)若原料气从左向右流向时,上述装置组装连接的顺序是:原料气→c→d→b→a→e。
(2)装置Ⅱ中发生反应的离子方程式为_______________;
当装置Ⅱ中出现_____________现象时,立即停止通气。
(3)你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是_____。
A.酸性KMnO4溶液 B.NaOH溶液
C.溴水 D.稀硫酸
(4)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),则SO2的体积分数为_____。
【解析】装置Ⅱ中的试剂吸收SO2,应长管进,短管出;而装置Ⅰ的目的是用排水法测N2与O2的体积,应短管进,长管出。可以用来代替试管中碘的淀粉溶液的应是能和二氧化硫反应且有明显现象的试剂。
(4) SO2 ~ I2
22 400 mL 1 mol
V 0.05 mol/L×0.020 L=1.0×10-3 mol
V=22.4 mL
SO2的体积分数为22.4 mL/(297.6 mL+22.4 mL)×100%=7%。
答案:(2)SO2+I2+2H2O====4H++SO42-+2I- 蓝色退去
(3)A、C (4)7%
(三)
第3章 自然界中的元素
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1.(2010·上海高考)下列做法不能体现低碳生活的是( )
A.减少食物加工过程
B.注意节约用电
C.尽量购买本地的、当季的食物
D.大量使用薪柴为燃料
【解析】选D。低碳生活的核心是减少二氧化碳的排放,减少食物加工过程,可减少能源的消耗,也就减少了二氧化碳的排放,A项符合低碳生活的要求;目前电力的主要来源是火电,节约用电,可减少煤炭的燃烧,也就减少了二氧化碳的排放,B项符合低碳生活的要求;本地食物能减少运输消耗,当季食物能减少贮存的能量消耗,C项符合低碳生活的要求;薪柴为燃料会产生大量二氧化碳,不符合低碳生活的要求,故选D。
2.(2011·锦州高一检测)以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是( )
C CO2 H2CO3 CaCO3 CO2
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
CuO
高温
H2O
Ca(OH)2
高温
【解析】选D。反应方程式依次为:
C+2CuO CO2↑+2Cu CO2+H2O====H2CO3
H2CO3+Ca(OH)2====CaCO3↓+2H2O
CaCO3 CaO+CO2↑
高温
====
高温
====
3.下列有关氮气的叙述中,正确的是( )
A.医学上常用液氮作冷冻剂,在冷冻麻醉条件下做手术,
是利用氮气化学性质的不活泼性
B.高温条件下,N2和O2可反应生成NO
C.氮气只能作氧化剂
D.1 mol N2可与3 mol H2完全反应生成2 mol NH3
【解析】选A。N2与O2放电时可生成NO,N2既能作氧化剂又
能作还原剂;N2与H2的反应属于可逆反应,1 mol N2和
3 mol H2不可能完全反应生成2 mol NH3。
4.稀硝酸是一种较强的氧化剂,在溶液中下列微粒能将HNO3还原成NO的是( )
①Fe2+;②Mg2+;③SO32-;④S2-;⑤I-;⑥SO42-
A.①③④⑤ B.①②③④⑤⑥
C.②③④⑥ D.①③④⑥
【解析】选A。Fe2+、SO32-、 S2-、I-都具有较强的还原性,可将NO3-还原,Mg2+无还原性,SO42-在反应中不表现还原性。
5.目前,世界上生产的镁有60%来自海水。从海水中提取
镁,最基本的方法就是往海水里加石灰乳,使镁沉淀出
来,然后经过一系列处理,最终得到单质镁。试判断在海
水提镁的过程中,不可能发生的反应是( )
A.2MgO====2Mg+O2
B.MgCl2 Mg+Cl2↑
C.Mg(OH)2+2HCl====MgCl2+2H2O
D.Mg2++2OH-====Mg(OH)2↓
通电
====
【解析】选A。海水中加入Ca(OH)2后,发生反应:Mg2++
2OH-====Mg(OH)2↓;再加入盐酸溶解Mg(OH)2,发生反应:
Mg(OH)2+2HCl====MgCl2+2H2O;得到无水MgCl2后,电解
熔融MgCl2,发生反应:MgCl2 Mg+Cl2↑。
通电
====
6.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4是N2的同素异形体
B.N4是2个N2构成的
C.相同质量的N4和N2所含原子个数比为1∶2
D.N4的摩尔质量是56 g
【解析】选A。一个N4分子是由4个N原子构成的,B错;相同质量的N4和N2所含原子个数比为1∶1,C错;摩尔质量的单位是g·mol-1。
7.(2010·北京高考)用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确定CuSO4生成,向①中加水,观察颜色
【解析】选D。Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑,题
中当向上移动①中铜丝时,铜丝与浓硫酸脱离接触,反应
停止;当向下移动铜丝时,铜丝与浓硫酸接触,生成SO2,
因此上下移动①中铜丝可控制SO2的量,故A正确。SO2可以
使品红溶液退色,加热后又可恢复原色,因此可用品红溶
液检验SO2,故B正确。SO2能污染大气造成酸雨,因此不能
直接排放,可用NaOH溶液吸收,故C正确。反应后,①中含
有大量硫酸,若直接向①中加水,容易使水沸腾而溅出,
造成危险,可以先将上清液倒出,然后再向残留固体的试
管中加入水,若溶液变蓝,则可以确定有CuSO4生成,故D
不正确。
△
====
8.为了检验NaHCO3固体中是否含有Na2CO3,下列实验及判断正确的是( )
A.加热,观察是否有气体放出
B.溶于水后加石灰水,看有无沉淀
C.溶于水后加BaCl2溶液,看有无沉淀
D.加热后称量,看质量是否变化
【解析】选C。不管NaHCO3中是否含有Na2CO3,加热均有气体生成,A错;加入Ca(OH)2均有沉淀生成,B错;加热后质量一定减少,D错;加入BaCl2如果有沉淀生成则证明有Na2CO3,发生的反应为Ba2++CO32-====BaCO3↓,而Ba2+和HCO3-不反应。
9.在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向该溶液中加入溴水,再加入淀粉,溶液变蓝。由此可推断溶液中( )
A.一定含有I-,不能确定是否含有Cl-
B.可能含有NO3-、Cl-和I-
C.可能含有NO3-
D.一定含有Fe3+
【解析】选A。加溴水后再加入淀粉,溶液变蓝说明溶液中一定含I-,则一定不含Fe3+、NO3-,不能确定是否含Cl-。
【方法技巧】离子共存的判断
离子共存问题判断时可先根据题中的已知条件判断出确定存在或确定不存在的离子,再根据离子共存原则,与确定存在的离子能发生反应的离子则不能存在,最后还要注意溶液中电荷守恒问题,即溶液呈电中性,阳离子存在时,一定存在阴离子。
10.用加热法可以分离的一组物质是( )
A.氯化铵和消石灰
B.碳酸氢铵和过氧化钠
C.氯化铵和氯化钠
D.碘和氯化铵
【解析】选C。铵盐可与碱反应,因此选项A在加热时发生
反应2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2,不能用于分
离两者的混合物。选项B中的NH4HCO3分解,且产生的H2O及
CO2能与Na2O2反应,也无法达到分离的目的。碘在受热时升
华,NH4Cl受热分解再重新化合后仍与碘混合,故选项D无
法达到分离的目的。选项C,NH4Cl受热分解后可从体系中
脱离,遇冷又重新化合为NH4Cl晶体,从而达到与NaCl分离
的目的。
△
====
11.将磁性氧化铁放入稀硝酸中可发生如下反应:
3Fe3O4+28HNO3====9Fe(NO3)x+NO↑+14H2O。
下列判断合理的是( )
A.Fe(NO3)x中的x为2
B.反应中每生成0.2 mol还原产物,就有0.6 mol电子转移
C.稀硝酸在反应中只作氧化剂
D.磁性氧化铁中的所有铁元素全部被氧化
【解析】选B。根据方程式中氮原子守恒知x=3;Fe3O4中+2价铁元素被氧化,+3价铁元素未被氧化,HNO3在反应中部分被还原;还原产物为NO,每生成0.2 mol NO时转移电子0.2 mol×(5-2)=0.6 mol。
12.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
A.②③④ B.①②④ C.①③④ D.①②③
【解析】选C。①中发生的反应为Ca(OH)2+CO2====CaCO3↓
+H2O;Ca(OH)2+SO2====CaSO3↓+H2O,能产生CaCO3和CaSO3沉
淀;②中HCl的含量若很高,可以将CaCO3溶解,发生的反
应为CaCO3+2HCl====CaCl2+H2O+CO2↑,故②不一定能产生
沉淀;③CO2、SO2通入Ba(NO3)2溶液中使溶液呈酸性,NO3-、
H+会氧化SO2而得到BaSO4沉淀;④中发生的反应为
CaCl2+2NH3+CO2+H2O====CaCO3↓+2NH4Cl,得到CaCO3沉淀,
故选C。
二、非选择题(本题包括4小题,共52分)
13.(8分)海水是一个非常丰富的化学资源,以海水为原料可制取Mg、氯气、Br2、碘等。
(1)写出镁在二氧化碳中燃烧的化学方程式____________。(2)下列有关海水综合利用的说法正确的是_____。
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备镁
D.从海带中提取碘单质的过程不涉及氧化还原反应
(3)液溴呈_________色,提取单质溴时常将氯气通入苦卤(海水晒盐后得到的母液)中,将其中的溴离子氧化,反应的离子方程式为__________________________。
(4)加碘食盐中的含碘物质是__________,碘加热时变成紫色的碘蒸气,这一过程叫___________。
【解析】由海水提取钾、碘等单质都需经过氧化还原反应,制盐过程经过物理变化,如蒸发。
答案:(1)2Mg+CO2 2MgO+C
(2)C
(3)深红棕色 Cl2+2Br-====2Cl-+Br2
(4) KIO3 升华
点燃
====
14.(12分)(2011·烟台高一检测)某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验。
甲组取a g铜片和一定量的浓硫酸放入试管中加热,直到反应完毕,最后发现试管中还有一定量的H2SO4和Cu剩余。
(1)写出装置A中所发生反应的化学方程式_____________。
(2)若用含0.2 mol H2SO4的浓硫酸与过量铜片共热,能否收集到0.1 mol SO2?_____(填“能”或“不能”)。
(3)当集气瓶B中的气体收集满时,装置C中有可能观察到的现象是___________________________________________。
(4)为什么有一定量的余酸却未能使Cu完全溶解,你认为原因是_____________________________________________。
(5)乙组同学认为:实验装置C有可能造成环境污染,乙组学生设计了最简单方法给予解决:在C试管口塞上一团沾有_____(填化学式)溶液的棉花。
(6)为了证明反应结束后的试管中的确有剩余的稀硫酸,可选择的试剂是_____。
A.铁粉 B.Na2CO3溶液 C.BaCl2溶液
【解析】铜只能与浓硫酸反应,与稀硫酸不反应;二氧化硫可以使品红退色,可以用氢氧化钠溶液吸收,为防止污染,在试管口用浸有氢氧化钠溶液的棉花团堵住;证明剩余稀硫酸应检验其中的H+,不能检验SO42-,因为产物CuSO4中也含SO42-。
答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑ + 2H2O
(2)不能
(3)品红溶液退色
(4)稀硫酸不能与Cu反应
(5)NaOH
(6)A、B
△
====
15.(16分)(2011·冀州高一检测)已知A、B、C、D、E、F是
含有同一种元素的化合物,其中F是能使湿润红色石蕊试纸
变蓝的气体,它们之间能发生如下反应:
①A+H2O B+C ②C+F D
③D+NaOH F+E+H2O
(1)写化学式:C_____、D_____、E_____。
(2)写出下列反应的离子方程式
①__________________________________;
③__________________________________。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生
成B和H2O,写出该步反应的化学方程式________________。
△
【解析】本题题眼为F,根据题意,F为NH3,即A、B、C、D、
E、F均含有N元素。根据②C+F D和③D+NaOH F+E+H2O,推知D为铵盐,所以C为HNO3,E为硝酸钠,又由
①A+H2O B+C推知A为NO2,B为NO。
答案:(1)HNO3 NH4NO3 NaNO3
(2)3NO2+H2O====2HNO3+NO
NH4NO3+NaOH NaNO3+NH3↑+H2O
(3)4NH3+5O2 4NO+6H2O
△
△
====
高温
催化剂
====
16.(16分)已知SO2+I2+2H2O====H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
(1)若原料气从左向右流向时,上述装置组装连接的顺序是:原料气→c→d→b→a→e。
(2)装置Ⅱ中发生反应的离子方程式为_______________;
当装置Ⅱ中出现_____________现象时,立即停止通气。
(3)你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是_____。
A.酸性KMnO4溶液 B.NaOH溶液
C.溴水 D.稀硫酸
(4)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),则SO2的体积分数为_____。
【解析】装置Ⅱ中的试剂吸收SO2,应长管进,短管出;而装置Ⅰ的目的是用排水法测N2与O2的体积,应短管进,长管出。可以用来代替试管中碘的淀粉溶液的应是能和二氧化硫反应且有明显现象的试剂。
(4) SO2 ~ I2
22 400 mL 1 mol
V 0.05 mol/L×0.020 L=1.0×10-3 mol
V=22.4 mL
SO2的体积分数为22.4 mL/(297.6 mL+22.4 mL)×100%=7%。
答案:(2)SO2+I2+2H2O====4H++SO42-+2I- 蓝色退去
(3)A、C (4)7%
