2021-2022学年高中化学人教版(2019)选择性必修第一册课件 第一章 化学反应的热效应 章末整合提升(21张ppt)
文档属性
| 名称 | 2021-2022学年高中化学人教版(2019)选择性必修第一册课件 第一章 化学反应的热效应 章末整合提升(21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-07 19:47:18 | ||
图片预览








文档简介
(共21张PPT)
第一章 化学反应的热效应
章末整合提升
200
00
150
250
100
50
40
50m|
m
50
00
20
8—
50
30
tO
AAT
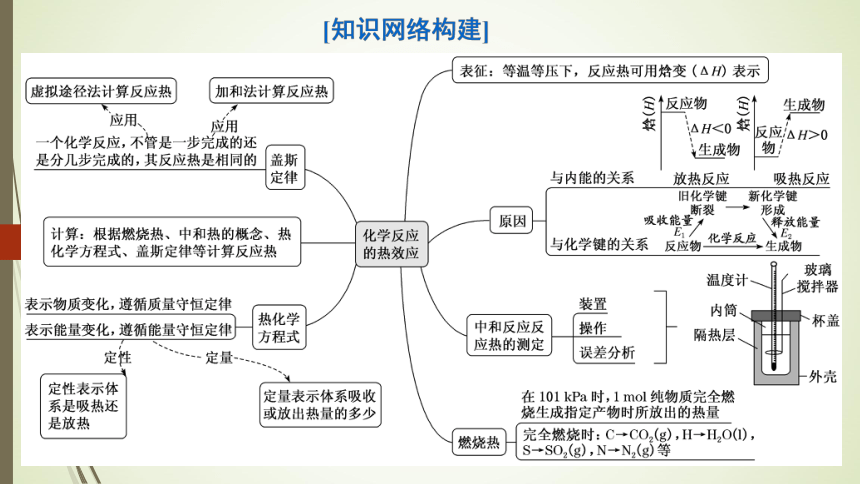
表征:等温等压下,反应热可用焓变(△H表示
虚拟途径法计算反应热
加和法计算反应热
↑反应物@↑生成物
应用
应用
个化学反应,不管是一步完成的还
△H<0零反应△H>0
生成物物
是分几步完成的,其反应热是相同的盖斯
定律
与内能的关系
放热反应
吸热反应
旧化学键新化学键
断裂
形成
原因
吸收能量
释放能量
计算:根据燃烧热、中和热的概念、热
化学反应
E1
化学方程式、盖斯定律等计算反应热
的热效应
与化学键的关系反应物化学反应生成物
玻璃
温度计
搅拌器
表示物质变化,遵循质量守恒定律
装置
热化学
内筒
表示能量变化,遵循能量守恒定律方程式
中和反应反操作
杯盖
应热的测定
隔热层
定性
定量
误差分析
外壳
定性表示体
系是吸热还
定量表示体系吸收
在101kPa时,1mol纯物质完全燃
或放出热量的多少
烧生成指定产物时所放出的热量
是放热
燃烧热完全燃烧时:C→CO2(g),H→HO(),
S→SO2(g),N→N2(g)等
放热反应一定为
审
吸热反应一定为
三审,单位人单位一定为kJ
”或“kJ
易错写成“kJ”或漏写
物质的聚集状态必须正确注明,特
E审:状态
别是溶液中的反应易写错
△H的数值必须与热化学方程式
物质前的化学计量数相对应,即化学
四审:数值计量数与△H成正比;当反应逆向进
时,其反应热的数值与正反应的反
热的数值的符号相反,绝对值相等
五审:是否表示燃烧热的热化学方程式中,可燃
符合概念物的化学计量数必须是1
放热
态
液态
吸热
放热
放热
吸热
吸热
固态
能量
反应物能量1(g),P(s)
△H1=¥306 kj. mol-l
中间产物总能量y
PCl3(g), Cl(g)
A△H293 kJ. mol
最终产物总能量
Pcl
反应过程
第一章 化学反应的热效应
章末整合提升
200
00
150
250
100
50
40
50m|
m
50
00
20
8—
50
30
tO
AAT
表征:等温等压下,反应热可用焓变(△H表示
虚拟途径法计算反应热
加和法计算反应热
↑反应物@↑生成物
应用
应用
个化学反应,不管是一步完成的还
△H<0零反应△H>0
生成物物
是分几步完成的,其反应热是相同的盖斯
定律
与内能的关系
放热反应
吸热反应
旧化学键新化学键
断裂
形成
原因
吸收能量
释放能量
计算:根据燃烧热、中和热的概念、热
化学反应
E1
化学方程式、盖斯定律等计算反应热
的热效应
与化学键的关系反应物化学反应生成物
玻璃
温度计
搅拌器
表示物质变化,遵循质量守恒定律
装置
热化学
内筒
表示能量变化,遵循能量守恒定律方程式
中和反应反操作
杯盖
应热的测定
隔热层
定性
定量
误差分析
外壳
定性表示体
系是吸热还
定量表示体系吸收
在101kPa时,1mol纯物质完全燃
或放出热量的多少
烧生成指定产物时所放出的热量
是放热
燃烧热完全燃烧时:C→CO2(g),H→HO(),
S→SO2(g),N→N2(g)等
放热反应一定为
审
吸热反应一定为
三审,单位人单位一定为kJ
”或“kJ
易错写成“kJ”或漏写
物质的聚集状态必须正确注明,特
E审:状态
别是溶液中的反应易写错
△H的数值必须与热化学方程式
物质前的化学计量数相对应,即化学
四审:数值计量数与△H成正比;当反应逆向进
时,其反应热的数值与正反应的反
热的数值的符号相反,绝对值相等
五审:是否表示燃烧热的热化学方程式中,可燃
符合概念物的化学计量数必须是1
放热
态
液态
吸热
放热
放热
吸热
吸热
固态
能量
反应物能量1(g),P(s)
△H1=¥306 kj. mol-l
中间产物总能量y
PCl3(g), Cl(g)
A△H293 kJ. mol
最终产物总能量
Pcl
反应过程
