电离平衡
图片预览




文档简介
(共19张PPT)
第三专题 第一单元 第二课时
结合化学平衡的知识,讨论交流下列问题:
1.随着电离的进行,c(CH3CHOOH)、c(H+)、c(CH3COO-) 、V(离子化)、V(分子化)
如何变化?
2.当足够长时间后, c(CH3CHOOH)、c(H+)、c(CH3COO-)是否发生变化?V(离子化)、
V(分子化)是否发生变化?
3.当足够长时间后,是否意味着电离停止了?
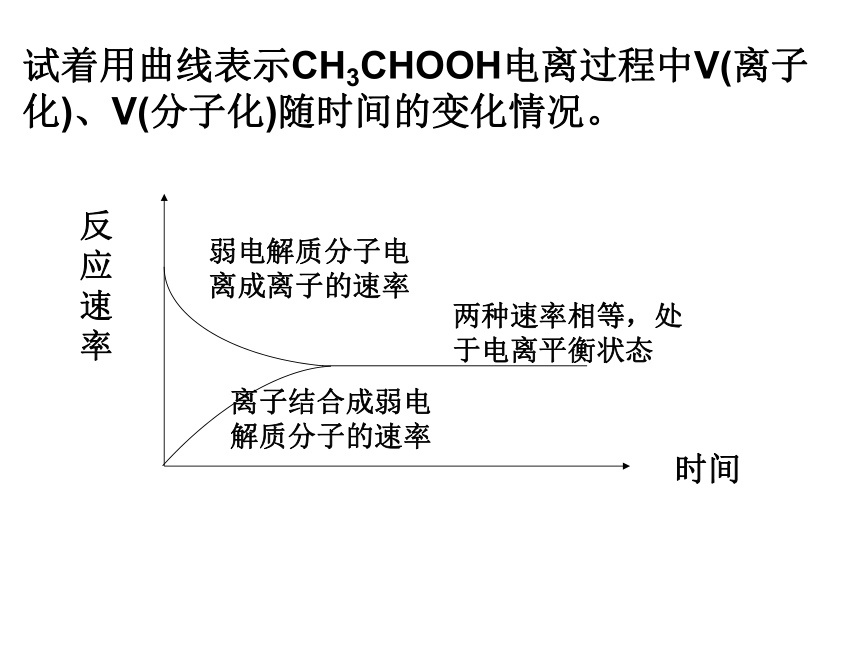
反应速率
时间
弱电解质分子电离成离子的速率
离子结合成弱电解质分子的速率
两种速率相等,处于电离平衡状态
试着用曲线表示CH3CHOOH电离过程中V(离子化)、V(分子化)随时间的变化情况。
2.特征
1.定义:在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态——电离平衡
电离平衡是一种动态平衡
条件不变,各分子、离子浓度不变
条件改变时,电离平衡发生移动
V离子化=V分子化≠0
弱电解质的电离是可逆过程
一、弱电解质的电离平衡的建立
逆
等
动
变
定
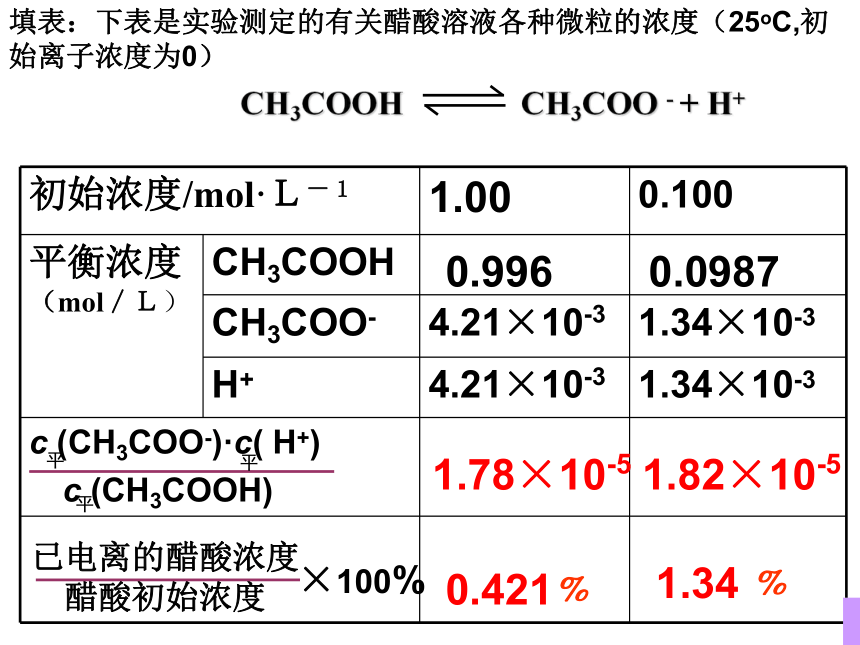
初始浓度/mol·L-1 1.00 0.100
平衡浓度(mol/L) CH3COOH
CH3COO- 4.21×10-3 1.34×10-3
H+ 4.21×10-3 1.34×10-3
c (CH3COO-)·c( H+)
c (CH3COOH)
已电离的醋酸浓度
醋酸初始浓度
×100%
1.78×10-5
1.82×10-5
0.996
0.0987
0.421﹪
1.34 ﹪
CH3COOH CH3COO - + H+
填表:下表是实验测定的有关醋酸溶液各种微粒的浓度(25oC,初始离子浓度为0)
平
平
平
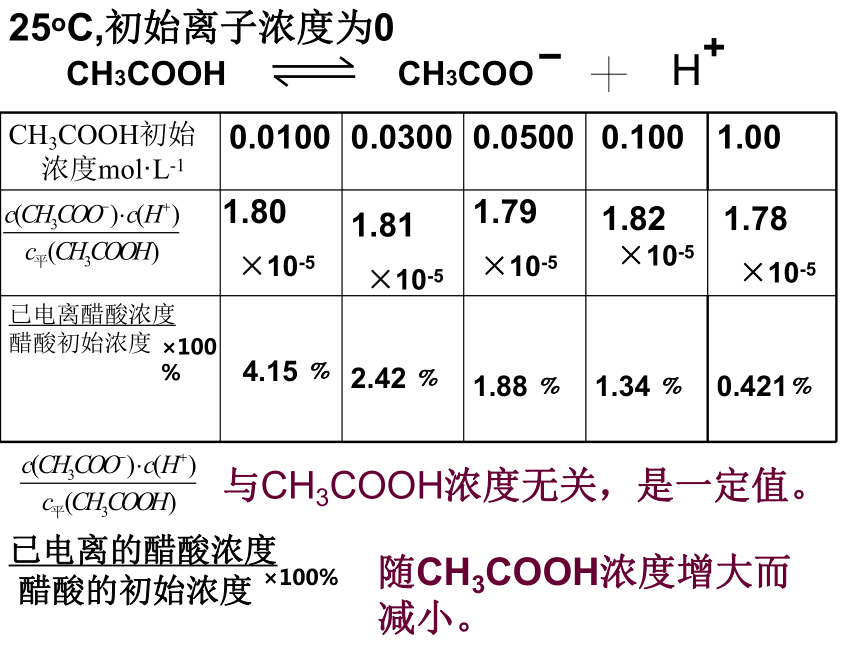
CH3COOH初始浓度mol·L-1 0.0100 0.0300 0.0500 0.100 1.00
已电离醋酸浓度
醋酸初始浓度
1.88 ﹪
1.34 ﹪
0.421﹪
CH3COOH
H
CH3COO
1.80
×10-5
1.81
×10-5
1.79
×10-5
4.15 ﹪
2.42 ﹪
已电离的醋酸浓度
醋酸的初始浓度
×100%
1.78
×10-5
25oC,初始离子浓度为0
与CH3COOH浓度无关,是一定值。
×100%
随CH3COOH浓度增大而减小。
1.82
×10-5
二.弱电解质的电离程度:
1、电离平衡常数:
(1)表达式
Ka=
c ( H+) .c( A-)
c(HA)
Kb=
c ( B+).c( OH- )
c(BOH)
对于一元弱酸:HA H++A-,平衡时
对于一元弱碱:BOH B+ +OH-,平衡时
二.弱电解质的电离程度:
1、电离平衡常数:
(1)表达式
(2)影响电离平衡常数的因素
电离平衡常数大小不受其浓度变化的影响,只受温度变化的影响。
温度 0℃ 20℃ 25℃ 50℃ 100℃
K 2.05
×10-17 1.22
×10-16 1.80
×10-16 9.84
×10-16 1.80
×10-14
温度越高,K越大,电离程度越大;
下表是某一弱电解质的电离平衡常数与温度的关系。分析表中的数据,有何规律,并解释之。
电离是个吸热过程。
二.弱电解质的电离程度:
1、电离平衡常数:
(1)表达式
(2)影响电离平衡常数的因素
(3)意义:K值越大,电离程度越大。
2、电离度:“α”
α =
已电离的弱电解质浓度
弱电解质的初始浓度
×100%
1、电离平衡常数:“K”(只与温度有关)
二.弱电解质的电离程度:
弱电解质浓度越小,电离程度越大;
温度越高,电离程度越大。
(与浓度、温度均有关)
25 0C时,1mol/L的氨水中一水合氨的电离度为0.42%,求一水合氨的电离平衡常数?
问题解决
1.8×10-5
(1)温度
(2)浓度
越热越电离
越稀越电离
影响电离平衡移动的因素
移动方向 n(H+) C(H+) α Ka
加少量乙酸钠固体
加少量氢氧化钠固体
加少量稀硫酸
加大量水
加冰醋酸
升温
左
减小
减小
减小
不变
右
减小
减小
增大
不变
左
增大
增大
减小
不变
右
增大
减小
增大
不变
右
增大
增大
减小
不变
右
增大
增大
增大
增大
250C时,0.1mol/L的乙酸溶液达到平衡,请填表:
CH3COOH
H
CH3COO
平衡移动
阿伦尼乌斯的最大贡献是1887年提出电离学说,它突破了当时的科学界普遍认为离子是在电流的作用下产生的金科玉律, 提出“电解质在溶液中能自动离解出正、负离子 ;溶液越稀,离解度就越大。”
这一学说是物理化学发展初期的重大发现,对溶液性质的解释起过重要的作用。它是物理和化学之间的一座桥梁。
阿伦尼乌斯与电离理论
思考题1:
1mol/L醋酸溶液中c(H+)是0.1mol/L
醋酸溶液中c(H+)的10倍吗?
分析:设1mol/L的醋酸溶液的电离度为α1,
0.1mol/L的醋酸溶液的电离度为α2,
所以α1< α2,
在1mol/L溶液中c(H+)1=α 1mol/L;
在0.1mol/L溶液中c(H+)2=0.1 α2mol/L
C(H+)1
C(H+)2
= 10α1 /α 2<10
以CH3COOH的电离平衡为例( CH3COOH的初始浓度为 c),你能得出电离平衡常数K与电离度α的计算关系吗?
思考题2:
第三专题 第一单元 第二课时
结合化学平衡的知识,讨论交流下列问题:
1.随着电离的进行,c(CH3CHOOH)、c(H+)、c(CH3COO-) 、V(离子化)、V(分子化)
如何变化?
2.当足够长时间后, c(CH3CHOOH)、c(H+)、c(CH3COO-)是否发生变化?V(离子化)、
V(分子化)是否发生变化?
3.当足够长时间后,是否意味着电离停止了?
反应速率
时间
弱电解质分子电离成离子的速率
离子结合成弱电解质分子的速率
两种速率相等,处于电离平衡状态
试着用曲线表示CH3CHOOH电离过程中V(离子化)、V(分子化)随时间的变化情况。
2.特征
1.定义:在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态——电离平衡
电离平衡是一种动态平衡
条件不变,各分子、离子浓度不变
条件改变时,电离平衡发生移动
V离子化=V分子化≠0
弱电解质的电离是可逆过程
一、弱电解质的电离平衡的建立
逆
等
动
变
定
初始浓度/mol·L-1 1.00 0.100
平衡浓度(mol/L) CH3COOH
CH3COO- 4.21×10-3 1.34×10-3
H+ 4.21×10-3 1.34×10-3
c (CH3COO-)·c( H+)
c (CH3COOH)
已电离的醋酸浓度
醋酸初始浓度
×100%
1.78×10-5
1.82×10-5
0.996
0.0987
0.421﹪
1.34 ﹪
CH3COOH CH3COO - + H+
填表:下表是实验测定的有关醋酸溶液各种微粒的浓度(25oC,初始离子浓度为0)
平
平
平
CH3COOH初始浓度mol·L-1 0.0100 0.0300 0.0500 0.100 1.00
已电离醋酸浓度
醋酸初始浓度
1.88 ﹪
1.34 ﹪
0.421﹪
CH3COOH
H
CH3COO
1.80
×10-5
1.81
×10-5
1.79
×10-5
4.15 ﹪
2.42 ﹪
已电离的醋酸浓度
醋酸的初始浓度
×100%
1.78
×10-5
25oC,初始离子浓度为0
与CH3COOH浓度无关,是一定值。
×100%
随CH3COOH浓度增大而减小。
1.82
×10-5
二.弱电解质的电离程度:
1、电离平衡常数:
(1)表达式
Ka=
c ( H+) .c( A-)
c(HA)
Kb=
c ( B+).c( OH- )
c(BOH)
对于一元弱酸:HA H++A-,平衡时
对于一元弱碱:BOH B+ +OH-,平衡时
二.弱电解质的电离程度:
1、电离平衡常数:
(1)表达式
(2)影响电离平衡常数的因素
电离平衡常数大小不受其浓度变化的影响,只受温度变化的影响。
温度 0℃ 20℃ 25℃ 50℃ 100℃
K 2.05
×10-17 1.22
×10-16 1.80
×10-16 9.84
×10-16 1.80
×10-14
温度越高,K越大,电离程度越大;
下表是某一弱电解质的电离平衡常数与温度的关系。分析表中的数据,有何规律,并解释之。
电离是个吸热过程。
二.弱电解质的电离程度:
1、电离平衡常数:
(1)表达式
(2)影响电离平衡常数的因素
(3)意义:K值越大,电离程度越大。
2、电离度:“α”
α =
已电离的弱电解质浓度
弱电解质的初始浓度
×100%
1、电离平衡常数:“K”(只与温度有关)
二.弱电解质的电离程度:
弱电解质浓度越小,电离程度越大;
温度越高,电离程度越大。
(与浓度、温度均有关)
25 0C时,1mol/L的氨水中一水合氨的电离度为0.42%,求一水合氨的电离平衡常数?
问题解决
1.8×10-5
(1)温度
(2)浓度
越热越电离
越稀越电离
影响电离平衡移动的因素
移动方向 n(H+) C(H+) α Ka
加少量乙酸钠固体
加少量氢氧化钠固体
加少量稀硫酸
加大量水
加冰醋酸
升温
左
减小
减小
减小
不变
右
减小
减小
增大
不变
左
增大
增大
减小
不变
右
增大
减小
增大
不变
右
增大
增大
减小
不变
右
增大
增大
增大
增大
250C时,0.1mol/L的乙酸溶液达到平衡,请填表:
CH3COOH
H
CH3COO
平衡移动
阿伦尼乌斯的最大贡献是1887年提出电离学说,它突破了当时的科学界普遍认为离子是在电流的作用下产生的金科玉律, 提出“电解质在溶液中能自动离解出正、负离子 ;溶液越稀,离解度就越大。”
这一学说是物理化学发展初期的重大发现,对溶液性质的解释起过重要的作用。它是物理和化学之间的一座桥梁。
阿伦尼乌斯与电离理论
思考题1:
1mol/L醋酸溶液中c(H+)是0.1mol/L
醋酸溶液中c(H+)的10倍吗?
分析:设1mol/L的醋酸溶液的电离度为α1,
0.1mol/L的醋酸溶液的电离度为α2,
所以α1< α2,
在1mol/L溶液中c(H+)1=α 1mol/L;
在0.1mol/L溶液中c(H+)2=0.1 α2mol/L
C(H+)1
C(H+)2
= 10α1 /α 2<10
以CH3COOH的电离平衡为例( CH3COOH的初始浓度为 c),你能得出电离平衡常数K与电离度α的计算关系吗?
思考题2:
