强电解质与弱电解质
图片预览






文档简介
(共19张PPT)
专题 3 溶液中的离子反应
第一单元 弱电解质的电离平衡
1、潮湿的手触摸正在工作的电器,可能会发生触电事故。
2、电解水制H2,O2时,向水中加入少量的NaOH溶液或H2SO4溶液。
你能解释下列事实吗
电解质:
非电解质:
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态时都不能导电的化合物。
强电解质:
弱电解质:
在水溶液中完全电离的电解质。
在水溶液中只能部分电离的电解质。
知识回顾
如何设计实验证明HCl和醋酸在水溶液中的电离程度差异?
方案:
1、分别测0.1mol/L的醋酸和盐酸的pH值;
2、等体积1mol/L的醋酸和盐酸分别与表面积相同的镁条反应;
3、等体积1mol/L的醋酸和盐酸分别与等量的碳酸钠反应;
4、去等体积0.1mol/L的醋酸与盐酸做导电性实验
……
测pH
与镁条反应
与碳酸钠反应
与锌粒反应
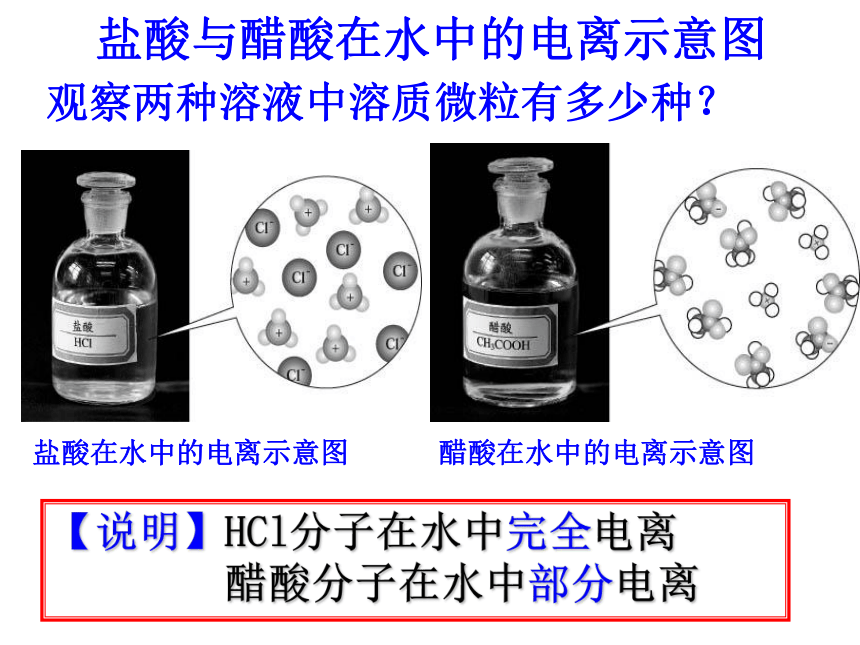
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
盐酸在水中的电离示意图
醋酸在水中的电离示意图
【说明】HCl分子在水中完全电离
醋酸分子在水中部分电离
强、弱电解质比较
强电解质 弱电解质
定义 溶于水后能够全部电离的电解质 溶于水后只能部分电离的电解质
电离程度
存在形式
化合物类型
完全
部分
离子
离子、分子
强酸、强碱、大多数盐、活泼金属氧化物
弱酸、弱碱、水
1.下列物质能导电的是__________,
属于强电解质的是________________,
属于弱电解质的是__________________,
属于非电解质的是______________。
a.铜丝 b.金刚石 c.石墨 d.NaCl e.稀硫酸
f.蔗糖 g.CO2 h.NaOH固体 i.硬脂酸 j.氨气
l.醋酸铵溶液 m. BaSO4 n. 熔融的硝酸钾
a c e l n
d h m n
i
f g j
随堂练习
2、根据你的经验,你认为相同浓度的氢氧化钠和氨水中,溶质的电离程度有无差异?请提出你的假设并设计实验加以验证。
实验假设
实验方案
实验现象
结论
电解质
非电解质
化合物
纯净物
物 质
混合物
单 质
强电解质
弱电解质
既不是电解质也不是非电解质
课堂小结
1、
2、实验探究的一般流程:
假设
设计方案
实验,
观察现象
结论
设计对比实验时,一般控制单一变量
1. 1mol/L的硫酸、盐酸、醋酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率________ ,
最终收集到的氢气的物质的量______ 。
硫酸>盐酸>醋酸
硫酸>盐酸=醋酸
随堂练习
2. H+浓度相同,溶液体积也相同的盐
酸和醋酸分别与等量的镁(不足)反应:
开始时刻产生氢气的速率_________
反应结束所以时间____________
产生氢气的量_______________
相等
盐酸多
相等
3.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电性基本不变,该液体是( )
A. 自来水 B. 0.5mol/L盐酸
C. 0.5mol/L醋酸 D. 0.05mol/L氢氧化钠
B
专题 3 溶液中的离子反应
第一单元 弱电解质的电离平衡
1、潮湿的手触摸正在工作的电器,可能会发生触电事故。
2、电解水制H2,O2时,向水中加入少量的NaOH溶液或H2SO4溶液。
你能解释下列事实吗
电解质:
非电解质:
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态时都不能导电的化合物。
强电解质:
弱电解质:
在水溶液中完全电离的电解质。
在水溶液中只能部分电离的电解质。
知识回顾
如何设计实验证明HCl和醋酸在水溶液中的电离程度差异?
方案:
1、分别测0.1mol/L的醋酸和盐酸的pH值;
2、等体积1mol/L的醋酸和盐酸分别与表面积相同的镁条反应;
3、等体积1mol/L的醋酸和盐酸分别与等量的碳酸钠反应;
4、去等体积0.1mol/L的醋酸与盐酸做导电性实验
……
测pH
与镁条反应
与碳酸钠反应
与锌粒反应
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
盐酸在水中的电离示意图
醋酸在水中的电离示意图
【说明】HCl分子在水中完全电离
醋酸分子在水中部分电离
强、弱电解质比较
强电解质 弱电解质
定义 溶于水后能够全部电离的电解质 溶于水后只能部分电离的电解质
电离程度
存在形式
化合物类型
完全
部分
离子
离子、分子
强酸、强碱、大多数盐、活泼金属氧化物
弱酸、弱碱、水
1.下列物质能导电的是__________,
属于强电解质的是________________,
属于弱电解质的是__________________,
属于非电解质的是______________。
a.铜丝 b.金刚石 c.石墨 d.NaCl e.稀硫酸
f.蔗糖 g.CO2 h.NaOH固体 i.硬脂酸 j.氨气
l.醋酸铵溶液 m. BaSO4 n. 熔融的硝酸钾
a c e l n
d h m n
i
f g j
随堂练习
2、根据你的经验,你认为相同浓度的氢氧化钠和氨水中,溶质的电离程度有无差异?请提出你的假设并设计实验加以验证。
实验假设
实验方案
实验现象
结论
电解质
非电解质
化合物
纯净物
物 质
混合物
单 质
强电解质
弱电解质
既不是电解质也不是非电解质
课堂小结
1、
2、实验探究的一般流程:
假设
设计方案
实验,
观察现象
结论
设计对比实验时,一般控制单一变量
1. 1mol/L的硫酸、盐酸、醋酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率________ ,
最终收集到的氢气的物质的量______ 。
硫酸>盐酸>醋酸
硫酸>盐酸=醋酸
随堂练习
2. H+浓度相同,溶液体积也相同的盐
酸和醋酸分别与等量的镁(不足)反应:
开始时刻产生氢气的速率_________
反应结束所以时间____________
产生氢气的量_______________
相等
盐酸多
相等
3.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电性基本不变,该液体是( )
A. 自来水 B. 0.5mol/L盐酸
C. 0.5mol/L醋酸 D. 0.05mol/L氢氧化钠
B
