人教版九年级上册 3.3《元素》复习课件(25张PPT)
文档属性
| 名称 | 人教版九年级上册 3.3《元素》复习课件(25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-07 20:05:42 | ||
图片预览






文档简介
(共25张PPT)
元 素
2021-2022学年九年级上册化学同步
第三单元 物质构成的奥秘
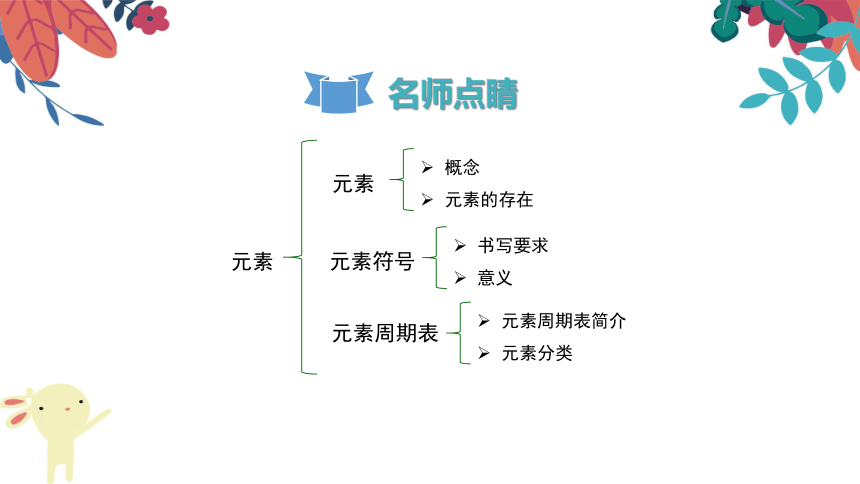
元素
元素
概念
元素的存在
元素符号
元素周期表
书写要求
意义
元素周期表简介
元素分类
1.元素的概念
(1)元素是________(即核电荷数)相同的一类原子的总称。
知识点1 元素
质子数
(2)元素三要素:
①相同质子数;
②同一类原子(质量不同但化学性质相同);
③总称。
注意:
(1)元素的种类是由原子的质子数(或核电荷数)决定。
(2)元素概念中的“一类原子”是指一种元素可能不止一种原子。它包括质子数相同,中子数不同的原子,也包括质子数相同,而电子数不同的原子和离子。
(3)元素的种类到目前为止已经发现的有100多种,这些元素组成的物质种类有3 000多万种。在不同物质中可以含有同一种元素。
2.元素的存在
(1)地壳中含量最多的元素是________,含量最多的金属元素是________。
(2)生物细胞中含量居前四位的元素是:
____(65%)、碳 (18%) 、氢(10%)、_____(3%)。
氧元素
铝元素
氧
氮
3.元素与物质、微观粒子的关系
(1)元素的化学性质
①元素的化学性质与其原子的核外电子排布,特别是______________________有关。
②在化学变化时,_____的种类不变,_____也不变。
最外层电子的数目
元素
原子
元素 原子
定义
不 同 点
相互关系 具有相同核电荷数的一类原子的总称
化学变化中的最小粒子
①只讲种类,不讲个数;
②是宏观的概念;
③只能组成物质,不能构成物质;
④化学变化中元素的种类和质量不变。
①既讲种类,又讲个数;
②是微观的概念;
③可直接构成物质,也可构成分子;
④化学变化中原子的种类、数目、质量都不变。
元素是具有相同核电荷数的一类原子的总称,原子是元素的个体,是化学变化中的最小粒子。
(2)元素与原子的区别与联系
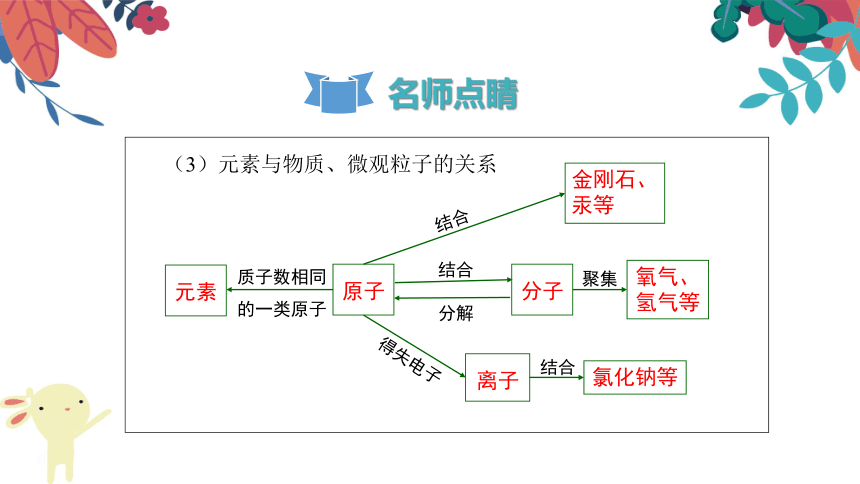
(3)元素与物质、微观粒子的关系
原子
元素
质子数相同的一类原子
金刚石、汞等
分子
氧气、氢气等
离子
氯化钠等
结合
结合
分解
聚集
得失电子
结合
1.元素符号的规定及书写
(1)国际上统一采用元素拉丁文名称的___________来表示元素,元素符号要______,如氢元素的符号为H。
(2)如果几种元素拉丁文名称的第一个字母相同时,就附加_____________来表示。第一个字母大写,第二个字母_____,如Cu表示铜元素,Cl表示氯元素。
知识点2 元素符号
第一个字母
大写
第二个字母
小写
2.元素符号的意义
(1)表示一种______;
(2)表示这种元素的一个______;
(3)对于由单个原子构成的单质,还表示这种____。
如:Fe,即可表示铁元素,也可以表示一个铁原子,还可以表示铁这种物质。
元素
原子
物质
1.定义
(1)元素周期表:根据元素的_________________,将100多种元素科学有序地排列起来所得的表。
(2)原子序数:元素周期表按原子_____________的顺序给元素编的号。
知识点3 元素周期表
原子结构和性质
核电荷数递增
原子序数=核电荷数=质子数=核外电子数
2.元素周期表的结构
(1)每一格:每一个元素占据一格,每一格均包含一种元素的_____________________________________________等内容。
(2)每一横行:每一横行叫做一个周期,共有7个横行,____个周期。
(3)每一纵行:每一纵行叫做一个族,周期表中共18纵行,____个族(8、9、10三纵行组成一个族)。
原子序数、元素符号、元素名称、相对原子质量
7
16
元素
金属元素:
非金属元素:
3.元素分类——目前已发现一百余种元素
汉字特点:带“钅”旁,“金”和“汞”例外
稀有气体元素:
“石” 固态非金属
“气” 气态非金属
“氵” 液态非金属
氦、氖、氩、氪、氙
命题角度:考查学生对元素的认识。
例1 某饮用水标签的部分内容如图所示,这里Na、K、Ca、Mg是指( )
A.元素 B.分子
C.原子 D.金属
类型一 元素的概念
A
【解析】A.元素是宏观概念,在饮用水中主要成分是元素的质量,故A正确;B.分子是微观粒子,其质量难确定,则饮用水中主要成分的质量不可能是分子质量,故B错误;C.原子是微观粒子,其质量难确定,则饮用水中主要成分的质量不可能是原子质量,故C错误;D.Na、K、Ca、Mg等是活泼金属元素,能与水反应,在饮用水中不可能是金属单质,故D错误。故选:A。
命题角度:考查学生对地壳中元素含量的了解。
例2 地壳中各元素的分布和含量并不均匀,如澳大利亚多铁矿,中国富产钨矿,南非多金矿等,从整个地壳而言,含量最丰富的金属元素是( )
A.氧元素 B.硅元素
C.铝元素 D.铁元素
类型二 元素的分布
C
【解析】A.含量最丰富的是氧元素,占第一位,属于非金属元素。故选项错误;B.硅元素占第二位,属于非金属元素。故选项错误;C.铝是含量最多的金属元素。故选项正确;D.铁属于金属元素,含量占第四位。故选项错误。故选:C。
命题角度:考查学生对元素符号的掌握情况。
例3 下图中的符号表示2个氢原子的是( )
类型三 元素符号的书写及意义
C
【解析】A.中2表示每个氢分子由2个氢原子构成,故A错误;B.中的前面的2表示2个氢分子,故B错误;C.表示2个氢原子,故C正确;D.中的2表示2个氢离子.故D错误。故选:C。
命题角度:考查学生对元素周期表的掌握情况。
例4 元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是依据元素周期表画出的1~18号元素的原子结构示意图,对它进行研究:
类型四 元素周期表
(1)原子序数为17的元素名称是_________,在化学反应中,该元素的原子容易_________电子,变成____________(填符号);原子序数为12的元素属于_________(金属、非金属、稀有气体)元素,上述两种元素所形成的化合物的化学式为____________。
氯
得到
Cl-
金属
MgCl2
(2)通过探究,我发现如下规律:
①原子最外层电子数一般不超过8个;
②金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;
③__________________________________________;
④ _________________________________________ 。
电子层数等于周期数
同一周期中最外层电子数由1-8依次排列
【解析】(1)根据金属元素的原子最外层电子数一般少于4个,可知原子序数为12的元素属于金属元素;非金属元素的原子最外层电子数一般多于4个,可知原子序数为17的元素为非金属元素,名称是氯;非金属元素在化学反应中易得到电子,形成阴离子;Cl、Mg形成的化合物的化学式为MgCl2;
(2)根据原子结构示意图的变化规律可知:电子层数等于周期数;同一周期中最外层电子数由1-8依次排列;
元 素
2021-2022学年九年级上册化学同步
第三单元 物质构成的奥秘
元素
元素
概念
元素的存在
元素符号
元素周期表
书写要求
意义
元素周期表简介
元素分类
1.元素的概念
(1)元素是________(即核电荷数)相同的一类原子的总称。
知识点1 元素
质子数
(2)元素三要素:
①相同质子数;
②同一类原子(质量不同但化学性质相同);
③总称。
注意:
(1)元素的种类是由原子的质子数(或核电荷数)决定。
(2)元素概念中的“一类原子”是指一种元素可能不止一种原子。它包括质子数相同,中子数不同的原子,也包括质子数相同,而电子数不同的原子和离子。
(3)元素的种类到目前为止已经发现的有100多种,这些元素组成的物质种类有3 000多万种。在不同物质中可以含有同一种元素。
2.元素的存在
(1)地壳中含量最多的元素是________,含量最多的金属元素是________。
(2)生物细胞中含量居前四位的元素是:
____(65%)、碳 (18%) 、氢(10%)、_____(3%)。
氧元素
铝元素
氧
氮
3.元素与物质、微观粒子的关系
(1)元素的化学性质
①元素的化学性质与其原子的核外电子排布,特别是______________________有关。
②在化学变化时,_____的种类不变,_____也不变。
最外层电子的数目
元素
原子
元素 原子
定义
不 同 点
相互关系 具有相同核电荷数的一类原子的总称
化学变化中的最小粒子
①只讲种类,不讲个数;
②是宏观的概念;
③只能组成物质,不能构成物质;
④化学变化中元素的种类和质量不变。
①既讲种类,又讲个数;
②是微观的概念;
③可直接构成物质,也可构成分子;
④化学变化中原子的种类、数目、质量都不变。
元素是具有相同核电荷数的一类原子的总称,原子是元素的个体,是化学变化中的最小粒子。
(2)元素与原子的区别与联系
(3)元素与物质、微观粒子的关系
原子
元素
质子数相同的一类原子
金刚石、汞等
分子
氧气、氢气等
离子
氯化钠等
结合
结合
分解
聚集
得失电子
结合
1.元素符号的规定及书写
(1)国际上统一采用元素拉丁文名称的___________来表示元素,元素符号要______,如氢元素的符号为H。
(2)如果几种元素拉丁文名称的第一个字母相同时,就附加_____________来表示。第一个字母大写,第二个字母_____,如Cu表示铜元素,Cl表示氯元素。
知识点2 元素符号
第一个字母
大写
第二个字母
小写
2.元素符号的意义
(1)表示一种______;
(2)表示这种元素的一个______;
(3)对于由单个原子构成的单质,还表示这种____。
如:Fe,即可表示铁元素,也可以表示一个铁原子,还可以表示铁这种物质。
元素
原子
物质
1.定义
(1)元素周期表:根据元素的_________________,将100多种元素科学有序地排列起来所得的表。
(2)原子序数:元素周期表按原子_____________的顺序给元素编的号。
知识点3 元素周期表
原子结构和性质
核电荷数递增
原子序数=核电荷数=质子数=核外电子数
2.元素周期表的结构
(1)每一格:每一个元素占据一格,每一格均包含一种元素的_____________________________________________等内容。
(2)每一横行:每一横行叫做一个周期,共有7个横行,____个周期。
(3)每一纵行:每一纵行叫做一个族,周期表中共18纵行,____个族(8、9、10三纵行组成一个族)。
原子序数、元素符号、元素名称、相对原子质量
7
16
元素
金属元素:
非金属元素:
3.元素分类——目前已发现一百余种元素
汉字特点:带“钅”旁,“金”和“汞”例外
稀有气体元素:
“石” 固态非金属
“气” 气态非金属
“氵” 液态非金属
氦、氖、氩、氪、氙
命题角度:考查学生对元素的认识。
例1 某饮用水标签的部分内容如图所示,这里Na、K、Ca、Mg是指( )
A.元素 B.分子
C.原子 D.金属
类型一 元素的概念
A
【解析】A.元素是宏观概念,在饮用水中主要成分是元素的质量,故A正确;B.分子是微观粒子,其质量难确定,则饮用水中主要成分的质量不可能是分子质量,故B错误;C.原子是微观粒子,其质量难确定,则饮用水中主要成分的质量不可能是原子质量,故C错误;D.Na、K、Ca、Mg等是活泼金属元素,能与水反应,在饮用水中不可能是金属单质,故D错误。故选:A。
命题角度:考查学生对地壳中元素含量的了解。
例2 地壳中各元素的分布和含量并不均匀,如澳大利亚多铁矿,中国富产钨矿,南非多金矿等,从整个地壳而言,含量最丰富的金属元素是( )
A.氧元素 B.硅元素
C.铝元素 D.铁元素
类型二 元素的分布
C
【解析】A.含量最丰富的是氧元素,占第一位,属于非金属元素。故选项错误;B.硅元素占第二位,属于非金属元素。故选项错误;C.铝是含量最多的金属元素。故选项正确;D.铁属于金属元素,含量占第四位。故选项错误。故选:C。
命题角度:考查学生对元素符号的掌握情况。
例3 下图中的符号表示2个氢原子的是( )
类型三 元素符号的书写及意义
C
【解析】A.中2表示每个氢分子由2个氢原子构成,故A错误;B.中的前面的2表示2个氢分子,故B错误;C.表示2个氢原子,故C正确;D.中的2表示2个氢离子.故D错误。故选:C。
命题角度:考查学生对元素周期表的掌握情况。
例4 元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是依据元素周期表画出的1~18号元素的原子结构示意图,对它进行研究:
类型四 元素周期表
(1)原子序数为17的元素名称是_________,在化学反应中,该元素的原子容易_________电子,变成____________(填符号);原子序数为12的元素属于_________(金属、非金属、稀有气体)元素,上述两种元素所形成的化合物的化学式为____________。
氯
得到
Cl-
金属
MgCl2
(2)通过探究,我发现如下规律:
①原子最外层电子数一般不超过8个;
②金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;
③__________________________________________;
④ _________________________________________ 。
电子层数等于周期数
同一周期中最外层电子数由1-8依次排列
【解析】(1)根据金属元素的原子最外层电子数一般少于4个,可知原子序数为12的元素属于金属元素;非金属元素的原子最外层电子数一般多于4个,可知原子序数为17的元素为非金属元素,名称是氯;非金属元素在化学反应中易得到电子,形成阴离子;Cl、Mg形成的化合物的化学式为MgCl2;
(2)根据原子结构示意图的变化规律可知:电子层数等于周期数;同一周期中最外层电子数由1-8依次排列;
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
