人教版九年级上册 2.3《制取氧气》课件(24张PPT)
文档属性
| 名称 | 人教版九年级上册 2.3《制取氧气》课件(24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 51.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-07 15:51:21 | ||
图片预览





文档简介
(共24张PPT)
课题三
制取氧气
2021-2022学年九年级上册化学同步
第二单元 我们周围的空气
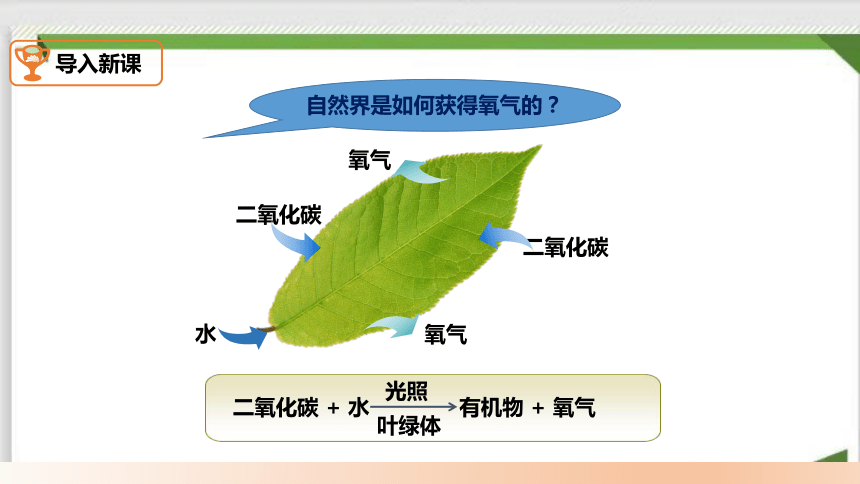
导入新课
二氧化碳
水
氧气
二氧化碳
氧气
二氧化碳 + 水 有机物 + 氧气
光照
叶绿体
自然界是如何获得氧气的?
新课学习
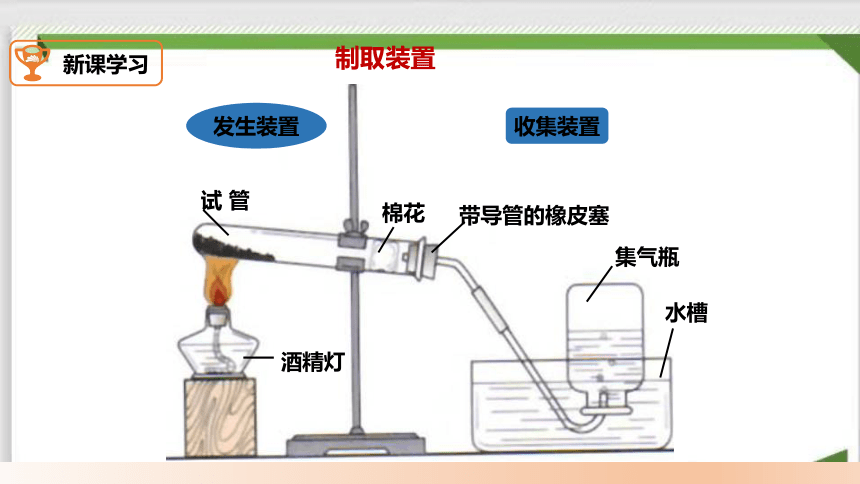
一、高锰酸钾制氧气
发生装置
收集装置
试 管
棉花
酒精灯
带导管的橡皮塞
集气瓶
水槽
制取装置
新课学习
加热
高锰酸钾
KMnO4
锰酸钾
K2MnO4
O2
氧气
+
+
二氧化锰
MnO2
操作步骤
1.查(装置气密性)
2.装(装药品在试管中,塞紧单孔塞)
3.定(固定试管在铁架台上)
4.点(酒精灯加热药品)
5.收(收集气体)
6.离(导管出水槽)
7.熄(灭酒精灯)
新课学习
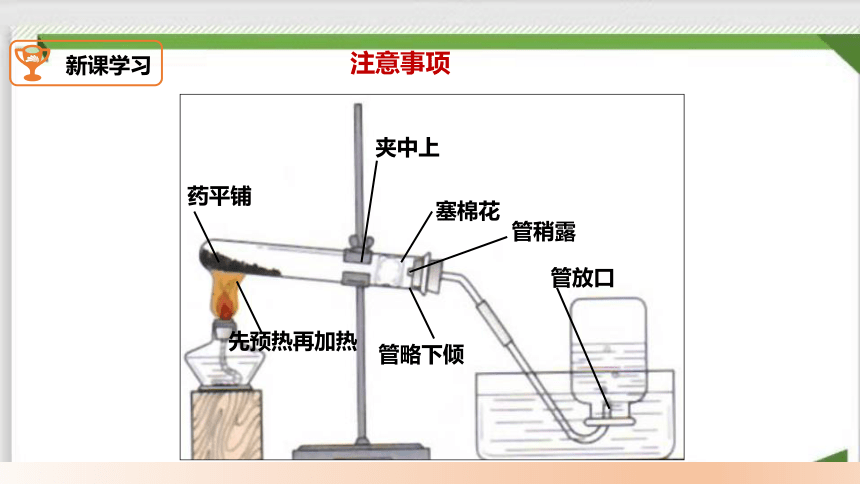
制取原理
药平铺
塞棉花
夹中上
管略下倾
管稍露
先预热再加热
管放口
注意事项
新课学习
1. 试管口要略向下倾斜
防止水倒流使试管炸裂
4.用排水集气法应什么时候开始收集?为什么?
气泡连续均匀放出时开收集,开始排出的是管内空气
5. 先将导管移出水面,后停止加热
防止水倒吸使试管炸裂
2. 试管口塞一团棉花
防止加热时高锰酸钾粉末进入导管
3.导气管稍露出
便于气体导出
操作注意事项原因
方法指导
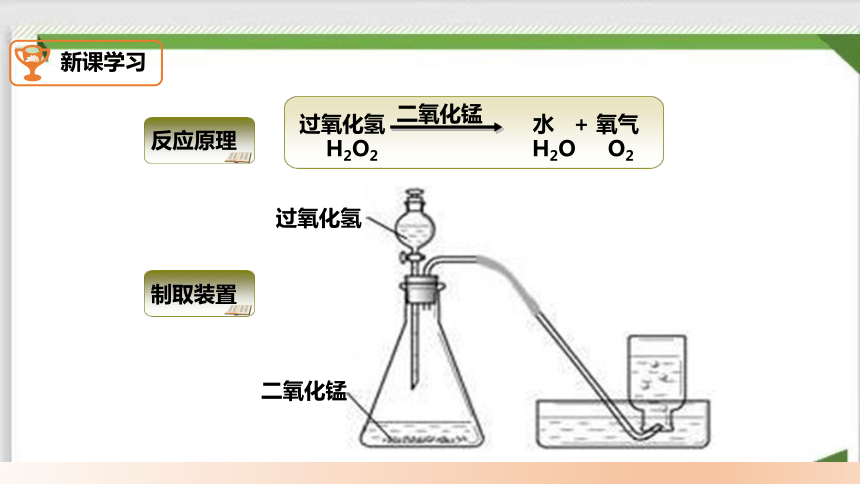
分解过氧化氢的反应中二氧化锰的作用
二、过氧化氢制氧气
新课学习
二氧化锰
过氧化氢 水 + 氧气
H2O2 H2O O2
制取装置
反应原理
过氧化氢
二氧化锰
新课学习
催化剂
新课学习
二氧化锰、硫酸铜溶液等
在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后没有发生变化的物质叫做催化剂(又叫触媒)
催化剂在化学反应中所起的作用
催化剂的物理性质不一定发生变化
催化剂
催化作用
归纳分析
一 变:化学反应速率改变
两不变:质量不变、化学性质不变
1.同一个反应可以用不同的催化剂
2.不同的反应可以用相同的催化剂
3.要证明某物质是某反应的催化剂
特点:
一是改变了某化学反应的速率
二是质量不变
三是化学性质不变
强调:
三点:
归纳小结
氯酸钾 氯化钾+氧气
二氧化锰
加热
三、氯酸钾制氧气
反应原理
新课学习
知识拓展
不易溶于水的气体且不与水反应
气体密度
比空气大
气体密度
比空气小
向下排空气法
排水法
向上排空气法
(1)排水法:当集气瓶的一侧有气泡放出时, 证明
已收集满
(2)向上排空气法:将带火星的木条放在集气瓶口,
若木条复燃,证明已收集满
放置
验满
正放在桌子上,并盖上毛玻璃片
把带火星的木条伸入集气瓶中,木条复燃,证明是氧气
验证
归纳分析
异同点?
由一种反应物生成两种或两种以上生成物的化学反应
AB → A + B
二氧化锰
过氧化氢 水 + 氧气
加热
高锰酸钾
锰酸钾
氧气
+
+
二氧化锰
氯酸钾 氯化钾+氧气
二氧化锰
加热
分解反应
新课学习
1.用哪一种药品制取氧气最好?
2.如果某同学制得的氧气不纯,你认为可能的原因有哪些?
用排空气法收集,时间不够;
用排水法收集,开始时集气瓶中没有装满水;
用排水法收集,没等到气泡连续均匀放出时就开始收集,原试管内空气进入集气瓶;等等。
用过氧化氢。操作简便、不加热、节能、安全等
思维拓展
四、氧气的工业制法
分离液态空气
空气
降温
加压
液态空气
氮气
液态氧
蒸发
-196 C
新课学习
1.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
A.加热固体药品前 B.与加热固体药品同时
C.开始有气泡放出时 D.气泡连续并均匀放出时
2.检验氧气是否充满集气瓶的操作是( )
A.用燃着的木条伸入集气瓶中
B.将带火星的木条伸在集气瓶口
C.将带火星的木条伸到集气瓶底
D.用燃着的木条伸在集气瓶口
D
B
课堂练习
3.你能用简单的方法区分水和过氧化氢这两种无色液体吗?
取两种无色液体分别于试管中,向试管里加入二氧化锰或分别对试管微热,有气泡冒出则为双氧水。
课堂练习
我们都学了什么?
氧气实验室制法
药品及原理
仪器及装置
实验的步骤及注意事项
收集验满方法
课堂小结
作业布置
1.完成P41练习与应用。
2. “氧立得” 是一种轻便、快捷的制氧装置,请同学们课下找找它的说明书或通过上网查询,来了解它的原理。你能否从中受到启发,利用身边的材料自己动手做一个简易的制氧装置
板书设计
由一种反应物生成两种或两种以上生成物的化学反应
二氧化锰
过氧化氢 水 + 氧气
加热
高锰酸钾
锰酸钾
氧气
+
+
二氧化锰
氯酸钾 氯化钾+氧气
二氧化锰
加热
分解反应
催化剂 催化作用
反应原理
制取氧气
课题三
制取氧气
2021-2022学年九年级上册化学同步
第二单元 我们周围的空气
导入新课
二氧化碳
水
氧气
二氧化碳
氧气
二氧化碳 + 水 有机物 + 氧气
光照
叶绿体
自然界是如何获得氧气的?
新课学习
一、高锰酸钾制氧气
发生装置
收集装置
试 管
棉花
酒精灯
带导管的橡皮塞
集气瓶
水槽
制取装置
新课学习
加热
高锰酸钾
KMnO4
锰酸钾
K2MnO4
O2
氧气
+
+
二氧化锰
MnO2
操作步骤
1.查(装置气密性)
2.装(装药品在试管中,塞紧单孔塞)
3.定(固定试管在铁架台上)
4.点(酒精灯加热药品)
5.收(收集气体)
6.离(导管出水槽)
7.熄(灭酒精灯)
新课学习
制取原理
药平铺
塞棉花
夹中上
管略下倾
管稍露
先预热再加热
管放口
注意事项
新课学习
1. 试管口要略向下倾斜
防止水倒流使试管炸裂
4.用排水集气法应什么时候开始收集?为什么?
气泡连续均匀放出时开收集,开始排出的是管内空气
5. 先将导管移出水面,后停止加热
防止水倒吸使试管炸裂
2. 试管口塞一团棉花
防止加热时高锰酸钾粉末进入导管
3.导气管稍露出
便于气体导出
操作注意事项原因
方法指导
分解过氧化氢的反应中二氧化锰的作用
二、过氧化氢制氧气
新课学习
二氧化锰
过氧化氢 水 + 氧气
H2O2 H2O O2
制取装置
反应原理
过氧化氢
二氧化锰
新课学习
催化剂
新课学习
二氧化锰、硫酸铜溶液等
在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后没有发生变化的物质叫做催化剂(又叫触媒)
催化剂在化学反应中所起的作用
催化剂的物理性质不一定发生变化
催化剂
催化作用
归纳分析
一 变:化学反应速率改变
两不变:质量不变、化学性质不变
1.同一个反应可以用不同的催化剂
2.不同的反应可以用相同的催化剂
3.要证明某物质是某反应的催化剂
特点:
一是改变了某化学反应的速率
二是质量不变
三是化学性质不变
强调:
三点:
归纳小结
氯酸钾 氯化钾+氧气
二氧化锰
加热
三、氯酸钾制氧气
反应原理
新课学习
知识拓展
不易溶于水的气体且不与水反应
气体密度
比空气大
气体密度
比空气小
向下排空气法
排水法
向上排空气法
(1)排水法:当集气瓶的一侧有气泡放出时, 证明
已收集满
(2)向上排空气法:将带火星的木条放在集气瓶口,
若木条复燃,证明已收集满
放置
验满
正放在桌子上,并盖上毛玻璃片
把带火星的木条伸入集气瓶中,木条复燃,证明是氧气
验证
归纳分析
异同点?
由一种反应物生成两种或两种以上生成物的化学反应
AB → A + B
二氧化锰
过氧化氢 水 + 氧气
加热
高锰酸钾
锰酸钾
氧气
+
+
二氧化锰
氯酸钾 氯化钾+氧气
二氧化锰
加热
分解反应
新课学习
1.用哪一种药品制取氧气最好?
2.如果某同学制得的氧气不纯,你认为可能的原因有哪些?
用排空气法收集,时间不够;
用排水法收集,开始时集气瓶中没有装满水;
用排水法收集,没等到气泡连续均匀放出时就开始收集,原试管内空气进入集气瓶;等等。
用过氧化氢。操作简便、不加热、节能、安全等
思维拓展
四、氧气的工业制法
分离液态空气
空气
降温
加压
液态空气
氮气
液态氧
蒸发
-196 C
新课学习
1.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
A.加热固体药品前 B.与加热固体药品同时
C.开始有气泡放出时 D.气泡连续并均匀放出时
2.检验氧气是否充满集气瓶的操作是( )
A.用燃着的木条伸入集气瓶中
B.将带火星的木条伸在集气瓶口
C.将带火星的木条伸到集气瓶底
D.用燃着的木条伸在集气瓶口
D
B
课堂练习
3.你能用简单的方法区分水和过氧化氢这两种无色液体吗?
取两种无色液体分别于试管中,向试管里加入二氧化锰或分别对试管微热,有气泡冒出则为双氧水。
课堂练习
我们都学了什么?
氧气实验室制法
药品及原理
仪器及装置
实验的步骤及注意事项
收集验满方法
课堂小结
作业布置
1.完成P41练习与应用。
2. “氧立得” 是一种轻便、快捷的制氧装置,请同学们课下找找它的说明书或通过上网查询,来了解它的原理。你能否从中受到启发,利用身边的材料自己动手做一个简易的制氧装置
板书设计
由一种反应物生成两种或两种以上生成物的化学反应
二氧化锰
过氧化氢 水 + 氧气
加热
高锰酸钾
锰酸钾
氧气
+
+
二氧化锰
氯酸钾 氯化钾+氧气
二氧化锰
加热
分解反应
催化剂 催化作用
反应原理
制取氧气
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
