人教版九年级上册 6.3《二氧化碳和一氧化碳 第二课时》课件(20张PPT)
文档属性
| 名称 | 人教版九年级上册 6.3《二氧化碳和一氧化碳 第二课时》课件(20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 27.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-07 16:00:09 | ||
图片预览







文档简介
(共20张PPT)
二氧化碳和一氧化碳
第二课时
导入新课
当碳燃烧不充分时,生成一氧化碳。
点燃
2C+O2 2CO
(1)无色、无味的气体
二、CO 的性质
(2)难溶于水
1.CO物理性质
(3)密度比空气略小
新课学习
1.可燃性
燃烧时发出蓝色的火焰
作燃料
点燃
2CO+O2 2CO2
新课学习
煤炉里的煤在燃烧过程中,发生了哪些化学反应?
点燃
C+O2 CO2
点燃
2C+O2 2CO
C+CO2 2CO
高温
点燃
2CO+O2 2CO2
新课学习
一氧化碳还原氧化铜
2.还原性
澄清的石灰水变浑浊。
黑色的氧化铜变成了红色物质
CuO+CO Cu+CO2
△
新课学习
实验注意事项:
1.使用CO前应先验纯。
2.实验开始应先通CO,再加热。
3.实验结束要先停止加热再停止通CO。
4.尾气要进行处理——点燃或用气球收集。
因为CO混有O2时,点燃可能发生爆炸
防止CO与管内空气混合加热时发生爆炸
防止还原得到的铜高温下又被氧化
防止CO污染空气
新课学习
一氧化碳还原氧化铁
冶炼金属
高温
2Fe2O3+3CO 4Fe+3CO2↑
新课学习
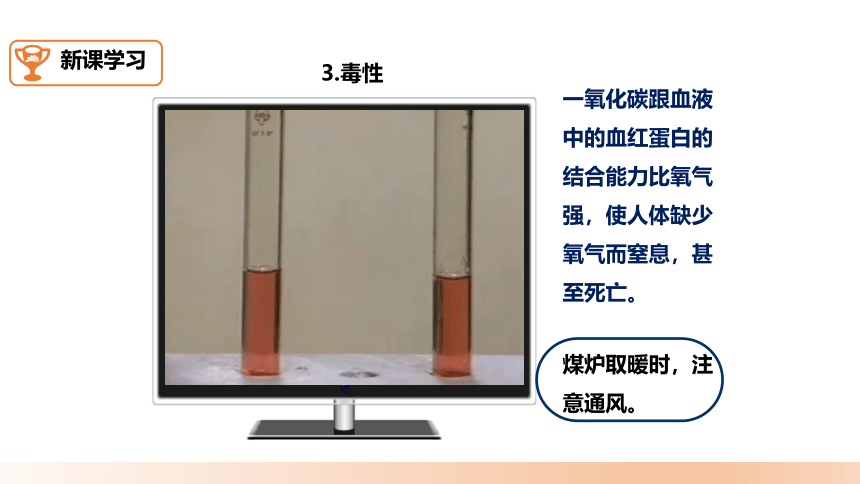
3.毒性
一氧化碳跟血液中的血红蛋白的结合能力比氧气强,使人体缺少氧气而窒息,甚至死亡。
煤炉取暖时,注意通风。
新课学习
对比学习
比较CO2和CO的物理性质:
二氧化碳( CO2 ) 一氧化碳( CO )
颜色
气味
状态
密度
溶解性
无色
无色
无味
无味
气体(常温常压)
气体
密度比空气大
密度比空气略小
能溶于水
难溶于水
分子的构成不同
对比学习
比较CO2和CO的化学性质:
二氧化碳 一氧化碳
跟水
跟澄清石灰水
可燃性
还原性
毒性
CO2+H2O=H2CO3
不反应
不反应
不能燃烧也不支持燃烧
无还原性
无毒
有毒
CO2+Ca(OH)2=
CaCO3↓+H2O
CuO+CO Cu+CO2
△
点燃
2CO+O2 2CO2
对比学习
CO2 CO
正面 作用
负面 作用
1.干冰人工降雨
和食品保藏
2.灭火
“温室效应”
1.做气体燃料
2.做还原剂(冶金)
易造成煤气中毒
比较CO2和CO的作用:
排放造成空气污染
重点拓展
先通过澄清石灰水除去CO2,再通过灼热的CuO,最后再将此气体通过澄清的石灰水。
1.如何鉴别CO和CO2?
燃烧的木条去点燃;通过灼热的CuO通入紫色石蕊试液;通过澄清的石灰水
通过足量澄清石灰水。
通过灼热的 CuO。
2.如何将CO中混有的CO2除去?
3.如何将CO2中混有的CO除去?
4.如何证明CO2中混有CO?
CO2
CO
CO2
CuO
CO
CO2
CO
石灰水
课外实验
向一个玻璃杯内倒入半杯食醋,再将一枚鸡蛋放入醋中,鸡蛋就在醋中浮上浮下,好像一艘潜水艇一样在海洋中潜入浮出。你能说明其中的道理吗?
鸡蛋潜水艇
有大量气泡产生,蛋壳不断减少,玻璃片上澄清石灰水变浑浊
根据现象可推知反应后生成了二氧化碳,证明鸡蛋壳中含有碳酸根,则鸡蛋壳中可能含有碳酸钙。
课堂练习
1.下列做法存在事故隐患的 是( )
A.在煤炉上放一壶水防止煤气中毒
B.用干冰制造舞台上的云雾
C.进入久未开启的菜窖前应先做灯火实验
D.点燃CO气体前,应先检验其纯度
2.将CO、CO2、N2的混合气体,通过足量的澄清石灰水,再通过足量灼热的氧化铜,充分反应后剩余的气体是( )
A.N2 B.CO2和N2 C.CO2和CO D.N2和CO
A
B
课堂练习
3.煤气的主要成分是一氧化碳,下列说法中不属于一氧化碳性质的是( ) A.煤气有可燃性 B.煤气有还原性 C.煤气有特殊气味 D.煤气有毒
4. CO、C分别与黑色的CuO反应,下列叙述中错误的是( )
A.反应都需要加热 B.都有红色的固体物质生成
C.CuO 都发生还原反应 D.都属于置换反应
C
D
课堂小结
我们都学了什么?
一氧化碳的化学性质
1.可燃性
2.还原性
3.毒性
作业布置
1.完成P123练习与应用中2、5。
2.收集材料,了解一氧化碳中毒的处理方法。
一氧化碳
1.可燃性
2.还原性
3.毒性
点燃
2CO+O2 2CO2
CuO+CO Cu+CO2
△
高温
2Fe2O3+3CO 4Fe+3CO2↑
板书设计
二氧化碳和一氧化碳
第二课时
导入新课
当碳燃烧不充分时,生成一氧化碳。
点燃
2C+O2 2CO
(1)无色、无味的气体
二、CO 的性质
(2)难溶于水
1.CO物理性质
(3)密度比空气略小
新课学习
1.可燃性
燃烧时发出蓝色的火焰
作燃料
点燃
2CO+O2 2CO2
新课学习
煤炉里的煤在燃烧过程中,发生了哪些化学反应?
点燃
C+O2 CO2
点燃
2C+O2 2CO
C+CO2 2CO
高温
点燃
2CO+O2 2CO2
新课学习
一氧化碳还原氧化铜
2.还原性
澄清的石灰水变浑浊。
黑色的氧化铜变成了红色物质
CuO+CO Cu+CO2
△
新课学习
实验注意事项:
1.使用CO前应先验纯。
2.实验开始应先通CO,再加热。
3.实验结束要先停止加热再停止通CO。
4.尾气要进行处理——点燃或用气球收集。
因为CO混有O2时,点燃可能发生爆炸
防止CO与管内空气混合加热时发生爆炸
防止还原得到的铜高温下又被氧化
防止CO污染空气
新课学习
一氧化碳还原氧化铁
冶炼金属
高温
2Fe2O3+3CO 4Fe+3CO2↑
新课学习
3.毒性
一氧化碳跟血液中的血红蛋白的结合能力比氧气强,使人体缺少氧气而窒息,甚至死亡。
煤炉取暖时,注意通风。
新课学习
对比学习
比较CO2和CO的物理性质:
二氧化碳( CO2 ) 一氧化碳( CO )
颜色
气味
状态
密度
溶解性
无色
无色
无味
无味
气体(常温常压)
气体
密度比空气大
密度比空气略小
能溶于水
难溶于水
分子的构成不同
对比学习
比较CO2和CO的化学性质:
二氧化碳 一氧化碳
跟水
跟澄清石灰水
可燃性
还原性
毒性
CO2+H2O=H2CO3
不反应
不反应
不能燃烧也不支持燃烧
无还原性
无毒
有毒
CO2+Ca(OH)2=
CaCO3↓+H2O
CuO+CO Cu+CO2
△
点燃
2CO+O2 2CO2
对比学习
CO2 CO
正面 作用
负面 作用
1.干冰人工降雨
和食品保藏
2.灭火
“温室效应”
1.做气体燃料
2.做还原剂(冶金)
易造成煤气中毒
比较CO2和CO的作用:
排放造成空气污染
重点拓展
先通过澄清石灰水除去CO2,再通过灼热的CuO,最后再将此气体通过澄清的石灰水。
1.如何鉴别CO和CO2?
燃烧的木条去点燃;通过灼热的CuO通入紫色石蕊试液;通过澄清的石灰水
通过足量澄清石灰水。
通过灼热的 CuO。
2.如何将CO中混有的CO2除去?
3.如何将CO2中混有的CO除去?
4.如何证明CO2中混有CO?
CO2
CO
CO2
CuO
CO
CO2
CO
石灰水
课外实验
向一个玻璃杯内倒入半杯食醋,再将一枚鸡蛋放入醋中,鸡蛋就在醋中浮上浮下,好像一艘潜水艇一样在海洋中潜入浮出。你能说明其中的道理吗?
鸡蛋潜水艇
有大量气泡产生,蛋壳不断减少,玻璃片上澄清石灰水变浑浊
根据现象可推知反应后生成了二氧化碳,证明鸡蛋壳中含有碳酸根,则鸡蛋壳中可能含有碳酸钙。
课堂练习
1.下列做法存在事故隐患的 是( )
A.在煤炉上放一壶水防止煤气中毒
B.用干冰制造舞台上的云雾
C.进入久未开启的菜窖前应先做灯火实验
D.点燃CO气体前,应先检验其纯度
2.将CO、CO2、N2的混合气体,通过足量的澄清石灰水,再通过足量灼热的氧化铜,充分反应后剩余的气体是( )
A.N2 B.CO2和N2 C.CO2和CO D.N2和CO
A
B
课堂练习
3.煤气的主要成分是一氧化碳,下列说法中不属于一氧化碳性质的是( ) A.煤气有可燃性 B.煤气有还原性 C.煤气有特殊气味 D.煤气有毒
4. CO、C分别与黑色的CuO反应,下列叙述中错误的是( )
A.反应都需要加热 B.都有红色的固体物质生成
C.CuO 都发生还原反应 D.都属于置换反应
C
D
课堂小结
我们都学了什么?
一氧化碳的化学性质
1.可燃性
2.还原性
3.毒性
作业布置
1.完成P123练习与应用中2、5。
2.收集材料,了解一氧化碳中毒的处理方法。
一氧化碳
1.可燃性
2.还原性
3.毒性
点燃
2CO+O2 2CO2
CuO+CO Cu+CO2
△
高温
2Fe2O3+3CO 4Fe+3CO2↑
板书设计
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
