硫和氮的氧化物
图片预览










文档简介
(共34张PPT)
第三节 硫和氮的氧化物
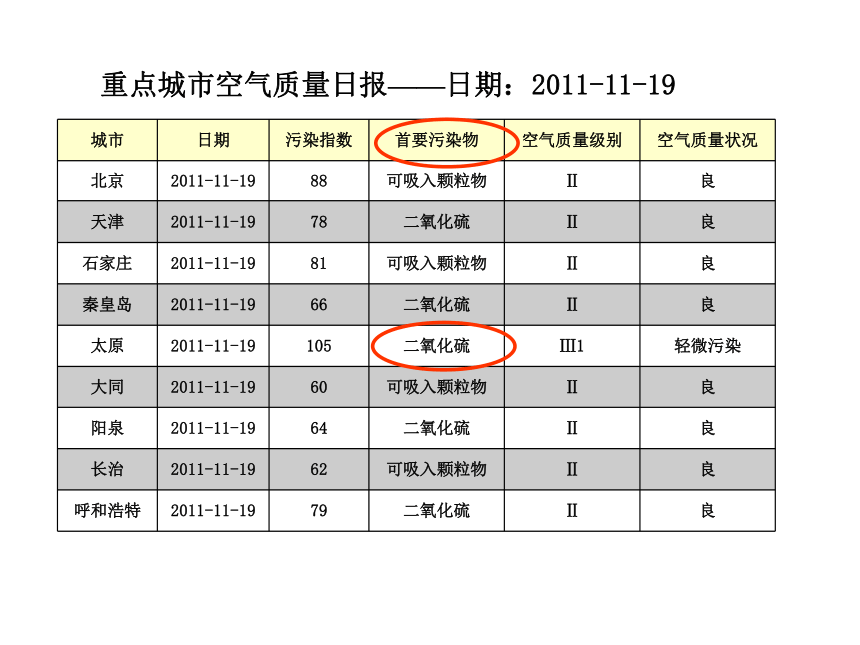
重点城市空气质量日报——日期:2011-11-19
城市 日期 污染指数 首要污染物 空气质量级别 空气质量状况
北京 2011-11-19 88 可吸入颗粒物 Ⅱ 良
天津 2011-11-19 78 二氧化硫 Ⅱ 良
石家庄 2011-11-19 81 可吸入颗粒物 Ⅱ 良
秦皇岛 2011-11-19 66 二氧化硫 Ⅱ 良
太原 2011-11-19 105 二氧化硫 Ⅲ1 轻微污染
大同 2011-11-19 60 可吸入颗粒物 Ⅱ 良
阳泉 2011-11-19 64 二氧化硫 Ⅱ 良
长治 2011-11-19 62 可吸入颗粒物 Ⅱ 良
呼和浩特 2011-11-19 79 二氧化硫 Ⅱ 良
(1)、硫元素的存在形式
(1)游离态:单质硫存在于火山口附近或 地壳的岩石
(3)固态硫化物和硫酸盐:
硫铁矿 FeS2
黄铜矿 CuFeS2
石膏 CaSO4·2H2O
芒硝 Na2SO4·10H2O
(2)气态化合物 :H2S、SO2、SO3
(4)硫是一种生命元素,组成某些蛋白质时不可离开它。因此化石燃料中经常 含有硫元素。
一、二氧化硫和三氧化硫
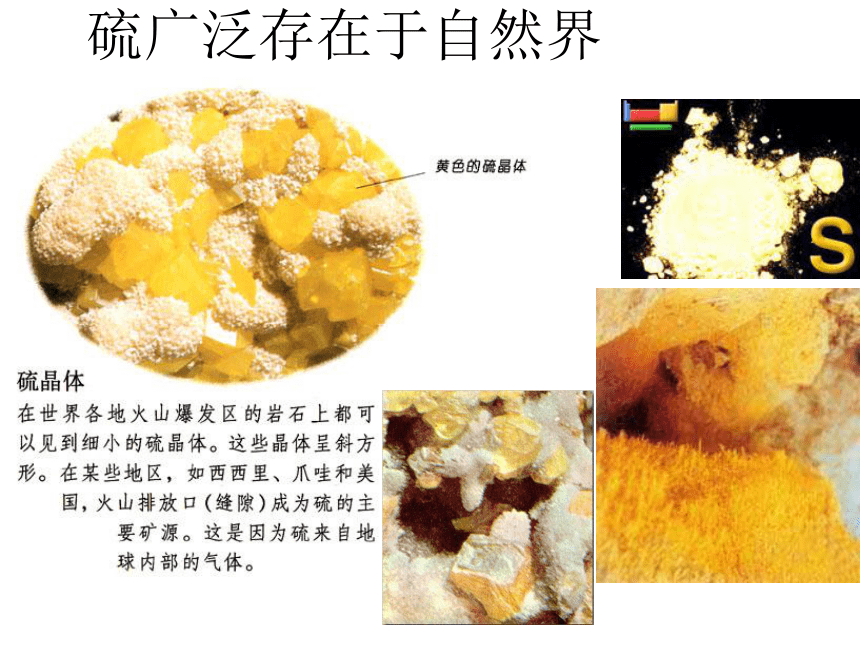
硫广泛存在于自然界
游离态的硫存在于火山喷口附近或地壳的岩层里
游离态的硫存在于火山喷口附近或地壳的岩层里
硫广泛存在于自然界
化合态的硫主要以硫化物和硫酸盐的形式存在
石膏
黄铁矿
黄铜矿
淡黄色晶体
质脆,容易研成粉末。
不溶于水,微溶于酒精,易溶于二硫化碳。
密度比水大(约为2 g/cm3 )
熔沸点低(112.8℃, 444.6 ℃)
俗称:硫磺
(2)硫的物理性质:
(3)硫的化学性质:
S + O2 = SO2
0
+4
硫作为还原剂,具有还原性。
现象:有刺激性气味的气体生成。硫在空气中安静地燃烧,发出淡蓝色的火焰; 硫在纯氧中发出蓝紫色的火焰
点燃
S+Fe FeS
△
△
S + 2Cu Cu2S
3S + 6NaOH = Na2SO3+ 2Na2S + 3H2O
硫作为氧化剂,具有氧化性。
但氧化性较弱。
硫还能溶于强碱溶液:即做氧化剂,又做还原剂。
乐山大佛开凿于唐玄宗开元初年(公元713年),为世界第一大石刻弥勒佛,“佛是一座山,山是一尊佛”是其真实写照,请同学们仔细观察,历经千年时间的流逝,是什么物质使大佛鼻翼发黑,佛容暗淡呢?
2、二氧化硫(SO2)
无色有刺激性气味的气体
密度比空气大
二氧化硫是污染大气的主要有害物质之一
易溶于水(常温常压下 1 : 40 )
有毒 (发生呼吸道疾病、浓度高时会令人死亡)
易液化(-10 ℃ )
(1)、二氧化硫(SO2)的物理性质:
(2)、二氧化硫(SO2)的化学性质:
1)、二氧化硫跟水反应:
实验4-7 书P90
实验步骤:见书
实验现象:
①试管中的水面上升,溶液几乎充满整个试管
②pH试纸变红
③加入品红溶液,品红溶液褪色
④加热后,溶液又变成红色,同时有刺激性气味的气体生成。
实验结论:
①SO2易溶于水,且与水反应
② SO2的漂白作用;但漂白后的新物质不稳定,易恢复原来的颜色
(检验SO2的存在)
SO2 + H2O
H2SO3
(1)、二氧化硫跟水反应:
可逆反应:在同一条件下, 既能向正反应方向进行,
又能向逆反应方向进行。
特点
正反应和逆反应同时发生,均不彻底,
反应物和生成物共存。
SO2漂白原理:由于它能与某些有色物质生成
不稳定的无色物质。无色物质容易分解而使有色物质恢复原来的颜色。
(中强酸)
SO2 + H2O
H2SO3
几种具有漂白性物质的性质比较:
物质 氯水(过氧化钠 双氧水) SO2 活性炭
原理
实质
效果
范围
氯水中的次氯酸将有色物质氧化成无色物质
氧化还原反应
(化学变化)
永久性
可漂白大多数有色物质,能使紫色石蕊试液褪色
二氧化硫溶于水产生的亚硫酸与有色物质直接结合生成不稳定的无色物质
非氧化还原反应(化学变化)
暂时性
可漂白某些有色物质,不能使石蕊试液褪色
将有色物质的分子吸附在其表面
物理吸附
(物理变化)
暂时性
可吸附某些有色物质的分子
实验室制取SO2,可选择碱液吸收尾气,防止空气污染。
SO2+Ca(OH)2 CaSO3 +H2O
(2)二氧化硫具有酸性氧化物的通性
SO2+CaO CaSO3
石灰法脱硫
SO2+ CaSO3 + H2O = Ca(HSO3)2
(3)氧化性:
2H2S+SO2 3S+2H2O
SO2 + I2 + 2H2O = H2SO4 + 2HI
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
(4) 、二氧化硫的还原性:
(工业制硫酸的第二步)
3、三氧化硫(酸性氧化物)
SO3 + Ca(OH)2 = CaSO4 + H2O
SO3 + CaO = CaSO4
SO3 + H2O=H2SO4
(工业制硫酸的第三步)
5SO2 + 2KMnO4+ 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
2SO2 + O2 2SO3
一、 SO2物理性质
无色、有刺激性气味、有毒、易溶于水
二、 SO2化学性质
1、与水反应生成酸
SO2 + H2O H2SO3 2、与碱反应生成盐和水 SO2 + 2NaOH Na2SO3 + H2O
3、既有氧化性,又有还原性 2SO2 + O2 2SO3 4、漂白性:
品红溶液 褪色
催化剂
课堂小结
三、SO3的性质
1.下列可以用来鉴别SO2和CO2的方法是( )
A、通入紫色石蕊试液 B、闻气味 C、通入澄清石灰水 D、通入品红溶液中
B D
课堂练习:
2.在BaCl2的水溶液中通入SO2未见沉淀,把其分成两份,向其中一份中A通入NH3,另一份B通入Cl2则( )
A、只有A中产生沉淀BaSO4
B、只有B中产生沉淀
C、都不产生沉淀
D、都产生沉淀
D
3.下列能说明SO2具有漂白作用的是( )
A.SO2能使酸性高锰酸钾褪色
B.SO2能使品红溶液褪色
C.SO2能溴水褪色
D.SO2难使品红试液变红
B
4.潮湿的氯气和二氧化硫都具有漂白性,将氯气和SO2在相同状况下等体积混合后,其漂白性变化为 ,其原因是 .写出有关反应的化学方程式 .
漂白性消失 ,Cl2和SO2作用生成了无漂白作用的HCl和H2SO4
2H2O +Cl2+SO2 H2SO4+2HCl
二、二氧化氮和一氧化氮
1、氮气(N2)
无色无味无毒气体
比空气稍轻
1)、氮气的物理性质:
不溶于水
收集氮气时用排水法不用排空法
N2 + O2 ===== 2NO
放电或高温
2)、氮气的化学性质:
3)、氮气的用途:
保护气:填充灯泡,焊接金属等
N2 + 3H2 2NH3
N2 + 3Mg Mg3N2
2、一氧化氮(NO):
1)、NO的物理性质:
无色、不溶于水、有毒气体
是大气的污染物
2)、NO的化学性质:
2NO + O2 = 2NO2 (红棕色)
(工业制硝酸的第二步)
3、二氧化氮(NO2):
1)、NO2的物理性质:
红棕色、有刺激性气味的有毒气体
密度比空气大
易液化(20℃)易溶于水并与水反应
是污染大气的有害物质之一
2)、NO2的化学性质:
3NO2 + H2O = 2HNO3 + NO
(工业制硝酸的第三步)
+4
+5
二氧化氮是硝酸的酸酐吗?为什么?
硝酸的酸酐是N2O5
+5
哪种氧化物是亚硝酸(HNO2)的酸酐?
N2O3
[科学探究] 书P92 NO2溶于水实验
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
液体充满整个试管
向试管中慢慢通入氧气
3
2KClO3=2KCl+3O2
2H2O2 = 2H2O+O2↑
制取氧气
2
红棕色气体变为无色,液面上升到2/3
将一支充满NO2的试管倒扣在水槽中
1
解释
现象
实验步骤
3NO2+H2O =2HNO3+NO
NO2为红棕色气体,NO为无色气体难溶于水。
△
NO2 和 O2 混和气体溶于水的反应
3NO2 + H2O = 2HNO3 + NO ①
2NO + O2 = 2NO2 ②
① ×2 + ②
总反应:4NO2 + O2 + 2H2O = 4HNO3
NO 和 O2 混和气体溶于水的反应
2NO + O2 = 2NO2 ①
3NO2 + H2O = 2HNO3 + NO ②
① ×3 + ②×2
4NO + 3O2 + 2H2O = 4HNO3
三、SO2、NO2对大气的污染:
1、SO2、NO2污染物的形成: 书P93
①、煤、石油、金属矿物质的燃烧和冶炼产生SO2
②、汽车尾气、硝酸工业产生的NO2
③、酸雨的形成
饮用酸化的地下水危害人类
腐蚀建筑物和工业设备
破坏土壤成分使农作物减产甚至死亡
损坏植物叶面导致森林死亡
破坏露天文物古迹
使湖泊中鱼虾死亡
酸雨的危害:
NO2、SO2与水反应造成的
硝酸酸雨:
酸雨:指pH小于5.6的降水。
3NO2 + H2O = 2HNO3 + NO
硫酸酸雨:
SO3 + H2O=H2SO4
2H2SO3 + O2 = 2H2SO4
催化剂
2SO2 + O2 2SO3
或:SO2 + H2O
H2SO3
2、大气污染的危害:
①、危害人体健康
②、酸雨破坏农作物、森林,土壤酸化,腐蚀建筑等
3、保护环境,整治污染
防治酸雨的措施 书P94
①、调整、发展、优化、提高,
减少污染物
②、严格控制污染物的排放量
③、研究开发新技术
第三节 硫和氮的氧化物
重点城市空气质量日报——日期:2011-11-19
城市 日期 污染指数 首要污染物 空气质量级别 空气质量状况
北京 2011-11-19 88 可吸入颗粒物 Ⅱ 良
天津 2011-11-19 78 二氧化硫 Ⅱ 良
石家庄 2011-11-19 81 可吸入颗粒物 Ⅱ 良
秦皇岛 2011-11-19 66 二氧化硫 Ⅱ 良
太原 2011-11-19 105 二氧化硫 Ⅲ1 轻微污染
大同 2011-11-19 60 可吸入颗粒物 Ⅱ 良
阳泉 2011-11-19 64 二氧化硫 Ⅱ 良
长治 2011-11-19 62 可吸入颗粒物 Ⅱ 良
呼和浩特 2011-11-19 79 二氧化硫 Ⅱ 良
(1)、硫元素的存在形式
(1)游离态:单质硫存在于火山口附近或 地壳的岩石
(3)固态硫化物和硫酸盐:
硫铁矿 FeS2
黄铜矿 CuFeS2
石膏 CaSO4·2H2O
芒硝 Na2SO4·10H2O
(2)气态化合物 :H2S、SO2、SO3
(4)硫是一种生命元素,组成某些蛋白质时不可离开它。因此化石燃料中经常 含有硫元素。
一、二氧化硫和三氧化硫
硫广泛存在于自然界
游离态的硫存在于火山喷口附近或地壳的岩层里
游离态的硫存在于火山喷口附近或地壳的岩层里
硫广泛存在于自然界
化合态的硫主要以硫化物和硫酸盐的形式存在
石膏
黄铁矿
黄铜矿
淡黄色晶体
质脆,容易研成粉末。
不溶于水,微溶于酒精,易溶于二硫化碳。
密度比水大(约为2 g/cm3 )
熔沸点低(112.8℃, 444.6 ℃)
俗称:硫磺
(2)硫的物理性质:
(3)硫的化学性质:
S + O2 = SO2
0
+4
硫作为还原剂,具有还原性。
现象:有刺激性气味的气体生成。硫在空气中安静地燃烧,发出淡蓝色的火焰; 硫在纯氧中发出蓝紫色的火焰
点燃
S+Fe FeS
△
△
S + 2Cu Cu2S
3S + 6NaOH = Na2SO3+ 2Na2S + 3H2O
硫作为氧化剂,具有氧化性。
但氧化性较弱。
硫还能溶于强碱溶液:即做氧化剂,又做还原剂。
乐山大佛开凿于唐玄宗开元初年(公元713年),为世界第一大石刻弥勒佛,“佛是一座山,山是一尊佛”是其真实写照,请同学们仔细观察,历经千年时间的流逝,是什么物质使大佛鼻翼发黑,佛容暗淡呢?
2、二氧化硫(SO2)
无色有刺激性气味的气体
密度比空气大
二氧化硫是污染大气的主要有害物质之一
易溶于水(常温常压下 1 : 40 )
有毒 (发生呼吸道疾病、浓度高时会令人死亡)
易液化(-10 ℃ )
(1)、二氧化硫(SO2)的物理性质:
(2)、二氧化硫(SO2)的化学性质:
1)、二氧化硫跟水反应:
实验4-7 书P90
实验步骤:见书
实验现象:
①试管中的水面上升,溶液几乎充满整个试管
②pH试纸变红
③加入品红溶液,品红溶液褪色
④加热后,溶液又变成红色,同时有刺激性气味的气体生成。
实验结论:
①SO2易溶于水,且与水反应
② SO2的漂白作用;但漂白后的新物质不稳定,易恢复原来的颜色
(检验SO2的存在)
SO2 + H2O
H2SO3
(1)、二氧化硫跟水反应:
可逆反应:在同一条件下, 既能向正反应方向进行,
又能向逆反应方向进行。
特点
正反应和逆反应同时发生,均不彻底,
反应物和生成物共存。
SO2漂白原理:由于它能与某些有色物质生成
不稳定的无色物质。无色物质容易分解而使有色物质恢复原来的颜色。
(中强酸)
SO2 + H2O
H2SO3
几种具有漂白性物质的性质比较:
物质 氯水(过氧化钠 双氧水) SO2 活性炭
原理
实质
效果
范围
氯水中的次氯酸将有色物质氧化成无色物质
氧化还原反应
(化学变化)
永久性
可漂白大多数有色物质,能使紫色石蕊试液褪色
二氧化硫溶于水产生的亚硫酸与有色物质直接结合生成不稳定的无色物质
非氧化还原反应(化学变化)
暂时性
可漂白某些有色物质,不能使石蕊试液褪色
将有色物质的分子吸附在其表面
物理吸附
(物理变化)
暂时性
可吸附某些有色物质的分子
实验室制取SO2,可选择碱液吸收尾气,防止空气污染。
SO2+Ca(OH)2 CaSO3 +H2O
(2)二氧化硫具有酸性氧化物的通性
SO2+CaO CaSO3
石灰法脱硫
SO2+ CaSO3 + H2O = Ca(HSO3)2
(3)氧化性:
2H2S+SO2 3S+2H2O
SO2 + I2 + 2H2O = H2SO4 + 2HI
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
(4) 、二氧化硫的还原性:
(工业制硫酸的第二步)
3、三氧化硫(酸性氧化物)
SO3 + Ca(OH)2 = CaSO4 + H2O
SO3 + CaO = CaSO4
SO3 + H2O=H2SO4
(工业制硫酸的第三步)
5SO2 + 2KMnO4+ 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
2SO2 + O2 2SO3
一、 SO2物理性质
无色、有刺激性气味、有毒、易溶于水
二、 SO2化学性质
1、与水反应生成酸
SO2 + H2O H2SO3 2、与碱反应生成盐和水 SO2 + 2NaOH Na2SO3 + H2O
3、既有氧化性,又有还原性 2SO2 + O2 2SO3 4、漂白性:
品红溶液 褪色
催化剂
课堂小结
三、SO3的性质
1.下列可以用来鉴别SO2和CO2的方法是( )
A、通入紫色石蕊试液 B、闻气味 C、通入澄清石灰水 D、通入品红溶液中
B D
课堂练习:
2.在BaCl2的水溶液中通入SO2未见沉淀,把其分成两份,向其中一份中A通入NH3,另一份B通入Cl2则( )
A、只有A中产生沉淀BaSO4
B、只有B中产生沉淀
C、都不产生沉淀
D、都产生沉淀
D
3.下列能说明SO2具有漂白作用的是( )
A.SO2能使酸性高锰酸钾褪色
B.SO2能使品红溶液褪色
C.SO2能溴水褪色
D.SO2难使品红试液变红
B
4.潮湿的氯气和二氧化硫都具有漂白性,将氯气和SO2在相同状况下等体积混合后,其漂白性变化为 ,其原因是 .写出有关反应的化学方程式 .
漂白性消失 ,Cl2和SO2作用生成了无漂白作用的HCl和H2SO4
2H2O +Cl2+SO2 H2SO4+2HCl
二、二氧化氮和一氧化氮
1、氮气(N2)
无色无味无毒气体
比空气稍轻
1)、氮气的物理性质:
不溶于水
收集氮气时用排水法不用排空法
N2 + O2 ===== 2NO
放电或高温
2)、氮气的化学性质:
3)、氮气的用途:
保护气:填充灯泡,焊接金属等
N2 + 3H2 2NH3
N2 + 3Mg Mg3N2
2、一氧化氮(NO):
1)、NO的物理性质:
无色、不溶于水、有毒气体
是大气的污染物
2)、NO的化学性质:
2NO + O2 = 2NO2 (红棕色)
(工业制硝酸的第二步)
3、二氧化氮(NO2):
1)、NO2的物理性质:
红棕色、有刺激性气味的有毒气体
密度比空气大
易液化(20℃)易溶于水并与水反应
是污染大气的有害物质之一
2)、NO2的化学性质:
3NO2 + H2O = 2HNO3 + NO
(工业制硝酸的第三步)
+4
+5
二氧化氮是硝酸的酸酐吗?为什么?
硝酸的酸酐是N2O5
+5
哪种氧化物是亚硝酸(HNO2)的酸酐?
N2O3
[科学探究] 书P92 NO2溶于水实验
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
液体充满整个试管
向试管中慢慢通入氧气
3
2KClO3=2KCl+3O2
2H2O2 = 2H2O+O2↑
制取氧气
2
红棕色气体变为无色,液面上升到2/3
将一支充满NO2的试管倒扣在水槽中
1
解释
现象
实验步骤
3NO2+H2O =2HNO3+NO
NO2为红棕色气体,NO为无色气体难溶于水。
△
NO2 和 O2 混和气体溶于水的反应
3NO2 + H2O = 2HNO3 + NO ①
2NO + O2 = 2NO2 ②
① ×2 + ②
总反应:4NO2 + O2 + 2H2O = 4HNO3
NO 和 O2 混和气体溶于水的反应
2NO + O2 = 2NO2 ①
3NO2 + H2O = 2HNO3 + NO ②
① ×3 + ②×2
4NO + 3O2 + 2H2O = 4HNO3
三、SO2、NO2对大气的污染:
1、SO2、NO2污染物的形成: 书P93
①、煤、石油、金属矿物质的燃烧和冶炼产生SO2
②、汽车尾气、硝酸工业产生的NO2
③、酸雨的形成
饮用酸化的地下水危害人类
腐蚀建筑物和工业设备
破坏土壤成分使农作物减产甚至死亡
损坏植物叶面导致森林死亡
破坏露天文物古迹
使湖泊中鱼虾死亡
酸雨的危害:
NO2、SO2与水反应造成的
硝酸酸雨:
酸雨:指pH小于5.6的降水。
3NO2 + H2O = 2HNO3 + NO
硫酸酸雨:
SO3 + H2O=H2SO4
2H2SO3 + O2 = 2H2SO4
催化剂
2SO2 + O2 2SO3
或:SO2 + H2O
H2SO3
2、大气污染的危害:
①、危害人体健康
②、酸雨破坏农作物、森林,土壤酸化,腐蚀建筑等
3、保护环境,整治污染
防治酸雨的措施 书P94
①、调整、发展、优化、提高,
减少污染物
②、严格控制污染物的排放量
③、研究开发新技术
