第一节 化学实验基本方法
图片预览









文档简介
(共50张PPT)
一、化学实验安全
1、遵守实验室规则
2、了解安全措施
3、掌握正确的操作方法
4、重视并逐步熟悉污染物和废弃物的处理方法。
二、混合物的分离和提纯
1、 过滤和蒸发
2、蒸馏和萃取
粗盐的提纯
离子的检验
(一)遵守实验室规则
1.进实验室前,应先预习实验,明确实验目的、
原理和方法,严禁不预习进入实验室。
2.进实验室后,应先检查实验用品是否齐全。
3.实验过程中,应严格遵守各项实验操作规程,
严禁随便地进行无关的实验,不得大声喧哗。
4.实验完毕后,应将仪器洗净,整理清洁实验台。
5.有意外事故,应及时向老师报告。
(二)了解安全措施
1、事故预防
*防爆炸:
*防暴沸:
*防失火:
*防中毒:
*防倒吸:
点燃可燃性气体或用可燃性气体进行加热反应前,要检验气体的纯度。
实验室中的可燃物质要远离火源,检查灭火设备是否齐全
制取有毒气体(Cl2、CO、SO2、H2S、NO等)时,要在通
风橱内进行,并采取相应的措施处理(灼烧、吸收、收集等)。
用加热法制取气体并用排水法收集时,注意熄灯顺序;吸
收溶解度较大的气体(HCl、NH3)时,加装安全瓶或漏斗。
配制硫酸的水溶液时,要将密度大的浓硫酸倒入水中;
加热液体混合物时要加沸石或碎瓷片。
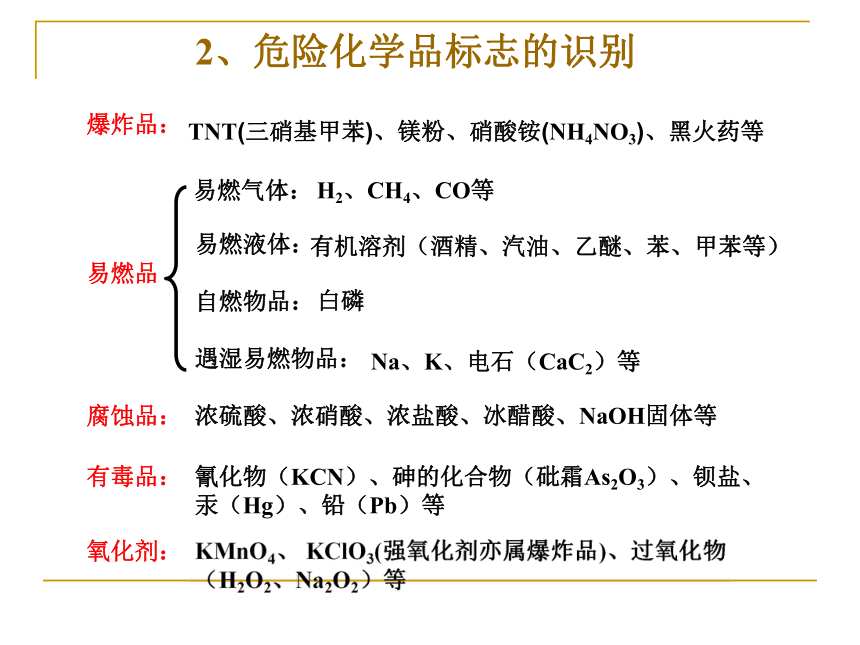
2、危险化学品标志的识别
易燃气体:
易燃液体:
自燃物品:
遇湿易燃物品:
H2、CH4、CO等
有机溶剂(酒精、汽油、乙醚、苯、甲苯等)
白磷
Na、K、电石(CaC2)等
浓硫酸、浓硝酸、浓盐酸、冰醋酸、NaOH固体等
氰化物(KCN)、砷的化合物(砒霜As2O3)、钡盐、
汞(Hg)、铅(Pb)等
爆炸品:
易燃品
腐蚀品:
有毒品:
氧化剂:
KMnO4、 KClO3(强氧化剂亦属爆炸品)、过氧化物(H2O2、Na2O2)等
TNT(三硝基甲苯)、镁粉、硝酸铵(NH4NO3)、黑火药等
3、意外事故的处理
创伤处理:
烫伤、烧伤处理:
酸碱腐蚀处理:
其他化学灼伤处理:
先除去伤口的玻璃,用双氧水擦洗消毒或涂碘酒,而后敷药包扎。
用70%-75%的酒精轻涂伤处,再涂烫伤药膏;严重
者立即就医。
浓酸撒在实验台上:
浓酸沾在皮肤上:
浓碱沾在皮肤上:
酸、碱溅入眼中:
先用NaCO3中和,再用水擦洗
直接用大量清水冲洗,而后用3%-5%的NaHCO3中和
抹布拭去,用水冲洗,涂上硼酸溶液中和
用大量清水冲洗,边洗边眨眼睛,然
后用硼酸溶液或NaHCO3溶液淋洗
汞洒落,立即撒上硫粉,并打开排气扇;
磷灼伤,用CuSO4溶液涂抹伤处
4、火灾处理方法:
防止火势扩展:移走可燃物,切断电源,停止通风。
扑灭火源:酒精等有机溶剂泼洒在桌面上着火燃烧,用湿布、石棉或沙子盖灭,火势大可以用灭火器扑灭。小范围的有机物、钾、钠、白磷等化学物质着火可用沙子盖灭。
类 型 药液成分 适用灭火对象
酸碱式 H2SO4和NaHCO3 非油类、电器
泡沫式 Al2(SO4)3和NaHCO3 油类
CO2灭火器 液态CO2 电器、小范围油类、忌水的化学品
四氯化碳(CCl4) 液态四氯化碳 电器、汽油、丙酮
不能用于钾、钠、电石、CS2等
干粉灭火器 NaHCO3等,适量润滑剂、防潮剂 油类、可燃气体、精密仪器、图书文件等
灭火器的种类
回顾:氧气的制备方法
①哪些仪器可以用来直接加热
哪些需要垫石棉网 哪些不能用来加热
加热固体KClO3或KMnO4制备氧气
②药品的取用原则:节约药品;剩余药品 不能放回原处,也不能随意丢弃,应放入指定容器。
③加热操作:容器外壁不能有水(易破裂)
给液体加热——管口向上倾斜约45°;试管内液体体积不超过试管容积的1/3;加热时,管口不能对着自己或他人。
(三)掌握正确的操作方法!
给固体加热——管口略向下倾斜,以防形
成的水滴倒流至管底引起试管破裂;先均
匀受热,再集中加热。
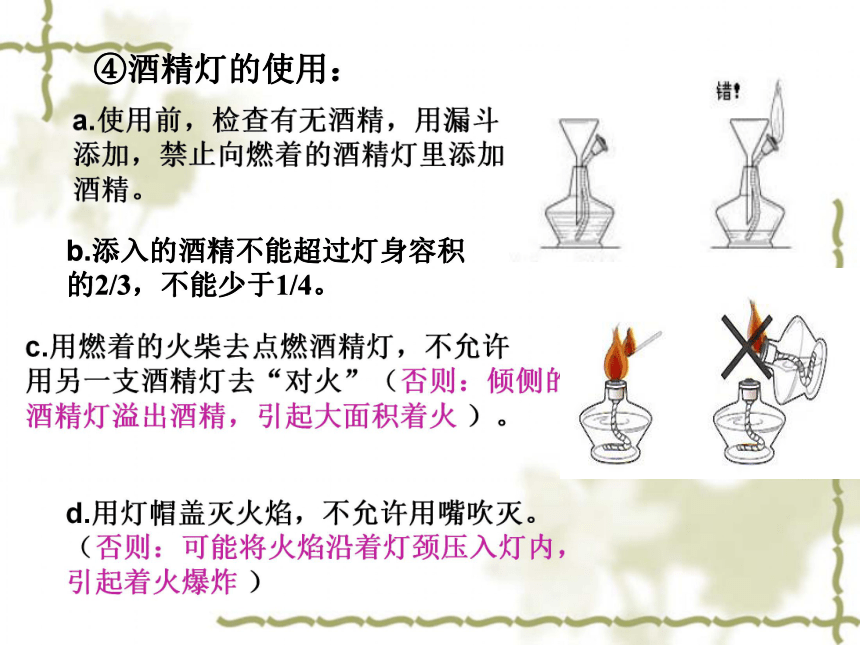
④酒精灯的使用:
a.使用前,检查有无酒精,用漏斗添加,禁止向燃着的酒精灯里添加酒精。
b.添入的酒精不能超过灯身容积的2/3,不能少于1/4。
c.用燃着的火柴去点燃酒精灯,不允许
用另一支酒精灯去“对火”(否则:倾侧的
酒精灯溢出酒精,引起大面积着火 )。
d.用灯帽盖灭火焰,不允许用嘴吹灭。
(否则:可能将火焰沿着灯颈压入灯内,
引起着火爆炸 )
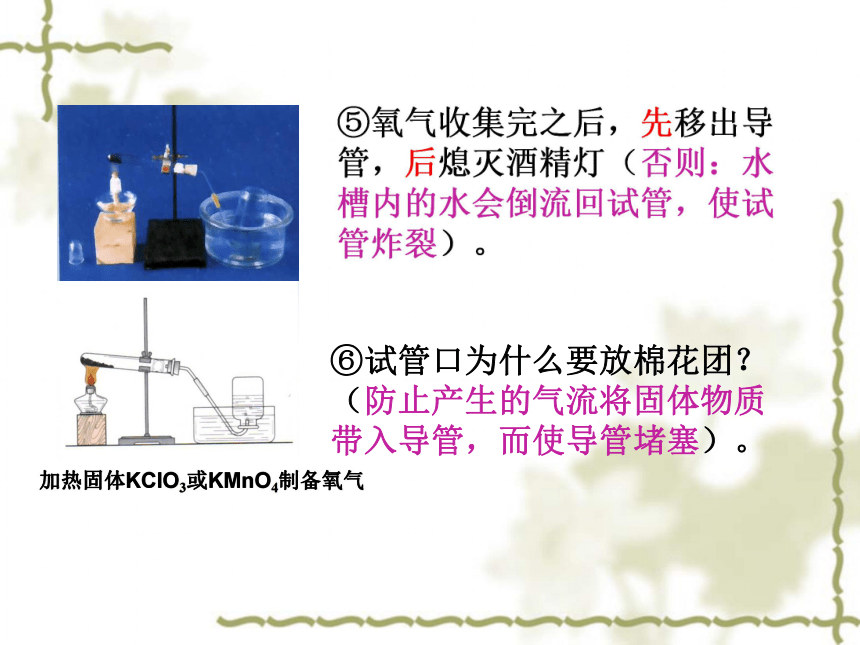
加热固体KClO3或KMnO4制备氧气
⑤氧气收集完之后,先移出导管,后熄灭酒精灯(否则:水槽内的水会倒流回试管,使试管炸裂)。
⑥试管口为什么要放棉花团?(防止产生的气流将固体物质带入导管,而使导管堵塞)。
仪器的使用——托盘天平
(1)调零防腐
先调节天平至零点,潮湿或有腐蚀性的药品必须放在玻璃器皿中称量,其他药品可用大小一样质地相同的纸
(2)左物右码
左盘放称量物,右盘放砝码
(3)先大后小
取用砝码先取质量大的,再取小的
(4)归零放盒
称量完毕,应把游码移回零处,砝码放回砝码盒
药品的取用
药品的取用 使用仪器
固体药品 粉末 药匙(或纸槽)
块状固体 镊子
一定量 托盘天平
液体药品 少量 胶头滴管
多量 用试剂瓶倾倒
一定量 量筒、滴定管等
气体的收集
排气法
收集 向下排气法 密度小于
空气
向上排气法 密度大于
空气
排水法收集 难溶于水的气体
(四)重视并逐步熟悉污染物和废弃物的
处理方法
废水
废气
废渣
其他(如破损玻璃、
反应后剩余的金属等)
二、混合物的分离和提纯
回顾:1、过滤与蒸发操作
过滤操作
①过滤的目的(适用范围)是什么?
②过滤操作需要哪些仪器?
③进行过滤操作时要注意哪些问题?
(一贴、二低、三靠)
(1)过滤
蒸发操作
①蒸发的目的是什么?
②蒸发操作需要哪些仪器?
③蒸发操作时的注意事项?
*加入的液体不超过蒸发皿容积的2/3。
*蒸发过程中要用玻棒不断搅拌(以防溶液 因局部过热而造成液滴飞溅)。
*加热至剩余少量液体时,应停止加热,利用余温使滤液蒸干。
*热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
(2)蒸发
1.通过溶解、过滤、蒸发操作之后,得到的固体就是纯净的食盐吗?
粗盐
溶解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
过滤
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
2.如何检验Cl-的存在
粗盐的提纯
离子的检验:
1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等特殊现象)进行离子鉴定的过程。
2、步骤:
(1)先对试样的外观进行观察(颜色、状态等);
(2)将试样(固体)配成溶液,取出少许进行检验;
(3 )选择合理的试剂(要求反应灵敏、现象明显);
(4)注意排除某些共有现象的干扰。
Cl-的检验方法:
操作:先加入稀HNO3酸化,再加入几滴AgNO3溶液。
现象:出现不溶于稀硝酸的白色沉淀
(AgCl)。
结论:存在Cl- 。
注意排除CO32-离子的干扰!
SO42-的检验方法:
操作:先加入稀盐酸酸化,再加入可溶性
钡盐(BaCl2)溶液。
现象:出现不溶于稀酸的白色沉淀
(BaSO4)。
结论:存在SO42- 。
注意排除CO32-等离子的干扰!
化学除杂
除杂原则:
*不增(尽量不引入新杂质)
*不减(尽量不损耗样品)
*易分(容易分离——生成完全不溶物或气体)
*复原(除去各种杂质,还原到目标产物)
注意:除杂试剂要适当过量;设计所加试剂的先后顺序!
对于粗盐水(NaCl)
要除去可溶杂质离子是:
Ca2+
Mg2+
SO42-
选择要加入的除杂试剂:
Na2CO3
NaOH
BaCl2
引入了新的离子:
CO32-
OH-
Ba2+
BaCO3↓
HCl
1.BaCl2→NaOH →Na2CO3 → HCl
2. BaCl2→ Na2CO3 → NaOH → HCl
3. NaOH →BaCl2→ Na2CO3 → HCl
加入除杂试剂的顺序可以是:
1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸必须适量
过滤
过滤
过滤
例题:某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.Ba(NO3)2、K2CO3、AgNO3、HNO3
B.K2CO3、Ba(NO3)2、AgNO3、HNO3
C.Ba(NO3)2、AgNO3、K2CO3、HNO3
D.AgNO3、Ba(NO3)2、K2CO3、HNO3
CD
2、蒸馏和萃取
饮用水处理
制取蒸馏水
1.原理——利用液态混合物(互溶)中各组分沸点的不同,加热使其某一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开,目的是将难挥发或不挥发的杂质除去。
2.装置
冷凝管
圆底烧瓶
牛角管
锥形瓶
温度计
进水口
出水口
3.注意事项:
4.烧瓶底加垫石棉网
1.温度计水银球处于蒸馏烧瓶支管口处
2.冷凝水,下口进,上口出
3.投放沸石或瓷片防暴沸
酒精和水的混合物能否用蒸馏法分离?
符合蒸馏的条件:
液体混合物——酒精与水以任意比互溶
各组分沸点不同——酒精78 ℃,水100 ℃
油和水可以用蒸馏法分离吗?
沸点( )的组分先蒸出,加热温度不能
超过混合物中沸点( )的物质的沸点!
低
高
4.蒸馏法的应用
蒸馏法
除此之外,还有反渗透法、电渗析法、离子交换法、冰冻法等。
反渗透法
电渗析法
西红柿汤
西红柿加食用油翻炒,然后加水煮沸,再加盐。
讨 论
油层更红
液体分层且
油层在上方
色素在水中的溶解度明显小于在油中的溶解度
食用油将番茄中的番茄红素富集,使油层的色泽更红。
原理:
油、水互不相溶且
ρ油<ρ水
油层色素浓度更大
若番茄红素在油中的溶解度比在水中大许多,则少量油中溶解的“精华”将比大量水中溶解的还要多。
萃取
可用于化学上的分离操作
分 析
欲获取上层的红油,可如何操作?
舀出
小心倾倒
滴管吸出
……
分液
问 题
仪器介绍
分液漏斗
分液漏斗——用于分离互不相溶的液体。
普通漏斗
长颈漏斗
分离“水和柴油”
1.分液漏斗使用之前要检验是否漏水,如何检验?
2.为何要振荡?振荡过程中还要注意何种操作?
3.静置分层之后,为什么要打开上口的玻璃塞?液体分别是如何倒出的?
1.
2.使液体充分混合;打开活塞,放出产生的气体。
3.使漏斗内外压强相等,便于液体流出。
下层液体从下端放出,上层液体从上口倒出。
实 验1-4:如何从碘水中提取碘?
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 棕黄→褐色
紫红色 紫红色
表一:碘溶解于不同溶剂中的颜色
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 0.029 g
14.1 g 2.9 g
表二:碘在不同溶剂中的溶解度(25℃)
密度:水1.0 g/ml;苯0.88 g/m;四氯化碳1.59 g/ml
碘水与CCl4刚刚混合
静置以后
用力振荡
为什么会出现颜色的转变?
I2从原来的水层中转移到了CCl4中。
注意事项
利用某种物质(溶质)在①互不相溶的溶剂里②溶解度的不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中的方法。
碘(I2)
水和四氯化碳
水
四氯化碳
萃取剂的选择条件:
1.萃取剂与原溶剂互不相溶、不发生化学反应;
2.溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大);
3.溶质不与萃取剂发生任何反应;
2.分液漏斗中盛有已分层的有机溶剂和水的混合液,但不知道哪一层液体是水层。试设计一种简便的判断方法。
思考
1.碘易溶于酒精,能否用酒精将碘水中的碘萃取出来?
一、化学实验安全
1、遵守实验室规则
2、了解安全措施
3、掌握正确的操作方法
4、重视并逐步熟悉污染物和废弃物的处理方法。
二、混合物的分离和提纯
1、 过滤和蒸发
2、蒸馏和萃取
粗盐的提纯
离子的检验
(一)遵守实验室规则
1.进实验室前,应先预习实验,明确实验目的、
原理和方法,严禁不预习进入实验室。
2.进实验室后,应先检查实验用品是否齐全。
3.实验过程中,应严格遵守各项实验操作规程,
严禁随便地进行无关的实验,不得大声喧哗。
4.实验完毕后,应将仪器洗净,整理清洁实验台。
5.有意外事故,应及时向老师报告。
(二)了解安全措施
1、事故预防
*防爆炸:
*防暴沸:
*防失火:
*防中毒:
*防倒吸:
点燃可燃性气体或用可燃性气体进行加热反应前,要检验气体的纯度。
实验室中的可燃物质要远离火源,检查灭火设备是否齐全
制取有毒气体(Cl2、CO、SO2、H2S、NO等)时,要在通
风橱内进行,并采取相应的措施处理(灼烧、吸收、收集等)。
用加热法制取气体并用排水法收集时,注意熄灯顺序;吸
收溶解度较大的气体(HCl、NH3)时,加装安全瓶或漏斗。
配制硫酸的水溶液时,要将密度大的浓硫酸倒入水中;
加热液体混合物时要加沸石或碎瓷片。
2、危险化学品标志的识别
易燃气体:
易燃液体:
自燃物品:
遇湿易燃物品:
H2、CH4、CO等
有机溶剂(酒精、汽油、乙醚、苯、甲苯等)
白磷
Na、K、电石(CaC2)等
浓硫酸、浓硝酸、浓盐酸、冰醋酸、NaOH固体等
氰化物(KCN)、砷的化合物(砒霜As2O3)、钡盐、
汞(Hg)、铅(Pb)等
爆炸品:
易燃品
腐蚀品:
有毒品:
氧化剂:
KMnO4、 KClO3(强氧化剂亦属爆炸品)、过氧化物(H2O2、Na2O2)等
TNT(三硝基甲苯)、镁粉、硝酸铵(NH4NO3)、黑火药等
3、意外事故的处理
创伤处理:
烫伤、烧伤处理:
酸碱腐蚀处理:
其他化学灼伤处理:
先除去伤口的玻璃,用双氧水擦洗消毒或涂碘酒,而后敷药包扎。
用70%-75%的酒精轻涂伤处,再涂烫伤药膏;严重
者立即就医。
浓酸撒在实验台上:
浓酸沾在皮肤上:
浓碱沾在皮肤上:
酸、碱溅入眼中:
先用NaCO3中和,再用水擦洗
直接用大量清水冲洗,而后用3%-5%的NaHCO3中和
抹布拭去,用水冲洗,涂上硼酸溶液中和
用大量清水冲洗,边洗边眨眼睛,然
后用硼酸溶液或NaHCO3溶液淋洗
汞洒落,立即撒上硫粉,并打开排气扇;
磷灼伤,用CuSO4溶液涂抹伤处
4、火灾处理方法:
防止火势扩展:移走可燃物,切断电源,停止通风。
扑灭火源:酒精等有机溶剂泼洒在桌面上着火燃烧,用湿布、石棉或沙子盖灭,火势大可以用灭火器扑灭。小范围的有机物、钾、钠、白磷等化学物质着火可用沙子盖灭。
类 型 药液成分 适用灭火对象
酸碱式 H2SO4和NaHCO3 非油类、电器
泡沫式 Al2(SO4)3和NaHCO3 油类
CO2灭火器 液态CO2 电器、小范围油类、忌水的化学品
四氯化碳(CCl4) 液态四氯化碳 电器、汽油、丙酮
不能用于钾、钠、电石、CS2等
干粉灭火器 NaHCO3等,适量润滑剂、防潮剂 油类、可燃气体、精密仪器、图书文件等
灭火器的种类
回顾:氧气的制备方法
①哪些仪器可以用来直接加热
哪些需要垫石棉网 哪些不能用来加热
加热固体KClO3或KMnO4制备氧气
②药品的取用原则:节约药品;剩余药品 不能放回原处,也不能随意丢弃,应放入指定容器。
③加热操作:容器外壁不能有水(易破裂)
给液体加热——管口向上倾斜约45°;试管内液体体积不超过试管容积的1/3;加热时,管口不能对着自己或他人。
(三)掌握正确的操作方法!
给固体加热——管口略向下倾斜,以防形
成的水滴倒流至管底引起试管破裂;先均
匀受热,再集中加热。
④酒精灯的使用:
a.使用前,检查有无酒精,用漏斗添加,禁止向燃着的酒精灯里添加酒精。
b.添入的酒精不能超过灯身容积的2/3,不能少于1/4。
c.用燃着的火柴去点燃酒精灯,不允许
用另一支酒精灯去“对火”(否则:倾侧的
酒精灯溢出酒精,引起大面积着火 )。
d.用灯帽盖灭火焰,不允许用嘴吹灭。
(否则:可能将火焰沿着灯颈压入灯内,
引起着火爆炸 )
加热固体KClO3或KMnO4制备氧气
⑤氧气收集完之后,先移出导管,后熄灭酒精灯(否则:水槽内的水会倒流回试管,使试管炸裂)。
⑥试管口为什么要放棉花团?(防止产生的气流将固体物质带入导管,而使导管堵塞)。
仪器的使用——托盘天平
(1)调零防腐
先调节天平至零点,潮湿或有腐蚀性的药品必须放在玻璃器皿中称量,其他药品可用大小一样质地相同的纸
(2)左物右码
左盘放称量物,右盘放砝码
(3)先大后小
取用砝码先取质量大的,再取小的
(4)归零放盒
称量完毕,应把游码移回零处,砝码放回砝码盒
药品的取用
药品的取用 使用仪器
固体药品 粉末 药匙(或纸槽)
块状固体 镊子
一定量 托盘天平
液体药品 少量 胶头滴管
多量 用试剂瓶倾倒
一定量 量筒、滴定管等
气体的收集
排气法
收集 向下排气法 密度小于
空气
向上排气法 密度大于
空气
排水法收集 难溶于水的气体
(四)重视并逐步熟悉污染物和废弃物的
处理方法
废水
废气
废渣
其他(如破损玻璃、
反应后剩余的金属等)
二、混合物的分离和提纯
回顾:1、过滤与蒸发操作
过滤操作
①过滤的目的(适用范围)是什么?
②过滤操作需要哪些仪器?
③进行过滤操作时要注意哪些问题?
(一贴、二低、三靠)
(1)过滤
蒸发操作
①蒸发的目的是什么?
②蒸发操作需要哪些仪器?
③蒸发操作时的注意事项?
*加入的液体不超过蒸发皿容积的2/3。
*蒸发过程中要用玻棒不断搅拌(以防溶液 因局部过热而造成液滴飞溅)。
*加热至剩余少量液体时,应停止加热,利用余温使滤液蒸干。
*热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
(2)蒸发
1.通过溶解、过滤、蒸发操作之后,得到的固体就是纯净的食盐吗?
粗盐
溶解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
过滤
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
2.如何检验Cl-的存在
粗盐的提纯
离子的检验:
1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等特殊现象)进行离子鉴定的过程。
2、步骤:
(1)先对试样的外观进行观察(颜色、状态等);
(2)将试样(固体)配成溶液,取出少许进行检验;
(3 )选择合理的试剂(要求反应灵敏、现象明显);
(4)注意排除某些共有现象的干扰。
Cl-的检验方法:
操作:先加入稀HNO3酸化,再加入几滴AgNO3溶液。
现象:出现不溶于稀硝酸的白色沉淀
(AgCl)。
结论:存在Cl- 。
注意排除CO32-离子的干扰!
SO42-的检验方法:
操作:先加入稀盐酸酸化,再加入可溶性
钡盐(BaCl2)溶液。
现象:出现不溶于稀酸的白色沉淀
(BaSO4)。
结论:存在SO42- 。
注意排除CO32-等离子的干扰!
化学除杂
除杂原则:
*不增(尽量不引入新杂质)
*不减(尽量不损耗样品)
*易分(容易分离——生成完全不溶物或气体)
*复原(除去各种杂质,还原到目标产物)
注意:除杂试剂要适当过量;设计所加试剂的先后顺序!
对于粗盐水(NaCl)
要除去可溶杂质离子是:
Ca2+
Mg2+
SO42-
选择要加入的除杂试剂:
Na2CO3
NaOH
BaCl2
引入了新的离子:
CO32-
OH-
Ba2+
BaCO3↓
HCl
1.BaCl2→NaOH →Na2CO3 → HCl
2. BaCl2→ Na2CO3 → NaOH → HCl
3. NaOH →BaCl2→ Na2CO3 → HCl
加入除杂试剂的顺序可以是:
1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸必须适量
过滤
过滤
过滤
例题:某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.Ba(NO3)2、K2CO3、AgNO3、HNO3
B.K2CO3、Ba(NO3)2、AgNO3、HNO3
C.Ba(NO3)2、AgNO3、K2CO3、HNO3
D.AgNO3、Ba(NO3)2、K2CO3、HNO3
CD
2、蒸馏和萃取
饮用水处理
制取蒸馏水
1.原理——利用液态混合物(互溶)中各组分沸点的不同,加热使其某一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开,目的是将难挥发或不挥发的杂质除去。
2.装置
冷凝管
圆底烧瓶
牛角管
锥形瓶
温度计
进水口
出水口
3.注意事项:
4.烧瓶底加垫石棉网
1.温度计水银球处于蒸馏烧瓶支管口处
2.冷凝水,下口进,上口出
3.投放沸石或瓷片防暴沸
酒精和水的混合物能否用蒸馏法分离?
符合蒸馏的条件:
液体混合物——酒精与水以任意比互溶
各组分沸点不同——酒精78 ℃,水100 ℃
油和水可以用蒸馏法分离吗?
沸点( )的组分先蒸出,加热温度不能
超过混合物中沸点( )的物质的沸点!
低
高
4.蒸馏法的应用
蒸馏法
除此之外,还有反渗透法、电渗析法、离子交换法、冰冻法等。
反渗透法
电渗析法
西红柿汤
西红柿加食用油翻炒,然后加水煮沸,再加盐。
讨 论
油层更红
液体分层且
油层在上方
色素在水中的溶解度明显小于在油中的溶解度
食用油将番茄中的番茄红素富集,使油层的色泽更红。
原理:
油、水互不相溶且
ρ油<ρ水
油层色素浓度更大
若番茄红素在油中的溶解度比在水中大许多,则少量油中溶解的“精华”将比大量水中溶解的还要多。
萃取
可用于化学上的分离操作
分 析
欲获取上层的红油,可如何操作?
舀出
小心倾倒
滴管吸出
……
分液
问 题
仪器介绍
分液漏斗
分液漏斗——用于分离互不相溶的液体。
普通漏斗
长颈漏斗
分离“水和柴油”
1.分液漏斗使用之前要检验是否漏水,如何检验?
2.为何要振荡?振荡过程中还要注意何种操作?
3.静置分层之后,为什么要打开上口的玻璃塞?液体分别是如何倒出的?
1.
2.使液体充分混合;打开活塞,放出产生的气体。
3.使漏斗内外压强相等,便于液体流出。
下层液体从下端放出,上层液体从上口倒出。
实 验1-4:如何从碘水中提取碘?
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 棕黄→褐色
紫红色 紫红色
表一:碘溶解于不同溶剂中的颜色
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 0.029 g
14.1 g 2.9 g
表二:碘在不同溶剂中的溶解度(25℃)
密度:水1.0 g/ml;苯0.88 g/m;四氯化碳1.59 g/ml
碘水与CCl4刚刚混合
静置以后
用力振荡
为什么会出现颜色的转变?
I2从原来的水层中转移到了CCl4中。
注意事项
利用某种物质(溶质)在①互不相溶的溶剂里②溶解度的不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中的方法。
碘(I2)
水和四氯化碳
水
四氯化碳
萃取剂的选择条件:
1.萃取剂与原溶剂互不相溶、不发生化学反应;
2.溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大);
3.溶质不与萃取剂发生任何反应;
2.分液漏斗中盛有已分层的有机溶剂和水的混合液,但不知道哪一层液体是水层。试设计一种简便的判断方法。
思考
1.碘易溶于酒精,能否用酒精将碘水中的碘萃取出来?
