物质的量(第二课时 )
图片预览







文档简介
(共49张PPT)
专题一 第一单元
第二课时 物质的量
让我展开理想的翅膀
在知识的天空自由地飞翔…...
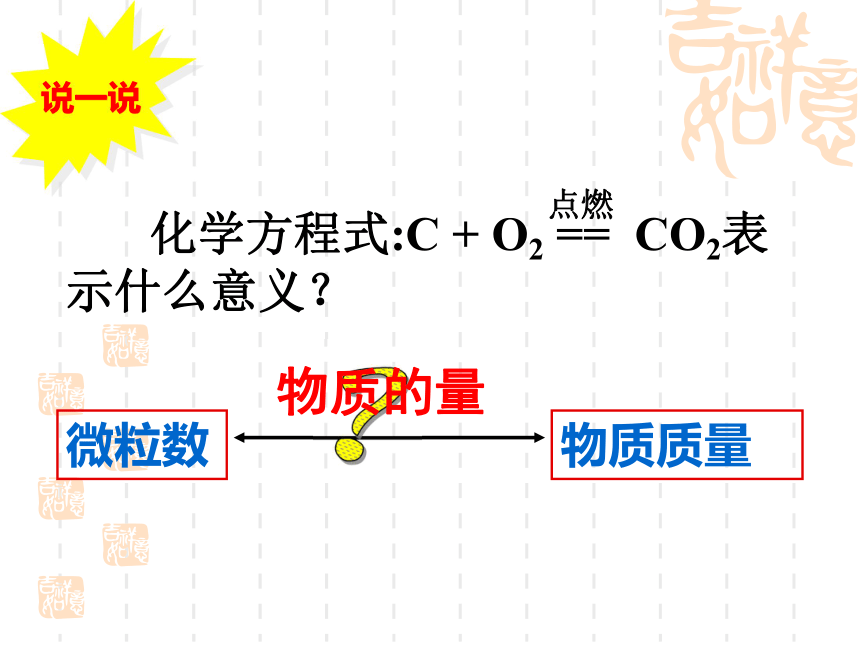
说一说
化学方程式:C + O2 == CO2表示什么意义?
微粒数
物质质量
物质的量
点燃
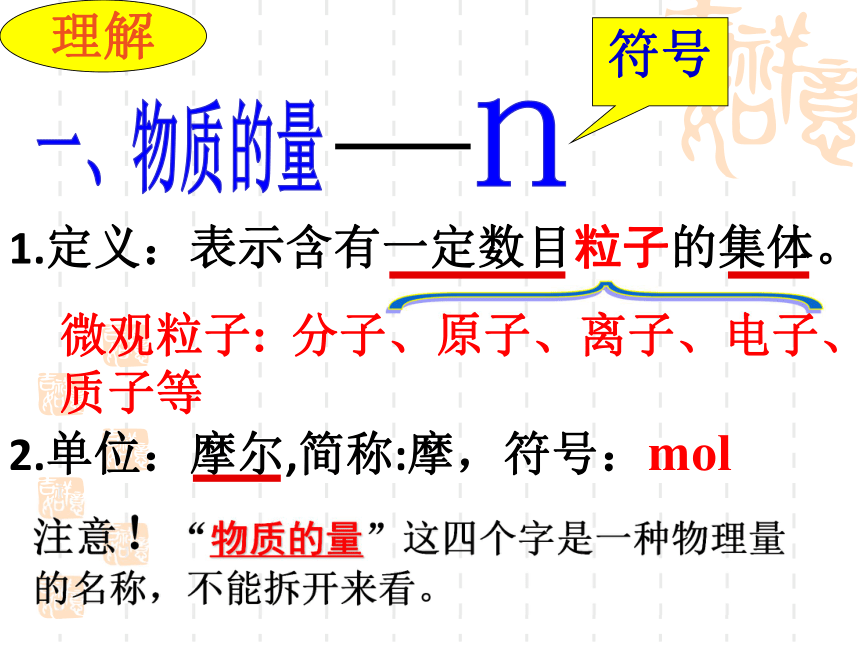
1.定义:表示含有一定数目粒子的集体。
2.单位:摩尔,简称:摩,符号:mol
理解
微观粒子: 分子、原子、离子、电子、质子等
符号
注意!“物质的量”这四个字是一种物理量的名称,不能拆开来看。
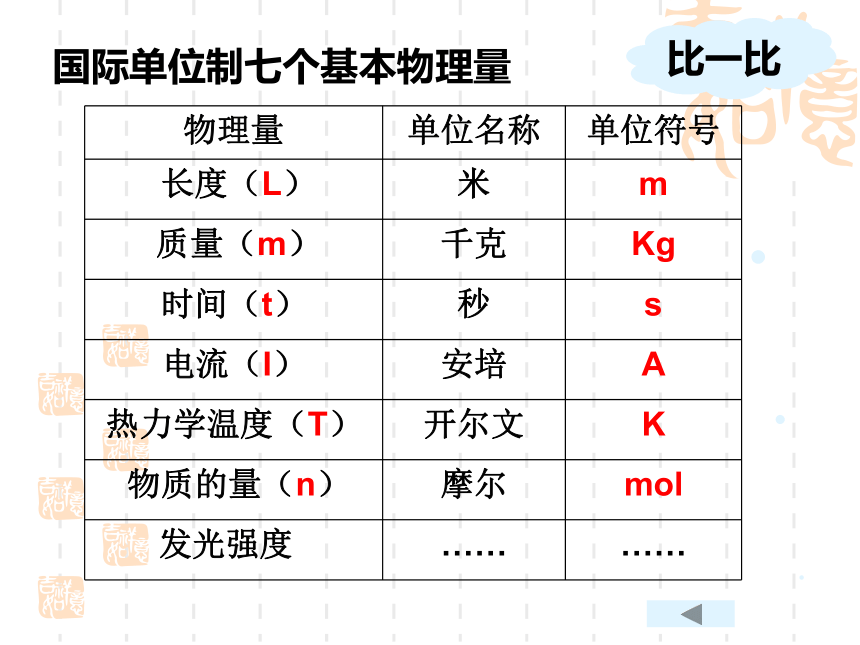
物理量 单位名称 单位符号
长度(L) 米 m
质量(m) 千克 Kg
时间(t) 秒 s
电流(I) 安培 A
热力学温度(T) 开尔文 K
物质的量(n) 摩尔 mol
发光强度 …… ……
国际单位制七个基本物理量
比一比
想一想
2、物质的量为1 mol某种微粒集合体中所含的微粒数目是多少呢
1、怎么理解“物质的量”与“一定数目微粒”之间的关系?
看一看
2、阿伏加德罗常数:0.012Kg12C中所含有的碳原子数,符号为NA ,单位mol.约为6.02×1023mol-1。
1、1 mol粒子的数目与0.012 kg 12C中所含的碳原子数目相同。
3、1 mol粒子的数目又叫阿伏加德罗常数,符号为NA,约为6.02×1023 个。
意大利化学家。他对6.02×1023这个数据的得出,有着很大的贡献,用其名字来表示该常数,以示纪念。他在化学上的重大贡献是建立分子学说。为了纪念阿伏加德罗的伟大功绩,将0.012kg12C中所含的C原子数目称为阿伏加德罗常数。它是自然科学中的基本常数之一。
阿伏加德罗
Avogadro
1776~1856
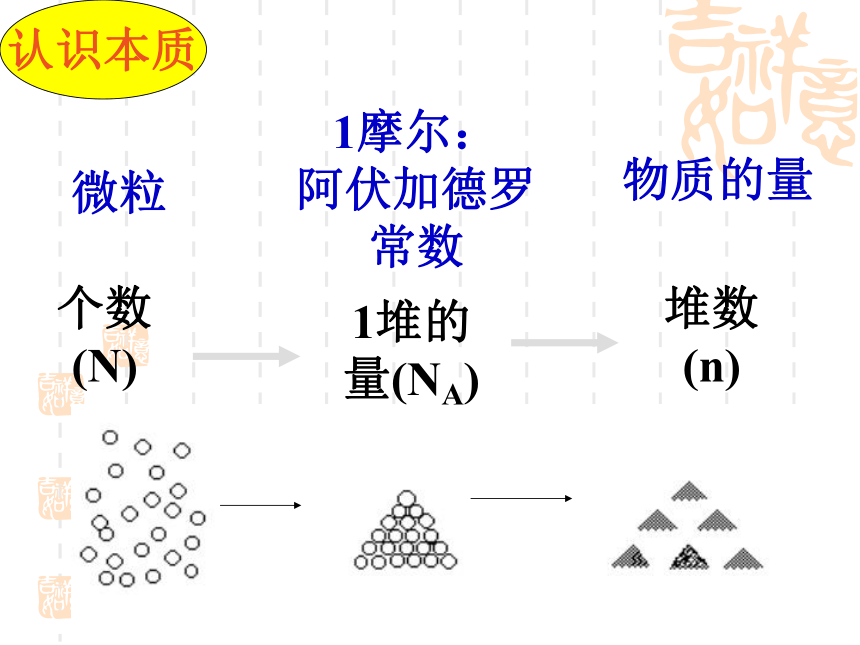
微粒
1摩尔: 阿伏加德罗常数
物质的量
个数(N)
1堆的量(NA)
堆数(n)
认识本质
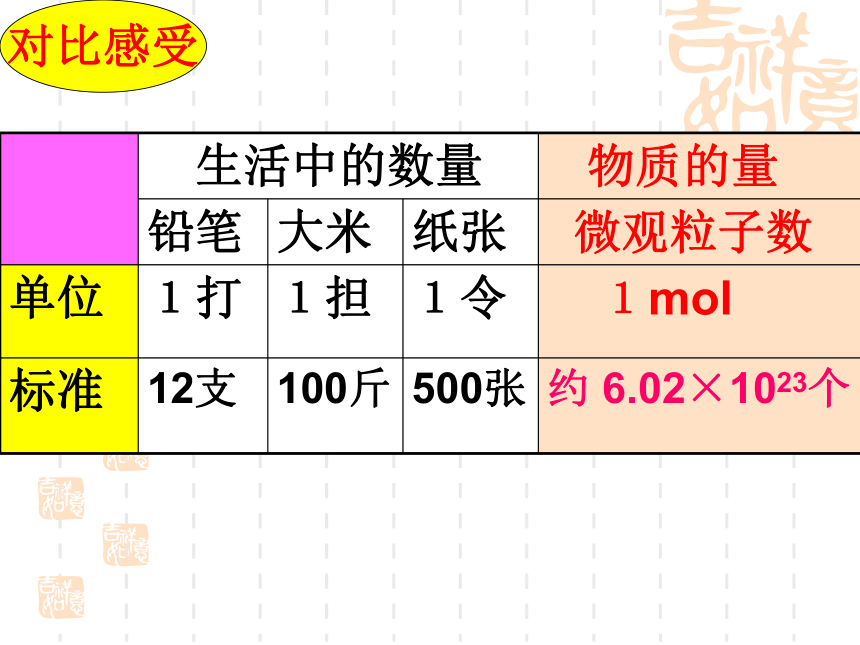
对比感受
生活中的数量 物质的量
铅笔 大米 纸张 微观粒子数
单位 1打 1担 1令 1mol
标准 12支 100斤 500张 约 6.02×1023个
因此我们可以这样说
1molC中约含有6.02×1023个碳原子
1molO2中约含有6.02×1023个氧分子
1molH2O中约含有6.02×1023个H2O
1molH+中约含有6.02×1023个H+
1mol任何粒子集体中约含有6.02×1023个粒子
nmol某种微粒集合体中所含的微粒数约为n×6.02×1023.
能不能这样说
1mol人中约含有6.02×1023个人
1mol氧中约含有6.02×1023个氧
1mol水中约含有6.02×1023个水
1mol电子中约含有6.02×1023个电子
1、物质的量表示的是微观粒子的集体,不表示宏观物质的数目
2、物质由不同的微粒构成,因此,我们在使用摩尔表示物质的量时,要用化学式指明粒子的种类
3、粒子的种类可以是分子、原子、离子;也可以是质子、中子、电子等
使用物质的量和摩尔时的注意事项
判断下列说法是否正确,并加以说明理由
1、1mol 苹果
不对,指代不明,可指氧原子也可指氧分子
对,特定组合
对,指氧原子
对
不对,不能指宏观物质
不对,元素是宏观概念,只能说种类
2、1mol O
3、1mol 氧
4、1mol H2O
8、1mol 钠元素
9、1mol NaCl
5、1mol e-
6、1mol 质子
7、1mol OH-
对
对
对
1.判断下列说法是否正确,并说明理由。
(1)1mol氧 (2)0.25molCO2。 (3)摩尔是7个基本物理量之一。 (4)1mol是6.02×1023个微粒的粒子集合体。 (5)0.5molH2含有3.01×1023个氢原子。 (6)3molNH3中含有3molN原子,9molH原子。
答案(1)错误。没有指明微粒的种类。改成1molO、 1molO2,都是正确的。因此使用摩尔作单位时,所指粒子必须十分明确,且粒子的种类用化学式表示。(2)正确。 (3)错误。物质的量是基本物理量之一。摩尔只是它的单位,不能把二者混为一谈。 (4)错误。6.02×1023是阿伏加德罗常数的近似值。二者不能简单等同。 (5)错误。0.5molH2含有0.5×2=1molH原子,6.02×1023×1=6.02×1023个。 (6)正确。3molNH3中含有3×1=3 mol N原子,3×3=9molH原子。
想一想
物质的量(n)、阿伏加德罗常数(NA)粒子数(N)之间有何关系?
阿伏加德罗常数
物质的量
微粒个数
(约6.02×1023)
N
=
NA
×
n
在0.5molO2中含有的O2的分子数目是多少?
解:O2的分子数为
N = n × NA
= 0.5 mol × 6.02 ×1023个/mol
= 3.01 × 1023个
答:O2的分子数为3.01 × 1023个
例题1
在0.5molO2中含有的O的原子数目是多少?
解:O2的O原子数为
N = n ×2 × NA
=0.5 mol×2× 6.02 ×1023个/mol
= 6.02 × 1023个
答:O2的O原子数为6.02 × 1023个
例题2
在0.5molO2中含有的电子数目是多少?
解:O2的电子数为
N = n ×16 × NA
=0.5 mol×16× 6.02 ×1023个/mol
= 4.816 × 1024个
答: 0.5molO2的电子数为4.816 × 1024个
例题3
例题4
1mol的Na2CO3中约含有___mol的Na+、___mol的CO32-离子,共含有离子的个数为______________个。
2
1
3× 6.02 ×1023
0.5molH2中的氢分子数____________
1molNaCl中的氯离子数____________
1molH2SO4中的氧原子数____________
1.204X1024个水分子的物质的量___________
9.03X1023个铁原子的物质的量____________
10molNaOH中约含有 _________个Na+
N个水分子的物质的量是 (已知阿伏加德罗常数为NA)
【问题解决】
物质的量(n)
知识小结:
基准:NA
1、表示含有一定数目粒子的集体
2、专有名词,不能随意拆开
3、对象为微观粒子及其特定组合
单位:摩尔(mol)
1、是基本物理量的单位
2、量度对象:具体微观粒子及其特定组合
3、使用时用化学式指明粒子的种类
1、准确值:12g12C所含原子数
近似值: 6.02 1023
n=
NA
N
2、
=
N2
N1
n2
n1
基本物理量
练习
1、关于摩尔的叙述中,正确的是( )
A. 摩尔是表示物质质量的单位
B. 摩尔是表示物质数量的单位
C. 摩尔既表示物质微粒数量,又表示物质质量双重意义的单位
D. 摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
D
2、下列叙述正确的是( )
A. 6.02×1023就是阿伏加德罗常数
B. 1molH2O含2mol氢元素和1mol氧元素
C. 1molCaCl2中含3mol离子
D. 每摩尔物质均含有6.02×1023个原子
C
3、3molH2O中含____mol氢原子,____mol氧原子;与_____molNH3中所含的氢原子数相同.
6
3
2
4、 如果ag某气体中含有的分子数为b,则cg该气体的物质的量是(NA表示阿伏加德罗常数)( )
mol
A.
C.
mol
B.
mol
D.
mol
A
物质的量
知识小结:
基准:NA
1、衡量物质所含微粒数多少
2、专有名词,不能随意拆开
3、对象为微观粒子及其特定组合
单位:摩尔
1、是基本物理量的单位
2、量度对象:具体微观粒子及其特定组合
3、使用时用化学式指明粒子的种类
1、准确值:12g12C所含原子数
近似值: 6.02 1023
n=
NA
N
2、
=
N2
N1
n2
n1
基本物理量
一、物 质 的 量
1、1mol H2O含有_______个分子,有________个氢原子,有________个O,含有________质子,_______个电子。
3、下列物质中含分子数目由大到小顺序为__________
A.0.5molO2 B. 6.02 1023个N2
C.6.02 1024个HCl
D.与0.12kg12C含相同原子数目的Cl2
4、0.1molH2O中与_____molCO2所含的氧原子数目相
同,与__________个CH4分子中所含的氢原子数相同。
深化应用:
6.02 1023
1.204 1024
6.02 1023
6.02 1024
6.02 1024
6.02 1022
6.02 1022
D>C>B>A
0.05
3.01 1022
2、0.1molNaOH能电离出 ______ 个Na+,______ 个OH-
一、物 质 的 量
物质的量将宏观可称量的物质的质量与微观粒子的数目联系起来。
质量
粒子数
物质的量
NA
微观粒子
宏观质量
一个C
原子
一个O
原子
一个Fe
原子
扩大6.02 ×1023
1molC
原子
1molO
原子
1molFe
原子
0.012kg
16g
56g
12g
相对原子
质量
16
56
12
规律一:1摩尔任何原子的质量如果以克为单位,在数值上等于
该原子的相对原子质量
1摩尔物质的质量
1)、1molNa的质量为 。
1molH的质量为 。
1molO的质量为 。
2)、1molH2的质量为 。
1molH2O的质量为 。
1molH2SO4的质量为 。
1molMg2+的质量为 。
规律二:1摩尔任何分子的质量如果以克为单位,在数值
上等于该分子的相对分子质量
规律三:1摩尔任何离子的质量如果以克为单位,在数值
上等于该离子的相对离子质量
总结:1摩尔任何粒子的质量,以克为单位,在数
值上等于该粒子的式量。
23g
1g
16g
2g
18g
98g
24g
1摩尔物质的质量
单位物质的量(1mol)的物质所具有的质量。或者说,质量与物质的量之比。
g.mol-1
kg.mol-1
以g/mol为单位时,等于相对分子(或原子)质量
理解
符号
注意:摩尔质量只与物质的种类有关,与物质的量、
物质的质量无关。
1、1molCa2+的质量为 ,Ca2+的摩尔
质量为 。Na2O2的摩尔质量为 。
0.5molSO42-的质量为 。
40g
40g·mol-1
48g
78g·mol-1
2、1molH2O的摩尔质量为 ,2molH2O的
摩尔质量为 。1molO含有 个 O, 质量为 ,O原子的摩尔质量为 。
18g·mol-1
18g·mol-1
6.02 ×1023
16g
16g·mol-1
课堂练习
物质的量(n)、物质的质量(m)、摩尔质量(M)之间的关系:
M
m
n =
(单位:mol)
归纳公式
m=n×M
(单位:g)
(单位:g/mol)
例如: m(CO2)=M(CO2)×n(CO2)
[例题]483 g Na2SO4·10H2O中所含的Na+和SO42-的物质的量各是多少?
所含H2O分子的数目是多少?
[解]Na2SO4·10H2O的相对分子质量为322,摩尔质量为322 g·mol-1。
则Na+的物质的量为3.00mol,SO42-的物质的量为1.50mol,H2O的物质的量为15.0mol。
答:483 g Na2SO4·10H2O中所含的Na+的物质的量为3.00 mol ,SO42-的物质的量为1.50mol,H2O分子的数目约为9.03×1024。
2、求0.3molH2O的质量,其中O原子数?
m(H2O)
=
n(H2O)
M(H2O)
×
=
0.3mol
18g·mol-1
×
=
5.4g
N(O)
=
n(O)
NA
×
=
0.3mol
6.02 ×1023mol-1
×
=
1.806 ×1023
=
n(H2O)
NA
×
练 习
3、下列说法是否正确:
A、 6.02 ×1023个C-12原子的质量为1g
B、 H的摩尔质量为1g
C、 H2SO4的摩尔质量等于6.02 ×1023个
H2SO4 分子的质量
D、 NaOH的摩尔质量为40g·mol-1
√
n
=
NA
N
M
=
n
m
n
=
M
m
n
=
NA
N
M
m
=
以物质的量为桥梁,将微粒个数与物质的质量
联系起来
关 系 式 应 用
I、求agFe的物质的量?Fe原子的个数?
n(Fe)
=
=
=
m(Fe)
M(Fe)
ag
56g·mol-1
a
56
mol
N(Fe)
NA
×
=
NA
n(Fe)
=
a
56
1、公式套用
II、amolH2SO4中含b个O原子,则NA如何表示?
n(O)
=
=
N(O)
NA
b
NA
4a
b
NA
=
4a
b
NA
=
n(H2SO4)
=
NA
N(H2SO4)
=
b
NA
4
1、公式套用
III、53gNa2CO3中含有Na+和CO32-的物质的量的
是多少?
M(Na2CO3)
=
n (Na2CO3)
m (Na2CO3)
n (Na+)
=
n (Na2CO3)
2
n (CO32-)
=
n (Na2CO3)
1
1、公式套用
n=
N
NA
物质的量与微粒个数成正比
IV、下列哪种物质与0.2molH3PO4所含原子个数相同
A、0.4molH2O2
B、0.1molH2SO4
C、0.8molNaCl
D、0.6molHNO3
√
1、公式套用
2、公式理解
n=
m
M
1.n相同,M越大,m越大
V、等质量下列物质,所含分子数最多的是:
A、CO2
B、CH4
C、O2
D、N2
2.m相同,M越大,n越小
3.M与m,n无关,只决定与物质的种类
√
VI、含相同O原子数的SO2与SO3,其物质的量比
和质量比分别是多少?
SO2
=
2
SO3
3
n(SO2)
n(SO3)
=
3
2
SO2
~
2
SO3
3
3×64
2×80
m(SO2)
m(SO3)
=
3×64
2×80
m(SO2)
m(SO3)
=
6
5
2、公式理解
VII、17.4gK2SO4和 gKNO3含有相同的K+
3、关系式法
K2SO4
~
2
KNO3
1
1×74
2×101
174
17.4
=
202
x
x
=
20.2g
依据:
1.质量守恒法
2.化学反应方程式
VIII、将10.6gNa2CO3溶于 g水中所得溶液
中Na+与H2O分子个数之比为1:100
1×106
200×18
106
10.6
=
3600
x
x
=
360g
依据:
1.质量守恒法
2.化学反应方程式
Na2CO3
~
2Na+
H2O
~
200
3、关系式法
作业
1、与4.8gCH4含相同质子数目的SO2的质量为
多少克?
2、2.06gX2O5中含有0.1molO原子,则X的相对
原子质量是多少?
专题一 第一单元
第二课时 物质的量
让我展开理想的翅膀
在知识的天空自由地飞翔…...
说一说
化学方程式:C + O2 == CO2表示什么意义?
微粒数
物质质量
物质的量
点燃
1.定义:表示含有一定数目粒子的集体。
2.单位:摩尔,简称:摩,符号:mol
理解
微观粒子: 分子、原子、离子、电子、质子等
符号
注意!“物质的量”这四个字是一种物理量的名称,不能拆开来看。
物理量 单位名称 单位符号
长度(L) 米 m
质量(m) 千克 Kg
时间(t) 秒 s
电流(I) 安培 A
热力学温度(T) 开尔文 K
物质的量(n) 摩尔 mol
发光强度 …… ……
国际单位制七个基本物理量
比一比
想一想
2、物质的量为1 mol某种微粒集合体中所含的微粒数目是多少呢
1、怎么理解“物质的量”与“一定数目微粒”之间的关系?
看一看
2、阿伏加德罗常数:0.012Kg12C中所含有的碳原子数,符号为NA ,单位mol.约为6.02×1023mol-1。
1、1 mol粒子的数目与0.012 kg 12C中所含的碳原子数目相同。
3、1 mol粒子的数目又叫阿伏加德罗常数,符号为NA,约为6.02×1023 个。
意大利化学家。他对6.02×1023这个数据的得出,有着很大的贡献,用其名字来表示该常数,以示纪念。他在化学上的重大贡献是建立分子学说。为了纪念阿伏加德罗的伟大功绩,将0.012kg12C中所含的C原子数目称为阿伏加德罗常数。它是自然科学中的基本常数之一。
阿伏加德罗
Avogadro
1776~1856
微粒
1摩尔: 阿伏加德罗常数
物质的量
个数(N)
1堆的量(NA)
堆数(n)
认识本质
对比感受
生活中的数量 物质的量
铅笔 大米 纸张 微观粒子数
单位 1打 1担 1令 1mol
标准 12支 100斤 500张 约 6.02×1023个
因此我们可以这样说
1molC中约含有6.02×1023个碳原子
1molO2中约含有6.02×1023个氧分子
1molH2O中约含有6.02×1023个H2O
1molH+中约含有6.02×1023个H+
1mol任何粒子集体中约含有6.02×1023个粒子
nmol某种微粒集合体中所含的微粒数约为n×6.02×1023.
能不能这样说
1mol人中约含有6.02×1023个人
1mol氧中约含有6.02×1023个氧
1mol水中约含有6.02×1023个水
1mol电子中约含有6.02×1023个电子
1、物质的量表示的是微观粒子的集体,不表示宏观物质的数目
2、物质由不同的微粒构成,因此,我们在使用摩尔表示物质的量时,要用化学式指明粒子的种类
3、粒子的种类可以是分子、原子、离子;也可以是质子、中子、电子等
使用物质的量和摩尔时的注意事项
判断下列说法是否正确,并加以说明理由
1、1mol 苹果
不对,指代不明,可指氧原子也可指氧分子
对,特定组合
对,指氧原子
对
不对,不能指宏观物质
不对,元素是宏观概念,只能说种类
2、1mol O
3、1mol 氧
4、1mol H2O
8、1mol 钠元素
9、1mol NaCl
5、1mol e-
6、1mol 质子
7、1mol OH-
对
对
对
1.判断下列说法是否正确,并说明理由。
(1)1mol氧 (2)0.25molCO2。 (3)摩尔是7个基本物理量之一。 (4)1mol是6.02×1023个微粒的粒子集合体。 (5)0.5molH2含有3.01×1023个氢原子。 (6)3molNH3中含有3molN原子,9molH原子。
答案(1)错误。没有指明微粒的种类。改成1molO、 1molO2,都是正确的。因此使用摩尔作单位时,所指粒子必须十分明确,且粒子的种类用化学式表示。(2)正确。 (3)错误。物质的量是基本物理量之一。摩尔只是它的单位,不能把二者混为一谈。 (4)错误。6.02×1023是阿伏加德罗常数的近似值。二者不能简单等同。 (5)错误。0.5molH2含有0.5×2=1molH原子,6.02×1023×1=6.02×1023个。 (6)正确。3molNH3中含有3×1=3 mol N原子,3×3=9molH原子。
想一想
物质的量(n)、阿伏加德罗常数(NA)粒子数(N)之间有何关系?
阿伏加德罗常数
物质的量
微粒个数
(约6.02×1023)
N
=
NA
×
n
在0.5molO2中含有的O2的分子数目是多少?
解:O2的分子数为
N = n × NA
= 0.5 mol × 6.02 ×1023个/mol
= 3.01 × 1023个
答:O2的分子数为3.01 × 1023个
例题1
在0.5molO2中含有的O的原子数目是多少?
解:O2的O原子数为
N = n ×2 × NA
=0.5 mol×2× 6.02 ×1023个/mol
= 6.02 × 1023个
答:O2的O原子数为6.02 × 1023个
例题2
在0.5molO2中含有的电子数目是多少?
解:O2的电子数为
N = n ×16 × NA
=0.5 mol×16× 6.02 ×1023个/mol
= 4.816 × 1024个
答: 0.5molO2的电子数为4.816 × 1024个
例题3
例题4
1mol的Na2CO3中约含有___mol的Na+、___mol的CO32-离子,共含有离子的个数为______________个。
2
1
3× 6.02 ×1023
0.5molH2中的氢分子数____________
1molNaCl中的氯离子数____________
1molH2SO4中的氧原子数____________
1.204X1024个水分子的物质的量___________
9.03X1023个铁原子的物质的量____________
10molNaOH中约含有 _________个Na+
N个水分子的物质的量是 (已知阿伏加德罗常数为NA)
【问题解决】
物质的量(n)
知识小结:
基准:NA
1、表示含有一定数目粒子的集体
2、专有名词,不能随意拆开
3、对象为微观粒子及其特定组合
单位:摩尔(mol)
1、是基本物理量的单位
2、量度对象:具体微观粒子及其特定组合
3、使用时用化学式指明粒子的种类
1、准确值:12g12C所含原子数
近似值: 6.02 1023
n=
NA
N
2、
=
N2
N1
n2
n1
基本物理量
练习
1、关于摩尔的叙述中,正确的是( )
A. 摩尔是表示物质质量的单位
B. 摩尔是表示物质数量的单位
C. 摩尔既表示物质微粒数量,又表示物质质量双重意义的单位
D. 摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
D
2、下列叙述正确的是( )
A. 6.02×1023就是阿伏加德罗常数
B. 1molH2O含2mol氢元素和1mol氧元素
C. 1molCaCl2中含3mol离子
D. 每摩尔物质均含有6.02×1023个原子
C
3、3molH2O中含____mol氢原子,____mol氧原子;与_____molNH3中所含的氢原子数相同.
6
3
2
4、 如果ag某气体中含有的分子数为b,则cg该气体的物质的量是(NA表示阿伏加德罗常数)( )
mol
A.
C.
mol
B.
mol
D.
mol
A
物质的量
知识小结:
基准:NA
1、衡量物质所含微粒数多少
2、专有名词,不能随意拆开
3、对象为微观粒子及其特定组合
单位:摩尔
1、是基本物理量的单位
2、量度对象:具体微观粒子及其特定组合
3、使用时用化学式指明粒子的种类
1、准确值:12g12C所含原子数
近似值: 6.02 1023
n=
NA
N
2、
=
N2
N1
n2
n1
基本物理量
一、物 质 的 量
1、1mol H2O含有_______个分子,有________个氢原子,有________个O,含有________质子,_______个电子。
3、下列物质中含分子数目由大到小顺序为__________
A.0.5molO2 B. 6.02 1023个N2
C.6.02 1024个HCl
D.与0.12kg12C含相同原子数目的Cl2
4、0.1molH2O中与_____molCO2所含的氧原子数目相
同,与__________个CH4分子中所含的氢原子数相同。
深化应用:
6.02 1023
1.204 1024
6.02 1023
6.02 1024
6.02 1024
6.02 1022
6.02 1022
D>C>B>A
0.05
3.01 1022
2、0.1molNaOH能电离出 ______ 个Na+,______ 个OH-
一、物 质 的 量
物质的量将宏观可称量的物质的质量与微观粒子的数目联系起来。
质量
粒子数
物质的量
NA
微观粒子
宏观质量
一个C
原子
一个O
原子
一个Fe
原子
扩大6.02 ×1023
1molC
原子
1molO
原子
1molFe
原子
0.012kg
16g
56g
12g
相对原子
质量
16
56
12
规律一:1摩尔任何原子的质量如果以克为单位,在数值上等于
该原子的相对原子质量
1摩尔物质的质量
1)、1molNa的质量为 。
1molH的质量为 。
1molO的质量为 。
2)、1molH2的质量为 。
1molH2O的质量为 。
1molH2SO4的质量为 。
1molMg2+的质量为 。
规律二:1摩尔任何分子的质量如果以克为单位,在数值
上等于该分子的相对分子质量
规律三:1摩尔任何离子的质量如果以克为单位,在数值
上等于该离子的相对离子质量
总结:1摩尔任何粒子的质量,以克为单位,在数
值上等于该粒子的式量。
23g
1g
16g
2g
18g
98g
24g
1摩尔物质的质量
单位物质的量(1mol)的物质所具有的质量。或者说,质量与物质的量之比。
g.mol-1
kg.mol-1
以g/mol为单位时,等于相对分子(或原子)质量
理解
符号
注意:摩尔质量只与物质的种类有关,与物质的量、
物质的质量无关。
1、1molCa2+的质量为 ,Ca2+的摩尔
质量为 。Na2O2的摩尔质量为 。
0.5molSO42-的质量为 。
40g
40g·mol-1
48g
78g·mol-1
2、1molH2O的摩尔质量为 ,2molH2O的
摩尔质量为 。1molO含有 个 O, 质量为 ,O原子的摩尔质量为 。
18g·mol-1
18g·mol-1
6.02 ×1023
16g
16g·mol-1
课堂练习
物质的量(n)、物质的质量(m)、摩尔质量(M)之间的关系:
M
m
n =
(单位:mol)
归纳公式
m=n×M
(单位:g)
(单位:g/mol)
例如: m(CO2)=M(CO2)×n(CO2)
[例题]483 g Na2SO4·10H2O中所含的Na+和SO42-的物质的量各是多少?
所含H2O分子的数目是多少?
[解]Na2SO4·10H2O的相对分子质量为322,摩尔质量为322 g·mol-1。
则Na+的物质的量为3.00mol,SO42-的物质的量为1.50mol,H2O的物质的量为15.0mol。
答:483 g Na2SO4·10H2O中所含的Na+的物质的量为3.00 mol ,SO42-的物质的量为1.50mol,H2O分子的数目约为9.03×1024。
2、求0.3molH2O的质量,其中O原子数?
m(H2O)
=
n(H2O)
M(H2O)
×
=
0.3mol
18g·mol-1
×
=
5.4g
N(O)
=
n(O)
NA
×
=
0.3mol
6.02 ×1023mol-1
×
=
1.806 ×1023
=
n(H2O)
NA
×
练 习
3、下列说法是否正确:
A、 6.02 ×1023个C-12原子的质量为1g
B、 H的摩尔质量为1g
C、 H2SO4的摩尔质量等于6.02 ×1023个
H2SO4 分子的质量
D、 NaOH的摩尔质量为40g·mol-1
√
n
=
NA
N
M
=
n
m
n
=
M
m
n
=
NA
N
M
m
=
以物质的量为桥梁,将微粒个数与物质的质量
联系起来
关 系 式 应 用
I、求agFe的物质的量?Fe原子的个数?
n(Fe)
=
=
=
m(Fe)
M(Fe)
ag
56g·mol-1
a
56
mol
N(Fe)
NA
×
=
NA
n(Fe)
=
a
56
1、公式套用
II、amolH2SO4中含b个O原子,则NA如何表示?
n(O)
=
=
N(O)
NA
b
NA
4a
b
NA
=
4a
b
NA
=
n(H2SO4)
=
NA
N(H2SO4)
=
b
NA
4
1、公式套用
III、53gNa2CO3中含有Na+和CO32-的物质的量的
是多少?
M(Na2CO3)
=
n (Na2CO3)
m (Na2CO3)
n (Na+)
=
n (Na2CO3)
2
n (CO32-)
=
n (Na2CO3)
1
1、公式套用
n=
N
NA
物质的量与微粒个数成正比
IV、下列哪种物质与0.2molH3PO4所含原子个数相同
A、0.4molH2O2
B、0.1molH2SO4
C、0.8molNaCl
D、0.6molHNO3
√
1、公式套用
2、公式理解
n=
m
M
1.n相同,M越大,m越大
V、等质量下列物质,所含分子数最多的是:
A、CO2
B、CH4
C、O2
D、N2
2.m相同,M越大,n越小
3.M与m,n无关,只决定与物质的种类
√
VI、含相同O原子数的SO2与SO3,其物质的量比
和质量比分别是多少?
SO2
=
2
SO3
3
n(SO2)
n(SO3)
=
3
2
SO2
~
2
SO3
3
3×64
2×80
m(SO2)
m(SO3)
=
3×64
2×80
m(SO2)
m(SO3)
=
6
5
2、公式理解
VII、17.4gK2SO4和 gKNO3含有相同的K+
3、关系式法
K2SO4
~
2
KNO3
1
1×74
2×101
174
17.4
=
202
x
x
=
20.2g
依据:
1.质量守恒法
2.化学反应方程式
VIII、将10.6gNa2CO3溶于 g水中所得溶液
中Na+与H2O分子个数之比为1:100
1×106
200×18
106
10.6
=
3600
x
x
=
360g
依据:
1.质量守恒法
2.化学反应方程式
Na2CO3
~
2Na+
H2O
~
200
3、关系式法
作业
1、与4.8gCH4含相同质子数目的SO2的质量为
多少克?
2、2.06gX2O5中含有0.1molO原子,则X的相对
原子质量是多少?
