山西省太原市56中2021-2022学年高二上学期10月月考化学试卷(Word版含答案)
文档属性
| 名称 | 山西省太原市56中2021-2022学年高二上学期10月月考化学试卷(Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 282.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-08 00:00:00 | ||
图片预览



文档简介
太原市第五十六中学校
2021—2022学年第一学期高二年级十月月考
化学试卷
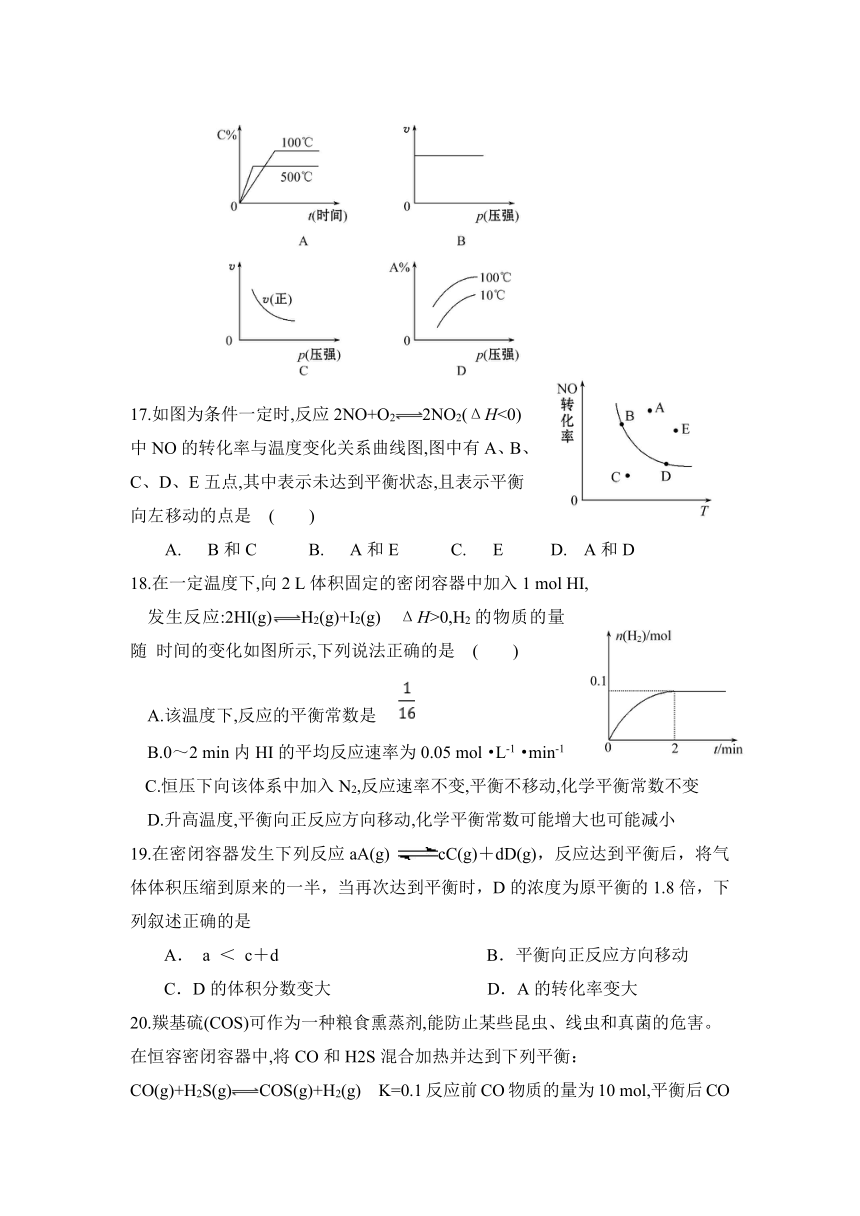
考试时间 60分钟 分值 100分
可能用到的原子量 C : 12 H :1 O : 16 Si :28
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15 16 17 18 19 20
答案
一.选择题每小题只有一个正确答案(60分)
1.下列反应中,放出热量的是( )
①NaOH溶液中加入盐酸 ②由乙醇制C2H4 ③铝热反应 ④由氯酸钾制O2
A.①② B.②③ C.①③ D.①④
2.下列有关光合作用的说法错误的是( )
A.将无机物转化为有机物
B.反应物的总能量高于生成物的总能量
C.将太阳能转变为化学能
D.是自然界碳元素循环的重要途径
3.在不同条件下分别测得反应2SO2+O22SO3的化学反应速率,其中表示该反应进行得最快的是 ( )
A.v(SO2)=4 mol·L-1·min-1 B.v(SO2)=0.1 mol·L-1·s-1
C.v(O2)=3 mol·L-1·min-1 D.v(O2)=0.1 mol·L-1·s-1
4.下列说法中正确的是( )
A.在化学反应中,发生物质变化的同时不一定发生能量变化
B.ΔH>0表示放热反应,ΔH<0表示吸热反应
C.ΔH的大小与热化学方程式中的各物质的化学计量数无关
D.反应产物的总焓大于反应物的总焓时,ΔH>0
5.下列热化学方程式中ΔH的绝对值(单位:kJ·mol-1)代表燃烧热的是( )
A.CH4(g)+O2(g)2H2O(l)+CO(g) ΔH1
B.S(s)+O2(g)SO3(s) ΔH2
C.C6H12O6(s)+6O2(g)6CO2(g)+6H2O(l) ΔH3
D.2CO(g)+O2(g)2CO2(g) ΔH4
6.一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g)2Z(g)一定达到化学平衡状态的是 ( )
①容器中气体的密度不再发生变化 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成2nmol Z,同时消耗2nmol Y
A.①② B.②③ C.③④ D.①④
7.根据以下三个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1;
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1;
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-Q3 kJ·mol-1。
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
8.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1
CH4(g)+2O2(g)CO2(g)+2H2O(l)
ΔH=-890 kJ·mol-1
由1 mol CO和3 mol CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为
A.2 912 kJ B.2 953 kJ C.3 236 kJ D.3 867 kJ
9.在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=+725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=+1 452 kJ·mol-1
10.已知:2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1
N2(g)+O2(g)2NO(g) ΔH=+180 kJ·mol-1
则2CO(g)+2NO(g)N2(g)+2CO2(g)的ΔH是( )
A.-386 kJ·mol-1 B.+386 kJ·mol-1 C.-746 kJ·mol-1 D.+746 kJ·mol-1
11.已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1;
(2)C(s)+O2(g)CO2(g) ΔH2=-393.5 kJ·mol-1;
(3)H2(g)+1/2O2(g)H2O(l) ΔH3=-285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)CH3COOH(l)的ΔH为( )
A.-488.3kJ·mol-1
B.-244.15 kJ·mol-1
C.+488.3kJ·mol-1
D.+244.15 kJ·mol-1
12.下列方法中可以证明2HI(气)H2(气)+I2(气)已达平衡状态的是 ( )
①单位时间内生成nmol H2的同时生成nmol HI
②一个H-H键断裂的同时有两个H-I键断裂
③温度和压强一定时混合气体密度不再变化
④反应速率v(H2)=v(I2)=0.5v(HI)时
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时混合气体的颜色不再变化
A.②③④⑤⑥ B.②⑥⑦⑧⑨ C.①②⑥⑧ D.②⑥⑨
13.单斜硫和正交硫是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)SO2(g) ΔH2=-296.83 kJ·mol-1
下列说法正确的是( )
A. S(单斜,s)S(正交,s) ΔH3=+0.33 kJ·mol-1
B. 正交硫比单斜硫稳定
C. 相同物质的量的正交硫比单斜硫所含有的能量高
D. ①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ
14.反应A(g)+B(g)C(g) ΔH
分两步进行:①A(g)+B(g)X(g) ΔH1;
②X(g)C(g) ΔH2,反应过程中能量
变化如图所示,下列说法正确的是( )
A.ΔH1=ΔH-ΔH2>0
B.ΔH2=ΔH-ΔH1>0
C.X是反应A(g)+B(g)C(g)的催化剂
D.ΔH=E1-E2
15.下列热化学方程式错误的是( )
化学键 A—A B—B A—B
键能/(kJ·mol-1) 436 243 431
A.1/2A2(g)+1/2B2(g)=AB(g) ΔH=-91.5 kJ·mol-1
B.A2(g)+B2(g)=2AB(g) ΔH=-183 kJ·mol-1
C.1/2A2(g)+1/2B2=AB(g) ΔH=+91.5 kJ·mol-1
D.2AB(g)=A2(g)+B2(g) ΔH=+183 kJ·mol-1
16.已知2A(g)+B(g)2C(g) ΔH<0,下列图象中能正确表示该可逆反应的是 ( )
17.如图为条件一定时,反应2NO+O22NO2(ΔH<0) 中NO的转化率与温度变化关系曲线图,图中有A、B、 C、D、E五点,其中表示未达到平衡状态,且表示平衡 向左移动的点是 ( )
A. B和C B. A和E C. E D. A和D
18.在一定温度下,向2 L体积固定的密闭容器中加入1 mol HI,
发生反应:2HI(g)H2(g)+I2(g) ΔH>0,H2的物质的量随 时间的变化如图所示,下列说法正确的是 ( )
A.该温度下,反应的平衡常数是
B.0~2 min内HI的平均反应速率为0.05 mol·L-1·min-1
C.恒压下向该体系中加入N2,反应速率不变,平衡不移动,化学平衡常数不变
D.升高温度,平衡向正反应方向移动,化学平衡常数可能增大也可能减小
19.在密闭容器发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. a < c+d B.平衡向正反应方向移动
C.D的体积分数变大 D.A的转化率变大
20.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol,下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.CO的平衡转化率为80%
21.(10分)一定温度下,在2 L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)从反应开始到10 s时,用Z表示的反应速率为________,X的物质的量浓度减少了________,Y的转化率为________。
(2)该反应的化学方程式为_________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示。则下列说法符合该图象的是________。
A. t1时刻,增大了X的浓度
B. t1时刻,升高了体系温度
C. t1时刻,缩小了容器体积D. t1时刻,使用了催化剂
22 (8分)2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
回答下列问题:
(1)图中A、C分别表示: 、
,
E的大小对该反应的反应热有无影响 。
(2)图中ΔH= kJ·mol-1。
23.(8分) 由化学能产生的能量是目前人类使用的主要能源。
(1)意大利罗马大学的Fulria Craod等人获得了极具理论研究意义的N4分子。N4分子的为正四面体(如图所示)。与白磷分子相似。已经断裂1 ml N-N键吸收167 kJ热量.生成I mol N叁键放出946kJ热量。根据以上信息判断,写出N2气体生成N4气体的热化学方程式: 。
(2)SiH4是一种无色气体,遇到空气能发生爆炸性自然,生成SiO2和液态水。已知室温下2g SiH4自然放出热量89.2kJ,则SiH4自然的热化学方程式为 。
(3)比较下列两个热化学方程式中的ΔH的大小。
4Al(s)+3O2(g)===2Al2O3(s) ΔH1
4Fe(s)+3O2(g)===2Al2O3(s) ΔH2
ΔH1 ΔH2(填>、<、=)
(4)2C(s)+O2(g)===2CO ΔH= -221kJ/mol
C(s)+O2(g)===CO2 ΔH= -393.5kJ/mol
N2(g)+O2(g)===2NO ΔH= +181kJ/mol
若某反应的平衡常数表达为K=c(N2)c2(CO2)/c2(CO)c2(NO).请写出此反应的热化学方程式 。
24.(14分) 2018年,美国退出了《巴黎协定》实行在工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年来我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究。实现可持续发展。
(1) 以CO2(g)和H2(g)为原料合成甲醇,反应过程的能量变化如图所示
①补全上图:图中A处应填入___
②该反应需要加人钢-锌基催化剂。加人催化刺后.该反应的△H ___ (填“ 变大” “ 变小” “ 不变”)
③为提高CH,OH的产率.理论上规采用的反应条件是____ .( 填字母)。
a高温高压 b. 低温低压 c 高温低压 d低温高压
(2)250℃,在恒容密团容器中由CO2催化氢化合成CH3OH(g) .如图为不同投料比(n(H2)/n(CO2)时某反应物X的平衡转化率变化曲线。
反应物X是____ ( "CO2,"或“H2”)。
(3)甲醇可以替代汽油和柴油作为内燃机燃料。某研究者分别以甲醇和汽油做燃料.实骑侧得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。根据图信息分析,与汽油相比.甲醇作为燃料的优点是 。
(4)250℃在容积为2.0L的恒容密闭容器中加入6molH2、2molCO2,和催化剂.10min时
反应达到平衡,测得c(CH3OH)=0.75mol.L-1
①10 min的平均反应速率v(H2)________________,
②该温度下平衡常数K的数值为_____ ( 结果保留两位小数)。
化学月考答案
选择每空3分,共60分
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
C B D D C B A B B C A D B A C A B B A C
填空每空2分,共40分
21 (1)0.079mol/l 0.395mol/l 79% (2) X+Y2Z (3) C D
22 (1) A 反应物具有的能量 C 生成物具有的能量 无影响
(2) 198
23(1)2N2(g)= N4(g) △H =+882 kJ/mol
B.SiH4(g)+2O2(g)= 2H2O(l)+SiO2(g) △H=-1427.2 kJ/mol
B.<
B.2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-747 kJ/mol
24 (1) 1 mol CO2(g) + 3 mol H2(g) 不变 d
(2) CO2
(2) 汽车的加速性能相同的情况下,CO 排放量低,污染小
(4) 0.225mol/(L·min) 5.33
2021—2022学年第一学期高二年级十月月考
化学试卷
考试时间 60分钟 分值 100分
可能用到的原子量 C : 12 H :1 O : 16 Si :28
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15 16 17 18 19 20
答案
一.选择题每小题只有一个正确答案(60分)
1.下列反应中,放出热量的是( )
①NaOH溶液中加入盐酸 ②由乙醇制C2H4 ③铝热反应 ④由氯酸钾制O2
A.①② B.②③ C.①③ D.①④
2.下列有关光合作用的说法错误的是( )
A.将无机物转化为有机物
B.反应物的总能量高于生成物的总能量
C.将太阳能转变为化学能
D.是自然界碳元素循环的重要途径
3.在不同条件下分别测得反应2SO2+O22SO3的化学反应速率,其中表示该反应进行得最快的是 ( )
A.v(SO2)=4 mol·L-1·min-1 B.v(SO2)=0.1 mol·L-1·s-1
C.v(O2)=3 mol·L-1·min-1 D.v(O2)=0.1 mol·L-1·s-1
4.下列说法中正确的是( )
A.在化学反应中,发生物质变化的同时不一定发生能量变化
B.ΔH>0表示放热反应,ΔH<0表示吸热反应
C.ΔH的大小与热化学方程式中的各物质的化学计量数无关
D.反应产物的总焓大于反应物的总焓时,ΔH>0
5.下列热化学方程式中ΔH的绝对值(单位:kJ·mol-1)代表燃烧热的是( )
A.CH4(g)+O2(g)2H2O(l)+CO(g) ΔH1
B.S(s)+O2(g)SO3(s) ΔH2
C.C6H12O6(s)+6O2(g)6CO2(g)+6H2O(l) ΔH3
D.2CO(g)+O2(g)2CO2(g) ΔH4
6.一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g)2Z(g)一定达到化学平衡状态的是 ( )
①容器中气体的密度不再发生变化 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成2nmol Z,同时消耗2nmol Y
A.①② B.②③ C.③④ D.①④
7.根据以下三个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1;
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1;
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-Q3 kJ·mol-1。
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
8.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1
CH4(g)+2O2(g)CO2(g)+2H2O(l)
ΔH=-890 kJ·mol-1
由1 mol CO和3 mol CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为
A.2 912 kJ B.2 953 kJ C.3 236 kJ D.3 867 kJ
9.在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=+725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=+1 452 kJ·mol-1
10.已知:2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1
N2(g)+O2(g)2NO(g) ΔH=+180 kJ·mol-1
则2CO(g)+2NO(g)N2(g)+2CO2(g)的ΔH是( )
A.-386 kJ·mol-1 B.+386 kJ·mol-1 C.-746 kJ·mol-1 D.+746 kJ·mol-1
11.已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1;
(2)C(s)+O2(g)CO2(g) ΔH2=-393.5 kJ·mol-1;
(3)H2(g)+1/2O2(g)H2O(l) ΔH3=-285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)CH3COOH(l)的ΔH为( )
A.-488.3kJ·mol-1
B.-244.15 kJ·mol-1
C.+488.3kJ·mol-1
D.+244.15 kJ·mol-1
12.下列方法中可以证明2HI(气)H2(气)+I2(气)已达平衡状态的是 ( )
①单位时间内生成nmol H2的同时生成nmol HI
②一个H-H键断裂的同时有两个H-I键断裂
③温度和压强一定时混合气体密度不再变化
④反应速率v(H2)=v(I2)=0.5v(HI)时
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时混合气体的颜色不再变化
A.②③④⑤⑥ B.②⑥⑦⑧⑨ C.①②⑥⑧ D.②⑥⑨
13.单斜硫和正交硫是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)SO2(g) ΔH2=-296.83 kJ·mol-1
下列说法正确的是( )
A. S(单斜,s)S(正交,s) ΔH3=+0.33 kJ·mol-1
B. 正交硫比单斜硫稳定
C. 相同物质的量的正交硫比单斜硫所含有的能量高
D. ①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ
14.反应A(g)+B(g)C(g) ΔH
分两步进行:①A(g)+B(g)X(g) ΔH1;
②X(g)C(g) ΔH2,反应过程中能量
变化如图所示,下列说法正确的是( )
A.ΔH1=ΔH-ΔH2>0
B.ΔH2=ΔH-ΔH1>0
C.X是反应A(g)+B(g)C(g)的催化剂
D.ΔH=E1-E2
15.下列热化学方程式错误的是( )
化学键 A—A B—B A—B
键能/(kJ·mol-1) 436 243 431
A.1/2A2(g)+1/2B2(g)=AB(g) ΔH=-91.5 kJ·mol-1
B.A2(g)+B2(g)=2AB(g) ΔH=-183 kJ·mol-1
C.1/2A2(g)+1/2B2=AB(g) ΔH=+91.5 kJ·mol-1
D.2AB(g)=A2(g)+B2(g) ΔH=+183 kJ·mol-1
16.已知2A(g)+B(g)2C(g) ΔH<0,下列图象中能正确表示该可逆反应的是 ( )
17.如图为条件一定时,反应2NO+O22NO2(ΔH<0) 中NO的转化率与温度变化关系曲线图,图中有A、B、 C、D、E五点,其中表示未达到平衡状态,且表示平衡 向左移动的点是 ( )
A. B和C B. A和E C. E D. A和D
18.在一定温度下,向2 L体积固定的密闭容器中加入1 mol HI,
发生反应:2HI(g)H2(g)+I2(g) ΔH>0,H2的物质的量随 时间的变化如图所示,下列说法正确的是 ( )
A.该温度下,反应的平衡常数是
B.0~2 min内HI的平均反应速率为0.05 mol·L-1·min-1
C.恒压下向该体系中加入N2,反应速率不变,平衡不移动,化学平衡常数不变
D.升高温度,平衡向正反应方向移动,化学平衡常数可能增大也可能减小
19.在密闭容器发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. a < c+d B.平衡向正反应方向移动
C.D的体积分数变大 D.A的转化率变大
20.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol,下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.CO的平衡转化率为80%
21.(10分)一定温度下,在2 L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)从反应开始到10 s时,用Z表示的反应速率为________,X的物质的量浓度减少了________,Y的转化率为________。
(2)该反应的化学方程式为_________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示。则下列说法符合该图象的是________。
A. t1时刻,增大了X的浓度
B. t1时刻,升高了体系温度
C. t1时刻,缩小了容器体积D. t1时刻,使用了催化剂
22 (8分)2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
回答下列问题:
(1)图中A、C分别表示: 、
,
E的大小对该反应的反应热有无影响 。
(2)图中ΔH= kJ·mol-1。
23.(8分) 由化学能产生的能量是目前人类使用的主要能源。
(1)意大利罗马大学的Fulria Craod等人获得了极具理论研究意义的N4分子。N4分子的为正四面体(如图所示)。与白磷分子相似。已经断裂1 ml N-N键吸收167 kJ热量.生成I mol N叁键放出946kJ热量。根据以上信息判断,写出N2气体生成N4气体的热化学方程式: 。
(2)SiH4是一种无色气体,遇到空气能发生爆炸性自然,生成SiO2和液态水。已知室温下2g SiH4自然放出热量89.2kJ,则SiH4自然的热化学方程式为 。
(3)比较下列两个热化学方程式中的ΔH的大小。
4Al(s)+3O2(g)===2Al2O3(s) ΔH1
4Fe(s)+3O2(g)===2Al2O3(s) ΔH2
ΔH1 ΔH2(填>、<、=)
(4)2C(s)+O2(g)===2CO ΔH= -221kJ/mol
C(s)+O2(g)===CO2 ΔH= -393.5kJ/mol
N2(g)+O2(g)===2NO ΔH= +181kJ/mol
若某反应的平衡常数表达为K=c(N2)c2(CO2)/c2(CO)c2(NO).请写出此反应的热化学方程式 。
24.(14分) 2018年,美国退出了《巴黎协定》实行在工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年来我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究。实现可持续发展。
(1) 以CO2(g)和H2(g)为原料合成甲醇,反应过程的能量变化如图所示
①补全上图:图中A处应填入___
②该反应需要加人钢-锌基催化剂。加人催化刺后.该反应的△H ___ (填“ 变大” “ 变小” “ 不变”)
③为提高CH,OH的产率.理论上规采用的反应条件是____ .( 填字母)。
a高温高压 b. 低温低压 c 高温低压 d低温高压
(2)250℃,在恒容密团容器中由CO2催化氢化合成CH3OH(g) .如图为不同投料比(n(H2)/n(CO2)时某反应物X的平衡转化率变化曲线。
反应物X是____ ( "CO2,"或“H2”)。
(3)甲醇可以替代汽油和柴油作为内燃机燃料。某研究者分别以甲醇和汽油做燃料.实骑侧得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。根据图信息分析,与汽油相比.甲醇作为燃料的优点是 。
(4)250℃在容积为2.0L的恒容密闭容器中加入6molH2、2molCO2,和催化剂.10min时
反应达到平衡,测得c(CH3OH)=0.75mol.L-1
①10 min的平均反应速率v(H2)________________,
②该温度下平衡常数K的数值为_____ ( 结果保留两位小数)。
化学月考答案
选择每空3分,共60分
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
C B D D C B A B B C A D B A C A B B A C
填空每空2分,共40分
21 (1)0.079mol/l 0.395mol/l 79% (2) X+Y2Z (3) C D
22 (1) A 反应物具有的能量 C 生成物具有的能量 无影响
(2) 198
23(1)2N2(g)= N4(g) △H =+882 kJ/mol
B.SiH4(g)+2O2(g)= 2H2O(l)+SiO2(g) △H=-1427.2 kJ/mol
B.<
B.2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-747 kJ/mol
24 (1) 1 mol CO2(g) + 3 mol H2(g) 不变 d
(2) CO2
(2) 汽车的加速性能相同的情况下,CO 排放量低,污染小
(4) 0.225mol/(L·min) 5.33
同课章节目录
