5.3化学反应中的有关计算同步练习—2021—2022学年九年级化学鲁教版上册(word 含答案)
文档属性
| 名称 | 5.3化学反应中的有关计算同步练习—2021—2022学年九年级化学鲁教版上册(word 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 403.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-08 16:06:09 | ||
图片预览



文档简介
5.3化学反应中的有关计算——同步练习
一、单选题(共13题;共39分)
1.某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
A. Zn B. Cu C. Mg D. Ag
2.下列图像中正确反映了其对应操作的是( )
A. 在盛有空气的密闭容器中点燃红磷
B. 向NaOH溶液中不断加入水
C. 将浓硫酸敞口放置在空气中
D. 分别向等质量的锌粉和铁粉中,加人足量且质量分数相等的稀盐酸
3.已知NaHCO3受热分解生成Na2CO3 , 2NaHCO3 Na2CO3+CO2↑+H2O.把12克NaHCO3和Na2CO3的混合物样品加热至完全反应,剩余固体的质量为8.9克.下列说法正确的是( )
A. 反应生成的CO2质量为4.4克 B. 样品中Na2CO3的质量分数为30%
C. 样品中NaHCO3的质量为8.6克 D. 样品中钠元素的质量分数为43.3%
4.使两份等质量的碳酸钙,一份与稀盐酸完全反应,一份高温煅烧所产生的CO2的质量( )
A. 一样多 B. 跟稀盐酸反应的多 C. 煅烧的多 D. 无法判断
5.以“2H2+O2 2H2O”这一化学方程式为例,下列哪些信息是化学方程式能提供的( )
①反应物和生成物是什么 ②各物质的微观粒子个数之比 ③各物质的物质的量之比
④各物质的质量之比 ⑤化学反应速度是快是慢 ⑥化学反应的现象
A. ①②③④⑤⑥ B. ①②④⑤ C. ①②④⑥ D. ①②③④
6.在“宏观一微观”之间建立联系,是学习化学学科必备的思维方式。下图是某反应的微观示意图,下列说法正确的是( )
A. 该反应中甲、乙、丙、丁都属于化合物 B. 反应生成丙、丁分子个数比为1:1
C. 参加反应的甲、乙的质量比为6O: 224 D. 该反应不遵守质量守恒定律
7.下列关于化学反应2X+Y=2Z的叙述,错误的是( )
A. Z一定是化合物
B. 若agX与bgY充分反应,生成Z的质量可能为(a+b)g
C. 若X和Y的相对分子质量分别为m和n,则Z的相对分子质量为(m+n)
D. 在反应中X、Y、Z三种物质的粒子数目比为2:1:2
8.某同学取用一定量过氧化氢溶液与一定量二氧化锰混合制取氧气,如图所示下列有关氧气的体积(V)、二氧化锰的质量(m)与时间(t)关系的曲线正确的是( )
A. B. C. D.
9.下列图示与相应的文字描述相符合的是( )
A. 加热分解KMnO4固体
B. 镁带在密闭容器中燃烧
C. 完全分解等质量的过氧化氢
D. 盛有二氧化锰的烧杯中加入过氧化氢溶液
10.下列图像能正确反映对应变化关系的是 ( )
A.电解水产生氢气与氧气 B.向氯化钠的饱和溶液中加入硝酸钾 C.向混有少量硫酸的硫酸铜溶液中加入氢氧化钠溶液 D.向一定质量的稀盐酸中加氢氧化钠
A. A B. B C. C D. D
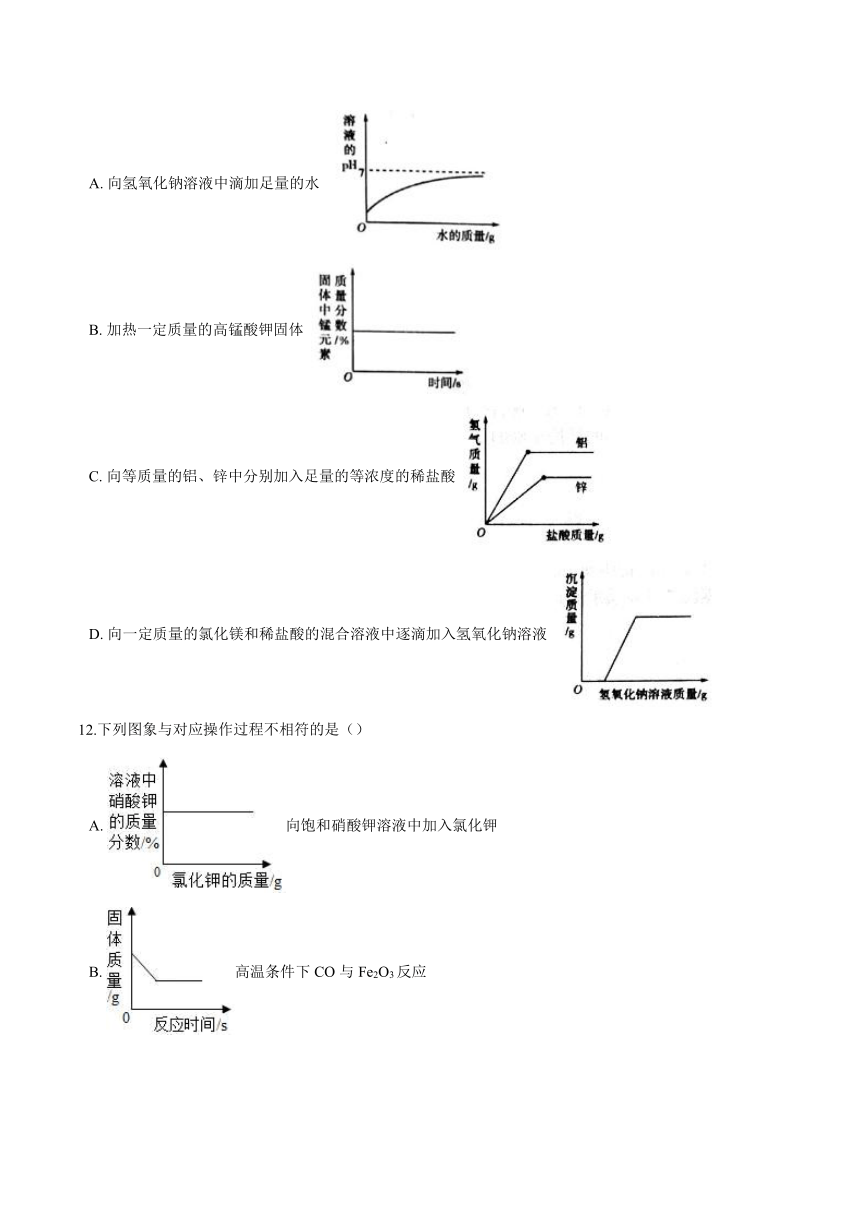
11.图中能正确反映对应变化关系的是( )
A. 向氢氧化钠溶液中滴加足量的水
B. 加热一定质量的高锰酸钾固体
C. 向等质量的铝、锌中分别加入足量的等浓度的稀盐酸
D. 向一定质量的氯化镁和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
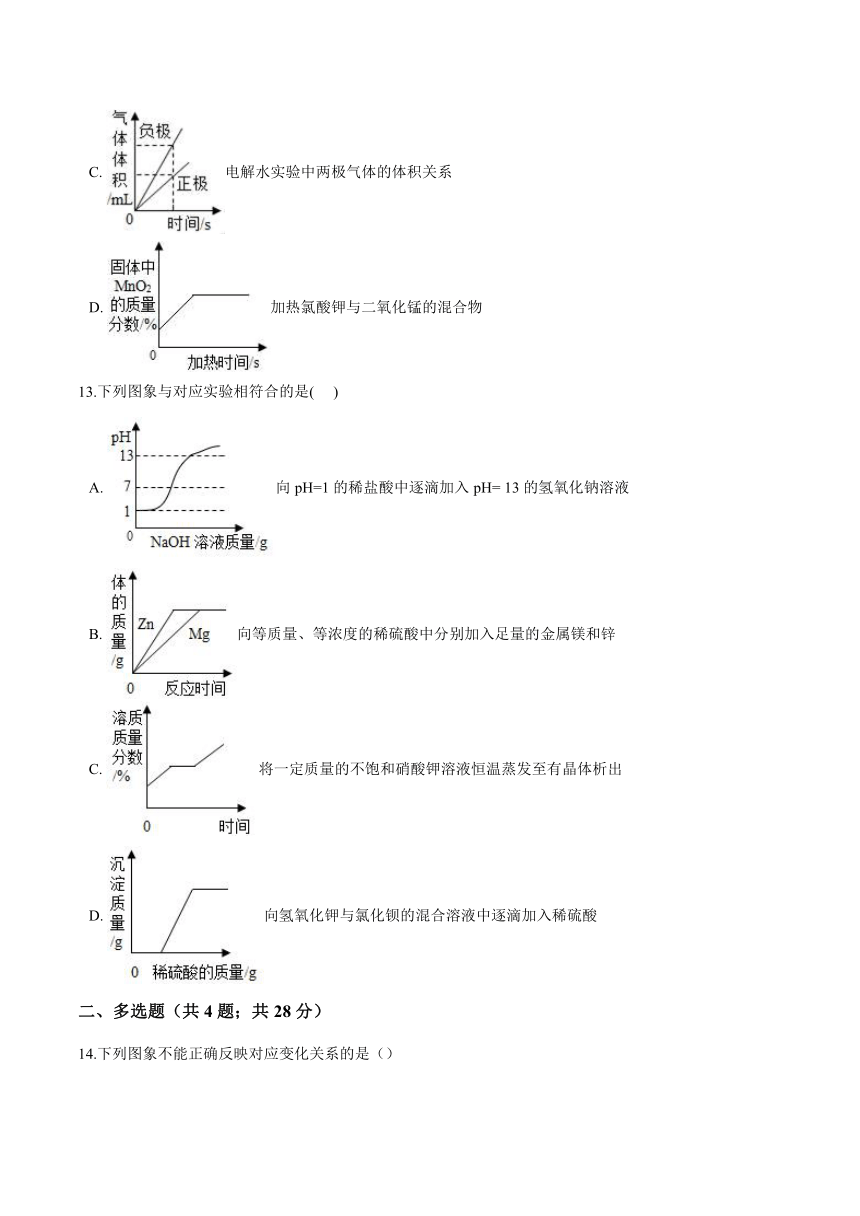
12.下列图象与对应操作过程不相符的是()
A. 向饱和硝酸钾溶液中加入氯化钾
B. 高温条件下CO与Fe2O3反应
C. 电解水实验中两极气体的体积关系
D. 加热氯酸钾与二氧化锰的混合物
13.下列图象与对应实验相符合的是( )
A. 向pH=1的稀盐酸中逐滴加入pH= 13的氢氧化钠溶液
B. 向等质量、等浓度的稀硫酸中分别加入足量的金属镁和锌
C. 将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出
D. 向氢氧化钾与氯化钡的混合溶液中逐滴加入稀硫酸
二、多选题(共4题;共28分)
14.下列图象不能正确反映对应变化关系的是()
A. 加热一定量的高锰酸钾固体
B. 向一定量的二氧化锰中加入过氧化氢溶液
C. 用等质量氯酸钾制取氧气
D. 将水通电电解一段时间
15.肼(N2H4)是氮和氢形成的化合物,易溶于水。工业上利用尿素法生产肼,同时得副产品十水碳酸钠,工艺流程如下:
【资料】①尿素的化学式为CO(NH2)2;②Cl2+H2O=HCl+HClO;
③制肼过程的反应为CO(NH2)2+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O;
下列说法不正确的是( )
A. 尿素不能与熟石灰、草木灰等碱性物质混合使用,会生成氨气,造成肥效流失
B. Cl2与NaOH溶液发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O
C. 从母液中分离出十水合碳酸钠晶体,可采用蒸发浓缩、冷却结晶、过滤、洗涤干燥等步骤
D. 从后续反应过程来看,若要使原料利用率最佳,合成次氯酸钠时投入的液氯与烧碱的质量之比为71 :80
16.在 100mL 烧杯中加入 20g0.4%的氢氧化钠溶液,滴加 2~3 滴酚酞试液,再逐滴滴加 0.365%的稀盐酸, 关于反应过程中的说法正确的是( )
A. 溶液由无色变为红色 B. 溶液可能不变色
C. 产生大量热,烧杯变烫,形成大量水雾 D. 当溶液为无色时,溶质的质量分数为 0.3%
17.某氢氧化钠固体样品,可能含有氢氧化钾和氯化钠,取5.6g该样品与100g一定溶质质量分数的稀盐酸恰好完全反应,生成Xg水,下列说法正确的是( )
A. 若X=1.8,则样品中一定含有氯化钠,可能含有氢氧化钾
B. 若X>1.8,则样品中一定含有氢氧化钾和氯化钠
C. 若样品不含任何杂质,则X<1.8
D. 若样品中不含氯化钠,则盐酸的溶质质量分数可能为4%
三、综合题(共5题;共33分)
18.
(1).从物质分类来看,澄清石灰水属于 物(选填“纯净”或“混合”),其溶质属于 (选填“单质”或“化合物”或“氧化物”)。
(2).某澄清石灰水中含有氢氧化钙1.48g,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,至少需要二氧化碳的质量是 ?
19.某兴趣小组利用下列装置进行实验室制取和收集气体的实验,请回答:
(1).选择装置A用高锰酸钾制取 ,你认为该装置的不足之处是 , 改进后继续实验,并与装置C组合制取并收集 ,待收集完 后,先从水槽中取出导气管,再停止加热的原因是 。
(2).实验室用过氧化氢和 制取 ,化学反应的化学符号表达式为 (填序号,下同)。该装置与E装置组合来收集 ,检验其中是否集满 的操作是 。
(3).某无毒气体的密度是空气密度的59倍,且极难溶于水,在空气中不易变质,则该气体不能选用的收集装置是 。
(4).氧气可采用C装置收集并采用带火星的木条检验,这是利用了氧气的哪些性质?
(5).若将装置F注满水用排水法收集 ,请简述操作步骤 。
(6).中科院研制出一种将二氧化碳转化为汽油的方法,其流程如图所示。(如图中a、b是两种起始反应物的分子模型,c、d是最终制得的汽油中所含两种物质的分子模型)
①物质d中碳元素与氢元素的质量比为 。
②将15g氯酸钾和二氧化锰的固体混合物充分加热,待完全反应后称量剩余物为10.2g,则原混合物中氯酸钾质量为 。
③已知甲烷化学式为 ,乙烷化学式为 ,丙烷化学式 ,试推断丁烷化学式为 。
20.水是生命之源。
(1).自然界的水循环如图所示。从分子、原子角度分析,水变为水蒸气时,变化的是 。自然界的水可分为硬水和软水。硬水中溶有较多的 , 遇到肥皂水会产生较多的 。
(2).如图是某种自热饭盒内部结构的简单示意。使用时,水与生石灰接触就会反应并放出大量的热,发生反应的化学方程式是 要保证反应恰好完成,配料时生石灰与水的质量比应为 (填最简整数比)
(3).按图所示装置进行电解水实验,试管 (填“a”或"b”)中的气体能使燃着的木条燃烧更旺。试管a、b中气体的体积比为 ;密度比为 (填最简整数比)
21.某同学用下图所示装置研究质量守恒定律的相关问题。
反应前称得总质量为m1 , 将足量稀硫酸全部倒入烧杯,充分反应后,称得总质量为m2。
(1)m1≠m2的原因是________(用化学方程式表示)。该反应是否遵守质量守恒定律________(填“是”或“否”)。
(2)理论上m1和m2的差值是________ g。
22.下面是同学们测定黄铜(铜锌合金)中铜的质量分数的过程。
(1).小华同学取10g黄铜,加入足量的稀硫酸,共收集到气体0.2g,则黄铜中铜的质量分数是多少?(写出计算过程)
(2).小婷同学另取10g黄铜于烧杯中,将120g稀硫酸分六次加入烧杯中,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表:
次数 一 二 三 四 五 六
加入稀硫酸的质量/g 20 20 20 20 20 20
烧杯中剩余物的质量/g 29.96 49.92 m 89.84 109.8 129.8
①表中m= 。
②请在下图画出10g黄铜加入稀硫酸与生成氢气的质量的图象 。
答案部分
一、单选题
1.【答案】 C
2.【答案】 D
3.【答案】 B
4.【答案】 A
5.【答案】 D
6.【答案】 C
7.【答案】 C
8.【答案】 D
9.【答案】 D
10.【答案】 D
11.【答案】 D
12.【答案】 A
13.【答案】 D
二、多选题
14.【答案】 B,C
15.【答案】 A,D
16.【答案】 B,D
17.【答案】 A,D
三、综合题
18.【答案】 (1)混合;化合物
(2)0.88g
19.【答案】 (1)管口未放棉花;防止水槽中的水倒流炸裂试管
(2);将一带火星的木条放在集气瓶口
(3)D
(4)氧气不易溶于水,能支持燃烧
(5)先将集气瓶充满水,将气体从a管通入
(6)48:5;12.25g;
20.【答案】 (1)水分子之间的间隔变大;可溶性钙镁化合物;浮渣
(2);28:9
(3)b;2:1;1:16
21.【答案】 (1)Zn + H2SO4 = ZnSO4 + H2↑;是
(2)0.2
22.【答案】 (1)解:设参与反应的锌的质量为x,
Zn+H2SO4=ZnSO4+ H2↑
65 2
x 0.2g
解得:x=6.5g
则样品中铜的质量分数为: ×100%=35%
答:该样品中铜的质量分数为35%
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
(2)69.88;
一、单选题(共13题;共39分)
1.某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
A. Zn B. Cu C. Mg D. Ag
2.下列图像中正确反映了其对应操作的是( )
A. 在盛有空气的密闭容器中点燃红磷
B. 向NaOH溶液中不断加入水
C. 将浓硫酸敞口放置在空气中
D. 分别向等质量的锌粉和铁粉中,加人足量且质量分数相等的稀盐酸
3.已知NaHCO3受热分解生成Na2CO3 , 2NaHCO3 Na2CO3+CO2↑+H2O.把12克NaHCO3和Na2CO3的混合物样品加热至完全反应,剩余固体的质量为8.9克.下列说法正确的是( )
A. 反应生成的CO2质量为4.4克 B. 样品中Na2CO3的质量分数为30%
C. 样品中NaHCO3的质量为8.6克 D. 样品中钠元素的质量分数为43.3%
4.使两份等质量的碳酸钙,一份与稀盐酸完全反应,一份高温煅烧所产生的CO2的质量( )
A. 一样多 B. 跟稀盐酸反应的多 C. 煅烧的多 D. 无法判断
5.以“2H2+O2 2H2O”这一化学方程式为例,下列哪些信息是化学方程式能提供的( )
①反应物和生成物是什么 ②各物质的微观粒子个数之比 ③各物质的物质的量之比
④各物质的质量之比 ⑤化学反应速度是快是慢 ⑥化学反应的现象
A. ①②③④⑤⑥ B. ①②④⑤ C. ①②④⑥ D. ①②③④
6.在“宏观一微观”之间建立联系,是学习化学学科必备的思维方式。下图是某反应的微观示意图,下列说法正确的是( )
A. 该反应中甲、乙、丙、丁都属于化合物 B. 反应生成丙、丁分子个数比为1:1
C. 参加反应的甲、乙的质量比为6O: 224 D. 该反应不遵守质量守恒定律
7.下列关于化学反应2X+Y=2Z的叙述,错误的是( )
A. Z一定是化合物
B. 若agX与bgY充分反应,生成Z的质量可能为(a+b)g
C. 若X和Y的相对分子质量分别为m和n,则Z的相对分子质量为(m+n)
D. 在反应中X、Y、Z三种物质的粒子数目比为2:1:2
8.某同学取用一定量过氧化氢溶液与一定量二氧化锰混合制取氧气,如图所示下列有关氧气的体积(V)、二氧化锰的质量(m)与时间(t)关系的曲线正确的是( )
A. B. C. D.
9.下列图示与相应的文字描述相符合的是( )
A. 加热分解KMnO4固体
B. 镁带在密闭容器中燃烧
C. 完全分解等质量的过氧化氢
D. 盛有二氧化锰的烧杯中加入过氧化氢溶液
10.下列图像能正确反映对应变化关系的是 ( )
A.电解水产生氢气与氧气 B.向氯化钠的饱和溶液中加入硝酸钾 C.向混有少量硫酸的硫酸铜溶液中加入氢氧化钠溶液 D.向一定质量的稀盐酸中加氢氧化钠
A. A B. B C. C D. D
11.图中能正确反映对应变化关系的是( )
A. 向氢氧化钠溶液中滴加足量的水
B. 加热一定质量的高锰酸钾固体
C. 向等质量的铝、锌中分别加入足量的等浓度的稀盐酸
D. 向一定质量的氯化镁和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
12.下列图象与对应操作过程不相符的是()
A. 向饱和硝酸钾溶液中加入氯化钾
B. 高温条件下CO与Fe2O3反应
C. 电解水实验中两极气体的体积关系
D. 加热氯酸钾与二氧化锰的混合物
13.下列图象与对应实验相符合的是( )
A. 向pH=1的稀盐酸中逐滴加入pH= 13的氢氧化钠溶液
B. 向等质量、等浓度的稀硫酸中分别加入足量的金属镁和锌
C. 将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出
D. 向氢氧化钾与氯化钡的混合溶液中逐滴加入稀硫酸
二、多选题(共4题;共28分)
14.下列图象不能正确反映对应变化关系的是()
A. 加热一定量的高锰酸钾固体
B. 向一定量的二氧化锰中加入过氧化氢溶液
C. 用等质量氯酸钾制取氧气
D. 将水通电电解一段时间
15.肼(N2H4)是氮和氢形成的化合物,易溶于水。工业上利用尿素法生产肼,同时得副产品十水碳酸钠,工艺流程如下:
【资料】①尿素的化学式为CO(NH2)2;②Cl2+H2O=HCl+HClO;
③制肼过程的反应为CO(NH2)2+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O;
下列说法不正确的是( )
A. 尿素不能与熟石灰、草木灰等碱性物质混合使用,会生成氨气,造成肥效流失
B. Cl2与NaOH溶液发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O
C. 从母液中分离出十水合碳酸钠晶体,可采用蒸发浓缩、冷却结晶、过滤、洗涤干燥等步骤
D. 从后续反应过程来看,若要使原料利用率最佳,合成次氯酸钠时投入的液氯与烧碱的质量之比为71 :80
16.在 100mL 烧杯中加入 20g0.4%的氢氧化钠溶液,滴加 2~3 滴酚酞试液,再逐滴滴加 0.365%的稀盐酸, 关于反应过程中的说法正确的是( )
A. 溶液由无色变为红色 B. 溶液可能不变色
C. 产生大量热,烧杯变烫,形成大量水雾 D. 当溶液为无色时,溶质的质量分数为 0.3%
17.某氢氧化钠固体样品,可能含有氢氧化钾和氯化钠,取5.6g该样品与100g一定溶质质量分数的稀盐酸恰好完全反应,生成Xg水,下列说法正确的是( )
A. 若X=1.8,则样品中一定含有氯化钠,可能含有氢氧化钾
B. 若X>1.8,则样品中一定含有氢氧化钾和氯化钠
C. 若样品不含任何杂质,则X<1.8
D. 若样品中不含氯化钠,则盐酸的溶质质量分数可能为4%
三、综合题(共5题;共33分)
18.
(1).从物质分类来看,澄清石灰水属于 物(选填“纯净”或“混合”),其溶质属于 (选填“单质”或“化合物”或“氧化物”)。
(2).某澄清石灰水中含有氢氧化钙1.48g,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,至少需要二氧化碳的质量是 ?
19.某兴趣小组利用下列装置进行实验室制取和收集气体的实验,请回答:
(1).选择装置A用高锰酸钾制取 ,你认为该装置的不足之处是 , 改进后继续实验,并与装置C组合制取并收集 ,待收集完 后,先从水槽中取出导气管,再停止加热的原因是 。
(2).实验室用过氧化氢和 制取 ,化学反应的化学符号表达式为 (填序号,下同)。该装置与E装置组合来收集 ,检验其中是否集满 的操作是 。
(3).某无毒气体的密度是空气密度的59倍,且极难溶于水,在空气中不易变质,则该气体不能选用的收集装置是 。
(4).氧气可采用C装置收集并采用带火星的木条检验,这是利用了氧气的哪些性质?
(5).若将装置F注满水用排水法收集 ,请简述操作步骤 。
(6).中科院研制出一种将二氧化碳转化为汽油的方法,其流程如图所示。(如图中a、b是两种起始反应物的分子模型,c、d是最终制得的汽油中所含两种物质的分子模型)
①物质d中碳元素与氢元素的质量比为 。
②将15g氯酸钾和二氧化锰的固体混合物充分加热,待完全反应后称量剩余物为10.2g,则原混合物中氯酸钾质量为 。
③已知甲烷化学式为 ,乙烷化学式为 ,丙烷化学式 ,试推断丁烷化学式为 。
20.水是生命之源。
(1).自然界的水循环如图所示。从分子、原子角度分析,水变为水蒸气时,变化的是 。自然界的水可分为硬水和软水。硬水中溶有较多的 , 遇到肥皂水会产生较多的 。
(2).如图是某种自热饭盒内部结构的简单示意。使用时,水与生石灰接触就会反应并放出大量的热,发生反应的化学方程式是 要保证反应恰好完成,配料时生石灰与水的质量比应为 (填最简整数比)
(3).按图所示装置进行电解水实验,试管 (填“a”或"b”)中的气体能使燃着的木条燃烧更旺。试管a、b中气体的体积比为 ;密度比为 (填最简整数比)
21.某同学用下图所示装置研究质量守恒定律的相关问题。
反应前称得总质量为m1 , 将足量稀硫酸全部倒入烧杯,充分反应后,称得总质量为m2。
(1)m1≠m2的原因是________(用化学方程式表示)。该反应是否遵守质量守恒定律________(填“是”或“否”)。
(2)理论上m1和m2的差值是________ g。
22.下面是同学们测定黄铜(铜锌合金)中铜的质量分数的过程。
(1).小华同学取10g黄铜,加入足量的稀硫酸,共收集到气体0.2g,则黄铜中铜的质量分数是多少?(写出计算过程)
(2).小婷同学另取10g黄铜于烧杯中,将120g稀硫酸分六次加入烧杯中,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表:
次数 一 二 三 四 五 六
加入稀硫酸的质量/g 20 20 20 20 20 20
烧杯中剩余物的质量/g 29.96 49.92 m 89.84 109.8 129.8
①表中m= 。
②请在下图画出10g黄铜加入稀硫酸与生成氢气的质量的图象 。
答案部分
一、单选题
1.【答案】 C
2.【答案】 D
3.【答案】 B
4.【答案】 A
5.【答案】 D
6.【答案】 C
7.【答案】 C
8.【答案】 D
9.【答案】 D
10.【答案】 D
11.【答案】 D
12.【答案】 A
13.【答案】 D
二、多选题
14.【答案】 B,C
15.【答案】 A,D
16.【答案】 B,D
17.【答案】 A,D
三、综合题
18.【答案】 (1)混合;化合物
(2)0.88g
19.【答案】 (1)管口未放棉花;防止水槽中的水倒流炸裂试管
(2);将一带火星的木条放在集气瓶口
(3)D
(4)氧气不易溶于水,能支持燃烧
(5)先将集气瓶充满水,将气体从a管通入
(6)48:5;12.25g;
20.【答案】 (1)水分子之间的间隔变大;可溶性钙镁化合物;浮渣
(2);28:9
(3)b;2:1;1:16
21.【答案】 (1)Zn + H2SO4 = ZnSO4 + H2↑;是
(2)0.2
22.【答案】 (1)解:设参与反应的锌的质量为x,
Zn+H2SO4=ZnSO4+ H2↑
65 2
x 0.2g
解得:x=6.5g
则样品中铜的质量分数为: ×100%=35%
答:该样品中铜的质量分数为35%
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
(2)69.88;
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
