第2章 物质转化与材料利用(置换反应)专题复习(课件 18张PPT)
文档属性
| 名称 | 第2章 物质转化与材料利用(置换反应)专题复习(课件 18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-11-10 10:46:23 | ||
图片预览




文档简介
(共18张PPT)
置换反应专题复习
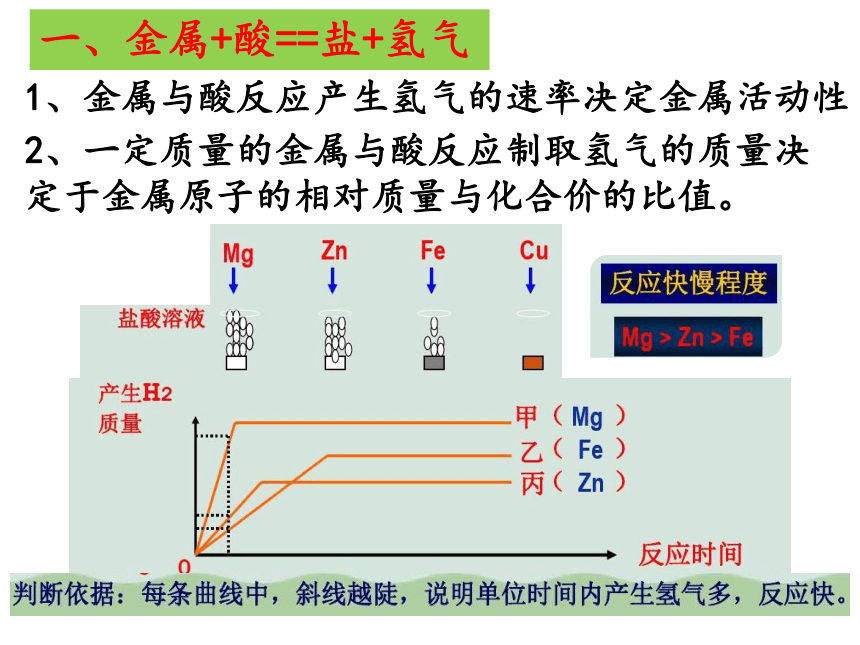
一、金属+酸==盐+氢气
1、金属与酸反应产生氢气的速率决定金属活动性
2、一定质量的金属与酸反应制取氢气的质量决定于金属原子的相对质量与化合价的比值。
3、一定质量的酸与足量的不同金属反应产生氢气的质量决定于酸中氢元素的质量,所以产生的氢气质量一样多。
1、实验室有两瓶丢失标签的试剂,分别是铁粉和锌粉。帅帅将等质量的两种粉末分别与足量的溶质质量分数相同且等质量的稀硫酸充分反应。他将产生氢气的质量与时间的关系用图表示出来。请回答下列问题:
(1)a表示的物质是_______(填化学式),原因是:_____________________________________。
(2)在反应中消耗硫酸质量的大小关系:Zn____Fe(填<、>、=)。
Zn
Zn的活动性比Fe强,和硫酸反应速率快,所用时间短
<
例题讲解
2、现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量的稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。
(1)相对原子质量:_____________;(2)生成氢气的质量:____________;(3)金属活动性:______________;(4)消耗硫酸的质量:____________。
丙>乙>甲
甲>乙>丙
乙>甲>丙
甲>乙>丙
变式1:两个烧杯中装有等质量的金属铝和镁,然后分别逐渐加入同浓度的稀盐酸,产生氢气的质量与加入盐酸的质量关系如图所示。下列说法正确的是( )
A.该图反映出镁比铝的金属活动性强
B.a点时,两个烧杯中都有金属剩余
C.b点时,两个烧杯中产生氢气的质量相同
D.c点时,两个烧杯中的酸都恰好完全反应
B
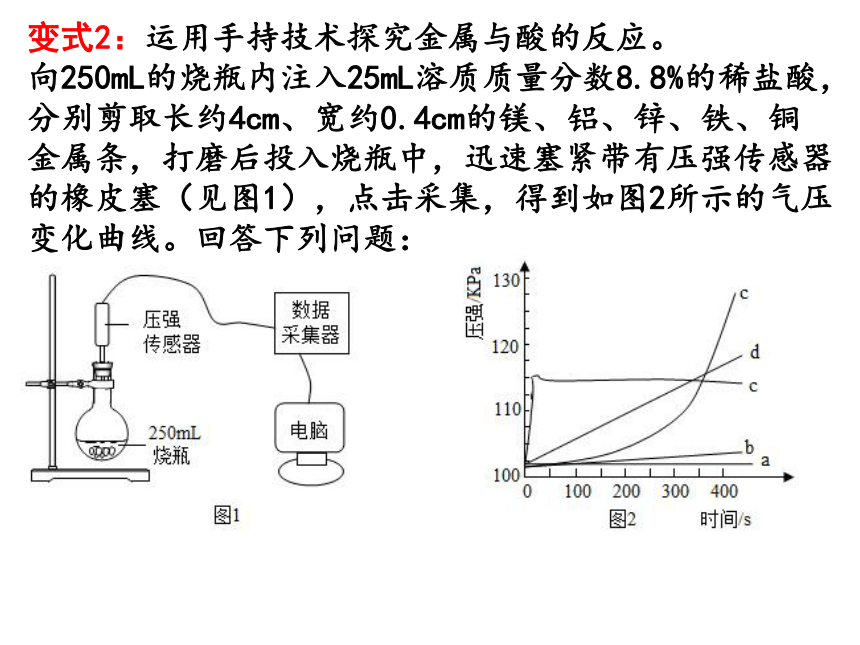
变式2:运用手持技术探究金属与酸的反应。
向250mL的烧瓶内注入25mL溶质质量分数8.8%的稀盐酸,分别剪取长约4cm、宽约0.4cm的镁、铝、锌、铁、铜金属条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图1),点击采集,得到如图2所示的气压变化曲线。回答下列问题:
(1)曲线a对应的金属是______。
(2)曲线b对应的金属是铁,反应的化学方程式为_____________________。
(3)曲线c在18s左右达到最高点后又略微下降的原因是___________________________________________。
(4)下列说法错误的是________。
A.d对应的反应速率适中,适合实验室制取气体
B.如延长反应时间,可得到d的图象是一条直线
C.从0~100s图象可推测e对应的金属打磨不彻底
D.从250-450s图象推测e反应时盐酸浓度在变大
铜
Fe+2HCl=FeCl2+H2↑
镁与稀盐酸反应放热,在18s反应结束,温度降低
BD
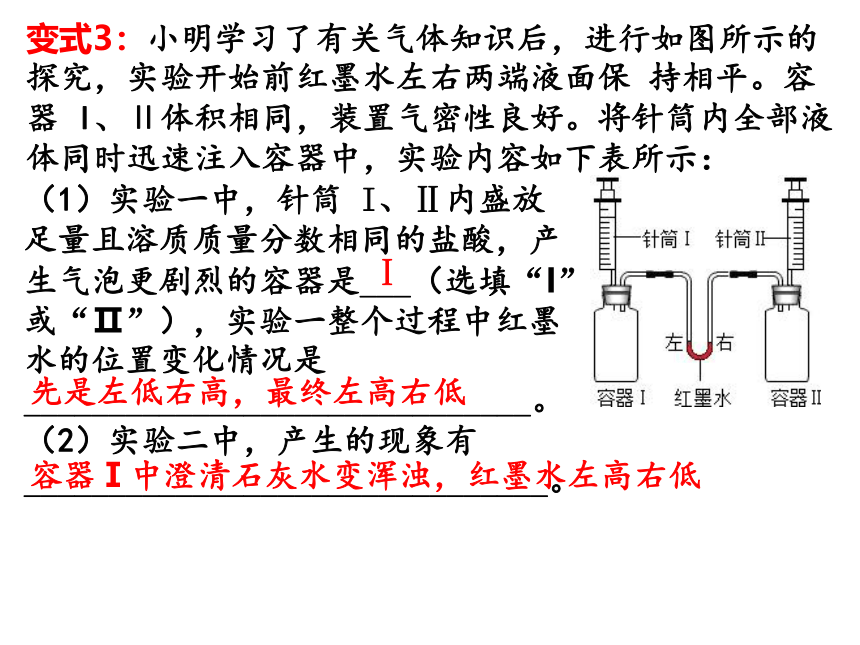
变式3:小明学习了有关气体知识后,进行如图所示的探究,实验开始前红墨水左右两端液面保 持相平。容器 I、Ⅱ体积相同,装置气密性良好。将针筒内全部液体同时迅速注入容器中,实验内容如下表所示:
(1)实验一中,针筒 I、Ⅱ内盛放足量且溶质质量分数相同的盐酸,产生气泡更剧烈的容器是___(选填“I”或“Ⅱ”),实验一整个过程中红墨水的位置变化情况是______________________________。
(2)实验二中,产生的现象有_______________________________。
Ⅰ
先是左低右高,最终左高右低
容器Ⅰ中澄清石灰水变浑浊,红墨水左高右低
二、金属+盐溶液==新金属+新盐溶液
类型一:一种金属与多种盐溶液反应。
1、向Cu(NO3)2、AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,发现没有气泡产生。则滤渣中一定含有的物质是_______。
Ag
2、向AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,滤液呈蓝色。下列说法正确的是( ) A、滤液中可能有Fe(NO3)2、Mg(NO3)2、Cu(NO3)2 B、向滤渣中加入稀盐酸,可能有气泡产生 C、与原溶液相比滤液的质量可能增大 D、向滤液中滴入稀盐酸,可能会有白色沉淀出现
D
类型二:几种不同的金属放入同一盐溶液中反应
1、向AgNO3溶液中加入一定质量Cu和Zn的混合物,充分反应后过滤得到无色溶液和滤渣。下列说法正确的是 A、反应后所得的溶液中一定含有Zn(NO3)2,一定不含Cu(NO3)2和AgNO3 ( )B、反应后所得的溶液中一定含有Zn(NO3)2,可能含有Cu(NO3)2和AgNO3 C、反应后所得的滤渣中一定含有Ag,一定不含Cu、Zn D、反应后所得的滤渣中一定含有Cu,可能含Ag、Zn
A
2、同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量AgNO3溶液的烧杯中,充分反应后过滤,得到滤液和滤渣。 (1)若将所得滤渣放入到稀盐酸中,有气泡产生。则:①滤液中一定含有________;可能含有_________. ②滤渣中一定含有________;可能含有______。 (2)若反应后所得滤液呈无色,则滤渣中一定有_____.(3)反应后所得滤液的溶质质量分数_______(填“大于”、“小于”、“等于”)原AgNO3溶液的溶质质量分数。
Zn(NO3)2
Fe(NO3)2
Ag、Fe
Zn
Ag、Fe
小于
类型三:几种不同的金属放入不同盐溶液中反应
1、向AgNO3、Cu(NO3)2混合液中加入一定量的Zn、Fe和Cu的混合粉末,充分反应后,过滤、洗涤得到滤渣和滤液。下列说法正确的有( ) ①滤渣中一定有Ag;滤液中可能有Fe(NO3)2、Cu(NO3)3、AgNO3; ②当滤液为蓝色时,滤渣中一定有Cu、Ag,一定没有 Zn、Fe ③向滤渣中加入盐酸,有气泡产生,则滤渣中一定有Fe、Cu、Ag,可能有Zn ④向滤液中加入KCl溶液,无明显现象,则滤液中一定有Zn(NO3)2,可能有Fe(NO3)2、Cu(NO3)2,滤渣中可能有Zn、Fe、Cu A、1种 B、2种 C、3种 D、4种
C
2、小王为比较Mg、Fe、Cu三种金属的活动性顺序,进行如图甲所示的实验,实验后把两试管中的物质倒入烧杯中(如图乙),发现烧杯内的红色固体明显增多,充分反应后过滤,滤液中含有的金属离子可能的组成有①Mg2+;②Mg2+和Fe2+; ③Mg2+和Cu2+; ④Mg2+、Fe2+和Cu2+ ( ) A、①② B、①③ C、②④ D、③④
C
3、某同学为了探究相关金属的化学性质,做了下列实验:
(1)A试管中实验现象是_______(填序号)。
A.溶液由蓝色逐渐变无色 B.锌片表面析出红色物质
C.产生大量气泡
该反应结束后,溶液质量_______(填增加、减小或不变)。
(2)只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明,补充实验所用试剂合理的是___(填编号)
A.Cu、Ag、稀盐酸 B.Cu、AgNO3溶液
(3)实验C中物质充分反应后,某同学对试管中固体的成分提出以下四种猜想:
A.Zn、Cu、Ag B.Zn、Cu C.Cu、Ag D.Ag 这四种猜想中明显不合理的是________(填编号)。
AB
增加
B
B
4、某兴趣小组根据铁、铜、银三种金属的活动性依次减弱的规律。在进行实验验证时,将铁粉加入到盛有硝酸银和硝酸铜的混合溶液的烧杯中,待充分反应后过滤,得到滤渣和滤液。实验结果有图1、图2两种情况。请回答下列问题:(资料:常见的不溶于酸的白色沉淀有AgCl、BaSO4)
(1)图1是向滤液中加入稀盐酸,观察到有白色沉淀产生。
①滤液颜色的变化情况是________________________,则滤液中一定含有的溶质为______________________。
②写出产生白色沉淀的化学反应方程式_______________________。
蓝色和浅绿色的混合色
Fe(NO3)2、Cu(NO3)2、AgNO3
AgNO3+HCl═AgCl↓+HNO3
(2)图2是向滤渣中加入稀盐酸,观察到有无色气体产生
①滤渣中一定含有____________(填化学式,下同)。
②滤液颜色是_______,则滤液中含有的离子__________(填离子符号)。
Ag、Cu、Fe
浅绿色
Fe2+、NO3-
5、某金属(用R表示)能与盐酸发生置换反应,其金属活动性弱于Zn,相对原子质量小于65.向一定质量的AgNO3、Cu(NO3)2和R(NO3)2混合溶液中加入Zn,充分反应后过滤,得到固体和溶液。向所得到的固体上滴加盐酸时有气泡产生。
(1)写出R与盐酸反应的化学方程式。
(2)所得到的固体中一定含有哪些金属?
(3)所得到的溶液的质量与原混合溶液的质量相比,可能增大,其原因是什么?
R+2HCl=RCl2+H2↑
Ag、Cu、R
锌与硝酸银溶液反应,溶液质量减小;锌与硝酸铜、R(NO3)2溶液反应,溶液质量增大,如果后两个反应进行的比较多,则所得到的溶液的质量与原混合溶液的质量相比,可能增大。
6、图为铜片A的系列变化,据图回答问题:
(1)若方法1中的X物质为常见气体,且发生置换反应,
则X是_____(填化学式);
(2)写出方法2的化学方程式_____________________;
(3)铜片A、铜片B、铜片C的质量分别为mA、mB、mC,
其中方法1和方法2均完全反应,则mA、mB、mC的
大小关系为_____________.
H2
CuO+H2SO4=CuSO4+H2O
mA=mB>mC
7、某化学兴趣小组的同学在进行“活泼金属与酸的反应”实验时,对铝和铝的化合物的性质进行了探究。
【查阅资料】铝是一种活泼金属,在空气中表现出良好的抗腐蚀性,是由于铝与氧气作用形成一层致密的氧化膜覆盖在铝的表面。
【性质探究】(1)金属的活动性:甲同学将用砂纸打磨过的铝片放入氯化镁溶液中,看到的现象是________,说明铝的金属活动性排在镁的_________。
无现象
后面
(2)金属与酸的反应:①铝片与稀硫酸反应产生氢气的速度与时间的关系如图1所示,单质铝与稀硫酸反应的化学方程式为__________________________________。图中从a点到c点曲线上升的原因可能是__________________________________。
②将铝片与pH相同的足量稀硫酸、稀盐酸反应,结果是生成氢气的速度前者比后者慢很多。甲同学认为,可能是两片铝片的大小、质地等不一致的原因,于是将某铝片从中间切成两等份,再分别放入pH相同的稀硫酸和稀盐酸中,观察反应现象,结果仍是生成氢气的速度前者比后者慢得多。此实验方法是_________________。
乙同学提出,可能是与稀硫酸反应的铝片表面有氧化膜的原因,大家一致表示反对,因为_________________________________。
丙同学对比盐酸和硫酸的化学式之后,认为可能是盐酸中的氯离子对反应产生促进作用,你认为还存在另一种可能是__________________________________。
【验证猜想】为了验证是“盐酸中的氯离子对反应产生促进作用”的猜想,大家一起设计了如图2所示的实验。如果该实验能证明猜想,则加入的两种溶液的溶质化学式分别为A____________,B_______________.
2Al+3 H2SO4═Al2(SO4)3+3H2↑
随着反应的进行,温度升高,加快了反应的速度
控制变量法
与盐酸反应的铝片表面也有氧化膜
硫酸根离子对反应有抑制作用
NaCl
Na2SO4
置换反应专题复习
一、金属+酸==盐+氢气
1、金属与酸反应产生氢气的速率决定金属活动性
2、一定质量的金属与酸反应制取氢气的质量决定于金属原子的相对质量与化合价的比值。
3、一定质量的酸与足量的不同金属反应产生氢气的质量决定于酸中氢元素的质量,所以产生的氢气质量一样多。
1、实验室有两瓶丢失标签的试剂,分别是铁粉和锌粉。帅帅将等质量的两种粉末分别与足量的溶质质量分数相同且等质量的稀硫酸充分反应。他将产生氢气的质量与时间的关系用图表示出来。请回答下列问题:
(1)a表示的物质是_______(填化学式),原因是:_____________________________________。
(2)在反应中消耗硫酸质量的大小关系:Zn____Fe(填<、>、=)。
Zn
Zn的活动性比Fe强,和硫酸反应速率快,所用时间短
<
例题讲解
2、现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量的稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。
(1)相对原子质量:_____________;(2)生成氢气的质量:____________;(3)金属活动性:______________;(4)消耗硫酸的质量:____________。
丙>乙>甲
甲>乙>丙
乙>甲>丙
甲>乙>丙
变式1:两个烧杯中装有等质量的金属铝和镁,然后分别逐渐加入同浓度的稀盐酸,产生氢气的质量与加入盐酸的质量关系如图所示。下列说法正确的是( )
A.该图反映出镁比铝的金属活动性强
B.a点时,两个烧杯中都有金属剩余
C.b点时,两个烧杯中产生氢气的质量相同
D.c点时,两个烧杯中的酸都恰好完全反应
B
变式2:运用手持技术探究金属与酸的反应。
向250mL的烧瓶内注入25mL溶质质量分数8.8%的稀盐酸,分别剪取长约4cm、宽约0.4cm的镁、铝、锌、铁、铜金属条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图1),点击采集,得到如图2所示的气压变化曲线。回答下列问题:
(1)曲线a对应的金属是______。
(2)曲线b对应的金属是铁,反应的化学方程式为_____________________。
(3)曲线c在18s左右达到最高点后又略微下降的原因是___________________________________________。
(4)下列说法错误的是________。
A.d对应的反应速率适中,适合实验室制取气体
B.如延长反应时间,可得到d的图象是一条直线
C.从0~100s图象可推测e对应的金属打磨不彻底
D.从250-450s图象推测e反应时盐酸浓度在变大
铜
Fe+2HCl=FeCl2+H2↑
镁与稀盐酸反应放热,在18s反应结束,温度降低
BD
变式3:小明学习了有关气体知识后,进行如图所示的探究,实验开始前红墨水左右两端液面保 持相平。容器 I、Ⅱ体积相同,装置气密性良好。将针筒内全部液体同时迅速注入容器中,实验内容如下表所示:
(1)实验一中,针筒 I、Ⅱ内盛放足量且溶质质量分数相同的盐酸,产生气泡更剧烈的容器是___(选填“I”或“Ⅱ”),实验一整个过程中红墨水的位置变化情况是______________________________。
(2)实验二中,产生的现象有_______________________________。
Ⅰ
先是左低右高,最终左高右低
容器Ⅰ中澄清石灰水变浑浊,红墨水左高右低
二、金属+盐溶液==新金属+新盐溶液
类型一:一种金属与多种盐溶液反应。
1、向Cu(NO3)2、AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,发现没有气泡产生。则滤渣中一定含有的物质是_______。
Ag
2、向AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,滤液呈蓝色。下列说法正确的是( ) A、滤液中可能有Fe(NO3)2、Mg(NO3)2、Cu(NO3)2 B、向滤渣中加入稀盐酸,可能有气泡产生 C、与原溶液相比滤液的质量可能增大 D、向滤液中滴入稀盐酸,可能会有白色沉淀出现
D
类型二:几种不同的金属放入同一盐溶液中反应
1、向AgNO3溶液中加入一定质量Cu和Zn的混合物,充分反应后过滤得到无色溶液和滤渣。下列说法正确的是 A、反应后所得的溶液中一定含有Zn(NO3)2,一定不含Cu(NO3)2和AgNO3 ( )B、反应后所得的溶液中一定含有Zn(NO3)2,可能含有Cu(NO3)2和AgNO3 C、反应后所得的滤渣中一定含有Ag,一定不含Cu、Zn D、反应后所得的滤渣中一定含有Cu,可能含Ag、Zn
A
2、同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量AgNO3溶液的烧杯中,充分反应后过滤,得到滤液和滤渣。 (1)若将所得滤渣放入到稀盐酸中,有气泡产生。则:①滤液中一定含有________;可能含有_________. ②滤渣中一定含有________;可能含有______。 (2)若反应后所得滤液呈无色,则滤渣中一定有_____.(3)反应后所得滤液的溶质质量分数_______(填“大于”、“小于”、“等于”)原AgNO3溶液的溶质质量分数。
Zn(NO3)2
Fe(NO3)2
Ag、Fe
Zn
Ag、Fe
小于
类型三:几种不同的金属放入不同盐溶液中反应
1、向AgNO3、Cu(NO3)2混合液中加入一定量的Zn、Fe和Cu的混合粉末,充分反应后,过滤、洗涤得到滤渣和滤液。下列说法正确的有( ) ①滤渣中一定有Ag;滤液中可能有Fe(NO3)2、Cu(NO3)3、AgNO3; ②当滤液为蓝色时,滤渣中一定有Cu、Ag,一定没有 Zn、Fe ③向滤渣中加入盐酸,有气泡产生,则滤渣中一定有Fe、Cu、Ag,可能有Zn ④向滤液中加入KCl溶液,无明显现象,则滤液中一定有Zn(NO3)2,可能有Fe(NO3)2、Cu(NO3)2,滤渣中可能有Zn、Fe、Cu A、1种 B、2种 C、3种 D、4种
C
2、小王为比较Mg、Fe、Cu三种金属的活动性顺序,进行如图甲所示的实验,实验后把两试管中的物质倒入烧杯中(如图乙),发现烧杯内的红色固体明显增多,充分反应后过滤,滤液中含有的金属离子可能的组成有①Mg2+;②Mg2+和Fe2+; ③Mg2+和Cu2+; ④Mg2+、Fe2+和Cu2+ ( ) A、①② B、①③ C、②④ D、③④
C
3、某同学为了探究相关金属的化学性质,做了下列实验:
(1)A试管中实验现象是_______(填序号)。
A.溶液由蓝色逐渐变无色 B.锌片表面析出红色物质
C.产生大量气泡
该反应结束后,溶液质量_______(填增加、减小或不变)。
(2)只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明,补充实验所用试剂合理的是___(填编号)
A.Cu、Ag、稀盐酸 B.Cu、AgNO3溶液
(3)实验C中物质充分反应后,某同学对试管中固体的成分提出以下四种猜想:
A.Zn、Cu、Ag B.Zn、Cu C.Cu、Ag D.Ag 这四种猜想中明显不合理的是________(填编号)。
AB
增加
B
B
4、某兴趣小组根据铁、铜、银三种金属的活动性依次减弱的规律。在进行实验验证时,将铁粉加入到盛有硝酸银和硝酸铜的混合溶液的烧杯中,待充分反应后过滤,得到滤渣和滤液。实验结果有图1、图2两种情况。请回答下列问题:(资料:常见的不溶于酸的白色沉淀有AgCl、BaSO4)
(1)图1是向滤液中加入稀盐酸,观察到有白色沉淀产生。
①滤液颜色的变化情况是________________________,则滤液中一定含有的溶质为______________________。
②写出产生白色沉淀的化学反应方程式_______________________。
蓝色和浅绿色的混合色
Fe(NO3)2、Cu(NO3)2、AgNO3
AgNO3+HCl═AgCl↓+HNO3
(2)图2是向滤渣中加入稀盐酸,观察到有无色气体产生
①滤渣中一定含有____________(填化学式,下同)。
②滤液颜色是_______,则滤液中含有的离子__________(填离子符号)。
Ag、Cu、Fe
浅绿色
Fe2+、NO3-
5、某金属(用R表示)能与盐酸发生置换反应,其金属活动性弱于Zn,相对原子质量小于65.向一定质量的AgNO3、Cu(NO3)2和R(NO3)2混合溶液中加入Zn,充分反应后过滤,得到固体和溶液。向所得到的固体上滴加盐酸时有气泡产生。
(1)写出R与盐酸反应的化学方程式。
(2)所得到的固体中一定含有哪些金属?
(3)所得到的溶液的质量与原混合溶液的质量相比,可能增大,其原因是什么?
R+2HCl=RCl2+H2↑
Ag、Cu、R
锌与硝酸银溶液反应,溶液质量减小;锌与硝酸铜、R(NO3)2溶液反应,溶液质量增大,如果后两个反应进行的比较多,则所得到的溶液的质量与原混合溶液的质量相比,可能增大。
6、图为铜片A的系列变化,据图回答问题:
(1)若方法1中的X物质为常见气体,且发生置换反应,
则X是_____(填化学式);
(2)写出方法2的化学方程式_____________________;
(3)铜片A、铜片B、铜片C的质量分别为mA、mB、mC,
其中方法1和方法2均完全反应,则mA、mB、mC的
大小关系为_____________.
H2
CuO+H2SO4=CuSO4+H2O
mA=mB>mC
7、某化学兴趣小组的同学在进行“活泼金属与酸的反应”实验时,对铝和铝的化合物的性质进行了探究。
【查阅资料】铝是一种活泼金属,在空气中表现出良好的抗腐蚀性,是由于铝与氧气作用形成一层致密的氧化膜覆盖在铝的表面。
【性质探究】(1)金属的活动性:甲同学将用砂纸打磨过的铝片放入氯化镁溶液中,看到的现象是________,说明铝的金属活动性排在镁的_________。
无现象
后面
(2)金属与酸的反应:①铝片与稀硫酸反应产生氢气的速度与时间的关系如图1所示,单质铝与稀硫酸反应的化学方程式为__________________________________。图中从a点到c点曲线上升的原因可能是__________________________________。
②将铝片与pH相同的足量稀硫酸、稀盐酸反应,结果是生成氢气的速度前者比后者慢很多。甲同学认为,可能是两片铝片的大小、质地等不一致的原因,于是将某铝片从中间切成两等份,再分别放入pH相同的稀硫酸和稀盐酸中,观察反应现象,结果仍是生成氢气的速度前者比后者慢得多。此实验方法是_________________。
乙同学提出,可能是与稀硫酸反应的铝片表面有氧化膜的原因,大家一致表示反对,因为_________________________________。
丙同学对比盐酸和硫酸的化学式之后,认为可能是盐酸中的氯离子对反应产生促进作用,你认为还存在另一种可能是__________________________________。
【验证猜想】为了验证是“盐酸中的氯离子对反应产生促进作用”的猜想,大家一起设计了如图2所示的实验。如果该实验能证明猜想,则加入的两种溶液的溶质化学式分别为A____________,B_______________.
2Al+3 H2SO4═Al2(SO4)3+3H2↑
随着反应的进行,温度升高,加快了反应的速度
控制变量法
与盐酸反应的铝片表面也有氧化膜
硫酸根离子对反应有抑制作用
NaCl
Na2SO4
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
