2021-2022学年人教版(2019)化学必修一 3.1铁盐与亚铁盐的转化
文档属性
| 名称 | 2021-2022学年人教版(2019)化学必修一 3.1铁盐与亚铁盐的转化 |  | |
| 格式 | zip | ||
| 文件大小 | 20.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-10 09:10:50 | ||
图片预览




文档简介
(共19张PPT)
新课程人教版 必修一 第三章 第二节 几种重要的金属化合物
铁盐和亚铁盐
的转化
调制“鸡尾酒”
一、Fe3+的检验方法
请同学们分组讨论,合作探究,总结出Fe3+的检验方法。
方案二:加 NaOH溶液,生成 红褐色沉淀
方案一:观察溶液的颜色,溶液显黄色
Fe3+ + 3OH- = Fe(OH)3↓(红褐色)
方案三:加 KSCN溶液,溶液显红色
Fe3+
KSCN溶液
显红色
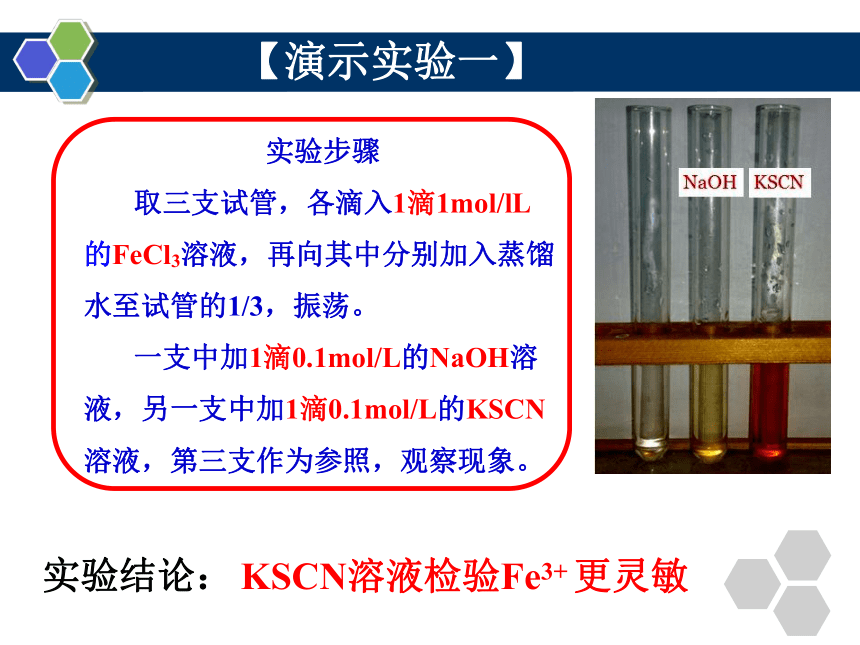
实验步骤
取三支试管,各滴入1滴1mol/lL 的FeCl3溶液,再向其中分别加入蒸馏水至试管的1/3,振荡。
一支中加1滴0.1mol/L的NaOH溶液,另一支中加1滴0.1mol/L的KSCN溶液,第三支作为参照,观察现象。
KSCN溶液检验Fe3+ 更灵敏
【演示实验一】
实验结论:
1. 原理分析(从化合价角度)
(一)Fe3+转化为Fe2+的条件
Fe3+ Fe2+
氧化性
还原剂
一、Fe3+与Fe2+的转化
Fe3+变为Fe2+ ,是化合价降低的过程,化合价降低的实质得电子了,得电子体现了Fe3+的氧化性,要实现这个过程,需要加入还原剂。
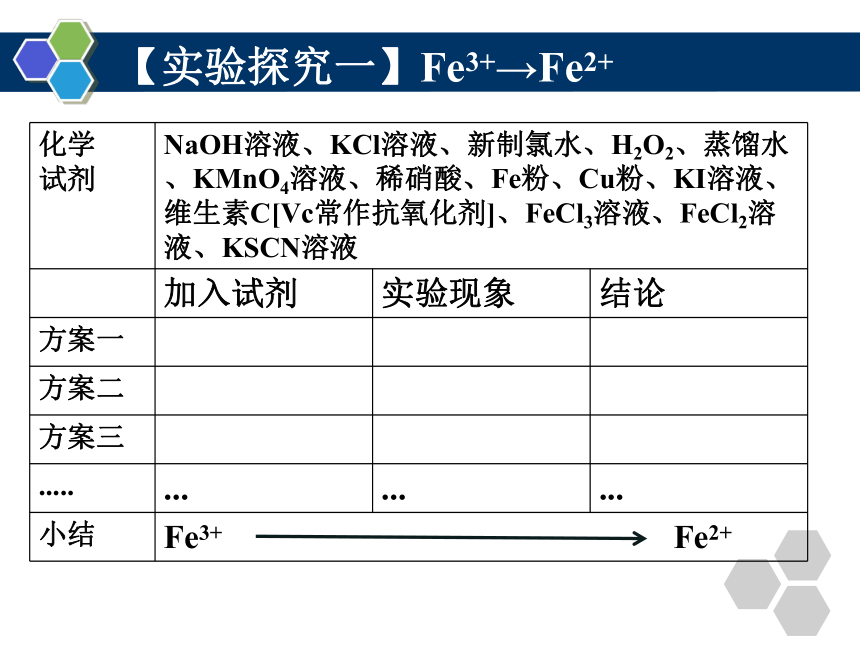
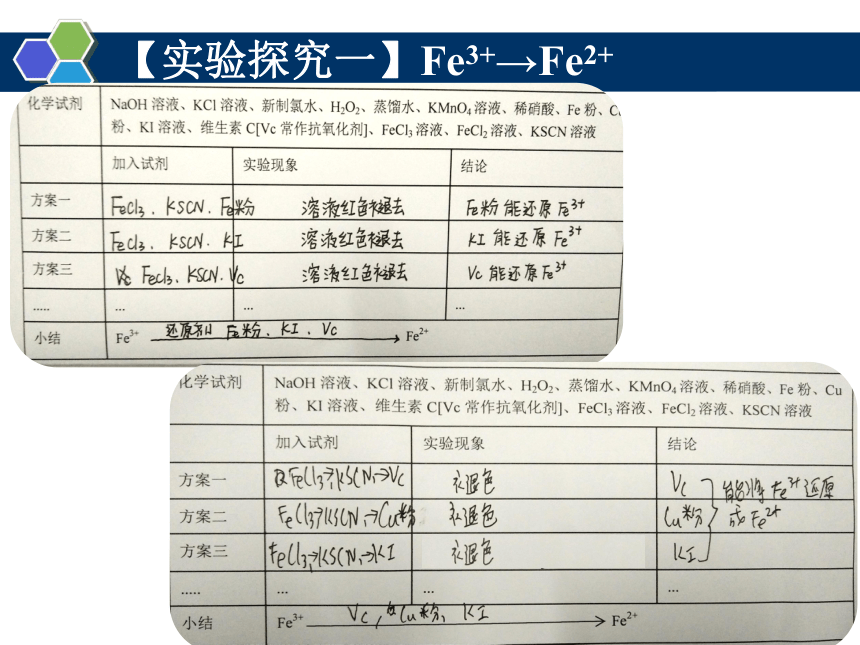
【实验探究一】Fe3+→Fe2+
化学 试剂 NaOH溶液、KCl溶液、新制氯水、H2O2、蒸馏水、KMnO4溶液、稀硝酸、Fe粉、Cu粉、KI溶液、维生素C[Vc常作抗氧化剂]、FeCl3溶液、FeCl2溶液、KSCN溶液
加入试剂 实验现象 结论
方案一
方案二
方案三
..... ... ... ...
小结 Fe3+ Fe2+
【实验探究一】Fe3+→Fe2+
1. 原理分析(从化合价角度)
Fe2+变为Fe3+ ,是化合价升高的过程,化合价升高的实质是失去电子,失电子体现了Fe2+的还原性,要实现这个过程,需要加入氧化剂。
(二)Fe2+转化为Fe3+的条件
Fe2+ Fe3+
还原性
氧化剂
一、Fe3+与Fe2+的转化
【实验探究二】Fe2+→Fe3+
化学 试剂 NaOH溶液、KCl溶液、新制氯水、H2O2、蒸馏水、KMnO4溶液、稀硝酸、Fe粉、Cu粉、KI溶液、维生素C[Vc常作抗氧化剂]、FeCl3溶液、FeCl2溶液、KSCN溶液
加入试剂 实验现象 结论
方案一
方案二
方案三
..... ... ... ...
小结 Fe2+ Fe3+
一、Fe3+与Fe2+的转化
合理!
不合理!
氧化剂
Cl2、H2O2、HNO3、KMnO4
一、Fe3+与Fe2+的转化
检验Fe2+
待测液
①KSCN试剂
无现象
②氧化剂
溶液变
为血红色
“鸡尾酒”解密
白酒KSCN
黄酒FeCl3
红酒
Fe(SCN)3
柠檬
Vc
Fe2+
白酒
H2O2
红酒
Fe(SCN)3
氢氧化亚铁的制备
氢氧化钠溶液
硫酸亚铁溶液
氢氧化亚铁的制备
①
②
①胶头滴管伸入液面下
②加密度小于水的苯形成液封
③新制备的FeSO4,氢气充满整个装置,
形成无氧环境
③
氢氧化亚铁的制备
要点:隔绝空气中氧气
2Fe3+ +Cu = 2Fe2+ + Cu2+
学以致用——印刷电路版原理
密封保存,加入铁粉
2Fe3++Fe= 3Fe2+
学以致用——配制保存Fe2+溶液
课后思考?
作业
1、阅读课本62页资料卡片并完成实践活动。
2、在作业本上完成课本63页习题的第10、12题
新课程人教版 必修一 第三章 第二节 几种重要的金属化合物
铁盐和亚铁盐
的转化
调制“鸡尾酒”
一、Fe3+的检验方法
请同学们分组讨论,合作探究,总结出Fe3+的检验方法。
方案二:加 NaOH溶液,生成 红褐色沉淀
方案一:观察溶液的颜色,溶液显黄色
Fe3+ + 3OH- = Fe(OH)3↓(红褐色)
方案三:加 KSCN溶液,溶液显红色
Fe3+
KSCN溶液
显红色
实验步骤
取三支试管,各滴入1滴1mol/lL 的FeCl3溶液,再向其中分别加入蒸馏水至试管的1/3,振荡。
一支中加1滴0.1mol/L的NaOH溶液,另一支中加1滴0.1mol/L的KSCN溶液,第三支作为参照,观察现象。
KSCN溶液检验Fe3+ 更灵敏
【演示实验一】
实验结论:
1. 原理分析(从化合价角度)
(一)Fe3+转化为Fe2+的条件
Fe3+ Fe2+
氧化性
还原剂
一、Fe3+与Fe2+的转化
Fe3+变为Fe2+ ,是化合价降低的过程,化合价降低的实质得电子了,得电子体现了Fe3+的氧化性,要实现这个过程,需要加入还原剂。
【实验探究一】Fe3+→Fe2+
化学 试剂 NaOH溶液、KCl溶液、新制氯水、H2O2、蒸馏水、KMnO4溶液、稀硝酸、Fe粉、Cu粉、KI溶液、维生素C[Vc常作抗氧化剂]、FeCl3溶液、FeCl2溶液、KSCN溶液
加入试剂 实验现象 结论
方案一
方案二
方案三
..... ... ... ...
小结 Fe3+ Fe2+
【实验探究一】Fe3+→Fe2+
1. 原理分析(从化合价角度)
Fe2+变为Fe3+ ,是化合价升高的过程,化合价升高的实质是失去电子,失电子体现了Fe2+的还原性,要实现这个过程,需要加入氧化剂。
(二)Fe2+转化为Fe3+的条件
Fe2+ Fe3+
还原性
氧化剂
一、Fe3+与Fe2+的转化
【实验探究二】Fe2+→Fe3+
化学 试剂 NaOH溶液、KCl溶液、新制氯水、H2O2、蒸馏水、KMnO4溶液、稀硝酸、Fe粉、Cu粉、KI溶液、维生素C[Vc常作抗氧化剂]、FeCl3溶液、FeCl2溶液、KSCN溶液
加入试剂 实验现象 结论
方案一
方案二
方案三
..... ... ... ...
小结 Fe2+ Fe3+
一、Fe3+与Fe2+的转化
合理!
不合理!
氧化剂
Cl2、H2O2、HNO3、KMnO4
一、Fe3+与Fe2+的转化
检验Fe2+
待测液
①KSCN试剂
无现象
②氧化剂
溶液变
为血红色
“鸡尾酒”解密
白酒KSCN
黄酒FeCl3
红酒
Fe(SCN)3
柠檬
Vc
Fe2+
白酒
H2O2
红酒
Fe(SCN)3
氢氧化亚铁的制备
氢氧化钠溶液
硫酸亚铁溶液
氢氧化亚铁的制备
①
②
①胶头滴管伸入液面下
②加密度小于水的苯形成液封
③新制备的FeSO4,氢气充满整个装置,
形成无氧环境
③
氢氧化亚铁的制备
要点:隔绝空气中氧气
2Fe3+ +Cu = 2Fe2+ + Cu2+
学以致用——印刷电路版原理
密封保存,加入铁粉
2Fe3++Fe= 3Fe2+
学以致用——配制保存Fe2+溶液
课后思考?
作业
1、阅读课本62页资料卡片并完成实践活动。
2、在作业本上完成课本63页习题的第10、12题
