第一节化学实验基本方法练习课
文档属性
| 名称 | 第一节化学实验基本方法练习课 |  | |
| 格式 | zip | ||
| 文件大小 | 14.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-17 10:23:26 | ||
图片预览





文档简介
(共14张PPT)
第一节 化学实验基本方法
课堂练习
一、单项选择题
1.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
C
2.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
B
3.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是:
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3) 2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
B
4.用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是
A.形成较多的白色沉淀 B.形成的沉淀纯度更高
C.排除SO42 -以外的其它阴离子及Ag+的干扰
D.排除Ba2+以外的其它阳离子的干扰
C
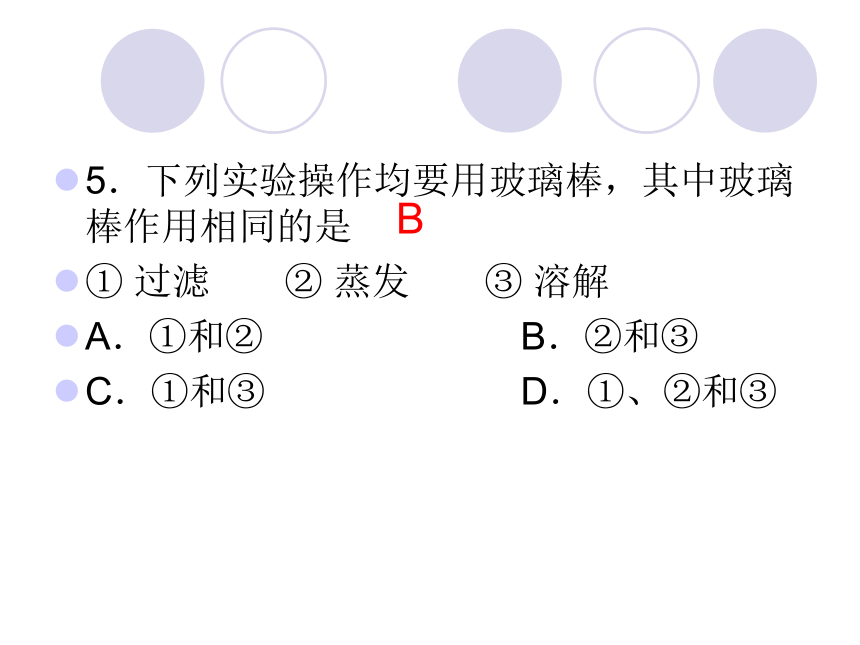
5.下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是
① 过滤 ② 蒸发 ③ 溶解
A.①和② B.②和③
C.①和③ D.①、②和③
B
6.欲萃取碘水中的I2 ,不能作为萃取剂的是
A.酒精 B.苯 C.CCl4 D.汽油
A
二、双项选择题
7.下列离子检验不正确的是
A.某溶液中滴入稀盐酸酸化,再滴入氯化钡溶液,生成白色沉淀,说明原溶液中有SO42-
B.某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl -
C.某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有CO32 -
D.某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
BC
8.选择下列实验方法分离物质,将分离方法的括号填在横线上。
A.萃取分液 B.过滤 C.结晶 D.分液 E.蒸馏
(1)分离饱和食盐水与沙子的混合物。( )
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾。( )
(3)分离水和汽油的混合物。( )
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。( )
B
C
D
E
9.为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
①
③
④
⑤
⑥
⑦
(1)判断BaCl2已过量的方法是
。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
。
称取粗盐
溶解
②
BaCl2
NaOH
Na2CO3
过滤
滤液
适量盐酸
蒸发、结晶、烘干
粗盐
(1)取第②步后的上层清液1~2滴于滴定板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
(2)CaCl2 + Na2CO3 = CaCO3↓+2NaCl; BaCl2 + Na2CO3 = BaCO3↓+2NaCl
(3)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
10.已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤1的主要操作是 ,需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,
固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是
。
工业
废水
步骤1
泥污
澄清
溶液
步骤2
Hg
固体残渣
CuSO4溶液
步骤3
CuSO4·5H2O
10.
(1)过滤, 漏斗、玻璃棒
(2)Cu, Ag、Cu
(3)冷却结晶
(4)因为Hg有挥发性,且有毒。
第一节 化学实验基本方法
课堂练习
一、单项选择题
1.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
C
2.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
B
3.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是:
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3) 2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
B
4.用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是
A.形成较多的白色沉淀 B.形成的沉淀纯度更高
C.排除SO42 -以外的其它阴离子及Ag+的干扰
D.排除Ba2+以外的其它阳离子的干扰
C
5.下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是
① 过滤 ② 蒸发 ③ 溶解
A.①和② B.②和③
C.①和③ D.①、②和③
B
6.欲萃取碘水中的I2 ,不能作为萃取剂的是
A.酒精 B.苯 C.CCl4 D.汽油
A
二、双项选择题
7.下列离子检验不正确的是
A.某溶液中滴入稀盐酸酸化,再滴入氯化钡溶液,生成白色沉淀,说明原溶液中有SO42-
B.某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl -
C.某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有CO32 -
D.某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
BC
8.选择下列实验方法分离物质,将分离方法的括号填在横线上。
A.萃取分液 B.过滤 C.结晶 D.分液 E.蒸馏
(1)分离饱和食盐水与沙子的混合物。( )
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾。( )
(3)分离水和汽油的混合物。( )
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。( )
B
C
D
E
9.为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
①
③
④
⑤
⑥
⑦
(1)判断BaCl2已过量的方法是
。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
。
称取粗盐
溶解
②
BaCl2
NaOH
Na2CO3
过滤
滤液
适量盐酸
蒸发、结晶、烘干
粗盐
(1)取第②步后的上层清液1~2滴于滴定板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
(2)CaCl2 + Na2CO3 = CaCO3↓+2NaCl; BaCl2 + Na2CO3 = BaCO3↓+2NaCl
(3)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
10.已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤1的主要操作是 ,需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,
固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是
。
工业
废水
步骤1
泥污
澄清
溶液
步骤2
Hg
固体残渣
CuSO4溶液
步骤3
CuSO4·5H2O
10.
(1)过滤, 漏斗、玻璃棒
(2)Cu, Ag、Cu
(3)冷却结晶
(4)因为Hg有挥发性,且有毒。
