第一节化学实验基本方法
图片预览









文档简介
(共51张PPT)
一、化学实验安全
(一)遵守实验室规则
应先预习实验,明确实验目的、
原理和方法,严禁不预习进入实验室。
应先检查实验用品是否齐全。
应严格遵守各项实验操作规程,
严禁随便地进行无关的实验,不得大声喧哗。
4.实验完毕后,应将仪器洗净,整理清洁实验台。
5.有意外事故,应及时向老师报告。
1.进实验室前,
2.进实验室后,
3.实验过程中,
1、点燃可燃性气体或对可燃性气体进行加热反应前,要做什么?如何操作?
3、制取有毒气体(Cl2、CO、SO2、H2S、NO等)时,要在什么地方进行?
如何闻气体的气味?能否用嘴尝药品的味道?
4、用加热法制取氧气并用排水法收集时,熄灭酒精灯前应先做什么?
2、如何稀释浓硫酸?
想一想,议一议
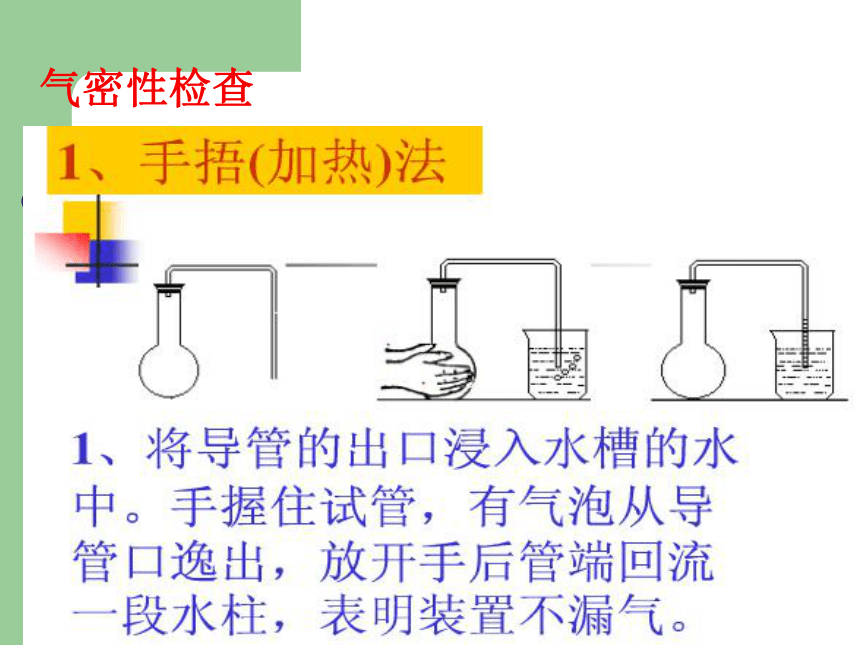
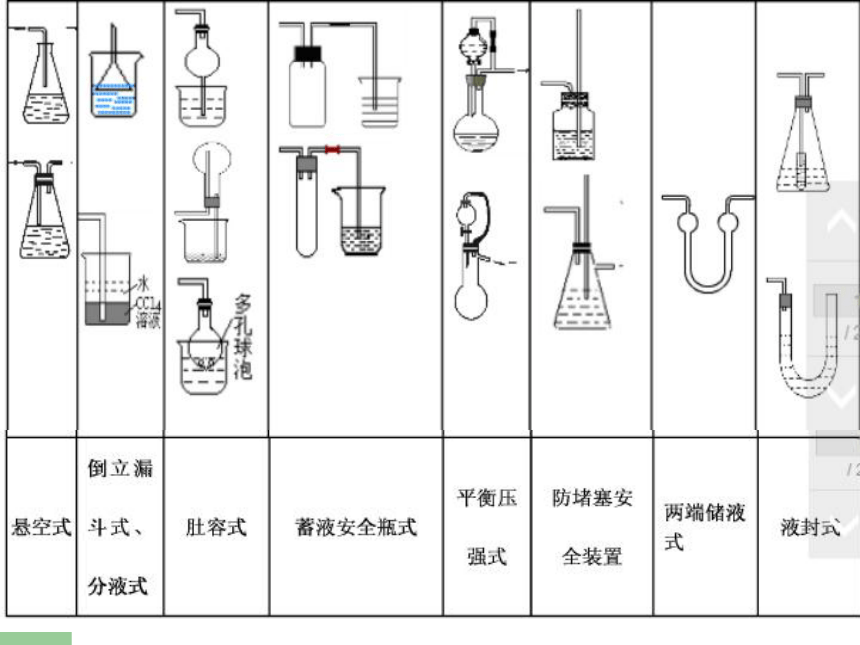
气密性检查
(二)预防事故的发生
*防爆炸:
*防暴沸:
*防失火:
点燃可燃性气体或对可燃性气体进行加热反应前,要检验气体的纯度。
实验室中的可燃物质要远离火源,检查灭火设备是否齐全
配制硫酸的水溶液时,要将浓硫酸倒入水中;
加热液体时要加沸石或碎瓷片。
用加热法制取气体并用排水法收集时,要先把导管拿出水面再移去酒精灯。
吸收溶解度较大的气体(HCl、NH3)时,加装安全瓶或漏斗。
*防倒吸:
制取有毒气体(Cl2、CO、SO2、H2S、NO等)时,要在通风橱内进行,有毒尾气要处理(灼烧、吸收、收集等)。
闻气体气味时,左手执瓶右手在瓶口轻轻扇动,让少量气体飘入鼻孔。
不能用嘴尝药品的味道。
*防中毒:
(三)、意外事故的处理
1、大量的酸、碱洒到实验台上;
2、一般的酸、碱沾到在皮肤上;
实验过程中,如果出现下列事故该如何处理?
酸洒到桌上,先加入Na2CO3至不再有气泡产生为止,再用水冲洗桌面,用抹布抹干。碱洒到桌上,先用醋酸中和,再用水冲洗桌面,用抹布抹干。
酸沾到皮肤上,先用水冲洗,再涂上3~5%的NaHCO3溶液。碱沾到皮肤上,先用水冲洗,再涂上硼酸溶液。
4、酒精灯内酒精洒到桌面上并燃烧起来。
3、浓硫酸沾到皮肤上;
先用棉花或干净的布将浓硫酸轻轻擦去,再用水冲洗,再涂上3~5%的NaHCO3溶液。
用湿抹布盖灭。
请阅读教材,危险化学品分为哪几类?标志是怎样的?你能否举例说明?
(四)、危险化学品的分类及标志
易燃气体:
易燃液体:
自燃物品:
遇湿易燃物品:
H2、CH4、CO等
有机溶剂(酒精、汽油等)
白磷
Na、K、电石(CaC2)等
浓硫酸、浓硝酸、浓盐酸、冰醋酸、NaOH固体等
氰化物(KCN)、砷的化合物(砒霜As2O3)、钡盐、
汞(Hg)、铅(Pb)等
爆炸品:
易燃品
腐蚀品:
有毒品:
氧化剂:
KMnO4、 KClO3(强氧化剂亦属爆炸品)、过氧化物(H2O2、Na2O2)等
硝酸铵(NH4NO3)、黑火药等
①药品的取用:
无用量说明时,液体1~2ml,固体只需盖满试管底部。剩余药品一般不能放回原处,也不能随意丢弃,应放入指定容器。
药品的取用 使用仪器
固体药品 粉末 药匙(或纸槽)
块状固体 镊子
一定量 托盘天平
液体药品 少量 胶头滴管
多量 用试剂瓶倾倒
一定量 量筒、滴定管等
(五)掌握正确的操作方法
药品的称量——托盘天平
(1)调零防腐
先调节天平至零点,潮湿或有腐蚀性的药品必须放在玻璃器皿中称量,其他药品可用大小一样质地相同的称量纸
(2)左物右码
左盘放称量物,右盘放砝码
(3)先大后小
用镊子取用砝码,先取质量大的,再取小的
(4)归零放盒
称量完毕,应把游码移回零处,砝码放回砝码盒
天平读数至小数点后一位。
液体的量取-----量筒
要选则合适规格的量筒,量筒要放平稳,读数时视线与凹液面的最低点平齐,读数至小数点后一位。
如果要你测量一定量液体的体积,读数时眼睛位置偏高了(俯视),读得结果比实际体积偏大还是偏小?
如果要你量取6.2mL某溶液,读数时眼睛位置偏高了(俯视),量取液体实际体积比所需体积偏大还是偏小?
酒精灯的使用:
a.使用前,检查有无酒精,用漏斗添加,禁止向燃着的酒精灯里添加酒精。
b. 酒精不能超过灯身容积的2/3,不能少于1/4。
c.用燃着的火柴去点燃酒精灯,不允许
用另一支酒精灯去“对火”(否则:倾侧的
酒精灯溢出酒精,引起大面积着火 )。
d.用灯帽盖灭火焰,不允许用嘴吹灭。
(否则:可能将火焰沿着灯颈压入灯内,
引起着火爆炸 )
②物质的加热
哪些仪器可以用来直接加热
哪些需要垫石棉网
试管、硬质玻璃管、蒸发皿、坩埚、燃烧匙等
烧杯、烧瓶(圆底、平底、蒸馏)、锥形瓶等
加热前容器外壁不能有水,否则易破裂
a.给试管内液体加热——管口向上倾斜约45°;试管内液体体积不超过试管容积的1/3;加热时,管口不能对着自己或他人。
b.给试管内固体加热——管口略向下倾斜,以防形成的水滴倒流至管底引起试管破裂;先均匀受热,再集中加热。
给试管内的液体、固体加热要注意什么?
习题
1.在化学实验中必须注意安全操作:
①用完酒精灯后,用灯帽盖灭,不用嘴吹.
②在稀释浓硫酸时将水沿器壁慢慢注入浓硫酸中,并用玻璃棒不断搅拌
③浓硫酸不慎滴到皮肤上,应立即用大量水冲洗,再用3%-5%的NaHCO3溶液涂上
④给试管中液体加热,液体一般不超过试管容积的1/3
⑤可以向燃着的酒精灯中添加酒精
上述说法中正确的是( )
A、①② B、②⑤ C、③⑤ D、①④
D
C
2.下列有关实验操作错误的是( )
A.用胶头滴管滴加少量液体
B.用药匙取用粉末状或小颗粒状固体
C.给盛有2/3体积液体的试管加热
D.倾倒液体时试剂瓶标签面向手心
3.在盛放浓硫酸的试剂瓶的标签应印有下列警示标记中的( )
A
D
B
4.下列仪器中不能用作反应容器的是( )
A.试管 B.烧瓶 C.烧杯 D.量筒
5.下列有关试剂的取用的说法不正确的是( )
A.胶头滴管可用来取用少量液体试剂
B.无毒的固体试剂可用手直接取用
C.制氢气实验时,多取的锌粒可放回原试剂瓶中
D.取用块状固体试剂时,一定要用镊子
7.下列实验操作正确的是( )
D
6.遇到下列情况,采用的措施正确的是( )
A.浓硫酸不慎沾在皮肤上,立即用大量水冲洗
B.酒精灯不慎打翻起火,立即用水浇灭
C.烧菜时油锅着火,立即盖上锅盖
D.发现家中天然所泄漏,立即打开抽油烟机
C
二、混合物的分离和提纯
1、过滤与蒸发操作
过滤操作
①过滤的目的(适用范围)是什么?
②过滤操作需要哪些仪器?
③进行过滤操作时要注意哪些问题?
(一贴、二低、三靠)
(1)过滤
一贴:滤纸要紧贴漏斗内壁。
二低:滤纸的边沿要低于漏斗的边沿,被过滤液
体的液面要低于滤纸的边沿。
三靠:漏斗颈口尖端要靠在烧杯内壁上,玻璃棒
要靠在三层滤纸上,倾倒被过滤物质的烧
杯嘴要靠在玻璃榜上。
蒸发操作
①蒸发的目的是什么?
②蒸发操作需要哪些仪器?
③蒸发操作时的注意事项?
*加入的液体不超过蒸发皿容积的2/3。
*蒸发过程中要用玻棒不断搅拌(以防溶液 因局部过热而造成液滴飞溅)。
*加热至剩余少量液体时,应停止加热,利用余温使滤液蒸干。
*热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
(2)蒸发
蒸发结晶适用于溶解度随温度变化不大的溶质,比如NaCl、KCl等。因为溶解度变化小,所以不论冷热都溶解度变化不大,只有通过(加热蒸发)减少溶剂(水)才能使其析出结晶。
降温结晶适用于溶解度随温度变化大而且是随温度降低而降低的溶质,比如NaNO3、KNO3等。高温时溶解度高,冷却热溶液时,其溶解度下降,溶质结晶析出。
1.通过溶解、过滤、蒸发操作之后,得到的固体就是纯净的食盐吗?
粗盐
溶解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
过滤
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
2.如何检验Cl-的存在
粗盐的提纯
蒸发
晶体
运用实例:
离子的检验:
1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等特殊现象)进行离子鉴定的过程。
2、步骤:
(1)先对试样的外观进行观察(颜色、状态等);
(2)将试样(固体)配成溶液,取出少许进行检验;
(3 )选择合理的试剂(要求反应灵敏、现象明显);
(4)注意排除某些共有现象的干扰。
Cl-的检验方法:
操作:用试管取待检液少量,先加入过量稀HNO3酸化,再加入几滴AgNO3溶液。
现象:出现不溶于稀硝酸的白色沉淀
(AgCl)。
结论:存在Cl- 。
注意排除CO32-离子的干扰!
SO42-的检验方法:
操作:用试管取待检液少量,先加入过量稀盐酸酸化,再加入可溶性钡盐(BaCl2)溶液。
现象:加入稀盐酸不出现沉淀,加入氯化钡后出现白色沉淀(BaSO4)。
结论:存在SO42- 。
注意排除Ag+、CO32-等离子的干扰!
化学除杂
除杂原则:
*不增(尽量不引入新杂质)
*不减(尽量不损耗样品)
*易分(容易分离——生成完全不溶物或气体)
*复原(除去各种杂质,还原到目标产物)
注意:除杂试剂要适当过量;设计所加试剂的先后顺序!
对于粗盐水(NaCl)
要除去可溶杂质离子是:
Ca2+
Mg2+
SO42-
选择要加入的除杂试剂:
Na2CO3
NaOH
BaCl2
引入了新的离子:
CO32-
OH-
Ba2+
BaCO3↓
HCl
1.BaCl2→NaOH →Na2CO3 → HCl
2. BaCl2→ Na2CO3 → NaOH → HCl
3. NaOH →BaCl2→ Na2CO3 → HCl
加入除杂试剂的顺序可以是:
1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸必须适量
过滤
过滤
过滤
粗盐
溶解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
过滤
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
粗盐的提纯
先加入过量的BaCl2溶液
再加入过量的NaOH溶液
再加入过量的Na2CO3溶液
过滤
滤液
晶体
加入盐酸至中性
蒸发
如何证明过量?
例题:某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.Ba(NO3)2、K2CO3、AgNO3、HNO3
B.K2CO3、Ba(NO3)2、AgNO3、HNO3
C.Ba(NO3)2、AgNO3、K2CO3、HNO3
D.AgNO3、Ba(NO3)2、K2CO3、HNO3
CD
2. 草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的CO32-、SO42-和Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解沉降,③________,④________冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示________(填选项的标号)。
A.左盘重,样品轻 B.左盘轻,砝码重
C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行②、③、④操作时,都要用到玻璃棒,其作用分别是:
②_____________________________________;
③_____________________________________;
④_____________________________________。
(4)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有________生成,证明溶液中有________。
②在第二支试管里加入足量稀盐酸后,再加入BaCl2溶液,可观察到有________生成,证明溶液中有________。
③在第三支试管里加入足量稀硝酸后,再加入AgNO3溶液,可观察到有________生成,证明溶液中有________。
2、蒸馏和萃取
饮用水处理
制取蒸馏水
1.原理——利用液态混合物(互溶)中各组分沸点的不同,加热使其某一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开,目的是将易挥发、难挥发或不挥发的杂质除去。
2.装置
冷凝管
圆底烧瓶
牛角管
锥形瓶
温度计
进水口
出水口
(1)蒸馏
3.注意事项:
4.烧瓶底加垫石棉网
1.温度计水银球处于蒸馏烧瓶支管口下0.5cm处
2.冷凝水,下口进,上口出
3.放入沸石或瓷片防暴沸
此处不能用橡皮塞连接
酒精和水的混合物能否用蒸馏法分离?
符合蒸馏的条件:
液体混合物——酒精与水以任意比互溶
各组分沸点不同——酒精78 ℃,水100 ℃
油和水可以用蒸馏法分离吗?
沸点( )的组分先蒸出,加热温度不能
超过混合物中沸点( )的物质的沸点!
低
高
蒸馏法
利用某种物质(溶质)在互不相溶的溶剂里溶解度的不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中,然后利用液体分层用分液漏斗将上下两层液体分离。
1.原理
2.仪器与药品
烧杯、玻璃棒、分液漏斗、漏斗架(铁架台、铁圈)
萃取剂
萃取剂的选择:
1.萃取剂与原溶剂互不相溶、不发生化学反应;
2.溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度远大于在原溶剂中的溶解度);
3.溶质不与萃取剂发生任何反应;
3.操作过程
(1)取一支分液漏斗,先检验是否漏水,将被萃取的液体及萃取剂倒入分液漏斗中。
(2)右手压住分液漏斗口部,左手握住货色部分,漏斗倒置上倾并振荡,振荡过程中不断打开活塞放气。
(3)将分液漏斗放置于漏斗架上静置分层,在漏斗下放置烧杯,漏斗下口尖端贴住烧杯内壁。
(4)分层后,打开颈口上的玻璃塞,将下层液体从下面颈口放出,上层液体从上面开口放出。
1.分液漏斗使用之前要检验是否漏水,如何检验?
2.为何要振荡?振荡过程中还要注意何种操作?
3.静置分层之后,为什么要打开上口的玻璃塞?液体分别是如何倒出的?
一、化学实验安全
(一)遵守实验室规则
应先预习实验,明确实验目的、
原理和方法,严禁不预习进入实验室。
应先检查实验用品是否齐全。
应严格遵守各项实验操作规程,
严禁随便地进行无关的实验,不得大声喧哗。
4.实验完毕后,应将仪器洗净,整理清洁实验台。
5.有意外事故,应及时向老师报告。
1.进实验室前,
2.进实验室后,
3.实验过程中,
1、点燃可燃性气体或对可燃性气体进行加热反应前,要做什么?如何操作?
3、制取有毒气体(Cl2、CO、SO2、H2S、NO等)时,要在什么地方进行?
如何闻气体的气味?能否用嘴尝药品的味道?
4、用加热法制取氧气并用排水法收集时,熄灭酒精灯前应先做什么?
2、如何稀释浓硫酸?
想一想,议一议
气密性检查
(二)预防事故的发生
*防爆炸:
*防暴沸:
*防失火:
点燃可燃性气体或对可燃性气体进行加热反应前,要检验气体的纯度。
实验室中的可燃物质要远离火源,检查灭火设备是否齐全
配制硫酸的水溶液时,要将浓硫酸倒入水中;
加热液体时要加沸石或碎瓷片。
用加热法制取气体并用排水法收集时,要先把导管拿出水面再移去酒精灯。
吸收溶解度较大的气体(HCl、NH3)时,加装安全瓶或漏斗。
*防倒吸:
制取有毒气体(Cl2、CO、SO2、H2S、NO等)时,要在通风橱内进行,有毒尾气要处理(灼烧、吸收、收集等)。
闻气体气味时,左手执瓶右手在瓶口轻轻扇动,让少量气体飘入鼻孔。
不能用嘴尝药品的味道。
*防中毒:
(三)、意外事故的处理
1、大量的酸、碱洒到实验台上;
2、一般的酸、碱沾到在皮肤上;
实验过程中,如果出现下列事故该如何处理?
酸洒到桌上,先加入Na2CO3至不再有气泡产生为止,再用水冲洗桌面,用抹布抹干。碱洒到桌上,先用醋酸中和,再用水冲洗桌面,用抹布抹干。
酸沾到皮肤上,先用水冲洗,再涂上3~5%的NaHCO3溶液。碱沾到皮肤上,先用水冲洗,再涂上硼酸溶液。
4、酒精灯内酒精洒到桌面上并燃烧起来。
3、浓硫酸沾到皮肤上;
先用棉花或干净的布将浓硫酸轻轻擦去,再用水冲洗,再涂上3~5%的NaHCO3溶液。
用湿抹布盖灭。
请阅读教材,危险化学品分为哪几类?标志是怎样的?你能否举例说明?
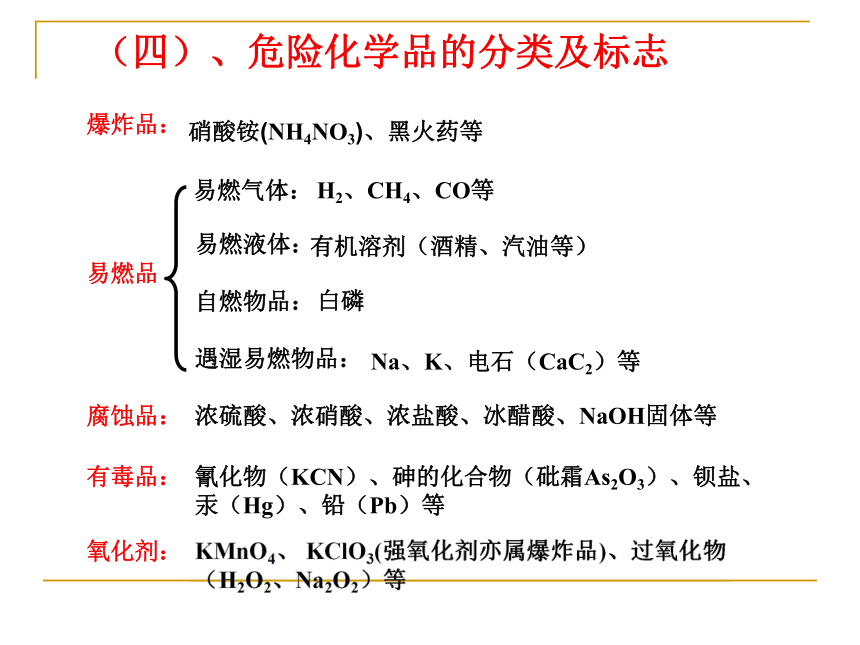
(四)、危险化学品的分类及标志
易燃气体:
易燃液体:
自燃物品:
遇湿易燃物品:
H2、CH4、CO等
有机溶剂(酒精、汽油等)
白磷
Na、K、电石(CaC2)等
浓硫酸、浓硝酸、浓盐酸、冰醋酸、NaOH固体等
氰化物(KCN)、砷的化合物(砒霜As2O3)、钡盐、
汞(Hg)、铅(Pb)等
爆炸品:
易燃品
腐蚀品:
有毒品:
氧化剂:
KMnO4、 KClO3(强氧化剂亦属爆炸品)、过氧化物(H2O2、Na2O2)等
硝酸铵(NH4NO3)、黑火药等
①药品的取用:
无用量说明时,液体1~2ml,固体只需盖满试管底部。剩余药品一般不能放回原处,也不能随意丢弃,应放入指定容器。
药品的取用 使用仪器
固体药品 粉末 药匙(或纸槽)
块状固体 镊子
一定量 托盘天平
液体药品 少量 胶头滴管
多量 用试剂瓶倾倒
一定量 量筒、滴定管等
(五)掌握正确的操作方法
药品的称量——托盘天平
(1)调零防腐
先调节天平至零点,潮湿或有腐蚀性的药品必须放在玻璃器皿中称量,其他药品可用大小一样质地相同的称量纸
(2)左物右码
左盘放称量物,右盘放砝码
(3)先大后小
用镊子取用砝码,先取质量大的,再取小的
(4)归零放盒
称量完毕,应把游码移回零处,砝码放回砝码盒
天平读数至小数点后一位。
液体的量取-----量筒
要选则合适规格的量筒,量筒要放平稳,读数时视线与凹液面的最低点平齐,读数至小数点后一位。
如果要你测量一定量液体的体积,读数时眼睛位置偏高了(俯视),读得结果比实际体积偏大还是偏小?
如果要你量取6.2mL某溶液,读数时眼睛位置偏高了(俯视),量取液体实际体积比所需体积偏大还是偏小?
酒精灯的使用:
a.使用前,检查有无酒精,用漏斗添加,禁止向燃着的酒精灯里添加酒精。
b. 酒精不能超过灯身容积的2/3,不能少于1/4。
c.用燃着的火柴去点燃酒精灯,不允许
用另一支酒精灯去“对火”(否则:倾侧的
酒精灯溢出酒精,引起大面积着火 )。
d.用灯帽盖灭火焰,不允许用嘴吹灭。
(否则:可能将火焰沿着灯颈压入灯内,
引起着火爆炸 )
②物质的加热
哪些仪器可以用来直接加热
哪些需要垫石棉网
试管、硬质玻璃管、蒸发皿、坩埚、燃烧匙等
烧杯、烧瓶(圆底、平底、蒸馏)、锥形瓶等
加热前容器外壁不能有水,否则易破裂
a.给试管内液体加热——管口向上倾斜约45°;试管内液体体积不超过试管容积的1/3;加热时,管口不能对着自己或他人。
b.给试管内固体加热——管口略向下倾斜,以防形成的水滴倒流至管底引起试管破裂;先均匀受热,再集中加热。
给试管内的液体、固体加热要注意什么?
习题
1.在化学实验中必须注意安全操作:
①用完酒精灯后,用灯帽盖灭,不用嘴吹.
②在稀释浓硫酸时将水沿器壁慢慢注入浓硫酸中,并用玻璃棒不断搅拌
③浓硫酸不慎滴到皮肤上,应立即用大量水冲洗,再用3%-5%的NaHCO3溶液涂上
④给试管中液体加热,液体一般不超过试管容积的1/3
⑤可以向燃着的酒精灯中添加酒精
上述说法中正确的是( )
A、①② B、②⑤ C、③⑤ D、①④
D
C
2.下列有关实验操作错误的是( )
A.用胶头滴管滴加少量液体
B.用药匙取用粉末状或小颗粒状固体
C.给盛有2/3体积液体的试管加热
D.倾倒液体时试剂瓶标签面向手心
3.在盛放浓硫酸的试剂瓶的标签应印有下列警示标记中的( )
A
D
B
4.下列仪器中不能用作反应容器的是( )
A.试管 B.烧瓶 C.烧杯 D.量筒
5.下列有关试剂的取用的说法不正确的是( )
A.胶头滴管可用来取用少量液体试剂
B.无毒的固体试剂可用手直接取用
C.制氢气实验时,多取的锌粒可放回原试剂瓶中
D.取用块状固体试剂时,一定要用镊子
7.下列实验操作正确的是( )
D
6.遇到下列情况,采用的措施正确的是( )
A.浓硫酸不慎沾在皮肤上,立即用大量水冲洗
B.酒精灯不慎打翻起火,立即用水浇灭
C.烧菜时油锅着火,立即盖上锅盖
D.发现家中天然所泄漏,立即打开抽油烟机
C
二、混合物的分离和提纯
1、过滤与蒸发操作
过滤操作
①过滤的目的(适用范围)是什么?
②过滤操作需要哪些仪器?
③进行过滤操作时要注意哪些问题?
(一贴、二低、三靠)
(1)过滤
一贴:滤纸要紧贴漏斗内壁。
二低:滤纸的边沿要低于漏斗的边沿,被过滤液
体的液面要低于滤纸的边沿。
三靠:漏斗颈口尖端要靠在烧杯内壁上,玻璃棒
要靠在三层滤纸上,倾倒被过滤物质的烧
杯嘴要靠在玻璃榜上。
蒸发操作
①蒸发的目的是什么?
②蒸发操作需要哪些仪器?
③蒸发操作时的注意事项?
*加入的液体不超过蒸发皿容积的2/3。
*蒸发过程中要用玻棒不断搅拌(以防溶液 因局部过热而造成液滴飞溅)。
*加热至剩余少量液体时,应停止加热,利用余温使滤液蒸干。
*热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
(2)蒸发
蒸发结晶适用于溶解度随温度变化不大的溶质,比如NaCl、KCl等。因为溶解度变化小,所以不论冷热都溶解度变化不大,只有通过(加热蒸发)减少溶剂(水)才能使其析出结晶。
降温结晶适用于溶解度随温度变化大而且是随温度降低而降低的溶质,比如NaNO3、KNO3等。高温时溶解度高,冷却热溶液时,其溶解度下降,溶质结晶析出。
1.通过溶解、过滤、蒸发操作之后,得到的固体就是纯净的食盐吗?
粗盐
溶解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
过滤
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
2.如何检验Cl-的存在
粗盐的提纯
蒸发
晶体
运用实例:
离子的检验:
1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等特殊现象)进行离子鉴定的过程。
2、步骤:
(1)先对试样的外观进行观察(颜色、状态等);
(2)将试样(固体)配成溶液,取出少许进行检验;
(3 )选择合理的试剂(要求反应灵敏、现象明显);
(4)注意排除某些共有现象的干扰。
Cl-的检验方法:
操作:用试管取待检液少量,先加入过量稀HNO3酸化,再加入几滴AgNO3溶液。
现象:出现不溶于稀硝酸的白色沉淀
(AgCl)。
结论:存在Cl- 。
注意排除CO32-离子的干扰!
SO42-的检验方法:
操作:用试管取待检液少量,先加入过量稀盐酸酸化,再加入可溶性钡盐(BaCl2)溶液。
现象:加入稀盐酸不出现沉淀,加入氯化钡后出现白色沉淀(BaSO4)。
结论:存在SO42- 。
注意排除Ag+、CO32-等离子的干扰!
化学除杂
除杂原则:
*不增(尽量不引入新杂质)
*不减(尽量不损耗样品)
*易分(容易分离——生成完全不溶物或气体)
*复原(除去各种杂质,还原到目标产物)
注意:除杂试剂要适当过量;设计所加试剂的先后顺序!
对于粗盐水(NaCl)
要除去可溶杂质离子是:
Ca2+
Mg2+
SO42-
选择要加入的除杂试剂:
Na2CO3
NaOH
BaCl2
引入了新的离子:
CO32-
OH-
Ba2+
BaCO3↓
HCl
1.BaCl2→NaOH →Na2CO3 → HCl
2. BaCl2→ Na2CO3 → NaOH → HCl
3. NaOH →BaCl2→ Na2CO3 → HCl
加入除杂试剂的顺序可以是:
1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸必须适量
过滤
过滤
过滤
粗盐
溶解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
过滤
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
粗盐的提纯
先加入过量的BaCl2溶液
再加入过量的NaOH溶液
再加入过量的Na2CO3溶液
过滤
滤液
晶体
加入盐酸至中性
蒸发
如何证明过量?
例题:某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.Ba(NO3)2、K2CO3、AgNO3、HNO3
B.K2CO3、Ba(NO3)2、AgNO3、HNO3
C.Ba(NO3)2、AgNO3、K2CO3、HNO3
D.AgNO3、Ba(NO3)2、K2CO3、HNO3
CD
2. 草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的CO32-、SO42-和Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解沉降,③________,④________冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示________(填选项的标号)。
A.左盘重,样品轻 B.左盘轻,砝码重
C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行②、③、④操作时,都要用到玻璃棒,其作用分别是:
②_____________________________________;
③_____________________________________;
④_____________________________________。
(4)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有________生成,证明溶液中有________。
②在第二支试管里加入足量稀盐酸后,再加入BaCl2溶液,可观察到有________生成,证明溶液中有________。
③在第三支试管里加入足量稀硝酸后,再加入AgNO3溶液,可观察到有________生成,证明溶液中有________。
2、蒸馏和萃取
饮用水处理
制取蒸馏水
1.原理——利用液态混合物(互溶)中各组分沸点的不同,加热使其某一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开,目的是将易挥发、难挥发或不挥发的杂质除去。
2.装置
冷凝管
圆底烧瓶
牛角管
锥形瓶
温度计
进水口
出水口
(1)蒸馏
3.注意事项:
4.烧瓶底加垫石棉网
1.温度计水银球处于蒸馏烧瓶支管口下0.5cm处
2.冷凝水,下口进,上口出
3.放入沸石或瓷片防暴沸
此处不能用橡皮塞连接
酒精和水的混合物能否用蒸馏法分离?
符合蒸馏的条件:
液体混合物——酒精与水以任意比互溶
各组分沸点不同——酒精78 ℃,水100 ℃
油和水可以用蒸馏法分离吗?
沸点( )的组分先蒸出,加热温度不能
超过混合物中沸点( )的物质的沸点!
低
高
蒸馏法
利用某种物质(溶质)在互不相溶的溶剂里溶解度的不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中,然后利用液体分层用分液漏斗将上下两层液体分离。
1.原理
2.仪器与药品
烧杯、玻璃棒、分液漏斗、漏斗架(铁架台、铁圈)
萃取剂
萃取剂的选择:
1.萃取剂与原溶剂互不相溶、不发生化学反应;
2.溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度远大于在原溶剂中的溶解度);
3.溶质不与萃取剂发生任何反应;
3.操作过程
(1)取一支分液漏斗,先检验是否漏水,将被萃取的液体及萃取剂倒入分液漏斗中。
(2)右手压住分液漏斗口部,左手握住货色部分,漏斗倒置上倾并振荡,振荡过程中不断打开活塞放气。
(3)将分液漏斗放置于漏斗架上静置分层,在漏斗下放置烧杯,漏斗下口尖端贴住烧杯内壁。
(4)分层后,打开颈口上的玻璃塞,将下层液体从下面颈口放出,上层液体从上面开口放出。
1.分液漏斗使用之前要检验是否漏水,如何检验?
2.为何要振荡?振荡过程中还要注意何种操作?
3.静置分层之后,为什么要打开上口的玻璃塞?液体分别是如何倒出的?
